氢气在呼吸系统疾病治疗中的应用
氢气作为一种抗氧化、抗炎和抗凋亡剂,正受到越来越多的关注。它曾被认为是一种惰性气体,但目前已显示出在炎症性疾病、癌症和运动医学等领域的治疗潜力。本综述旨在系统总结近二十年来氢气在主要呼吸系统疾病(包括过敏、哮喘、慢性阻塞性肺疾病、肺纤维化、各种原因引起的肺损伤以及呼吸道肿瘤和感染)中的应用研究结果,并阐述氢气对呼吸系统发挥生物活性的基本机制。
Molecular Hydrogen in the Treatment of Respiratory Diseases
图形摘要
1. 引言
氢气因其在治疗多种疾病方面的潜力,在现代医学中受到越来越多的关注。它具有独特的抗氧化特性[1],不仅是一种高选择性的自由基清除剂[2,3],还能诱导内源性解毒酶的产生,这些酶在关键转录因子水平上发挥作用。这些广泛的抗氧化特性有助于其抗炎和抗凋亡活性,在动物模型和人类治疗中可能缓解与多种疾病相关的许多症状[4,5,6]。理论上作为惰性气体的氢气,已成为一种具有广泛潜在应用的有前途的治疗剂。
氢气(H₂)是一种无色、无臭、无味的气体,水溶性差。在室温下,其最大浓度约为0.78 mM(≈1.6 mg/L),每3分钟损失约2–5%[7]。在正常条件下,由于其高解离能,其反应性可忽略不计,因此被归类为惰性气体。因此,它在欧盟被批准作为食品添加剂[8]。它由肠道微生物群的细菌通过降解低聚糖产生(并消耗)[9,10],而哺乳动物缺乏该过程所需的特定酶(氢化酶)。参与这一过程的最主要细菌门是厚壁菌门和拟杆菌门,其中包括厌氧梭菌属物种[9,10,11,12]。
自1783年安托万·拉瓦锡发现氢气以来,长期以来氢气一直被认为是一种没有显著生物活性的惰性气体。这种观念在1888年发生了变化,当时H₂首次被用作内脏疼痛的诊断工具[13]。直到1944年,深海潜水员才使用氢气与氧气以96%:4%的比例混合而成的Hydrox气体混合物来预防减压病,并允许潜水至500米的深度[14]。
后来,在1975年,进行了关于高压氢气可能用于治疗动物癌症的初步观察[15]。尽管有这些观察结果,但氢气一直被忽视,直到21世纪初,关于H₂的抗炎[16]和抗氧化[3]特性的首批出版物问世,氢气在医学中的应用进入了一个新时代。
从那时起,已经发表了数百篇论文,探索氢气在医学、兽医学和人类健康各个领域的应用。这些研究涵盖了广泛的主题,包括炎症性疾病的辅助治疗、癌症治疗,甚至预防运动员的肌肉疲劳、改善皮肤质量或治疗常见的宿醉。在最近的COVID-19大流行期间,H₂作为一种潜在的治疗剂受到了相当大的关注。
在过去的二十年中,已经发表了许多优秀的综述,重点关注H₂作用的潜在机制[1,3,5,6]以及氢气在各种疾病中的潜在应用[4,17,18,19,20,21]。大多数关于呼吸系统疾病的综述都包括氢气在一种特定疾病中的应用研究:癌症[22,23,24,25,26,27,28]、脓毒症相关肺损伤[29,30]或COVID-19[31,32]。只有一篇综述关注几种呼吸系统疾病[33]。另一方面,我们的文章不仅收集和描述了氢气在最常见的肺部疾病(哮喘、慢性阻塞性肺疾病(COPD)、肺癌和肺损伤)中的应用研究,还包括过敏和呼吸道感染(图1)。此外,本综述还更新了上述文章[33]中未包括的研究以及最新研究,并简要总结了H₂与呼吸系统相关的作用机制。本综述涵盖了动物研究,包括初步研究、综述、仅在细胞培养上进行的研究论文、病例报告、观察性研究和临床试验。许多研究缺乏结论性结果或统计效力。因此,它们应被视为初步结果或观察结果,以激励其他研究人员进行进一步的研究。
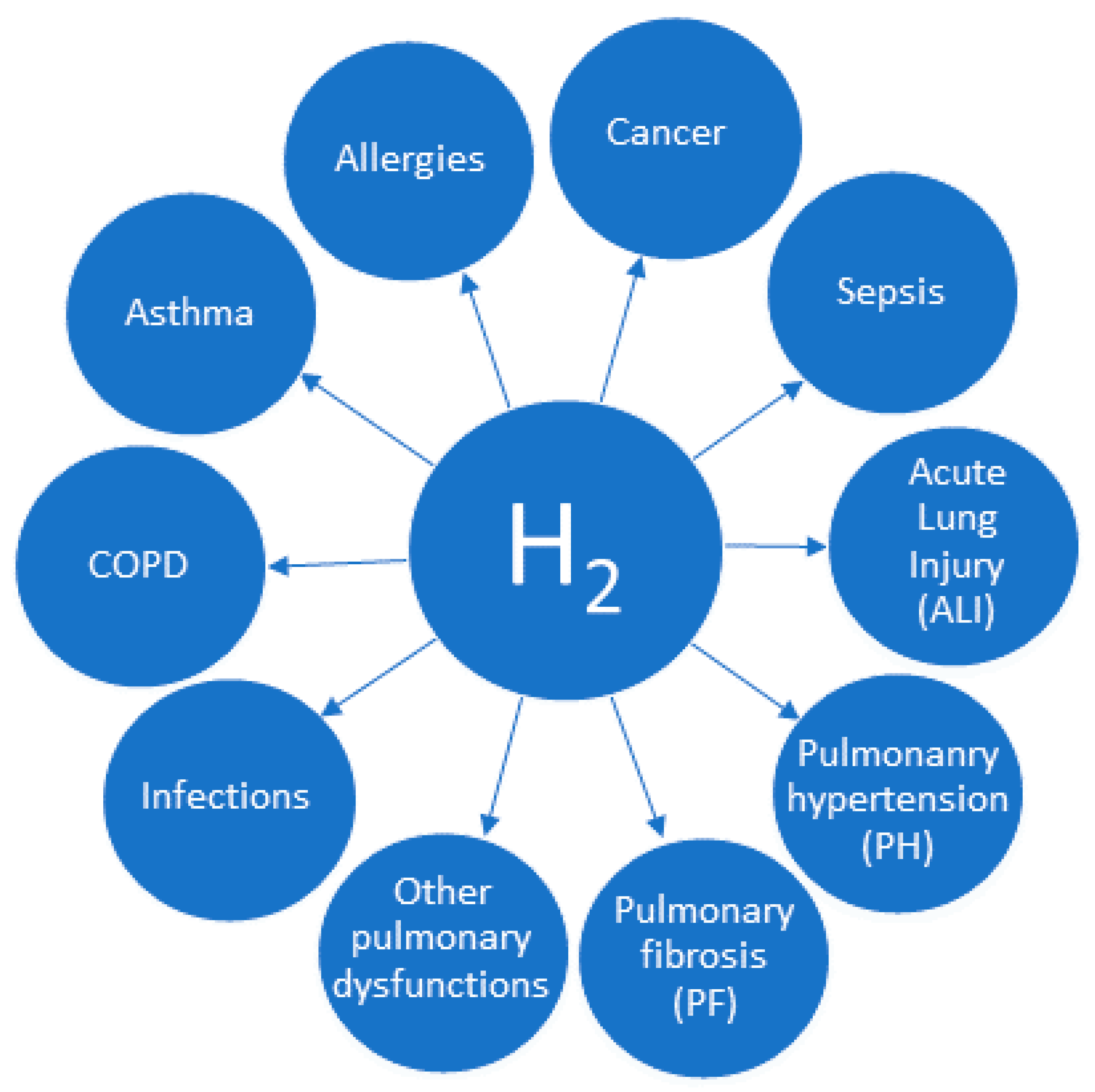
图1. 已证实氢气具有活性的最重要呼吸系统疾病。已证实氢气(H₂)具有治疗效果的主要呼吸系统疾病,包括肺纤维化(PF)、肺动脉高压(PH)、脓毒症、急性肺损伤(ALI)以及哮喘、COPD或癌症等其他疾病。
2. 氢气的作用机制
2.1 氢气的抗氧化活性
H₂的抗氧化活性基于两个过程:直接清除毒性最强的活性氧和氮物种(ROS/RNS)、羟基自由基(•OH)和过氧亚硝酸盐(ONOO−),以及间接调节解毒酶和途径(图2)。
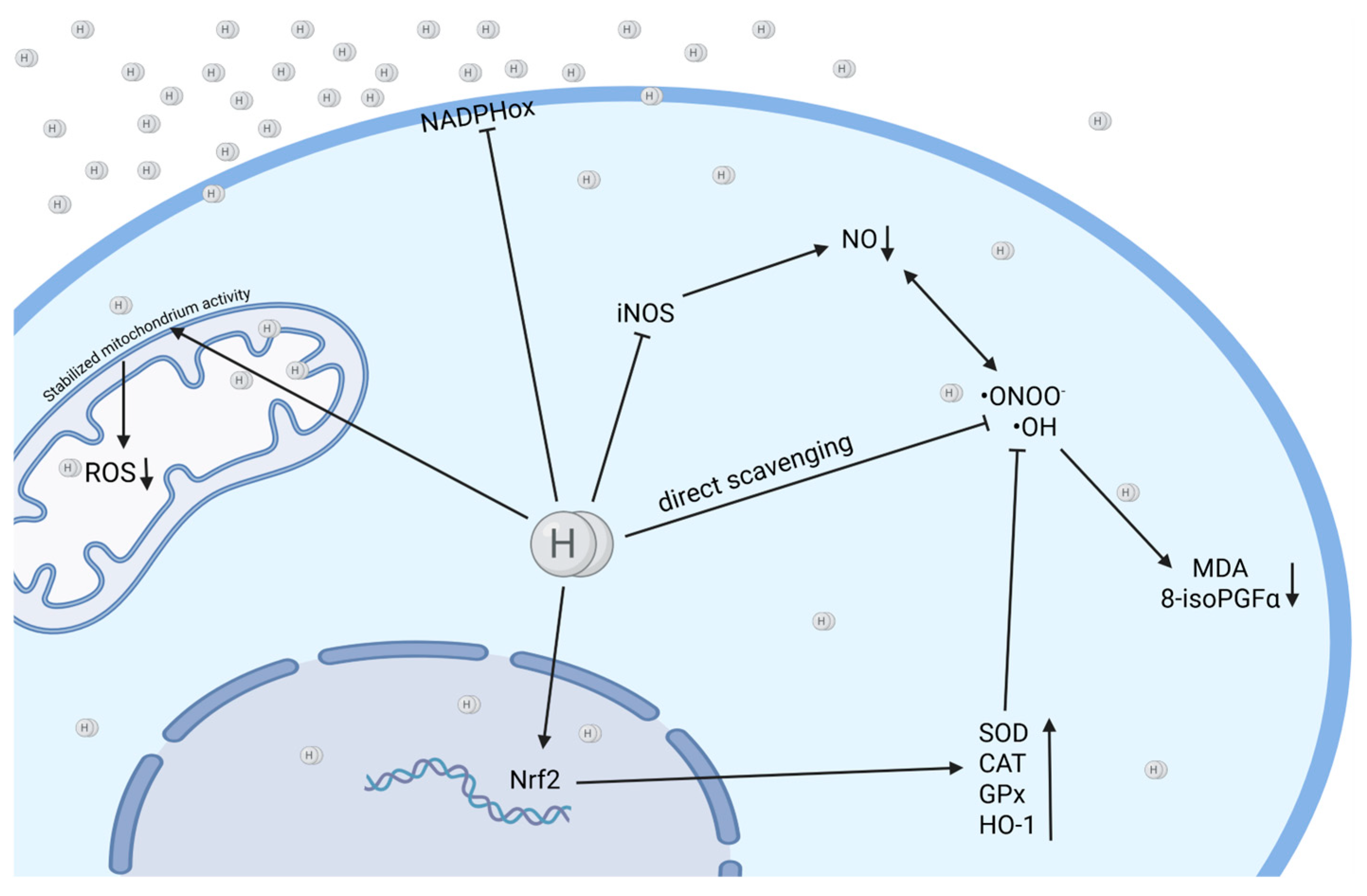
图2. 氢气(H₂)可通过直接清除ROS、稳定线粒体活性、上调保护酶(SOD、HO-1)和抗氧化途径,以及下调产生活性氧的酶(NADPHox、iNOS)来发挥细胞保护作用。H₂具有双重机制——直接清除和酶调节(在BioRender中创建。Pan, I. (2025) https://BioRender.com/qbvn8pb 访问时间:2025年4月11日)。
羟基自由基是一种特别有效的活性氧,其反应性约为超氧阴离子(O₂−)的100倍[25]。已证明它可氧化DNA并诱导脂质过氧化过程,导致产生氧化应激标志物,如4-羟基-2-壬烯醛(4HNE)、丙二醛(MDA)[34]和8-羟基脱氧鸟苷(8-OHdG),后者是氧化DNA损伤的标志物[35]。
过氧亚硝酸盐是参与亚硝化应激过程的最强RNS之一,包括蛋白质内酪氨酸残基的硝化。这一过程导致蛋白质功能随后恶化,导致细胞坏死或凋亡[36]。
氢气已被证明可以选择性中和•OH和ONOO−,而对其他生物活性自由基如超氧阴离子(O₂−)和过氧化氢(H₂O₂)没有任何反应性[1,3]。因此,H₂不会破坏生理代谢氧化还原反应。
氢气活性的一个重要领域与其在维持线粒体膜电位中的作用有关,部分是通过降低氧化还原酶活性,从而防止其消散。这反过来又导致线粒体细胞色素C含量的保留[21,37]。此外,由于H₂降低了线粒体ROS的水平,它阻碍了电子传递链中的电子泄漏,调节线粒体呼吸链复合物I(但不调节复合物II)[38,39],并增加线粒体融合蛋白-2(一种线粒体融合所必需的蛋白质)的表达[40],同时降低动力蛋白相关蛋白1(Drp1蛋白,线粒体分裂的调节因子)的水平[41,42]。因此,这导致线粒体动力学和功能的恢复和随后的调节[41,43]。同时,氢气已被证明可以抑制线粒体应激并调节线粒体自噬[44]。
除了直接中和•OH和ONOO−,从而保护基因组免受氧化损伤外,H₂还激活多种解毒酶。这些酶包括谷胱甘肽/硫氧还蛋白系统[8]、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和血红素加氧酶-1(HO-1),它们是关键的抗氧化酶[5,8,21,45,46,47,48,49]。
此外,H₂还激活Nrf2(核因子红细胞2相关因子2)通路,这是一种参与氧化应激相关反应的关键转录因子,包括细胞保护、抗氧化和解毒酶,如HO-1[50]。同时,Nrf2通路在呼吸系统疾病中起着关键作用,并将氧化应激和炎症联系起来[51]。值得注意的是,通过Nrf2通路激活的HO-1在维持肺内促氧化与抗氧化、促炎与抗炎、促凋亡与抗凋亡过程之间的平衡中起着关键作用[52]。在肺损伤模型及其症状(包括肺水肿、炎症和肺细胞凋亡)中观察到HO-1上调的保护作用[53]。这些作用可能归因于游离血红素的去除和芬顿反应的抑制[1,52]。反过来,芬顿反应通过增强氧化应激与肺损伤症状的发展有关,因为它会产生毒性最强的活性氧,即羟基自由基[25]。长期或过度的氧化应激无法被内源性抗氧化系统抵消[54],会导致肺泡巨噬细胞和上皮细胞的氧化损伤、凋亡,从而引起肺的组织学变化,如肺水肿。同时,已观察到它会诱导促炎通路如NFκB通路的过度激活,从而促进炎症的发展[55]。在几种肺部疾病中已报道HO-1表达及其水平的紊乱[56]。值得注意的是,Nrf2通路的激活已被证明可以抑制NLRP3(NLR家族含pyrin结构域3)炎症小体,这是一种在炎症反应传播和细胞死亡过程调节中起关键作用的蛋白质复合物[57]。
同时,H₂抑制NADPH氧化酶通路的激活,并下调NOX2和NOX4的表达,这是NADPH氧化酶负责产生活性氧的两个亚基[5,21,58,59]。此外,H₂已被证明可以减少髓过氧化物酶(MPO)的过度激活,MPO是中性粒细胞激活和脱颗粒的标志物之一,导致抑制中性粒细胞炎症,这是几种慢性呼吸系统疾病的标志[21,60,61]。
2.2 氢气的抗炎活性
氢气的抗炎特性主要归因于其作为ROS和RNS清除剂的抗氧化活性(图3)。H₂导致ROS产生减少,同时其清除或清除作用增强,这将导致过度激活的NLRP3炎症小体的下调。反过来,这将进一步抑制NFκB(核因子κB-活化B细胞轻链增强子,参与氧化应激和炎症相关反应的关键转录因子)通路[4,62,63]。
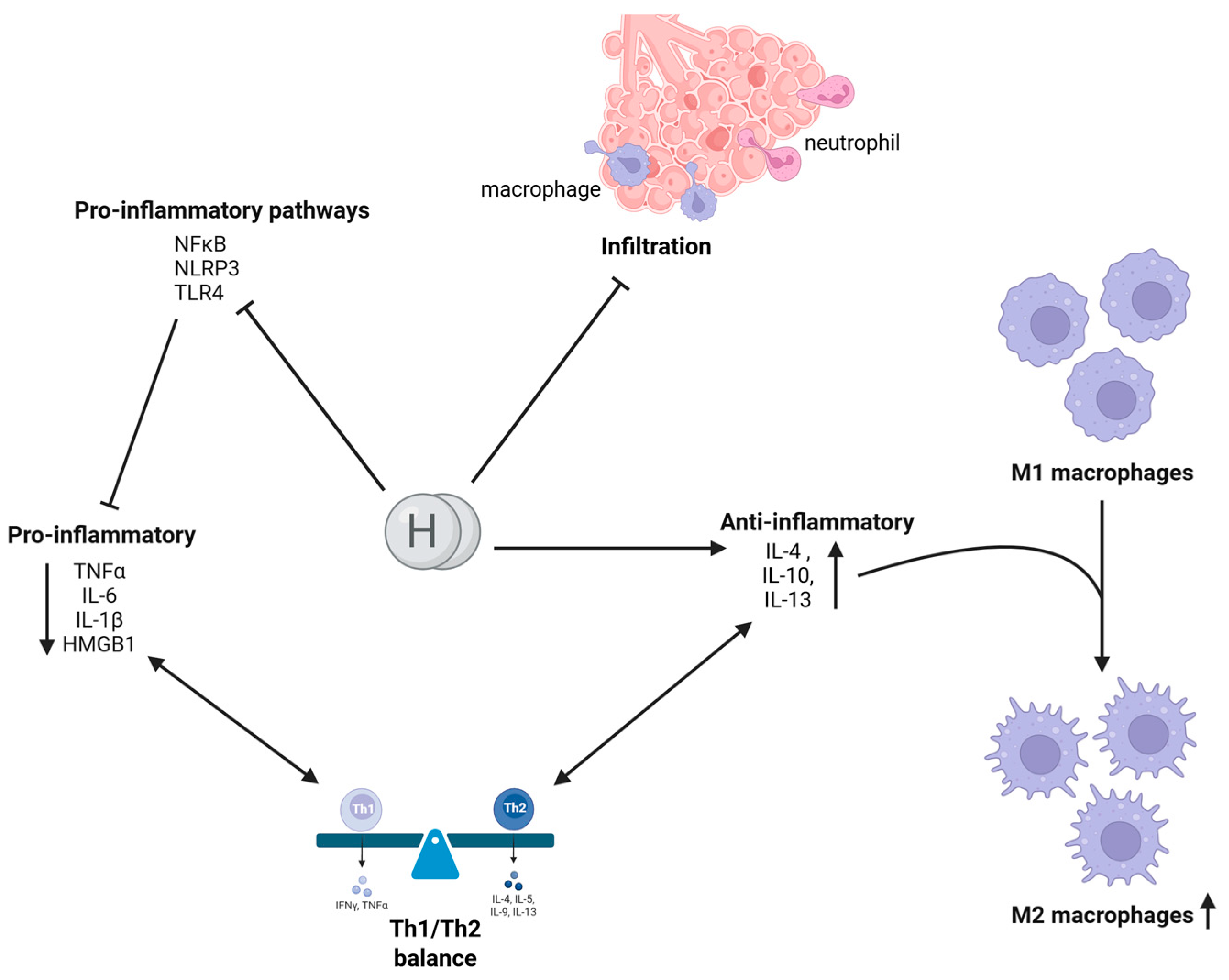
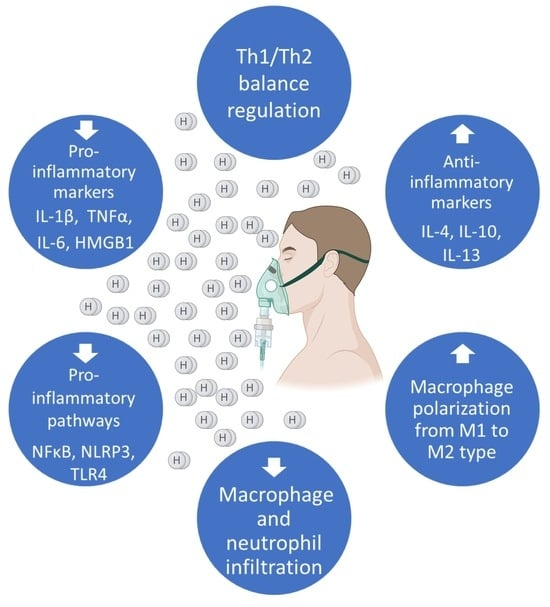
图3. 氢气的抗炎活性
氢气(H₂)通过抑制NFκB核转位、阻断NLRP3炎症小体激活和调节TLR4信号传导来减弱促炎信号传导,从而限制炎症介质(TNF-α、IL-6、IL-18、HMGB1)的释放。同时,H₂促进抗炎细胞因子(IL-4、IL-10、IL-13)的产生,这些细胞因子将M1型巨噬细胞极化为M2样表型。这些作用共同帮助恢复Th1/Th2平衡。此外,氢气减轻巨噬细胞和中性粒细胞向细支气管的浸润,减少氧化和组织损伤,防止过量黏液产生,并最终在炎症性肺部疾病中维持肺功能。值得注意的是,与传统抗炎疗法不同,H₂在实现这些效果时不会抑制必要的免疫防御(在BioRender中创建。Pan, I. (2025) https://BioRender.com/mx9zdvq 访问时间:2025年4月11日)。
同时,H₂对包括NFκB和MAPK(丝裂原活化蛋白激酶)级联反应(如p38、ERK和JNK)在内的促炎通路发挥抑制作用[64]。因此,依赖ROS的促炎通路如NLRP3和TLR4(Toll样受体4)分别在慢性炎症和对脂多糖(LPS)的反应中被减弱[43,63,65]。此外,抗炎细胞因子和趋化因子如白细胞介素(IL)-4、IL-10、IL-13的表达上调[5,17,43,66,67]。相反,促炎细胞因子如IL-1β、IL-6、肿瘤坏死因子α(TNF-α)、干扰素γ(INF-γ)和高迁移率族盒1蛋白(HMGB1)[5,21,43,66]以及粘附分子(如血管细胞粘附分子1(VCAM-1)或细胞间粘附分子1(ICAM-1))[21,67,68,69,70]的表达已被观察到下调。此外,H₂直接参与信号蛋白Sirtuin-1(SIRT-1)的调节,SIRT-1是氧化应激和炎症之间的潜在联系[71]。SIRT-1在调节细胞增殖和分化、应激反应和凋亡中起关键作用。此外,它在急性肺损伤(ALI)期间起保护作用[72]。在细胞水平上,H₂的抗炎特性表现为中性粒细胞和巨噬细胞活性降低以及向受损组织的迁移减少[43,68,73]。此外,H₂促进巨噬细胞从促炎的M1型向抗炎的M2型极化[43,74]。它还抑制Th2反应,恢复调节性T细胞(Treg),从而使过度激活的免疫系统正常化[21,43]。
2.3 氢气的抗凋亡活性
从其抗氧化特性衍生出的另一类特性是抗凋亡特性。如前所述,氢气影响许多信号通路,包括PI3K/Akt/GSK3b、Ask1/JNK、JAK2/STAT3、Ras/ERK1,2/MEK1,2通路,所有这些通路在维持促凋亡/抗凋亡平衡中起关键作用。因此,H₂已被证明下调促凋亡因子如Bax和ROS-p53信号通路的表达[29,43],并上调抗凋亡因子,包括Bcl-2和Bcl-xl。这种现象可能是由PI3K/Akt和JAK2/STAT3信号通路的激活所促进的[21,43,72,75]。同时,由于ROS产生减少和氧化应激降低而在线粒体水平产生的保护机制,在氢气的保护作用中也起关键作用[5]。
此外,氢气已被证明可调节内质网(ER)相关应激,这被认为是ROS生成与细胞死亡之间的联系[72]。这一过程取决于内质网中未折叠蛋白的过度积累。H₂已被证明通过与PERK-eIF2a-ATF4、IRE1-XBP1和ATF6相互作用来阻碍这一过程[21]。此外,它调节自噬,这是一个参与大分子降解和再循环的过程。虽然自噬在正常生理条件下起保护作用,但其过度激活可导致炎症和组织损伤[6]。H₂的活性主要依赖于对p-mTOR/mTOR和p62蛋白表达的调节[17,21,65]。
3. 给药方法
H₂有几种给药方法[76],最主要的是吸入(空气中2–4%或氧气中66%)、饮用富氢水(HRW)和注射富氢生理盐水(HRS)[1,19](见图4)。纯H₂的产生通常通过专用设备进行,该设备利用水或含有氢氧化钾等电催化剂的溶液的水解[20,76]。
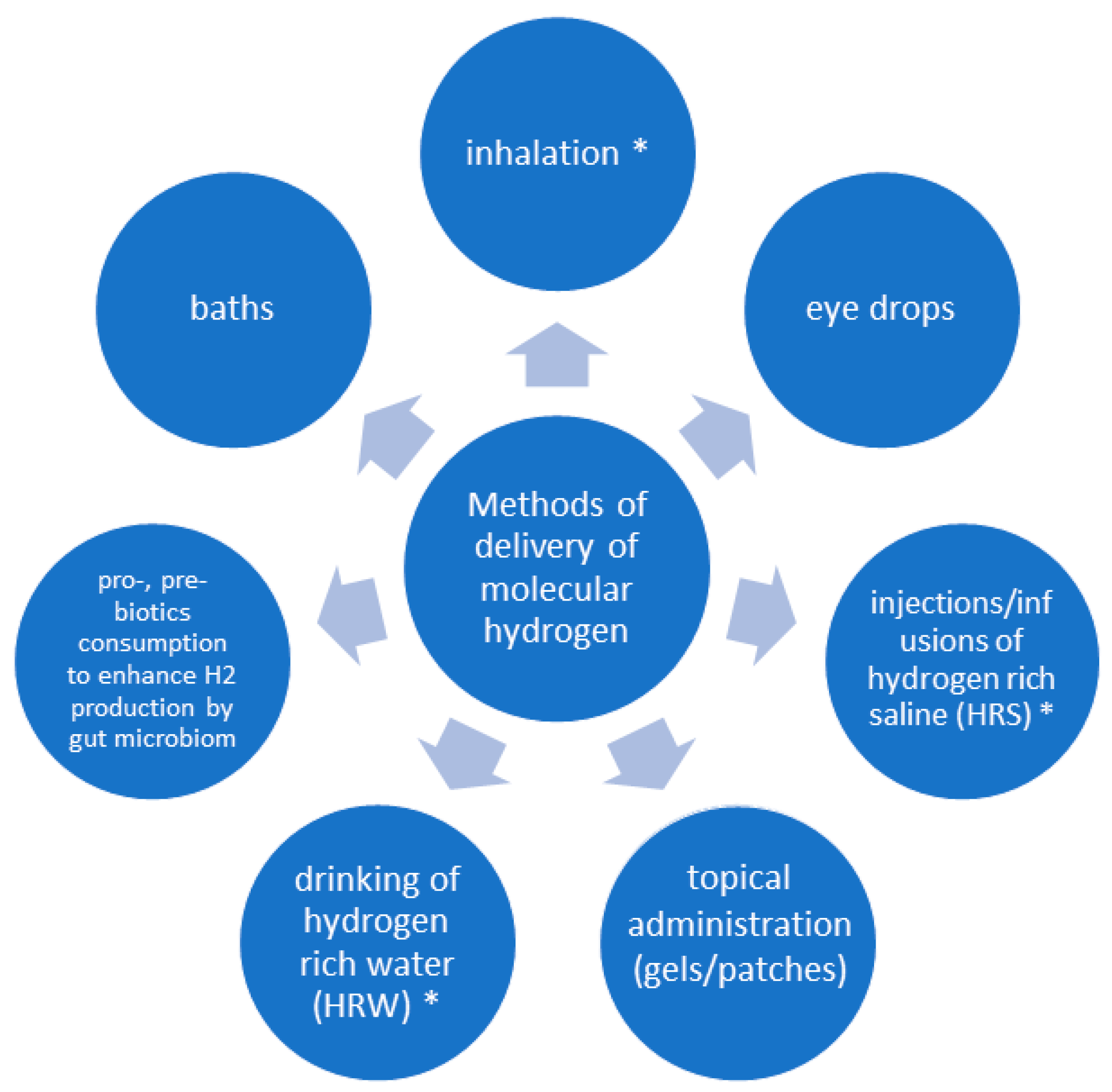
图4. 氢气的给药方法(*—与肺部疾病相关的方法)。用于治疗应用的氢气(H₂)给药方法,其中吸入、饮用富氢水(HRW)或输注富氢生理盐水(HRS)是治疗肺部疾病最相关的方法。其他方法包括局部应用(凝胶/贴片、浴疗)、使用益生菌促进肠道微生物群内源性H₂的产生,或施用于眼表。
通过镁和钙基制备氢水[76,77]。在一些亚洲国家,其中一些被批准为膳食补充剂[78],而其他含有镁、柠檬酸和抗坏血酸的产品则符合欧洲法规[79]。已发现一片含钙片剂可产生高达2.5 μg的H₂[80]。此外,H₂的另一个来源包括市售的产氢水箱或烧瓶,其主要基于过滤水的电解[76,81]。
已证明食用某些益生元,尤其是富含膳食纤维、不可消化淀粉和糖类(乳果糖)的益生元,可通过肠道菌群的活动增强肠道H₂的产生[10,28,82]。
目前正在开发许多替代方法,包括使用镁-透明质酸复合物、用于H₂长期储存的钯细胞、纳米气泡和基于纳米技术的镁合金。其他方法包括用于向肿瘤靶向递送的植入式镁原电池。它们的初步测试已在动物研究中进行[49,76,83,84]。
在所有情况下,都应考虑安全问题,如空气中浓度超过4%时的爆炸风险、生物降解性问题、植入物的一般耐受性,以及所制备的富H₂溶液的稳定性和储存时间有限。
4. 氢气与过敏
氢气在治疗或预防过敏反应或其恶化方面的潜在益处仍有待充分阐明。迄今为止,关于这一主题的大多数研究都是在与过敏相关的疾病上进行的,特别是卵清蛋白(OVA)动物模型中的过敏性鼻炎(AR)和过敏性哮喘,以及对患有AR伴或不伴鼻息肉的人类的观察。在所有情况下,氢气通过吸入、直接滴鼻或鼻灌洗给药。所有研究都报告了鼻部症状的严重程度下降,如瘙痒、抓挠或流鼻涕[85,86]。此外,测量到较低的炎症标志物,如血液嗜酸性粒细胞计数、嗜酸性粒细胞蛋白或黏膜嗜酸性粒细胞趋化蛋白、IL-4、IL-5、IL-13和单核细胞趋化蛋白-1(MCP-1)的水平[86,87,88]。同时,患者观察到组织充血减少、鼻水肿减轻、炎症和不适感减轻,生活质量改善。同时,未报告H₂给药的不良反应[89,90,91]。
具体而言,氢气已被证明通过下调Th2细胞反应、上调IL-10和转化生长因子(TGFβ)水平[85]以及减少CD4+ T细胞浸润[6,92]来恢复Th1/Th2失衡。H₂增加了CD4+CD25+Foxp3+ Treg细胞的数量,这些细胞在过敏性鼻炎(AR)中通常减少[87]。因此,H₂对受损的鼻黏膜发挥了调节作用,从而稳定了巨噬细胞受损的功能[85,87]。
H₂的抗炎作用似乎与其抗氧化特性密切相关,因为据报道氧化应激同时减少[86]。氧化应激是AR和其他鼻部炎症过程中的关键标志物,已被确定为这些病理的关键介质。炎症已被证明会促进氧化应激反应,而氧化应激反应反过来又会加剧过敏性炎症[89]。在鼻息肉中发现ROS增加,并且鼻上皮细胞中Nrf2通路的阻断已被证明会增强对鼻窦炎的易感性[89,93,94]。
Itoh等人[58]发表了一项关于I型超敏反应的研究。在这项研究中,H₂通过抑制高亲和力免疫球蛋白E受体(FcεRI IgE)的积累来减少肥大细胞脱颗粒,这反过来导致组胺、白三烯和细胞因子的释放减少,通过抑制NADPH氧化酶活性及其下游信号传导减少H₂O₂的产生。致敏小鼠饮用HRW导致血管通透性降低和组胺释放减少。
Choi等人的一项研究证明了氢气通过缩短过敏原与呼吸系统的接触时间来预防过敏反应的潜在用途。研究表明,HRW的施用导致碳纳米颗粒的清除率增加,并减少了它们的促过敏特性,以及这些颗粒的促氧化和促炎潜力[95]。
5. 氢气与哮喘
哮喘是最常见的气道炎症性疾病之一。目前,全世界约有3亿人受此疾病影响[96]。这些症状主要与持续性气道炎症和可逆性气道阻塞有关,包括喘息、呼吸困难、咳嗽和胸闷。在细胞水平上,这些症状与细胞向气道的流入增加、慢性氧化应激和Th1/Th2反应失衡以及促炎和抗炎细胞因子有关,随后导致气道高反应性。
在过敏性(OVA)哮喘的实验模型中,通过吸入或饮用HRW施用H₂已被证明可改善大多数哮喘症状。研究报告了气道高反应性和肺阻力的降低[33,97],作为炎症细胞流入气道测量的气道炎症[74],这些细胞的总数及其标志物水平,如MPO[33,97,98,99],以及血液和支气管肺泡灌洗液(BALF)中促炎细胞因子和趋化因子(IL-4、IL-5、IL-6、IL-13、TNF-α、CXCL15)的水平[33,97,98]。此外,发现杯状细胞增生、黏液积聚和粘蛋白-5AC(MUC5AC,黏液的主要糖蛋白[100])表达减少[33,74,97,98]。H₂施用通过降低MDA和其他脂质过氧化标志物以及增强内源性抗氧化酶如SOD或CAT的表达和活性来减轻氧化应激[33,97]。此外,通过广泛的I型胶原沉积和III型胶原和VEGF表达证明的气道重塑被阻止[33,98]。通过增加E-钙粘蛋白和紧密连接蛋白闭合蛋白-1(ZO-1)的表达以及抑制促凋亡过程如半胱天冬酶3和9通路,防止了上皮屏障损伤[99]。巨噬细胞的吞噬活性也得到恢复[74]。同样,H₂吸入或饮用对非哮喘健康小鼠没有影响[99]。
黄等人描述称,H₂治疗可逆转巨噬细胞的吞噬功能缺陷[74]。观察到的效应归因于抗氧化和抗炎的Nrf2通路的激活,该通路在抑制促炎的NFκB通路方面起主导作用[74,98]。
牛等人[102]提出了一个有趣的理论。哮喘发生和发展的一个可能分子机制是代谢从氧化磷酸化向无氧糖酵解的转变。该研究进一步假设,人类哮喘患者的单核细胞和卵清蛋白(OVA)小鼠的肺部表现出乳酸生成增加和糖酵解酶活性升高,进而导致线粒体呼吸复合物I和II的活性降低,最终导致ATP生成受损。H₂治疗的潜在益处可能依赖于通过使糖酵解酶活性增加和线粒体酶活性降低正常化来逆转和调节这种代谢转变,这将导致ATP和乳酸水平的正常化,同时使超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPx)的活性正常化。
目前已初步尝试研究氢气给药在哮喘中的潜在有益作用。Singh等人[103]的研究表明,哮喘和慢性阻塞性肺疾病(COPD)患者饮用富氢水(HRW)可导致血氧饱和度、维生素E水平升高,同时氧化应激标志物如硫代巴比妥酸反应物质(TBARS)、丙二醛(MDA)或共轭二烯降低。此外,该研究指出患者的运动耐量有所提高。Wang等人[104]的另一项研究显示,吸入空气中2.4%的H₂ 45分钟对呼出气冷凝物(EBC)中的IL-4、IL-6等炎症标志物以及血液中的MCP-1和IL-8具有有益影响。
另外两项研究并非针对哮喘本身,而是侧重于其常见触发因素,特别是职业性和空气污染相关的哮喘。Choi等人[95]证明,饮用HRW和腹腔注射富氢生理盐水(HRS)可增强碳纳米颗粒的清除,并减少暴露后的肺部炎症和过敏反应。H₂活性的潜在机制与其通过抑制芬顿反应进而抑制脂质过氧化的抗氧化特性有关。
在一项相关研究中,Feng等人[105]向大鼠施用直径小于2.5微米的颗粒物(PM2.5),随后进行H₂吸入。PM2.5已被证明通过芳烃受体起作用,从而增加氧化应激并促进肺部的促氧化和促炎反应。与其他哮喘研究的结果一致,发现H₂吸入可减轻组织病理学变化、黏液分泌过多和粘蛋白5AC(MUC5AC)表达过度。此外,H₂吸入已被证明可减少氧化应激和氧化损伤以及肺部炎症,这从IL-1β、IL-8和TNF-α水平降低可以看出。因此,H₂对肺功能障碍和肺力学下降显示出保护作用。H₂的有益作用还可进一步与芳烃受体的直接抑制相关。
总之,研究结果表明,吸入氢气可作为哮喘急性加重期间或直接暴露于环境触发因素时的有价值的辅助治疗手段。
6. 氢气与慢性阻塞性肺疾病(COPD)
另一种常见的肺部疾病是慢性阻塞性肺疾病(COPD),其特征是进行性气道阻塞、气促、呼吸困难、肺气肿和慢性支气管炎。目前尚不清楚单一病因,危险因素包括吸烟、空气污染以及职业性接触粉尘、化学物质和烟雾。在细胞水平上,炎症和慢性氧化应激均起关键作用[106,107,108,109]。
动物模型基于啮齿类动物长期暴露于香烟烟雾(CS),这确实是COPD发生的主要暴露风险。H₂通过吸入、腹腔注射HRS或饮用HRW给药,结果相似。总体而言,发现H₂给药可提高生存率并减少体重减轻[110],改善肺功能和静态肺顺应性,并降低动脉血压[110,111,112]。
此外,观察到肺损伤减少,伴随超微结构变化,如肺泡紊乱、肺泡壁增厚、纤毛细胞变性、小气道重塑和肺气肿,同时上皮细胞凋亡减少[110,111,112,113]。此外,观察到炎症和炎症细胞浸润减少[110],杯状细胞增生减少,并且还记录到CS诱导的MUC5AC表达上调。
此外,肺组织和支气管肺泡灌洗液(BALF)中的促炎细胞因子(IL-6、IL-17、IL-23、基质金属蛋白酶-12(MMP-12))水平和促凋亡标志物表达降低[110,111,113]。此外,金属蛋白酶组织抑制剂-1(TIMP-1,维持组织完整性的关键因子[114])表达升高[110]。
观察结果表明,COPD的主要病理——氧化应激减少,同时氧化DNA损伤标志物水平降低[112]。
在分子水平上,H₂降低了CS上调的表皮生长因子受体(EGFR)的磷酸化,但EGFR蛋白水平没有变化[113],同时ERK1/2和NFκB通路的激活减少[111]。
在人体研究中,发现COPD患者饮用HRW可提高血氧饱和度、运动耐量,并降低氧化应激标志物和全身缺氧[103]。一项双盲、平行对照试验表明,与单独吸入纯氧相比,吸入氢气(H₂)和氧气(O₂)的联合疗法在COPD急性加重期间产生了更好的结果[115]。患者表现出更好的呼吸困难、咳嗽和痰量表(BCSS)评分,表明COPD急性加重的严重程度降低。然而,在肺功能或血气参数方面未观察到显著差异。在另一项研究中,COPD患者吸入45分钟的XEN气体(空气中2.4%的H₂),即使如此短暂的吸入时间也导致EBC和血液中的炎症标志物减少[104]。
总之,氢气的有益作用与其抗氧化和抗炎特性有关,表明其是COPD急性加重期间有用的辅助治疗手段。
7. 氢气与肺纤维化
氢气已被证明有益的另一种肺部疾病是肺纤维化(PF),这是一种间质性肺病,其特征是肺部纤维化改变以及肺功能进行性和不可逆的下降。它与通过上皮-间充质转化(EMT)来自上皮的肌成纤维细胞过度激活有关,这种激活长期持续会导致肺泡-毛细血管单位的破坏和细胞外基质过度沉积。这一过程导致结构重塑和肺纤维化。EMT通常由过度氧化应激引发,氧化应激通过ROS依赖性途径激活转化生长因子TGF1β[41]。
使用不同纤维化诱导剂(百草枯、LPS或博来霉素)的动物模型表明,通过吸入或饮用(HRW)施用H₂已被证明可降低肺硬度并保持肺扩张能力,同时增加肺容量[116,117]。在细胞水平上,观察到炎症(IL-4、IL-6、IL-13)、氧化应激(ROS、MDA、羟脯氨酸)和纤维化(纤连蛋白、胶原蛋白沉积)减少[116,117,118,119]。此外,已描述肺部M2巨噬细胞和EMT减少,以及α-平滑肌肌动蛋白(α-SMA)和TGF1β表达降低。这些过程的潜在机制涉及H₂减少氧化应激、减少p38/MAPK和JNK通路激活以及减轻全身炎症,从而调节纤维化反应的能力[33]。
8. 氢气与其他肺部疾病
氢气已被用于治疗其他较不常见的肺部疾病。已证明吸入氢氧比为2:1的混合气体(H₂:O₂)可降低气管狭窄患者的气道阻力和吸气努力[120]。在另一项研究中,患有闭塞性气道疾病的小鼠在饮用HRW后表现出气道阻塞减少、CD4+/CD3+比率增加、IL-6减少和Treg活性增加,且对Nrf2通路无显著影响[121]。
Muramatsu等人[122]证明,即使产前暴露于H₂也会影响新生儿的肺功能。在肺发育不良的小鼠模型中,怀孕期间向羊膜腔注射LPS会导致后代肺泡发育因氧化应激而停滞。怀孕或哺乳期小鼠饮用HRW可使异常扩大的肺泡正常化,减少硝基酪氨酸和8OHdG等氧化应激标志物,并增强LPS抑制的HO-1、成纤维细胞生长因子受体4(FGFR4)和血管内皮生长因子受体2(VEGFR2)的表达,后者对于维持肺泡结构和参与正常肺发育至关重要[123]。
Hattori等人[124]也有类似的观察结果。母体感染常导致早产和新生儿严重呼吸损害。在本研究中,给怀孕大鼠腹腔注射LPS并口服HRW。母体摄入HRW导致新生儿肺功能、形态和发育状态增强,表现为动脉血pO₂和pH值更高,pCO₂更低。此外,注意到caspase-3阳性细胞数量以及IL-6和8OHdG水平减少。这些观察结果表明,母体摄入H₂可减少肺凋亡和氧化应激相关损伤,从而增强幼崽的肺功能。
H₂可能有益的另一种疾病是肺动脉高压,其特征包括气促、肺动脉压升高、右心室肥大、全身炎症以及氧化和硝化应激增加。该疾病似乎与ROS、RNS和慢性炎症密切相关[69]。在大鼠实验模型中,H₂吸入和HRW或HRS给药已被证明可降低肺动脉压、右心室重量和肥大指数、全身和肺部炎症反应、巨噬细胞浸润以及氧化(以8OHdG水平衡量)和硝化(以3-硝基酪氨酸水平衡量)应激标志物[69,125]。同样,这些保护作用基于H₂的抗氧化和抗炎活性[33]。
9. 氢气与肺损伤
9.1 脓毒症相关肺损伤
脓毒症是一种由机体对感染产生过度反应引发的严重病症,可导致多种并发症。其中最严重的包括全身性炎症(即所谓的细胞因子风暴)、急性肺损伤(ALI),后者可迅速进展为急性呼吸窘迫综合征(ARDS)。正如Zhang等人[30]所述,这种病症的特征是过度的炎症反应、细胞因子风暴、氧化应激,以及失调的细胞凋亡和自噬。此外,上述过程还伴随着肺功能下降。
在盲肠结扎穿刺(CLP)诱导的小鼠脓毒症模型中进行的研究表明,手术期间吸入氢气和注射富氢生理盐水(HRS)具有显著疗效[117]。在这两种情况下,H₂均提高了生存率、改善了以PaO₂/FiO₂系数或血气参数衡量的肺功能[126],同时减轻了肺损伤、肺水肿的严重程度和组织学评分,或降低了中性粒细胞计数[117,126]。在分子水平上,观察到炎症标志物如促炎细胞因子(IL-1β、IL-6、TNF-α、HMGB1)水平降低,氧化应激产物(脂质过氧化、DNA氧化、硝基酪氨酸水平)减少。这些效应主要与H₂的抗氧化活性及其对HO-1和Nrf2通路的激活以及对p38和NFκB通路的抑制有关[126]。此外,正如Ren等人[127]所证明的,这还通过调节mTOR/TFEB和PINK/Parkin吞噬通路,同时抑制NLRP3炎症小体,导致线粒体功能上调和自噬激活。在临床环境中,已观察到H₂的联合使用可增强标准治疗方案的疗效[30,33]。
9.2 一般性肺损伤
H₂可能有益的最重要临床问题之一是任何类型的肺损伤和炎症。这些病症可根据其严重程度(以PaO₂/FiO₂指数衡量)、持续时间(急性或慢性)或触发因素或病因进行分类。其中,细菌和病毒性肺损伤(LI)、缺氧/复氧、高氧、机械通气、烟雾、烧伤、辐射诱导的肺损伤以及胎儿肺损伤最为常见。急性肺损伤(ALI)的主要症状是肺部组织病理学变化,包括炎症细胞浸润、杯状细胞增生、肺泡壁增厚、肺和上皮细胞损伤、水肿、肺功能下降和血氧合降低(以PaO₂/FiO₂指数或血气水平衡量)。在分子水平上,ALI的特征是细胞因子和趋化因子水平升高、氧化应激和凋亡标志物升高,同时抗炎和抗凋亡因子水平降低。因此,促炎通路如NFκB被观察到上调,而抗氧化通路如Nrf2通路则下调。因此,ALI及其慢性形式是促氧化与抗氧化、促炎与抗炎平衡的复杂紊乱。
ALI有许多动物模型,最常见的是脂多糖(LPS)滴注模型。脂多糖(LPS)是革兰氏阴性细菌细胞壁的关键成分。在动物中气管内(it.)、腹腔内(ip.)或静脉内(iv.)给予LPS已被证明可重现ALI的大多数症状,包括肺水肿、气道白细胞积聚、严重肺部炎症等。LPS诱导的ALI与人类肺炎和脓毒症相关肺损伤的临床图景高度相似[128]。
H₂通过吸入不同浓度(空气中2%至66%或氧气中)或在不同时间点注射HRS进行给药。
H₂的施用几乎完全消除了LPS诱导的ALI的所有相关症状,包括以血气参数[29,65,129]、PaO₂/FiO₂指数[67,130,131]、通气参数[129]衡量的肺功能下降,以及组织学变化,包括肺泡壁增厚[129]、中性粒细胞流入[64,67,129,131]、肺水肿、湿干比增加、水通道蛋白1和5的表达紊乱[17,33,64,67,71,129,131,132]、上皮和肺泡细胞损伤[33,131,132]以及BALF中蛋白质含量增加[67,130]。此外,H₂降低了升高的炎症标志物,包括IL-1β、IL-6、TNF-α、前列腺素E2(PGE2)[29,65,71,128,130]、巨噬细胞蛋白1α 2(MP1α)和单核细胞趋化蛋白-1(MCP-1)[67],同时增加了降低的抗炎标志物如IL-10的水平[133]。它还减少了氧化应激标志物,包括MDA和硝基酪氨酸[64,132],以及ROS的产生[29],并上调了抗氧化酶如HO-1和SOD[64,130,132]。此外,研究观察到肺细胞凋亡减少,这归因于H₂诱导的末端脱氧核苷酸转移酶dUTP缺口末端标记(TUNEL,一种细胞凋亡检测方法[134])阳性细胞数量和半胱天冬酶-3和8水平的减少[17,33,64,130]。已证明其上调抗凋亡标志物如Bcl-2[17,29,64,67]。这些改变与以SIRT-1依赖的方式抑制NFκB通路[29,130]以及下调与MAPK和JNK激酶相关的信号通路有关[129]。自噬也受到调节,AMPK/mTOR/TFEB通路的激活减少[17,132]。此外,发现氢气可调节受损的肺泡屏障通透性[133]。
9.3 缺氧-复氧性肺损伤
除了众所周知的基于LPS的ALI模型外,还有几种类型的肺损伤(LI)和炎症。其中一个例子是缺氧-复氧(H/R)诱导的LI模型,类似于肺移植和心脏骤停后观察到的损伤。这种类型的LI的发病机制包括广泛的氧化应激、中性粒细胞和M1巨噬细胞向气道的迁移增加、肺细胞凋亡、促炎标志物产生增加以及导致低氧血症和高碳酸血症的肺功能严重恶化。
在缺氧-复氧模型中吸入氢气已被证明不仅可以改善受损的肺功能,还可以显著降低氧化应激和炎症[68]。在分子水平上,这些变化主要基于H₂依赖的羟基自由基产生减少和HO-1和SOD的诱导,这导致随后抑制炎症标志物如IL-1β和TNF-α。这些变化还导致促氧化和促炎的p38 MAPK和NFκB通路的抑制,这与凋亡和焦亡的抑制同时发生[30,33,68]。
通过H₂吸入对肺移植供体进行预处理可防止H/R后的肺部炎症,这表现为IL-1β、TNF-α、ICAM-1水平降低和炎症细胞流入减少,同时肺功能改善,表现为动脉pO₂升高和pCO₂降低[135]。观察到组织学和凋亡变化减少,如肺泡间隔增厚。此外,观察到氧化应激标志物如脂质过氧化和促凋亡标志物(包括Bax和caspase-3)减少。同时,注意到抗凋亡蛋白如Bcl-2和Bclx增加[136]。
Haam等人[137]在吸入H₂的心脏骤停猪中也有一致的观察结果。这些动物在H₂吸入和再灌注期间均表现出肺功能增强、血气参数改善、肺损伤严重程度评分降低和肺水肿减轻。此外,该研究指出抗氧化酶(HO-1、SOD)和抗炎细胞因子(IL-10)水平较高,同时凋亡细胞数量减少。
9.4 高氧相关肺损伤
临床环境中常见的另一种类型的肺损伤是高氧(高氧相关)性LI。与以吸入氧水平不足为特征的缺氧和随后的低氧血症不同,高氧主要与给予高浓度或纯氧导致的氧水平升高有关。已证明高氧与氧中毒密切相关,并可导致氧应激升高及其相关后果,包括肺部炎症、中性粒细胞和巨噬细胞过度激活、水肿,最终导致肺泡损伤和肺发育不良[75,138,139]。已尝试使用主要通过腹腔注射HRS给药的氢气作为高氧相关肺损伤的治疗干预措施。H₂的施用导致肺水肿、炎症细胞浸润、胸腔积液量和出血减少。此外,观察到H₂施用导致炎症减少,表现为IL-1β和TNF-α水平降低。在分子水平上,Sun等人的研究报告了凋亡减少(描述为TUNEL阳性细胞数量减少)及其相关标志物(p-Akt、p-FoxO3、细胞周期蛋白D1、Bcl-2)[72]。H₂这种有益作用的分子机制似乎包括其抗凋亡活性,这与PI3K/Akt/FoxO3+通路的激活有关。此外,H₂保护II型肺泡细胞免受高氧损伤[75],并增加SIRT-1蛋白的激活。因此,已观察到它减少内质网应激以及抗氧化HO-1和Nrf2通路的激活[30,52]。
9.5 机械通气诱导的肺损伤
机械通气诱导的肺损伤(VILI)是一个重要的临床问题,两项小鼠研究[140,141]已针对此问题展开探讨。在这两项研究中,H₂均通过吸入给药,导致肺水肿减少、炎症细胞浸润减少和炎症介质减少。同时,肺功能和气体交换得到增强[141]。Huang等人[140]提出的一个有趣机制表明,对H₂的反应呈双相性,下游效应可能随阶段发生变化。在吸入开始约一小时后的初始阶段,治疗导致NFκB通路激活、Bcl-2增加和Bax蛋白表达减少。在随后的阶段,H₂会诱导NFκB激活和NFκB DNA结合减少,从而减少肺细胞凋亡。与其他ALI一样,H₂的抗氧化特性起着重要作用。
9.6 海水诱导的肺损伤
通常认为,除了基于LPS的模型外,最有效的ALI动物模型之一是将海水滴入气道的模型。这两种模型均表现出肺水肿、肺泡塌陷、表面活性物质破坏以及低氧血症和氧化应激增加等特征。海水诱导的ALI表现出与溺水受害者一致的症状,而LPS诱导的ALI在本质上更具炎症性。值得注意的是,渗透压应激已被确定为海水诱导的ALI发病机制的一个促成因素[61,128,142]。在一项对滴入海水的兔子的研究中,吸入2%的H₂导致肺上皮通透性和组织病理学变化减少。此外,氧化应激标志物(如肺组织中的MDA水平)和气道炎症标志物(包括BALF中的IL-1β、IL-6、TNF-α)以及作为中性粒细胞浸润标志物的MPO活性均降低。此外,促凋亡标志物如caspase-3以及作为过程的凋亡均减少。关于其他类型的ALI的其他观察结果显示,HO-1和Nrf2及其各自的通路表达增加,表明它们在H₂活性及其对肺损伤的影响中的作用[61]。
9.7 其他形式的肺损伤
对于由烟雾、烧伤或辐射等触发因素引起的其他形式的ALI,也有类似的发现。在所有情况下,均描述了肺泡结构的改善、肺泡壁增厚的减少、促炎(IL-1β、IL-6、TNF-α)、促凋亡和凋亡指数标志物水平的降低,以及抗氧化酶如SOD的表达和活性升高。因此,无论给药途径如何,这些变化均导致ROS和MDA水平降低、炎症减轻和肺细胞凋亡减少[30,143]。
10. 氢气与感染性疾病
除了COVID-19之外,关于氢气在感染性疾病治疗中的潜在应用知之甚少。关于其在最常见的呼吸系统感染中的应用信息匮乏,这些感染由肺炎链球菌、流感嗜血杆菌、卡他莫拉菌、化脓链球菌、肺炎支原体、百日咳博德特菌、伯克霍尔德菌、肺炎衣原体、白喉棒状杆菌、流感嗜血杆菌、肺炎支原体、肺炎链球菌、伯纳特柯克斯体和军团菌等病原体引起。此外,缺乏探讨氢气在治疗呼吸道病毒感染(由鼻病毒、腺病毒、流感和副流感病毒、呼吸道合胞病毒、肠道病毒引起)中的应用的研究论文。
氢气在呼吸道感染中的唯一应用是治疗急性COVID-19和COVID后综合征。COVID-19由严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2病毒)过度激活免疫系统引起,导致严重的炎症性肺炎和病毒引起的直接肺泡损伤。这些损伤导致肺泡气体交换减少,从而导致低氧血症和呼吸困难[31,144]。因此,可能发生继发感染的发展和机械通气的需要[31,145]。在细胞水平上,SARS-CoV-2病毒激活INF-γ通路,导致免疫系统过度反应和所谓的细胞因子风暴,其特征是促炎介质(包括促炎细胞因子)的过度分泌[145]。同时,负反馈的抑制和反馈反应的放大导致细胞因子产生增加和白细胞中NADPH通路的激活。这反过来又通过ROS水平升高增强氧化应激[32,146]。COVID-19感染的临床表现与脓毒症相似,因为这两种病症均以症状迅速发展为特征,包括持续性中性粒细胞增多[144,147]。
最近疫情期间的人体研究表明,在不同浓度下将氢气与经典的吸氧疗法联合使用具有积极效果。与单独的氧疗相比,氧气中4%至66%的H₂降低了疾病的严重程度、呼吸困难、胸闷、咳嗽、疲劳和住院时间。同时,患者的出院率、血氧饱和度和总体健康状况更高。氢氧联合给药的呼吸效应可能与氧气更深地渗透到支气管区域、随后降低气道阻力、增加氧合和改善总体呼吸功能以及刺激黏液排出有关[31,62,148]。
在细胞水平上,H₂吸入的效应与其抗氧化和抗炎特性有关[31]。具体而言,H₂减少了中性粒细胞和巨噬细胞向肺部的浸润[149],从而抑制了它们的过度激活和随后促炎介质的释放,包括IL-1β、IL-6、TNF-α、HMGB-1、CCL和MCP-1。此外,H₂抑制了NLRP3、NFκB和MPO的激活[30,31,32,150],并调节了Nrf2通路[30]。因此,这导致细胞因子风暴和炎症的消退[149,151],并限制了气道损伤[32]。在轻度感染发作时给予H₂,已观察到可预防细胞因子风暴的发作,这可能是通过早期抑制氧化应激实现的[6,31]。值得注意的是,这些效应并非归因于H₂与病毒的直接相互作用[31],并且与其变体(奥密克戎与其他病毒变体)无关[151]。
在全球疫情背景下,吸入氢气(H₂)已成为一种有前景的COVID-19治疗方法。这种主要在中国采用的方法[149]在临床试验中显示出巨大潜力,目前正被探索为一种安全且经济高效的治疗选择。此外,氢气吸入已应用于COVID-19后呼吸康复。不同时长的H₂/O₂吸入已被观察到可降低症状严重程度、焦虑感(表现为疲劳评估量表(FAS)评分降低),还可改善呼吸功能(用力肺活量(FVC)、分钟通气量(VE)和第1秒用力呼气容积(FEV1)增加)。总体健康状况改善(以6分钟步行试验(6-MWT)距离增加衡量)和生活质量提高也有记录[18,152,153]。
11. 氢气与癌症
氢气在治疗呼吸道各种癌症及作为辅助治疗方面显示出疗效。
体外研究表明,富H₂培养基可减小舌癌细胞的集落大小和形成,降低人纤维肉瘤和食管癌细胞以及A549细胞的增殖[154,155]。此外,H1975细胞经处理后,细胞活力、迁移和侵袭能力下降,并催化细胞凋亡[155]。
动物研究显示,肿瘤重量和体积减小,鳞状细胞癌的细胞数量减少。此外,给予H₂后,结直肠癌小鼠的存活率提高[25,156]。A549异种移植小鼠表现出肿瘤生长减弱,同时抑制ROS产生和炎症进展(以IL-1β、IL-13、TNF-α水平降低衡量),表明H₂的抗氧化和抗炎特性在癌症治疗中也很重要[25,155]。值得注意的是,如前所述,H₂给药对健康动物或非癌细胞系无影响[25,157]。
然而,在人体中观察到了最引人注目的结果。吸入H₂或饮用HRW已显示可降低肿瘤标志物水平、肿瘤体积及其形成。这些干预措施导致疾病控制增强,包括更长的无进展期和更高的存活率,有些病例完全缓解[22,23,25]。患者报告生活质量改善,身体状况更好,肺部症状更少[158]。与传统疗法(如顺铂)和现代疗法(包括纳武单抗等抗体)联合使用时,H₂增强了药物活性,导致疗效增强、疾病控制改善,并减少治疗副作用,如肾毒性、体重减轻、失眠、疼痛或放疗引起的听力损失[23,159,160,161]。上述效果已在诊断为各种呼吸道癌症的患者中观察到。这种活性的机制涉及一系列过程,包括抑制ROS产生[159]、恢复免疫细胞(包括NKT、NK、T细胞)的最佳水平和活性,以及恢复免疫系统的正常功能[22,156,159]。这些过程延伸到促凋亡和抗凋亡通路的调节。如Yang等人所示,后者包括激活ROS/NLRP3/caspase-3/ gasdermin D介导的焦亡通路[162]。此外,已记录到抑制血管内皮生长因子(VEGF)表达和下调染色体浓缩调节因子(如染色体结构维持复合体(SMC)-2、5、6)[25,155,163]。此外,H₂的作用导致过度激活的Wnt/β-连环蛋白信号通路受到抑制,进而抑制肿瘤进展[164]。
放疗是一种常见的癌症治疗选择,但其伴随显著的副作用。放疗的疗效主要基于核酸、脂质和蛋白质水平对辐射能量的直接吸收,以及水辐射分解过程中随后产生的自由基[26,27]。放疗的主要副作用包括皮肤损伤、骨髓紊乱、免疫系统功能障碍、胃肠道损伤和认知障碍等。在临床环境中,使用了一系列辐射防护剂,包括维生素C、D、E、褪黑素、α-硫辛酸和N-乙酰半胱氨酸,主要起自由基清除剂的作用[24,165,166]。然而,这些药物并非没有副作用。在此背景下,已提出将氢气作为一种新的治疗选择,在放疗期间作为辅助治疗。
体外研究表明,在富H₂培养基中,暴露于放疗的A549、HIEC、HaCaT和BMSC细胞的ROS产生减少,氧化应激和凋亡标志物改善,存活率更高[167,168,169,170]。
在动物中,H₂与放疗联合给药已显示可防止免疫功能障碍[92,171]、急性和慢性肺[170]、心肌[172]、胃肠道[173]和黏膜[174]损伤。此外,H₂给药与皮炎、肾毒性和体重减轻的发生率降低相关[2,168]。此外,已证明它可提高存活率[175]并促进组织恢复和伤口愈合[176]。注册的临床试验和观察性人体研究显示,在调强放疗期间可防止骨髓损伤[177],并改善生活质量,包括与H₂给药联合时改善味觉障碍或厌食[178]。
H₂的辐射防护作用主要归因于其羟基自由基清除活性[3],强调了其抗氧化特性和通过降低线粒体DNA氧化水平和NLRP3级联反应的抗氧化活性。H₂的抗凋亡特性(其抗氧化和抗炎特性的结果)进一步增强了辐射防护作用。此外,促氧化和抗氧化基因表达的调节可能在辐射防护中起重要作用。
12. 未来展望与局限性
如今,氢气治疗的受欢迎程度正在上升。这种普及不仅出现在专业医疗中心,也作为健康或美容相关治疗选择的一部分。购买和租赁用于产生氢气的专业设备的经济负担正在减轻。在包括日本在内的几个国家,含有用于产生H₂的镁的胶囊已投放市场,并且H₂已被批准作为膳食补充剂[179]。氢相关治疗的广泛应用和日益普及导致氢气被视为一种新的万灵药。一个重要的问题是,氢气给药是否可以作为一种家庭治疗,一种轻度感染(如普通感冒)的附加治疗形式,类似于盐水吸入[180]。鉴于H₂在治疗COVID-19中的已证明疗效,它也可能有效治疗其他病毒性疾病,包括流感。另一个研究点是H₂可能的抑菌活性。已观察到一些病原体(如沙门氏菌或分枝杆菌[181,182])在感染进展期间利用氢气;因此,它不能用于减少所有细菌感染及其进展。迄今为止,没有关于H₂在呼吸道细菌感染中成功应用的数据。然而,已观察到氢气可减轻LPS和脓毒症诱导的ALI的症状,这些症状可能是细菌性的[181,182]。此外,H₂在细菌-病毒混合感染中的可能用途仍有待阐明。H₂吸入在特应性受试者中预防过敏加重、在易感受试者(如春秋感染季节的学龄儿童)中预防呼吸道感染的潜力,以及其作为免疫调节剂的作用(由于其抗炎特性),仍有待阐明。
尽管氢气具有优势特性,但其在临床和家庭环境中的应用受到限制。主要关注的是安全性,因为氢气在空气中浓度超过4–5%时具有爆炸性;此外,需要特殊设备来确保在此限值以上的安全给药,因此这种给药方式相当局限于专业机构。其次,H₂的精确给药具有挑战性,因为本综述中描述的所有方法(吸入除外)都无法确保所需的H₂水平。第三,富氢溶液的稳定性构成重大挑战,因为开放容器中溶解的氢气每3分钟损失约2–5%[8]。因此,迫切需要开发经济高效的捕获和存储系统来减少这些损失。另一个问题是与氢气生产、氢气发生和存储设备的成本以及这些系统的维护相关的经济负担。
13. 结论
氢气作为一种相对简单、经济高效且安全的急慢性呼吸系统疾病治疗选择,已受到越来越多的关注。其涉及抗炎、抗氧化和抗凋亡机制的多方面活性有助于更全面的治疗方法,解决疾病的多个方面,而不是单一症状或途径。因此,氢气在医学学科及相关的人类和兽医学领域的应用仍有相当大的潜力。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1485977.html?mobile=1
收藏

