博文
肠道衰老的微生物分子促使造血干细胞走向癌变  精选
精选
|
肠道衰老的微生物分子促使造血干细胞走向癌变
患血癌的风险会随着年龄的增长而增加。肠道细菌产生的一种分子在其中发挥作用这一发现,为干预血癌提供了新的途径。
每一秒,人体都会生成数百万个红细胞、白细胞以及被称为血小板的血细胞碎片。这些血液成分负责运输氧气、对抗感染以及防止出血[1]。它们由一群被称为造血干细胞(HSCs)的细胞生成。阿加瓦尔(Agarwal)等人在《自然》杂志上发表的文章[2]揭示了一种将衰老与肠道功能障碍以及造血干细胞异常联系起来的机制。
造血干细胞存在于骨髓中,在骨髓里它们维持着血细胞的平衡生成,并在有需要时对急性应激源做出反应。随着造血干细胞的老化,其DNA会积累突变,这会使其中一些细胞在分裂和生成血细胞的能力上比其他细胞更具优势。这种被称为克隆性造血的生长优势过程,与患血癌的风险增加有关——此时个体处于所谓的白血病前期状态——同时也与患如心脏病等与衰老相关疾病的风险增加有关。
自从十多年前克隆性造血现象被发现以来[3-5],相关研究已开始揭示驱动具有各种突变的细胞谱系生长(这一过程被称为突变克隆扩增)的机制,并确定这种生长与恶性或非恶性疾病发展之间的关联[6]。患有克隆性造血的人每年大约有0.5%至1.0%的几率进展为血癌[3]。多种因素与疾病进展的最高风险相关[7],比如某些类型或数量的突变,或者特定的突变细胞群体(克隆)是否在血细胞总数中占比超过20%。阿加瓦尔及其同事的研究拓展了我们对驱动克隆性造血机制的理解,或许还能为预防白血病的发生提供思路。
与衰老相关的变化,包括促炎因子水平的上升、肥胖的出现,或者自身免疫性或炎症性疾病的发生,都与白血病前期细胞的生长有关[8,9]。然而,这类促进细胞生长过程的环境调节因子此前并不为人所知。
阿加瓦尔及其同事的研究灵感来源于这样一个观察结果:在患有炎症性肠病(IBD)的患者体内常常能发现DNMT3A基因突变。炎症性肠病是一组与肠道炎症相关的慢性疾病[10]。在炎症性肠病中,肠道上皮细胞形成的屏障会受损,使得微生物及其产生的分子能够进入肠道组织和血管。阿加瓦尔及其同事研究了衰老对白血病前期细胞生长的影响,考察了肠道屏障的完整性以及肠道微生物的作用。
作者们使用了来自小鼠模型的造血干细胞,这些小鼠模型经过基因改造,有的缺失Dnmt3a基因,有的则带有在克隆性造血患者体内常见的特定突变形式的DNMT3A基因。他们还研究了从多种来源分离出的造血干细胞的生长情况:65岁以下的健康人群(年轻人)、65岁及以上的健康人群(老年人),以及被诊断患有克隆性造血、炎症性肠病或被称为骨髓增生异常综合征的血癌患者。
来自衰老小鼠和老年人的血液样本显示出肠道屏障受损的迹象,这是由于与衰老相关的血液中革兰氏阴性菌数量增加所导致的,而且这种变化伴随着微生物分子ADP-庚糖出现在血液中(图1)。ADP-庚糖值得关注,因为它能够刺激免疫反应,而且它能从存活和死亡的革兰氏阴性菌中释放出来,并且可以穿过哺乳动物细胞的细胞膜[11]。在接受检测的年轻人的血液中未检测到ADP-庚糖,但在老年人的血液样本中,以及患有克隆性造血、炎症性肠病或骨髓增生异常综合征的患者的血液样本中则存在这种分子。
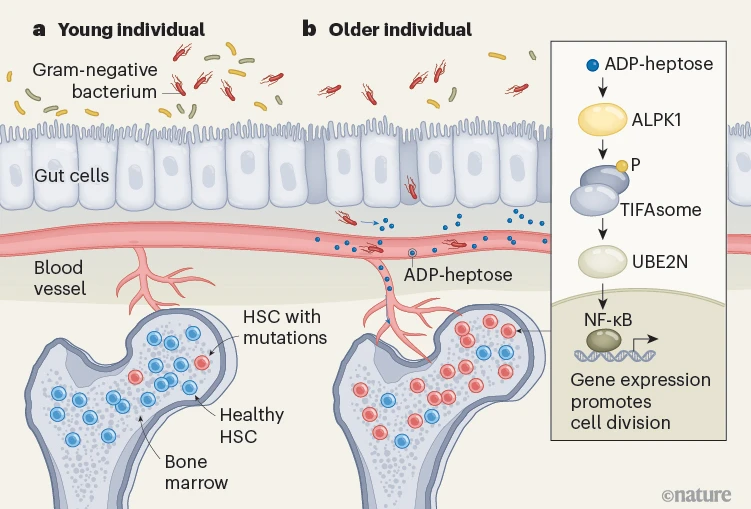
图1 | 肠道微生物如何使干细胞易于发展成血癌。阿加瓦尔等人[2]揭示了是什么驱动了骨髓中造血干细胞(HSCs)的分裂,这些造血干细胞存在DMNT3A基因突变。这样的细胞可能会发展成血癌,并且随着人年龄的增长,患血癌的风险也会增加。a,在年轻人(65岁以下)中,肠道上皮细胞形成一道屏障,阻止包括革兰氏阴性菌在内的微生物进入血管。造血干细胞大多是健康的,只有少数存在突变。b,在老年人(65岁及以上)中,受损的肠道屏障使得革兰氏阴性菌能够进入血液并释放分子ADP-庚糖。这种分子促进了突变造血干细胞的分裂。ADP-庚糖激活了激酶ALPK1,然后该激酶会给形成一种名为TIFAsome的复合物的蛋白质添加一个磷酸基团(P)。这个促进细胞分裂的途径还涉及蛋白质UBE2N,以及随后转录因子NF-κB的激活,而NF-κB会驱动促进生长的信号传导。
在克隆性造血的小鼠模型中,以及在对移植到小鼠体内的骨髓增生异常综合征患者细胞的研究中,添加ADP-庚糖足以赋予突变的白血病前期细胞生长竞争优势。阿加瓦尔等人报告称,在白血病前期的造血干细胞中,ADP-庚糖激活了激酶ALPK1,进而导致形成了名为TIFAsome的大型蛋白质复合物。这些复合物在一种名为UBE2N的泛素连接酶的辅助下,激活了由转录因子NF-κB介导的信号传导。这随后促进了白血病前期细胞的分裂。作者们在体外实验中使用了一种UBE2N抑制剂,抑制了缺乏Dnmt3a基因的白血病前期细胞在ADP-庚糖驱动下的生长。
这项研究的优势在于其来自精心控制实验的大量小鼠和人体数据,这些实验探究了驱动白血病前期细胞生长的因素的充分性和必要性。阿加瓦尔及其同事已经在与衰老相关的变化和导致白血病前期细胞生长的信号通路之间建立了因果联系。他们证明了是老化的肠道和血液中的ADP-庚糖,而非突变细胞的年龄,驱动了白血病前期细胞的扩增。
这项研究的一个局限性在于,它主要关注了与克隆性造血相关的最常见但风险最低的突变(DNMT3A)。对于携带这种突变的个体来说,临床干预带来的副作用风险可能会超过治疗的益处。目前尚不清楚阿加瓦尔及其同事所确定的机制是否适用于克隆性造血中那些最需要治疗的高风险突变。
阿加瓦尔及其同事的研究指出了许多潜在的治疗策略,这些策略可以作为阻止克隆性造血进展为血癌的方法加以研究。从造血干细胞移植的研究中我们知道,移植前微生物多样性较低,且移植接受者体内单一微生物群体(分类群)占主导地位,这与移植相关死亡的风险较高相关[12]。使肠道微生物多样化的策略可能是预防克隆性造血的有效措施。作者们的研究还指出了一些此前可能未被考虑过的恢复肠道完整性或操控微生物的干预措施。
除了抑制UBE2N之外,靶向ALPK1也值得研究。它具有可作为靶点的酶结构域,而且编码ALPK1的基因并非必需基因,这使得它成为一个很有前景的治疗靶点,尽管缺乏Alpk1基因的小鼠在某些细菌感染的情况下会患上肠道疾病结肠炎[13]。最后,是否应该将微生物多样性纳入当前的风险预测模型,并在临床试验中进行监测,这一点也有待确定。
还有许多问题有待解答。驱动克隆性造血细胞中ALPK1表达上升的机制尚未完全明晰。这项研究表明,一种名为DNA甲基化的特定DNA修饰的变化可能是原因所在,但这需要进一步研究。同样不清楚的是,为什么细胞生长对ALPK1的依赖只特定于突变的造血干细胞。
免疫系统在克隆性造血中扮演着什么角色?是否应该对患有炎症性肠病的患者进行克隆性造血监测,或者是否应该测试旨在使他们的肠道微生物多样化并改善肠道健康的策略?缺乏Dnmt3a基因(而非含有Dnmt3a基因)的造血干细胞在接触ADP-庚糖时准备激活转录程序的机制,也仍有待确定。未来对这些方面的研究或许会为治疗干预开辟更多途径。
阿加瓦尔及其同事的发现为研究肠道和微生物缺陷如何促使白血病前期状态进展为明显疾病的临床和机制研究奠定了基础。这项工作无疑将激发未来关于降低这种疾病进展风险的研究。
https://wap.sciencenet.cn/blog-41174-1483994.html
上一篇:饮用氢气纳米气泡水辐射防护作用研究【日本2025】
下一篇:氢疗法的机制、给予方式及应用 2025年大综述