氢气对珊瑚热应激的保护作用,包括氢气的危害性
由于全球海洋变暖,珊瑚礁正日益受到大规模白化事件的威胁。在全球努力缓解海洋变暖之前,迫切需要新的管理策略来帮助珊瑚生存。鉴于氢气具有强大的抗氧化、抗炎和抗凋亡特性,我们的研究探索了氢气减轻热应激对珊瑚负面影响的潜力。我们研究了来自红海中部的两种常见硬珊瑚(鹿角珊瑚属物种和疣杯形珊瑚)在环境温度(26°C)和升高的海水温度(32°C)下,添加和不添加氢气(约150微摩尔/升的H₂)48小时内的生态生理反应。我们的结果表明,在32°C且不添加氢气的情况下,疣杯形珊瑚表现出较高的耐高温性,而鹿角珊瑚属物种与环境条件(26°C)相比,光合效率和最大电子传递速率显著降低。在32°C时添加氢气使鹿角珊瑚属物种的最大电子传递速率提高了28%,维持在与26°C时相当的水平。相比之下,在26°C时添加氢气导致鹿角珊瑚属物种和疣杯形珊瑚的光生理显著下降。这表明珊瑚共生体对氢气的短期反应具有温度依赖性,在热应激下可能对珊瑚共生体有益,而在普通环境温度下会损害其光生理。因此,我们的发现为未来揭示氢气背后机制的长期研究奠定了基础,有可能为制定新的管理策略提供信息,以增强珊瑚对海洋变暖的适应能力。
本研究发表在plos one
Temperature-dependent responses of the hard corals Acropora sp. and Pocillopora verrucosa to molecular hydrogen
引言
珊瑚礁是全球生物多样性最丰富、生产力最高的生态系统之一 [1]。它们为人类提供了各种各样重要的生态系统服务 [1],数百万人的生计依赖于此 [2]。然而,由于许多不同的局部和全球人为及自然威胁,包括局部污染、过度捕捞和全球变暖 [5-9],珊瑚礁目前正严重衰退 [3,4]。
尽管目前许多这些威胁已被确定并部分得到解决,但气候变化仍在快速发展,在缓解方面取得的进展甚微 [10,11]。随着2023年厄尔尼诺现象的出现 [12],新的海洋温度记录不断涌现 [13,14],极大地增加了全球范围内珊瑚大规模白化和死亡事件发生的可能性和频率 [10,15-17]。迫切需要采取直接行动和策略,以进一步防止这些极具价值的生态系统迅速退化,并为珊瑚礁争取时间,直到全球努力能够控制气候变化 [18]。
与气候变化相关的物理和生物地球化学条件的变化被广泛认为会引发珊瑚白化,即珊瑚失去其作为主要能量来源的内共生藻类(共生藻科)[19,20]。因此,新的干预方法可以针对与珊瑚白化相关的生理级联反应,特别是那些由热应激引发的反应,这为提高珊瑚的适应能力提供了一个有前景的途径。已经提出了几个重要的级联反应,强调了氮可利用性和氧化应激的作用 [20]。一个级联反应涉及由于氮可利用性增加而破坏了对维持珊瑚宿主与其藻类之间稳定共生关系至关重要的氮限制状态 [19,21,22]。另一个级联反应涉及活性氧(ROS)和活性氮(RNS)的生成增加,主要由温度和光照应激触发,这超出了珊瑚的抗氧化能力,并可能引发应激反应,最终导致珊瑚白化,这就是 “氧化理论” 所提出的 [23,24]。
在这种背景下,氢气可能为缓解珊瑚白化提供一种有效的处理方法。由于氢具有强大的抗氧化、抗炎和抗凋亡特性,它已在人类医学中被用作预防和治疗剂 [25-30]。作为一种强抗氧化剂,氢气选择性地还原羟基自由基和过氧亚硝酸盐,它们是最具危害性的活性氧/活性氮之一 [25]。相比之下,其他具有潜在有益生理作用的活性氧/活性氮不受氢气的影响 [25,29,30]。由于氢气也能够迅速穿过细胞膜,它可以成功穿透细胞器 [25],并清除细胞质和线粒体中的活性氧/活性氮。此外,氢气被认为可以通过防止电子从电子传递链泄漏来抑制活性氧/活性氮的产生 [30],调节基因表达 [29],提高整体抗氧化能力 [31,32],并上调热休克反应 [33]。
基于先前在包括人类和大鼠在内的哺乳动物中观察到的氢气的这些作用 [25-30],我们在此首次深入了解氢气对珊瑚共生体的潜在影响。我们的目标是评估氢气是否会影响热应激下珊瑚的生态生理。考虑到其抗氧化、抗炎和抗凋亡特性 [25-30],我们假设氢气可以将热应激的负面影响降至最低。
为了解决这个研究问题并验证相关假设,我们通过实验研究了环境温度和热应激下富氢海水对来自红海中部的两种常见且分布广泛的硬珊瑚(鹿角珊瑚属物种和疣杯形珊瑚)的短期影响(48小时)。为此,我们分析了与白化表型、光合能力和共生体表型相关的几个生理参数。对于白化表型,分析了共生藻科细胞密度、叶绿素a和c₂浓度以及初级生产力(净初级生产力Pnet和总初级生产力Pgross)。这些参数可以直接表明内共生体和色素的丧失,这与初级生产力降低相关,并作为珊瑚白化的关键指标 [34]。
在评估白化表型的基础上,我们通过测量光合效率、最大电子传递速率(ETRmax)和最小饱和辐照度(Ek)来进一步评估光合能力,其中ETRmax表示电子传递链的最大能力,Ek反映光合作用达到饱和时的光照强度 [35]。因此,这些参数提供了对光合机构功能状态的深入了解 [35],温度引起的变化表明健康内共生体的丧失,或者揭示了光合机制内的破坏,甚至在内共生体丧失发生之前 [36,37]。
在共生体表型方面,我们评估了呼吸速率(R),它通常作为应激下代谢需求增加的替代指标 [34]。通过关联这些参数,我们对珊瑚共生体的健康状况进行了全面概述,确定了鹿角珊瑚属物种和疣杯形珊瑚对短期热应激的生理反应,并评估了氢在最小化温度引起的负面影响方面的潜在作用。
材料与方法
珊瑚采集与实验准备
为了评估添加氢气对珊瑚共生体的短期影响,选择了两种常见的红海珊瑚物种,鹿角珊瑚属物种和疣杯形珊瑚。鹿角珊瑚的断枝是根据形态特征(疑似亨氏鹿角珊瑚)采集的。然而,由于鹿角珊瑚属内的分类学较为复杂,我们决定保守地将其称为鹿角珊瑚属物种。珊瑚断枝是通过水肺潜水在位于沙特阿拉伯红海海岸图瓦尔的阿卜杜拉国王科技大学约20公里外的阿尔法哈尔礁(北纬22°18'19.1'',东经38°57'55.0'')的 “珊瑚益生菌村” 附近采集的。已从阿卜杜拉国王科技大学机构生物安全与生物伦理委员会获得许可(IBEC协议编号22IBEC003_v4)。
每个物种总共标记了六个珊瑚群体,深度约为10米,以便在实验期间识别和重新采样相同的群体。在每个采样日,使用钳子从每个群体采集两个长度约为3 - 5厘米的珊瑚断枝,并在水容器中收集90升海水。由于实验室空间有限,无法同时进行所有的培养实验。因此,在四个不同的日子进行了短期培养(48小时),每天随机分配到特定的温度和处理组(CT26、CT32、H₂26、H₂32)。这些培养实验在尽可能短的时间内进行,从2023年3月7日持续到23日,以尽量减少潜在的季节性变化的影响。对于每次培养,相应的珊瑚断枝都在同一天采集。我们采用这种方法的决定是出于对受控环境条件的需求、处理应用的可行性以及捕捉珊瑚较大生物变异性的目的。因此,我们的设置限制为每个处理和物种一个水箱,因为我们打算在48小时内施加热应激和处理,而不是进行长期的珊瑚养护。在此期间,使用多参数电导率、温度和深度(CTD)传感器(Ocean Seven 310,Idronaut,意大利)记录了包括海水温度和盐度在内的珊瑚礁环境参数(S1文件)。
实验设计
采集后,珊瑚断枝被放在装有环境海水的塑料箱内的透明采样袋中,并使用便携式水族箱泵进行运输,以确保通气。到达实验室后,立即将所有24个断枝附着在标有相应群体彩色条纹的定制支架上,并放置在两个塑料水族箱中,每个物种一个,水族箱中装有从珊瑚礁采集的30升海水。水族箱配备了一个水族箱泵和一个连接到恒温器的加热器,同时使用LED灯模拟自然光照,以复制12小时光照/黑暗周期(光合有效辐射PAR ~ 200微摩尔/平方米·秒,盐度39.0 ± 1.0‰,环境温度26.0 ± 0.5°C/升高到32 ± 0.5°C)。在每个采样日,所有断枝在一种处理(CT = 对照,H₂ = 富氢)和一种温度条件(环境温度 = 26°C,热应激 = 32°C)下培养48小时,从而产生四个不同的组:CT26、CT32、H₂26、H₂32。
为了提高氢气浓度,使用了一台氢水发生器(富氢水杯,ABS-FQ-02,Aukewel),根据制造商提供的测试报告,该发生器每个循环可产生240毫升浓度约为3ppm的富氢蒸馏水。在所有组中,在开始时和24小时后,用由MilliQ水和海洋海盐(红海盐,红海)在相应温度下配制的人工海水替换总海水量的10%。在氢气处理组中,人工海水事先进行了富氢处理,理论氢气浓度约为0.3ppm(约150微摩尔/升)。然而,由于氢气几乎不溶 [29] 且不断释放,我们只能假设在实验开始时和24小时后会出现氢气浓度峰值。在第一次换水后,热应激组的温度在2小时内从26°C升高到32°C。在整个实验过程中,使用手持式传感器(YSI专业增强型手持式多参数仪表)持续检查温度和盐度,以便可能对温度和盐度进行调整。由于在CT32组实验期间,疣杯形珊瑚水族箱中的加热器出现故障,水温在升温后的前12小时内降至28°C,然后在2小时内再次升温至32°C。
在48小时的培养期后,评估了几个与珊瑚生理和珊瑚共生体整体健康相关的响应参数,作为应激状态的替代指标。对每个断枝的存活和白化情况进行了视觉分析。然后,每个物种选取六个断枝用于测量光合作用和呼吸速率、光合效率(Fv/Fm)和快速光曲线(RLC)。每个物种剩余的六个断枝被冷冻,以便进一步分析共生藻科细胞密度以及叶绿素a和c₂含量。为了使响应参数与珊瑚断枝的大小归一化,根据Lavy等人 [38] 和Tilstra等人 [39] 的方法,在Autodesk ReCap Photo(版本23.1.0)中使用3D模型测量表面积。为此,从断枝的各个侧面拍摄至少20张照片。照片是在培养后拍摄的,以避免事先给珊瑚造成压力。根据这些照片创建3D模型,并进行切片,使其仅包含断枝表面。然后,程序使用放置在每张照片上的参考比例尺计算以平方厘米为单位的表面积。
数据收集
1.存活与白化情况:在48小时培养后,直接对所有断枝的存活和白化情况进行视觉评估。如果断枝出现100% 的组织损失,则将其归类为死亡。
2.光合作用与呼吸作用:每个物种的六个断枝被放置在定制的支架上,放入装有相应处理水的1升广口瓶中,并密封,确保瓶内没有气泡,以便根据Tilstra等人 [39] 和Mezger等人 [40] 的方法测量氧气通量。此外,每个水族箱中三个1升广口瓶装有不含任何珊瑚断枝的处理水,以考虑背景光合作用和呼吸速率。简而言之,所有广口瓶都放置在装有连接到恒温器的加热器的水浴中,以将温度维持在相应的温度条件下。放置在搅拌板上的磁力搅拌器(约200转/分钟)(磁力搅拌器HI 200M,Hanna instruments)确保了广口瓶内水流恒定且条件均匀。最初,所有断枝和海水空白样都在光照下培养90分钟(光合有效辐射PAR ~ 200微摩尔/平方米·秒),然后在黑暗中培养60分钟。光照和黑暗培养期的变化确保了氧气浓度保持在可靠的范围内。在光照和黑暗培养的开始和结束时,使用氧探头(Multi 3500i手持式万用表,WTW和YSI专业增强型手持式多参数仪表)测量氧气浓度。由于技术困难,在不同处理组之间使用了两个校准的氧探头(Multi 3500i手持式万用表,WTW用于H₂26组,YSI专业增强型手持式多参数仪表用于CT26、CT32和H₂32组)。
为了计算净光合作用(Pnet)和呼吸作用(R)速率,分别减去光照和黑暗培养开始和结束时的氧气浓度。然后,根据每个断枝的表面积、培养广口瓶的总体积、总培养时间以及背景光合作用和呼吸速率对Pnet和R进行归一化处理。
使用Pnet和R,根据以下公式计算总光合作用(Pgross):
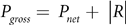
3.光合效率与快速光曲线:根据Ralph和Gademann [35] 以及Ralph等人 [41] 的方法,在黑暗培养后直接使用成像脉冲幅度调制荧光仪(Imaging-PAM,型号IMAG-K7,Walz GmbH)测量光合效率,因为珊瑚已经在黑暗中适应了超过30分钟。对于每个断枝,使用以下PAM设置测量暗水平荧光产量(F0)和最大荧光产量(Fm):增益 = 2,阻尼 = 2,饱和强度 = 7,饱和宽度 = 4,测量光强度 = 7。在珊瑚断枝上随机选取五个点计算最优PSII量子产量(Fv/Fm)。此外,随后对相同的五个点通过暴露于十二个光照系列(辐照度从0增加到702微摩尔光子/平方米·秒)生成快速光曲线(RLC)。在十二个光照系列之间,断枝用相应的作用光照射20秒,每个光照系列以一个饱和脉冲结束。对于每个断枝的五条RLC曲线,根据Platt等人 [42] 的方法使用以下公式拟合一个模型:
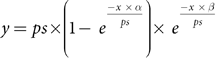
对于该模型,预先排除了在辐照度高于0微摩尔光子/平方米·秒时记录的0微摩尔电子/平方米·秒的值。进行这种排除是因为在选择感兴趣的变量之前,该模型对这个范围较为敏感。为了确定变量ps、α和β,在R程序v.4.3.0 [44] 中的phytotools v.1.0 [43] 软件包内运行了一个伪随机搜索算法。使用确定的变量,按照以下公式计算最大电子传递速率(ETRmax)和最小饱和辐照度(Ek):
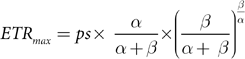
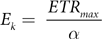
共生藻科细胞密度和叶绿素浓度
使用装有10毫升蒸馏水的喷枪去除珊瑚组织。将组织浆液收集在一个15毫升的离心管中,以测量总体积。在处理不同断枝之间,用70% 的乙醇清洗喷枪。喷枪处理后,将浆液在 -20°C 下冷冻,等待进一步分析。
为了评估共生藻科细胞密度,将总共100微升的组织浆液解冻并涡旋振荡(模拟涡旋混合器,VWR)。然后将每个样品在8000转/分钟的条件下离心5分钟(离心机5424R,艾本德公司)。随后,弃去上清液,并向沉淀中加入1毫升的超纯水(MilliQ水)。在溶解沉淀并使用涡旋混合器(模拟涡旋混合器,VWR)使混合物均质化后,将样品移液到孔径为30微米的细胞筛上,以去除较大的细胞。过滤后,每个样品取200微升,一式两份地置于微孔板的孔中。然后使用流式细胞仪(Accuri C6流式细胞仪,美国BD公司)测量共生藻科细胞密度。在样品之间,运行清洗和搅拌循环,并且每三个样品之间,对微孔板进行涡旋振荡,以确保混合物均匀。每个样品运行2分钟,如果流式细胞仪记录的事件数/秒超过1000,则用超纯水稀释样品并重新运行。初始计数根据流式细胞仪采样的体积、表面积、稀释倍数和浆液体积进行归一化处理。
将总共1毫升的组织浆液解冻,并用于一式两份地测量叶绿素a和c₂的含量。每个样品在4°C 下以5000转/分钟的速度离心5分钟(离心机5424R,艾本德公司),然后弃去上清液。为了提取叶绿素a和c₂,向每个样品中加入2毫升90% 的丙酮。然后将样品超声处理10分钟,并在4°C 下黑暗孵育24小时。24小时后,将每个样品的200微升,一式两份地转移到微孔板的孔中。此外,在每个微孔板的孔中放置三个200微升的90% 丙酮空白样,以便随后对测量值进行归一化处理。使用分光光度计(Multiskan SkyHigh微孔板分光光度计v.1.0.70.0,赛默飞世尔科技公司)通过测量在630纳米(E630)和663纳米(E663)处的吸光度来评估叶绿素a和c₂的浓度。最终值根据Jeffrey和Humphrey [45] 的方法计算,并根据表面积、浆液体积和空白样的平均吸光度进行归一化处理。由于Jeffrey和Humphrey [45] 假设的光程长度为1厘米,这对于微孔板的孔来说是不准确的,所有值都额外除以0.555。最终的叶绿素a和c₂浓度也根据共生藻科细胞密度进行了归一化处理。
统计分析
统计分析在PRIMER-E软件v.6.1.18 [46] 中进行,并使用PERMANOVA + 插件v.1.0.8 [47],采用置换多元方差分析(PERMANOVA)。对原始数据进行无限制置换(999次置换)的III型(偏)PERMANOVA分析,包括蒙特卡罗检验,分析是在一个相似性矩阵上进行的,该矩阵是用先前归一化数据的欧几里得距离创建的。对每个物种的氧气通量(净光合作用Pnet、呼吸作用R、总光合作用Pgross)、光合效率(Fv/Fm)、快速光曲线(α、光系统II电子传递速率ps/最大电子传递速率ETRmax、最小饱和辐照度Ek)、叶绿素(叶绿素a Chla、叶绿素c₂ Chlc₂)和共生藻科细胞密度(S1文件)等变量进行两因素(因素:温度 [T;两个水平:26°C、32°C],处理 [Tr;两个水平:对照、氢气])PERMANOVA分析。当p值小于0.05时,结果被认为是显著的。如果交互作用效应(T x Tr)显著,则在温度和处理水平内进行包括蒙特卡罗检验的PERMANOVA成对检验。
快速光曲线(RLC)模型和所有图表均在R软件v.4.3.0 [44] 中使用phytotools v.1.0 [43]、tidyverse v.2.0.0 [48]、ggpubr v.0.6.0 [49] 和rstatix v.0.7.2 [50] 软件包创建。所有的图和值均表示平均值和相应的标准误差(MEAN ± SE)。原始数据见支持信息(S1数据)。
结果
存活与白化情况
在所有处理组(CT26、CT32、H₂26、H₂32)中,鹿角珊瑚属物种和疣杯形珊瑚均未表现出明显的死亡或白化迹象。
光合作用与呼吸作用
鹿角珊瑚属物种的总光合作用和呼吸速率受到温度的显著影响(图1A,PERMANOVA分析,p(呼吸作用) = 0.004,p(总光合作用) = 0.049)。在热应激条件下(CT32和H₂32组),与环境海水温度条件下(CT26和H₂26组)相比,总光合作用和呼吸速率显著增加。
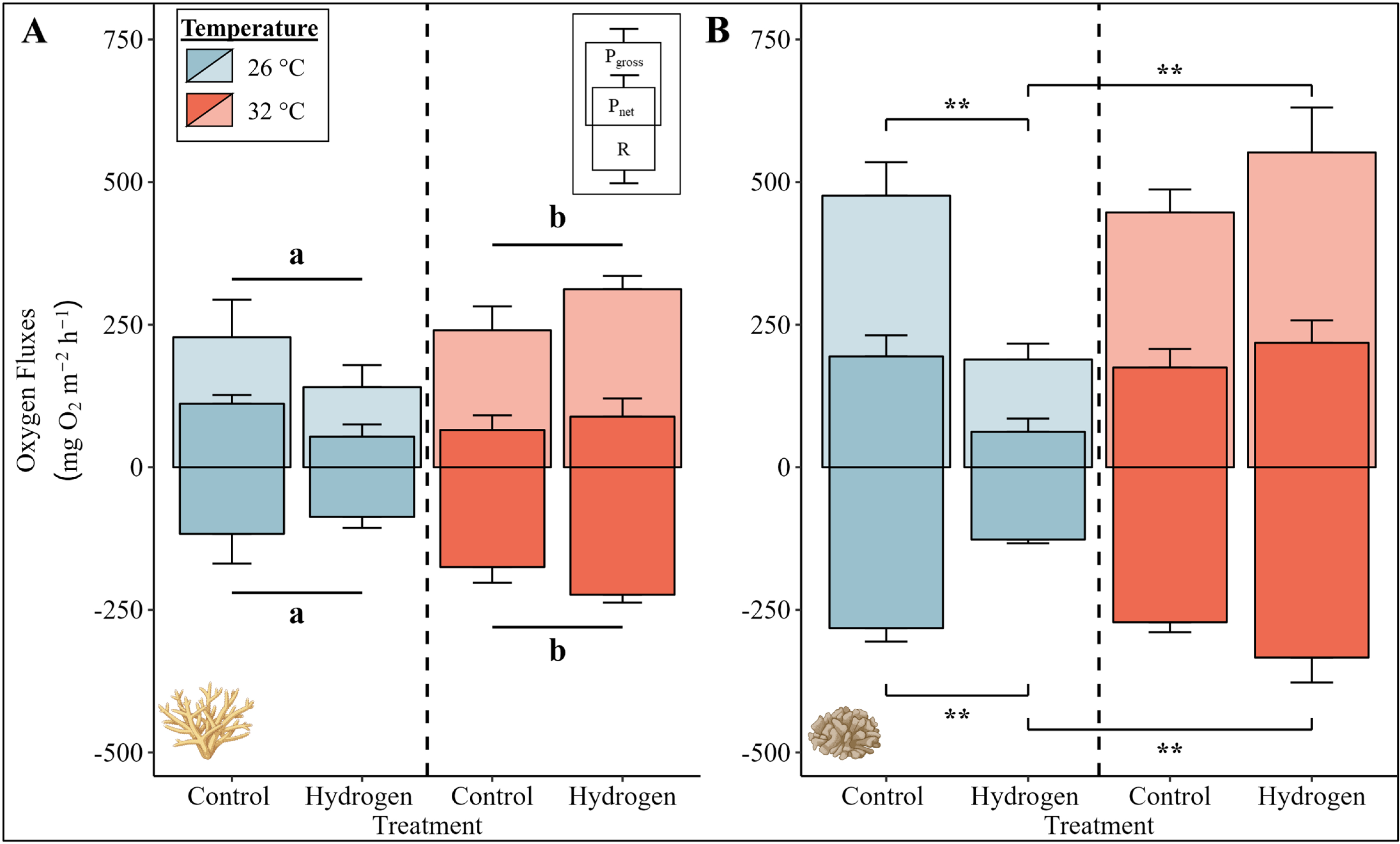
图1. (A)鹿角珊瑚属物种和(B)疣杯形珊瑚在四组实验中的光合作用和呼吸速率。
平均净光合作用和总光合作用(Pnet和Pgross)以及呼吸作用(R)速率以柱状图表示,误差条表示每组六个重复的相应标准误差(SE)(由于测量误差,鹿角珊瑚属物种的CT26组为四个重复,疣杯形珊瑚的CT32组为五个重复)。柱状图的颜色表示温度条件(蓝色 = 26°C,红色 = 32°C)。对于鹿角珊瑚属物种(A),根据带有蒙特卡罗检验的PERMANOVA分析,显著的温度主效应以字母表示(a/b表示p < 0.05;柱状图上方:Pgross,柱状图下方:R),并用黑线对温度条件进行分组。对于疣杯形珊瑚(B),由于温度和处理之间的交互作用效应显著,进行了带有蒙特卡罗检验的成对PERMANOVA分析。处理之间的显著差异用星号表示(*表示p < 0.05,表示p < 0.01;柱状图上方:Pgross,柱状图下方:R)。确切的p值见补充材料(S1文件)。珊瑚插图由BioRender.com创建。
https://doi.org/10.1371/journal.pone.0308894.g001
相比之下,疣杯形珊瑚的净光合作用、总光合作用以及呼吸速率受到处理和温度之间交互作用的显著影响(图1B,PERMANOVA分析,p(呼吸作用) = 0.001,p(净光合作用) = 0.019,p(总光合作用) = 0.003)。与CT26组相比,在环境海水温度下添加氢气(H₂26组)导致疣杯形珊瑚的净光合作用、总光合作用和呼吸速率显著下降(图1B,成对PERMANOVA分析,p(呼吸作用) = 0.013,p(净光合作用) = 0.001,p(总光合作用) = 0.003)。然而,在热应激条件下添加氢气(H₂32组)导致疣杯形珊瑚的呼吸速率、净光合作用和总光合作用速率显著高于H₂26组(图1B,成对PERMANOVA分析,p(呼吸作用) = 0.001,p(净光合作用) = 0.011,p(总光合作用) = 0.001)。H₂32组的这些光合作用和呼吸速率与在环境温度(CT26组)和热应激(CT32组)条件下的两个对照组中观察到的速率相似。
光合效率与快速光曲线
与光合作用和呼吸速率类似,鹿角珊瑚属物种的光合效率受到温度的显著影响(图2A,PERMANOVA分析,p = 0.003)。然而,与无热应激的处理组(CT26和H₂26组)相比,热应激(CT32和H₂32组)导致光合效率显著降低。
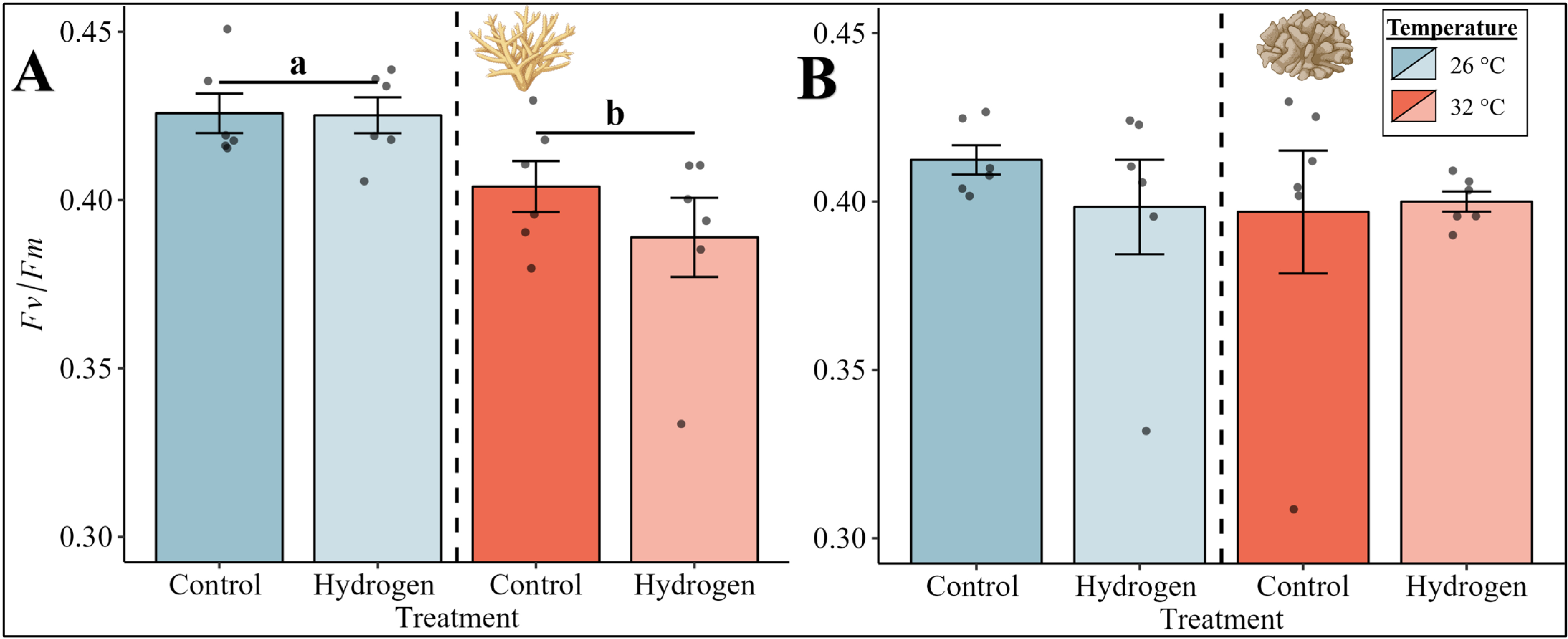
图2. (A)鹿角珊瑚属物种和(B)疣杯形珊瑚在四组实验中的光合效率(Fv/Fm)。
平均光合效率以柱状图表示,误差条表示每组六个重复的相应标准误差(SE)。柱状图的颜色表示温度条件(蓝色 = 26°C,红色 = 32°C)。根据带有蒙特卡罗检验的PERMANOVA分析,显著的温度主效应(p < 0.05)以字母表示,并用黑线对温度条件进行分组。确切的p值见补充材料(S1文件)。珊瑚插图由BioRender.com创建。
https://doi.org/10.1371/journal.pone.0308894.g002
相比之下,疣杯形珊瑚的光合效率不受温度或处理的影响。
从快速光曲线(RLC)中得出的鹿角珊瑚属物种的最大电子传递速率(ETRmax)和最小饱和辐照度(Ek)(图3A),均受到温度和处理之间交互作用的显著影响(图3B和3C,PERMANOVA分析,p(ETRmax) = 0.002,p(Ek) = 0.019)。与对照处理组CT26相比,鹿角珊瑚属物种在热应激处理组CT32(图3B,成对PERMANOVA分析,p = 0.003)和氢气处理组H₂26(图3B,成对PERMANOVA分析,p = 0.001)中的ETRmax显著降低。然而,在热应激和添加氢气的联合处理组(H₂32组)中,鹿角珊瑚属物种的ETRmax显著高于CT32组(图3B,成对PERMANOVA分析,p = 0.044)和H₂26处理组(图3B,成对PERMANOVA分析,p = 0.036),并且与CT26处理组中观察到的ETRmax相当。与ETRmax的下降类似,与对照组CT26相比,在富氢海水(H₂26组)存在的情况下,鹿角珊瑚属物种的Ek值也显著下降(图3C,成对PERMANOVA分析,p = 0.008)。
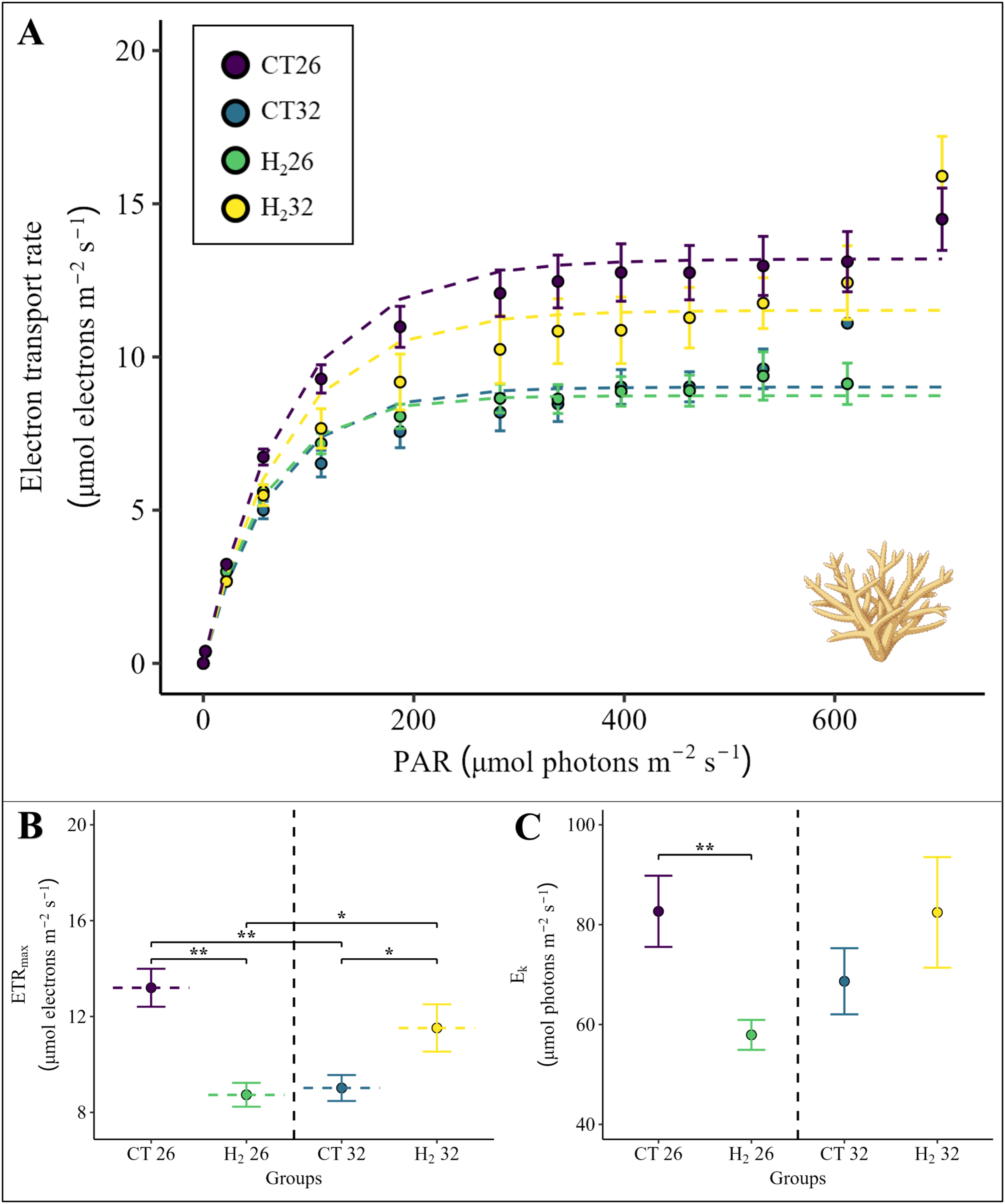
图3. (A)快速光曲线,(B)最大电子传递速率(ETRmax)和(C)根据Platt等人 [42] 拟合的模型得出的最小饱和辐照度(Ek),适用于鹿角珊瑚属物种的所有四组实验。
快速光曲线以及相应的ETRmax和Ek值计算为每组六个重复的平均值(S1文件)。四组实验用不同颜色表示。点表示平均值,误差条表示相应的标准误差(SE)。如果温度和处理之间的交互作用效应显著,则进行带有蒙特卡罗检验的成对PERMANOVA分析,并用星号表示显著差异(*表示p < 0.05,表示p < 0.01)。确切的p值见补充材料(S1文件)。珊瑚插图由BioRender.com创建。
https://doi.org/10.1371/journal.pone.0308894.g003
虽然从快速光曲线(RLC)中得出的疣杯形珊瑚的ETRmax(图4A)不受热应激或添加氢气的影响(图4B),但Ek受到温度的显著影响(图4C,PERMANOVA分析,p = 0.018),与无热应激的处理组(CT26和H₂26组)相比,在两个热应激处理组(CT32和H₂32组)中Ek显著降低。
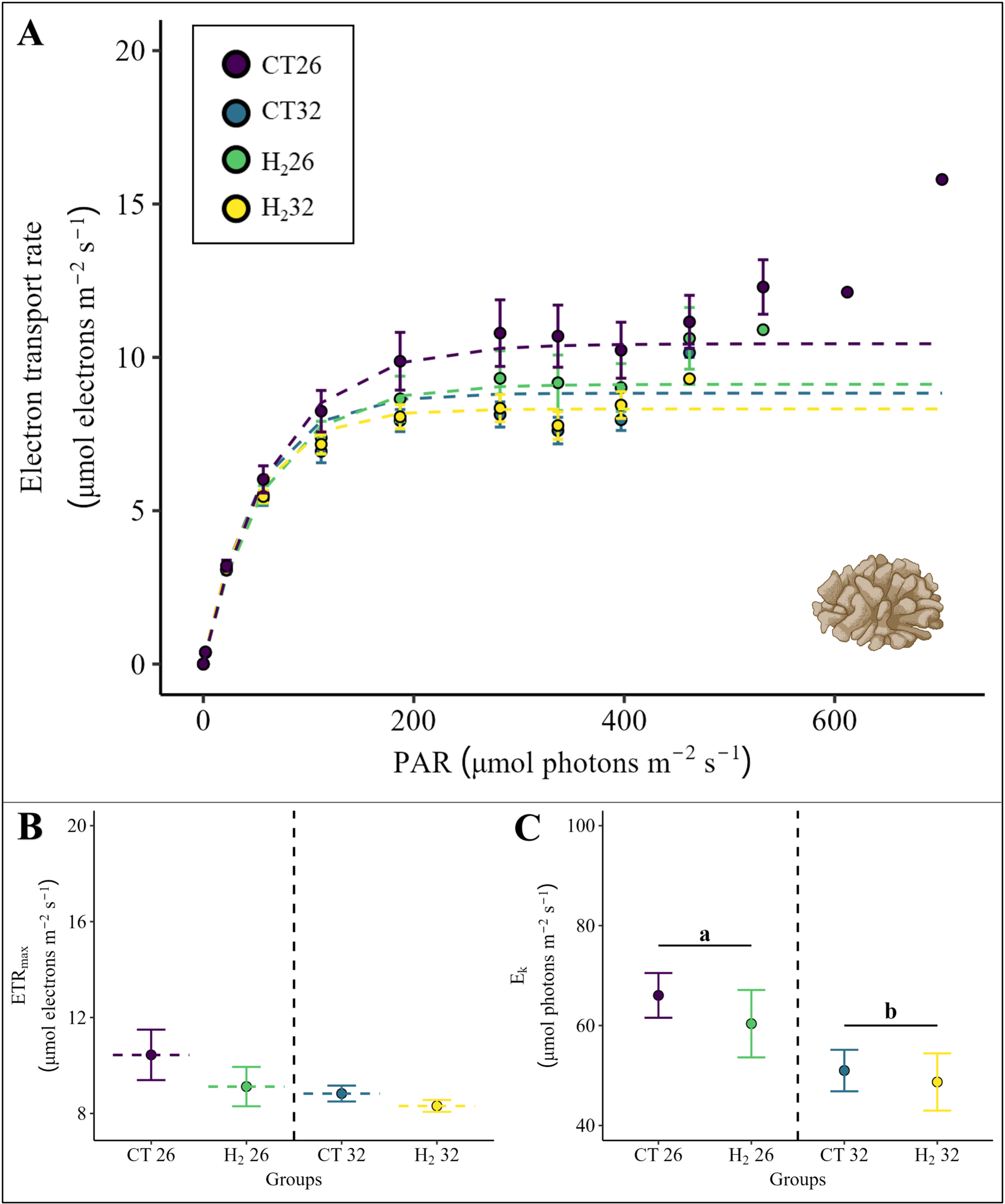
图4. (A)快速光曲线,(B)最大电子传递速率(ETRmax)和(C)根据Platt等人 [42] 拟合的模型得出的最小饱和辐照度(Ek),适用于疣杯形珊瑚的所有四组实验。
快速光曲线以及相应的ETRmax和Ek值计算为每组六个重复的平均值(S1文件)。四组实验用不同颜色表示。点表示平均值,误差条表示相应的标准误差(SE)。根据带有蒙特卡罗检验的PERMANOVA分析,显著的温度主效应(p < 0.05)以字母表示,并用黑线对温度条件进行分组。确切的p值见补充材料(S1文件)。珊瑚插图由BioRender.com创建。
https://doi.org/10.1371/journal.pone.0308894.g004
共生藻科细胞密度和叶绿素浓度
鹿角珊瑚属物种的共生藻科细胞密度受到温度的显著影响(图5A,PERMANOVA分析,p = 0.047)。与光合效率的显著下降相似,与环境温度下的处理组(CT26和H₂26组)相比,鹿角珊瑚属物种在两个热应激处理组(CT32和H₂32组)中的共生藻科细胞密度降低。然而,叶绿素a和c₂的浓度不受温度或处理的影响(图5C和5E)。
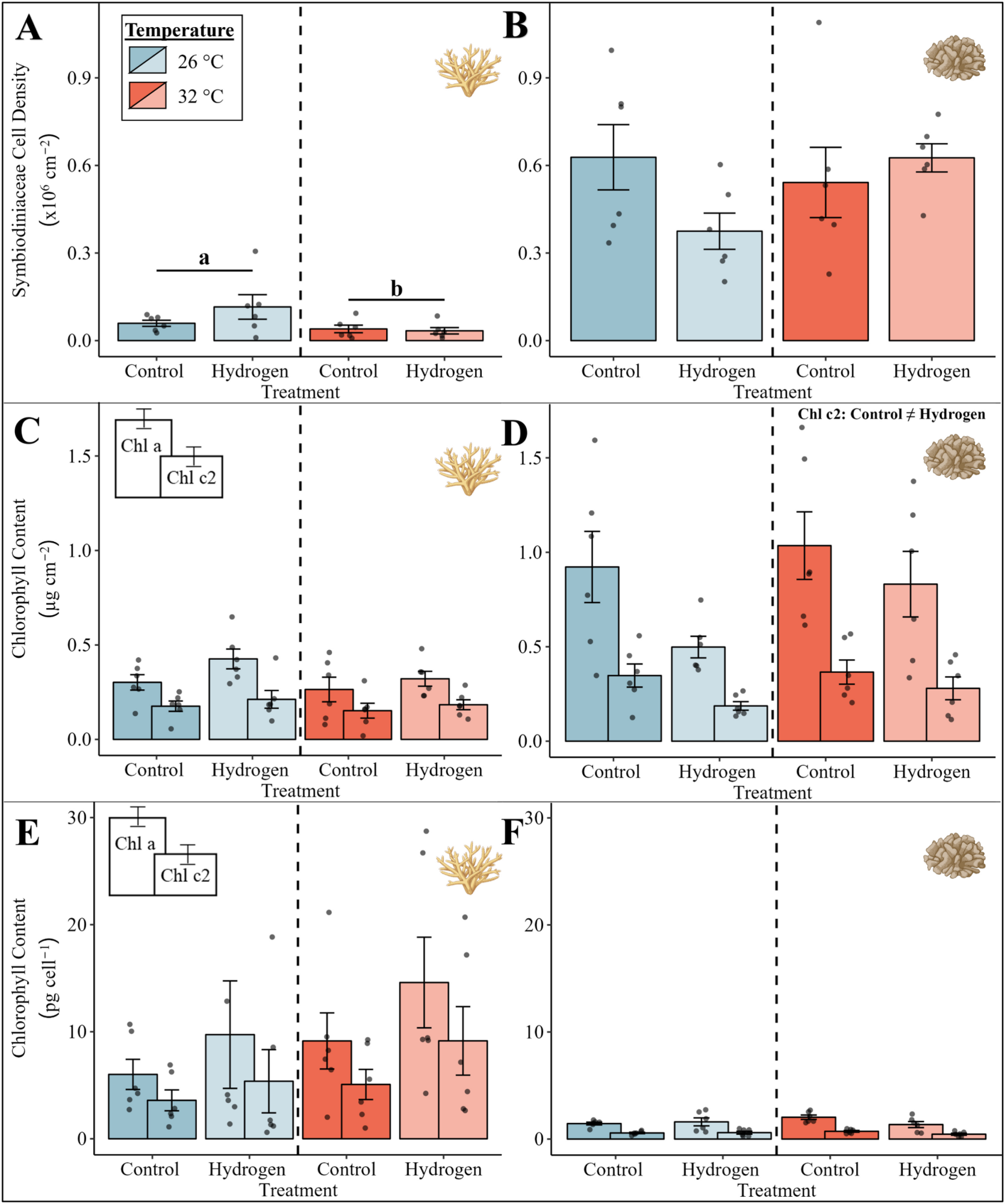
图5. (A)鹿角珊瑚属物种和(B)疣杯形珊瑚的共生藻科细胞密度,(C)鹿角珊瑚属物种和(D)疣杯形珊瑚的单位面积叶绿素含量,以及(E)鹿角珊瑚属物种和(F)疣杯形珊瑚的每个细胞的叶绿素含量,四组实验的数据情况。
带误差条的柱状图表示每组六个重复的平均值和相应的标准误差(SE)。对于叶绿素含量,叶绿素a显示在每个柱状图的左侧,叶绿素c₂显示在右侧。柱状图的颜色表示温度条件(蓝色 = 26°C,红色 = 32°C)。根据带有蒙特卡罗检验的PERMANOVA分析,显著的温度主效应(p < 0.05)以字母表示,并用黑线对温度条件进行分组。根据带有蒙特卡罗检验的PERMANOVA分析,显著的处理主效应(p < 0.05)在右上角用不等号表示。确切的p值见补充材料(S1文件)。珊瑚插图由BioRender.com创建。
https://doi.org/10.1371/journal.pone.0308894.g005
虽然疣杯形珊瑚的共生藻科细胞密度和叶绿素a浓度不受温度或处理的显著影响(图5B和5F),但单位面积的叶绿素c₂浓度显示出氢气处理的显著影响(图5D,PERMANOVA分析,p = 0.039)。与两个未添加氢气的处理组(CT26和CT32)相比,添加氢气(H₂26和H₂32)导致单位面积的叶绿素c₂浓度显著降低。
讨论
珊瑚礁目前正经历第四次全球珊瑚白化事件 [17,51],这再次证实了此类事件的规模和频率将会增加的预测 [10,15-17]。因此,加深我们对驱动珊瑚白化机制的理解 [20] 并研究加强珊瑚礁的新方法至关重要,从而有可能在未来应对这些事件 [52,53]。在这种背景下,氢气可能提供了一种有前景的方法,因为已有多项研究证明了氢在包括人类和大鼠在内的哺乳动物中具有广泛的预防和治疗效果 [25-30]。我们的研究首次调查了在环境温度和热应激下氢对珊瑚共生体生态生理的短期影响,为潜在的生态影响提供了见解。
氢气可以将热应激对硬珊瑚鹿角珊瑚属物种的负面影响降至最低
当仅处于热应激状态时,鹿角珊瑚属物种的光合效率、最大电子传递速率(ETRmax)和共生藻科细胞密度显著降低,同时代谢需求增加,这表明出现了明显的热应激反应 [54,55]。然而,同时暴露于氢气和热应激下,阻止了鹿角珊瑚属物种在仅受热应激时所观察到的ETRmax下降。如先前的研究所示,ETRmax的降低可作为光系统受损和共生藻科细胞健康状况恶化的指标 [36,37,56]。这种损伤很可能源于热应激下活性氧/活性氮(ROS/RNS)的积累,正如 “氧化理论” 所提出的 [20,23,24,57,58]。因此,我们的结果表明,氢气可能保护了珊瑚共生体免受氧化损伤,从而防止了ETRmax的降低。这些发现与先前报道的氢气的抗氧化能力一致 [25-30]。此外,氢气可能分别通过增加抗氧化酶活性 [59,60] 和上调热休克反应(如在植物和啮齿动物中所观察到的) [33] 来间接保护光合机构。
与我们的观察结果一致,先前在红海中部的一项研究报告称,与疣杯形珊瑚相比,鹿角珊瑚属物种受模拟短期热应激的影响更大 [61]。疣杯形珊瑚的这种不同反应可能表明,模拟的热应激在48小时内不足以诱导其产生负面影响,并表明疣杯形珊瑚具有更高的耐热性,尽管其他研究描述称在红海中疣杯形珊瑚比亨氏鹿角珊瑚对温度应激更敏感 [62]。所研究的两个物种在耐热性上的差异也可能与相关的内共生体有关,因为在红海中,杯形珊瑚属物种主要与共生藻属A1型共生,而鹿角珊瑚属物种主要宿主共生藻属C41型 [63]。
氢气在环境海水温度下对鹿角珊瑚属物种和疣杯形珊瑚的光生理产生负面影响
与我们的预期相反,在环境海水温度下添加氢气在鹿角珊瑚属物种中产生了相反的效果,显著降低了ETRmax和最小饱和辐照度(Ek)。有趣的是,在环境温度下添加氢气还导致疣杯形珊瑚的呼吸速率、光合速率以及叶绿素c₂浓度显著下降,同时共生藻科细胞密度和叶绿素a浓度也最低,尽管后两者的下降并不显著。
虽然补充抗氧化剂可能会导致有害影响,甚至可能通过潜在地破坏抗氧化系统的平衡而导致死亡 [64,65],但氢通常被认为是安全的 [29,66]。由于氢气选择性地还原最具危害性的活性氧和活性氮,即羟基自由基和过氧亚硝酸盐,而不影响其他具有潜在生理作用的活性氧和活性氮,因此氢被认为是一种理想的抗氧化剂 [29]。
因此,我们提出了一种潜在的机制,通过该机制氢气在环境海水温度下影响鹿角珊瑚属物种和疣杯形珊瑚,推测是通过抑制珊瑚共生体内固氮微生物的固氮作用。几项体外研究表明,氢与大气中的氮竞争,从而减少了生物可利用氮(如铵)的形成 [67-70]。在贫营养条件下,固氮作用对于提供生物可利用氮至关重要 [71,72],因此这种抑制可能会限制珊瑚共生体的整体氮可利用性,特别是在环境海水温度下,最终抑制珊瑚共生体的光生理和生长 [73-80]。鉴于共生藻科的世代时间较短,通常为一到几天 [81,82],因此生长速率的降低可能解释了在这一短时间内共生藻科细胞的总体损失。这可能解释了在环境温度下暴露于氢气时,疣杯形珊瑚中观察到的最低共生藻科细胞密度和单位面积叶绿素a浓度,这大概与显著降低的光合速率和单位面积叶绿素c₂浓度有关。物种之间的差异可能与固氮速率的差异相关。由于亨氏鹿角珊瑚的固氮速率比疣杯形珊瑚高约3倍 [83],通过添加氢气对固氮作用的部分抑制可能对疣杯形珊瑚原本较低的固氮速率产生更大的影响。
氢在热应激下维持疣杯形珊瑚的光合和呼吸速率的温度依赖性效应进一步支持了这一理论。在升高的温度下,珊瑚共生体内的固氮速率会增加 [84-86]。因此,氢气可能导致的固氮作用降低 [67-70] 可能有助于平衡氮的可利用性,与在环境温度下添加氢气相比,从而提高生产力。在热应激条件下,这种情况甚至可能是有益的,通过维持对珊瑚 - 藻类成功共生至关重要的氮限制环境,减轻内共生体过度增殖的风险 [55] [19,22,86-88]。
与这一理论相反,Rädecker等人 [89] 证明,热应激下固氮速率增加所产生的铵并未被内共生体同化。在这种情况下,氢的抑制作用可能不会在热应激下支持内共生体,而是可能影响其他微生物群落,如硝化细菌和反硝化细菌 [22,90]。然而,这一理论仍然是推测性的,未来的研究应该探讨氢气对珊瑚共生体内固氮作用和细菌群落的影响。
生态影响
总体而言,我们的研究结果表明,添加氢气对珊瑚共生体的影响具有温度依赖性。虽然在环境海水温度下暴露于氢气对鹿角珊瑚属物种和疣杯形珊瑚的生态生理产生了负面影响,但在热应激下,它对鹿角珊瑚属物种的共生体光生理显示出有益的影响,这表明氢气被纳入其中,并可能有助于增强珊瑚在热应激下的恢复力。
然而,重要的是要认识到本研究的局限性。氢气的影响仅在红海中部的两种硬珊瑚物种中进行了研究,并且仅限于48小时。此外,实验设置为每个处理和物种使用单个水箱,专门为了应用处理而设计,而非用于长期的珊瑚养护。虽然这种设计允许精确和一致的环境条件以及处理添加,但未来的长期研究应该旨在包括一个适应阶段,并使用更多的水箱,以减轻长时间内潜在的水箱效应。尽管存在这些局限性,我们的研究提供了氢气具有温度依赖性效应的初步证据。因此,它可以为未来的研究铺平道路,特别是研究以下问题:氢气在珊瑚共生体中起作用的具体机制是什么,特别是与固氮作用和氧化损伤相关的机制(图6中的假设机制)?在环境和热应激条件下,氢气对珊瑚共生体的长期影响是什么?
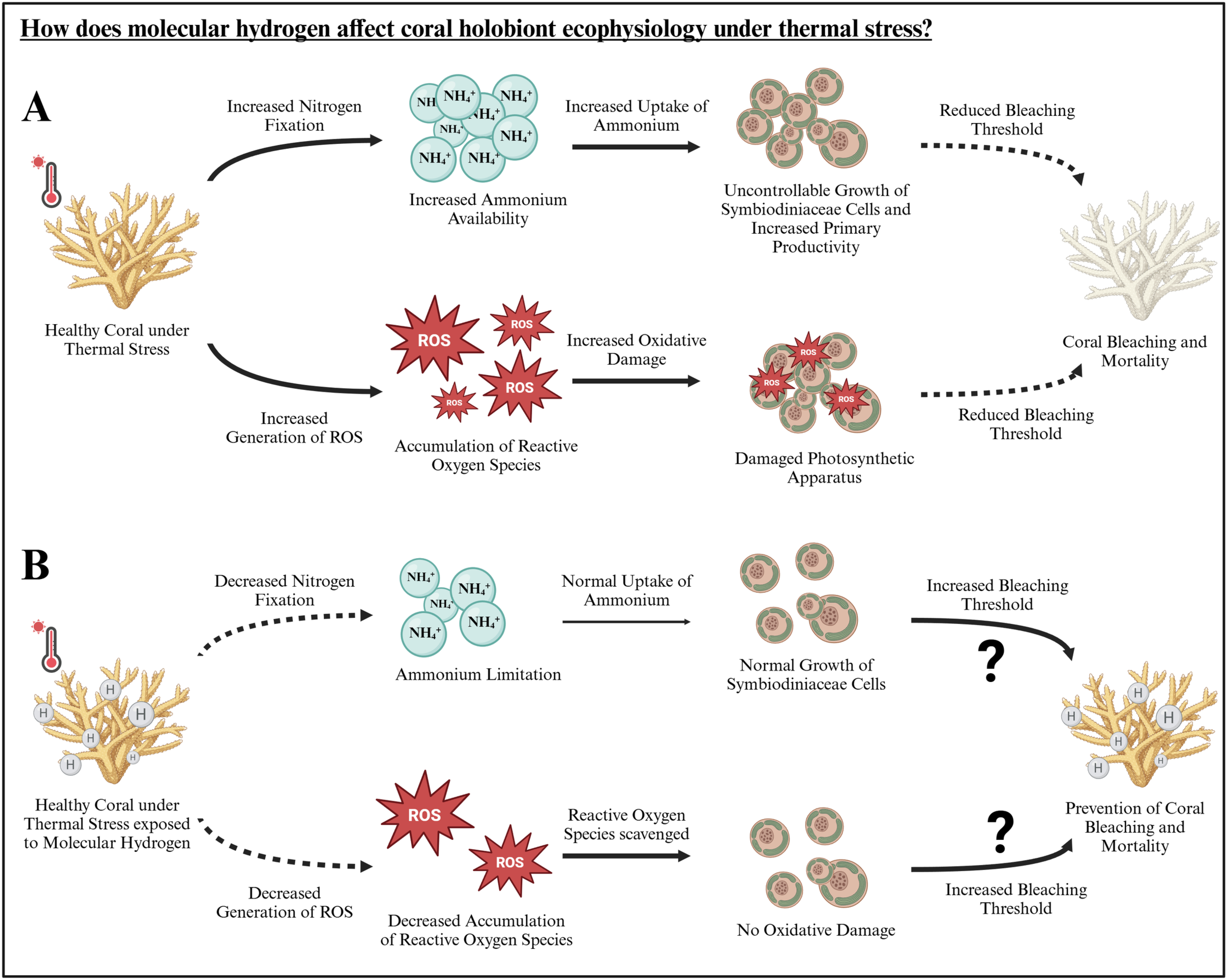
图6. (A)热应激和(B)热应激结合氢气对珊瑚共生体生态生理的假设影响。
初步结果表明,氢可防止共生藻科细胞光系统的氧化损伤。氢气在此效应背后的潜在机制如图所示,虚线表示相应过程的减少,粗线表示相应过程相比之下的增加。问号表示需要在进一步研究中探讨的潜在长期效应(插图由BioRender.com创建)。
https://doi.org/10.1371/journal.pone.0308894.g006
如果在未来的研究中揭示了氢气对珊瑚共生体影响的假设机制,这可能为珊瑚白化背后的机制提供宝贵的见解,有可能支持 “氧化理论” [23,24]。此外,这可以为开发对抗珊瑚白化的新工具奠定基础,因为活性氧和活性氮不仅参与热应激触发的级联反应,还参与光照应激、冷应激、高硝酸盐浓度和细菌感染所触发的级联反应 [20]。然而,需要仔细考虑氢气的安全性和潜在应用。
鉴于氢在水中的保留时间较短 [91],氢气对珊瑚的影响大概仅限于施用后立即的一段时间,从而防止在环境海水温度下产生不利影响。由于氢是一种非常小的分子,能够迅速穿过细胞膜 [25],氢很可能也会影响其他珊瑚礁生物。例如,最近的一项研究表明,氢刺激了多种海洋细菌的生长 [92]。因此,在应用之前,必须阐明氢气对微生物组以及其他无脊椎动物和脊椎动物的影响,以及驱动热抗性增强的潜在机制。
随着人们对氢作为一种潜在的无排放可再生能源载体的兴趣日益增加 [26,93],广泛的研究集中在开发简单的制氢方法上。将蒸馏水甚至海水转化为氢气的电解装置正在帮助使氢广泛可用且价格合理,从而增强了其在各种应用中的潜力 [94,95]。鉴于产氢细菌广泛存在 [96],并且它们很可能存在于珊瑚微生物组中,识别这些细菌可以进一步揭示潜在支持开发有效益生菌的新有益微生物 [97-100]。
然而,为了充分探索氢气的潜力,进一步的研究至关重要。特别是,揭示潜在的温度依赖性机制,即那些与氧化损伤和固氮作用相关的机制,以及确定最佳的氢浓度,是非常重要的。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1479948.html?mobile=1
收藏

