非常拥挤的生活环境对人和动物可产生不良应激,这是早就发现的现象,今天的地球人类数量增加导致的生存环境下降造成包括拥挤等各种应激损伤。如何克服应激造成的伤害也是医学和心理学研究的重要课题。氢气作为一种良好的适合日常使用的损伤保护工具,能否对应激损伤产生保护作用,也是氢气生物医学领域研究的重点。既往曾经有学者对氢气用于对抗束缚等应激损伤的保护研究,发现能取得可喜的预防效果。最近土耳其和美国学者对高密度拥挤环境大鼠应激相关指标进行了研究,发现饮用氢水能改善应激导致的动物生长抑制,氧化损伤和内分泌变化,并在组织学和免疫系统等方面进行了研究。
博主看法
Boğa Kuru B, Makav M, Kuru M, Aras ŞY, Karadağ Sarı E, Bulut M, Alwazeer D, Bektaşoğlu F, Ölmez M, Kırmızıbayrak T, LeBaron TW. Effects of Hydrogen-Rich Water on Growth, Redox Homeostasis and Hormonal, Histological and Immune Systems in Rats Exposed to High Cage Density Stress. Vet Med Sci. 2025 Mar;11(2):e70305.
题目:富氢水对处于高笼养密度应激状态下大鼠生长、氧化还原稳态以及激素、组织学和免疫系统的影响
目标
本研究旨在探究饮用富氢水(HRW)对在受限饲养环境中进食的大鼠生长性能、器官重量、硫醇/二硫键稳态、氧化状态以及一些激素、组织病理学和免疫组化变化的影响。
方法
实验分为八组(每组[雄性/雌性]各8只大鼠),包括两个对照组、两个富氢水组、两个应激组和两个应激+富氢水组。所有动物自由进食和饮水,实验周期为3个月。对照组和富氢水组大鼠根据体重计算,并按照指南规定的饲养条件进行饲养。应激组和应激+富氢水组大鼠根据体重,饲养空间为指南规定饲养条件的一半。在整个研究过程中每周测量动物体重。实验结束后,按照伦理规范处死动物。随后,对促甲状腺激素(TSH)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、皮质醇、甲状旁腺激素(PTH)和钙(Ca2+)、总硫醇(TT)、天然硫醇(NT)、二硫键、二硫键/TT×100、二硫键/NT×100和NT/TT×100、丙二醛(MDA)和谷胱甘肽(GSH)进行生化分析。还评估了用于组织病理学的苏木精染色和超氧化物歧化酶-2(SOD-2)免疫反应性。
结果
结果显示,富氢水组的活体重增加量高于应激组。与应激组相比,应激+富氢水组的生化分析中氧化状态有所降低。应激组的TSH水平下降。应激组的FT4、皮质醇和Ca2+水平升高。
结论
与应激组相比,应激+富氢水组的应激相关生理参数有所降低。当机体处于应激状态时,可考虑使用富氢水。
关键词:生长性能;富氢水;氢气;氧化状态;应激
对照组和富氢水组大鼠饲养在20×30×45规格的笼子中。应激组和应激+富氢水组大鼠饲养在20×15×45规格的笼子中。每周进行体重称量。3个月后,处死动物,并通过生化和组织病理学分析对结果进行评估。
1. 引言
生物体暴露在拥挤环境中会对身体功能产生显著影响,尤其是内分泌系统。这些影响包括应激激素增加、免疫系统减弱以及一些代谢活动的改变。拥挤会导致应激激素和促肾上腺皮质激素(ACTH)水平上升,从而降低对刺激的反应并导致脱敏。这种情况可能会引发慢性应激和健康问题。ACTH通过刺激肾上腺分泌皮质醇来触发应激反应。这种反应会在鸟类中引发各种应激迹象,如心率和血压升高、免疫系统减弱以及生殖功能受损。应激会导致细胞损伤、衰老、免疫力下降、生长发育迟缓以及代谢紊乱。这些损伤是由激素失衡、神经系统炎症和氧化应激引起的。应激会导致体内自由基水平升高。“活性氧物质”(ROS)是指一类对生物成分具有显著反应性的氧物种,会对蛋白质、脂质和DNA等重要分子造成损害(Conrad等人,2015)。
当ROS水平超过细胞的解毒能力并打破细胞内的微妙平衡时,就会发生氧化应激。这种失衡会导致ROS物种的积累,包括超氧自由基(O2−)、过氧化氢(H2O2)和羟基自由基(•OH)。细胞通过酶促抗氧化剂(如超氧化物歧化酶(SOD)、过氧化氢酶和谷胱甘肽过氧化物酶(GPx))以及非酶促抗氧化剂(如硫醇,例如谷胱甘肽(GSH))来对抗氧化应激。酶促抗氧化剂和GSH浓度的变化会破坏细胞的氧化还原稳态,并增加与各种疾病相关的氧化应激。因此,预防和控制应激对于整体健康至关重要。
氢气(H2)对最具反应性的氧化剂,即羟基自由基(•OH)和过氧亚硝酸盐(ONOO−)具有选择性抗氧化活性(Ohsawa等人,2007)。这种抗氧化作用是已报道的H2的37种以上生物学和物理化学特性之一。这些特性包括:促炎细胞因子的下调调节剂、能量代谢的刺激剂、神经保护剂、抗炎剂、抗自由基剂、抗癌剂、抗应激剂、抗凋亡剂、抗过敏剂、信号分子、氧化还原调节剂、基因表达调节剂、血管功能调节剂以及心肌对缺血/再灌注损伤的反应调节剂(Alwazeer,2024)。H2的治疗优势与其特定的物理、化学和生物学特性相关。氢气的给药方式包括吸入、富氢水、富氢盐水、富氢眼药水、富氢浴、镁-水反应和产氢纳米材料。有许多研究揭示了富氢水(HRW)对生长性能的影响。富氢水被认为是一种简单的方法,适用于室内和室外。
在高笼养密度应激下的大鼠,其氧化应激会严重威胁实验动物的福利和研究结果。氧化应激标志物的增加与多种生理和行为应激反应密切相关,这些应激反应已被证明是由高笼养密度诱导的。例如,研究表明,饲养在高饲养密度条件下的大鼠,其氧化应激的两个标志物丙二醛(MDA)和一氧化氮(NO)水平较高。下丘脑-垂体-肾上腺(HPA)轴在这些应激反应的生理机制中经常被激活,导致皮质酮等糖皮质激素的分泌增加。由于皮质酮水平升高会破坏细胞的氧化还原平衡并促进ROS的形成,因此它们与氧化应激有关。此外,许多研究报道富氢水是一种特别强大的抗氧化剂。
鉴于这些文献信息,本研究旨在验证由于拥挤应激而产生的氧化应激和激素活性的假设。因此,本研究的目的是探究富氢水对幼年大鼠生长性能、器官重量、硫醇/二硫键稳态、氧化状态、激素水平以及高笼养密度应激下的组织病理学和免疫组化参数的潜在影响。
2. 材料和方法
将大鼠分为八组,每组8只。本研究使用了64只Wistar Albino大鼠,其中32只雌性,32只雄性,体重在120 - 220g之间,年龄为8周。在开始实验前,动物进行了15天的适应期。在研究过程中,所有动物均接受12小时光照(白天)和12小时黑暗(夜晚)的光照周期。所有动物根据表S1中的饲料成分自由进食。大鼠自由饮用富氢水,每4小时更换一次。
在研究中,使用20×30×45规格的笼子饲养大鼠。对照组和富氢水组大鼠根据体重计算,并按照《指南》(NRC 2011)规定的饲养条件进行饲养。应激组和应激+富氢水组大鼠根据体重,饲养空间为《指南》规定饲养条件的一半。
分组
- 组I(对照组[C],雌性):大鼠喂食颗粒饲料并饮用普通水3个月,未接受其他处理。
- 组II(对照组[C],雄性):大鼠喂食颗粒饲料并饮用普通水3个月,未接受其他处理。
- 组III(富氢水组[H],雌性):大鼠喂食颗粒饲料并饮用富氢水3个月,未接受其他处理。
- 组IV(富氢水组[H],雄性):大鼠喂食颗粒饲料并饮用富氢水3个月,未接受其他处理。
- 组V(应激组[S],雌性):大鼠喂食颗粒饲料并饮用普通水3个月,并处于拥挤应激状态。
- 组VI(应激组[S],雄性):大鼠喂食颗粒饲料并饮用普通水3个月,并处于拥挤应激状态。
- 组VII(应激+富氢水组[SH],雌性):大鼠喂食颗粒饲料并饮用富氢水3个月,并处于拥挤应激状态。
- 组VIII(应激+富氢水组[SH],雄性):大鼠喂食颗粒饲料并饮用富氢水3个月,并处于拥挤应激状态。
在研究过程中每周测量大鼠体重。实验结束时,使用颈椎脱臼法处死大鼠,处死前先肌肉注射盐酸氯胺酮(75mg/kg)和甲苯噻嗪(15mg/kg)进行麻醉。采集血液样本用于生化测量。血液样本在1008×g离心,血清样本储存于-20°C直至分析。为进行组织病理学分析,采集组织样本,并将组织储存在10%的缓冲甲醛溶液中。处死后,用精密天平将器官从脂肪和结缔组织中分离出来,测量器官重量。
2.1 富氢水的制备
使用氢氧机(HB - 33 Epoch,台湾)制备富氢水,将氢氧混合气以1.25L/min的流速通入2L饮用水中30分钟。根据亨利定律和氧化还原电位(ORP)法,估计H2浓度约为1mg/L。
2.2 生化分析
使用雅培Architect c8000自动分析仪通过分光光度法分析促甲状腺激素(TSH)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、皮质醇、甲状旁腺激素(PTH)和钙(Ca2+)。使用TT检测试剂盒和NT检测试剂盒(Rel Assay Diagnostics,Mega Tıp,土耳其),按照试剂盒操作步骤,通过分光光度法测量总硫醇(TT)和天然硫醇(NT)。使用TT和NT数据计算二硫键、二硫键/TT×100、二硫键/NT×100和NT/TT×100(Atalay Mert等人,2022)。使用Beutler等人(1963)的方法测量GSH。按照Yoshioka等人(1979)的方法进行MDA分析。
2.3 组织学程序
将肾脏、心脏和肝脏的组织样本在10%的甲醛中保存24小时。固定后,采用常规组织处理方案。然后将样本包埋在石蜡中进行组织学检查。对5μm厚的连续切片进行苏木精和伊红(H&E)染色,以评估肝脏、肾脏和心脏组织的大体解剖结构。
2.4 免疫组化程序
组织切片用铬明矾明胶包被,并采用链霉亲和素 - 生物素过氧化物酶法进行处理。所有洗涤步骤均使用磷酸盐缓冲盐水(PBS,0.1M,pH 7.2)。切片在室温下用0.1M PBS中的3% H2O2孵育15分钟,然后在柠檬酸盐缓冲溶液中煮沸(微波炉,800W,10分钟)。用大体积超V封闭溶液封闭10分钟后,切片在室温下于湿润的培养箱中与SOD - 2(B - 1)一抗(Santa Cruz Sc - 133254,1:500稀释)孵育1小时。分别在室温下应用链霉亲和素过氧化物酶和生物素化山羊抗B多价抗体溶液30分钟。使用DAB - H2O2底物显示免疫反应性,然后用改良的吉尔III苏木精进行复染。
为确认特异性免疫反应性,用PBS代替一抗孵育的切片进行所有步骤处理。两名独立的观察者使用半定量评分系统评估靶细胞的免疫染色强度和密度(无反应:0;弱:1;中等:2;强:3)。使用光学显微镜(Olympus BX51,Olympus Optical Co. Ltd.,大阪,日本)对所有制备的切片进行评估和拍照。
2.5 统计分析
在实验前使用G - Power 3.1.9.7进行功效分析。基于该分析,根据Eroğlu、Makav、Fındık Güvendi等人(2020)的研究结果,确定样本量,效应量(d)为2.87,检验功效为0.95,显著性水平为0.05。使用Shapiro - Wilk检验评估每组数据的正态性。对体重和器官重量数据以及生化和免疫组化参数进行双向方差分析,以验证组间差异。p < 0.05被认为具有统计学意义。使用GraphPad 8.1(美国加利福尼亚州圣地亚哥)进行统计分析。
3. 结果
3.1. 体重和器官重量
图1展示了大鼠体重的变化趋势。结果显示,从第二周起,所有组的雄性大鼠体重增长均比雌性更为显著。在与性别相关的评估中,无论是雌性还是雄性,应激组(S)的体重增加量均低于其他组。雄性组的肝脏、肾脏、心脏和胃部重量相较于雌性组有更显著的增加(图1)。此外,结果表明,应激 + 富氢水(SH)组的雄性肾脏重量显著高于对照组(p < 0.05)(图1)。
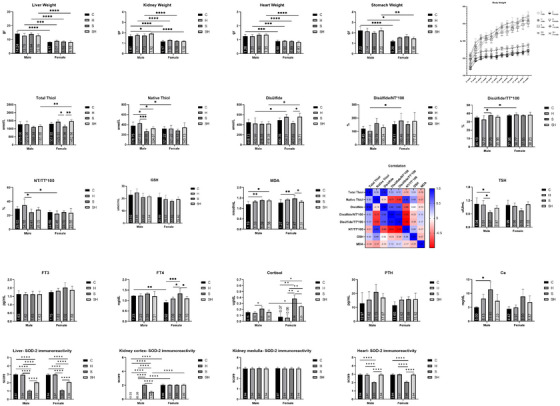
[图1:大鼠每周相对体重增加量]
注:图1展示了大鼠每周相对体重增加量。C:对照组;H:富氢水组;S:应激组;SH:应激 + 富氢水组,为八组器官重量的均值和标准差。C:对照组;H:富氢水组;S:应激组;SH:应激 + 富氢水组。*p < 0.05,p < 0.01,*p < 0.001,p < 0.0001。为八组总硫醇、天然硫醇、二硫键、二硫键/总硫醇×100、二硫键/天然硫醇×100、天然硫醇/总硫醇×100、谷胱甘肽和丙二醛的相关性、均值和标准差。*p < 0.05,p < 0.01,*p < 0.001。为八组促甲状腺激素、游离三碘甲状腺原氨酸、游离甲状腺素、皮质醇、甲状旁腺激素和钙的均值和标准差。C:对照组;H:富氢水组;S:应激组;SH:应激 + 富氢水组。*p < 0.05,p < 0.01,*p < 0.001。为八组超氧化物歧化酶 - 2免疫反应性的均值和标准差。C:对照组;H:富氢水组;S:应激组;SH:应激 + 富氢水组。p < 0.0001。
3.2. 生化参数
对总硫醇(TT)、天然硫醇(NT)、二硫键、二硫键/总硫醇×100、二硫键/天然硫醇×100、天然硫醇/总硫醇×100、谷胱甘肽(GSH)、丙二醛(MDA)、促甲状腺激素(TSH)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、皮质醇、甲状旁腺激素(PTH)和钙(Ca2+)水平进行了生化分析。TT、NT、二硫键、二硫键/总硫醇×100、二硫键/天然硫醇×100、天然硫醇/总硫醇×100、GSH、MDA、TSH、FT3、FT4、皮质醇、PTH和Ca的结果见图1。
- 总硫醇(TT):在雄性中,包括对照组在内的所有处理组的TT水平均无显著差异(p > 0.05)(图1)。在雌性中,富氢水组(p < 0.05)和应激 + 富氢水组(p < 0.01)的TT含量显著高于应激组。比较雄性和雌性时,只有应激 + 富氢水组的雌性TT水平显著高于同组雄性(图1)。
- 天然硫醇(NT):不同雌性组之间的NT水平无显著差异(p > 0.05)。在雄性组中,与应激组相比,对照组(p < 0.05)和富氢水组(p < 0.001)的NT显著增加,而富氢水组的NT水平高于应激 + 富氢水组(p < 0.05)。比较雄性和雌性时,只有富氢水组的雄性NT水平显著高于雌性(p < 0.05)(图1)。
- 二硫键:雄性组之间的二硫键水平无显著差异(p > 0.05)。在雌性组中,应激 + 富氢水组的二硫键水平显著高于应激组(p < 0.05)。比较雄性和雌性时,应激 + 富氢水组的雌性二硫键水平显著高于同组雄性和富氢水组雄性(p < 0.05)(图1)。
- 二硫键/总硫醇×100比值:雌性组之间该比值无显著差异。在雄性中,只有应激组的二硫键/总硫醇×100比值显著高于富氢水组(p < 0.05)。富氢水组雌性的二硫键/总硫醇×100比值高于雄性(p < 0.05)(图1)。
- 二硫键/天然硫醇×100比值:雌性和雄性组之间该比值无显著差异(p > 0.05)。然而,富氢水组雌性的二硫键/天然硫醇×100比值高于雄性(p < 0.05)(图1)。
- 天然硫醇/总硫醇×100比值:雌性组之间该比值无显著差异(p > 0.05)。在雄性中,只有富氢水组的天然硫醇/总硫醇×100比值高于应激组(p < 0.05)(图1)。不过,富氢水组雄性的天然硫醇/总硫醇×100比值高于雌性(p < 0.05)(图1)。
- 相关性:还评估了TT、NT、二硫键、二硫键/总硫醇×100、二硫键/天然硫醇×100和天然硫醇/总硫醇×100参数之间的相关性。结果显示,TT与NT、二硫键/总硫醇×100和二硫键/天然硫醇×100呈正相关(图1)。相反,TT与天然硫醇/总硫醇×100以及NT与二硫键呈负相关。
- 谷胱甘肽(GSH):尽管富氢水组和应激 + 富氢水组的GSH水平相较于应激组在数值上有所增加,但差异并不显著(p > 0.05)(图1)。此外,所有组中雄性的GSH水平在数值上均高于雌性,但这些差异也不显著(p > 0.05)。
- 丙二醛(MDA):在雄性中,应激组和应激 + 富氢水组的MDA水平高于对照组(p < 0.05)。然而,在雌性中,应激组的MDA水平高于对照组(p < 0.01)和应激 + 富氢水组(p < 0.05)(图1)。这一发现意味着富氢水降低了应激雌性大鼠的MDA水平,但对应激雄性大鼠并无此作用。比较雌性和雄性时,MDA水平无显著差异。
- 促甲状腺激素(TSH):在雄性中,对照组和富氢水组的TSH水平高于应激组(p < 0.05),而雌性组之间无差异(p > 0.05)(图1)。比较雌性和雄性时,未发现显著差异。
- 游离三碘甲状腺原氨酸(FT3):各处理组之间以及不同性别组之间的FT3水平均无显著差异(p > 0.05)(图1)。
- 游离甲状腺素(FT4):雄性组之间的FT4水平无显著差异(p > 0.05);然而,在雌性中,应激组的FT4水平显著高于对照组(p < 0.001)、富氢水组(p < 0.05)和应激 + 富氢水组(p < 0.05)。比较雄性和雌性时,雌性的FT4水平显著低于雄性(p < 0.01)。
- 皮质醇:在雄性中,应激组的皮质醇水平高于富氢水组(p < 0.05)(图1)。在雌性组中,应激组的皮质醇水平高于对照组(p < 0.01)、富氢水组(p < 0.01)和应激 + 富氢水组(p < 0.05)。比较雄性和雌性时,只有应激 + 富氢水组的雌性皮质醇水平显著高于同组雄性(p < 0.05)。
- 甲状旁腺激素(PTH):各处理组之间以及不同性别组之间均无显著差异(p > 0.05)。
- 钙(Ca2+):在雄性中,应激组的Ca2+水平高于对照组(p < 0.05),而雌性组之间无显著差异(p > 0.05)。此外,雄性和雌性之间也无显著差异(P>0.05)。
3.3. 组织学参数
对所有雄性和雌性大鼠组的肝脏、肾脏和心脏组织的组织学结构进行了测定(图2)。在肝脏组织中,确定了中央静脉和肝细胞的结构。此外,在雌性大鼠应激组的肝脏组织中发现了出血区域(图2A)。确定了肾脏组织的皮质和髓质部分,检测到皮质区域的肾小球、近端和远端小管以及髓质区域的亨利氏襻(图2B)。在心脏组织中,确定了心外膜和心肌区域以及冠状动脉(图2C)。

[图2:雌性大鼠(A)肝脏组织;(B)肾脏组织;(C)心脏组织。](https://i.imgur.com/xxxxxx.png)
注:图2为雌性大鼠(A)肝脏组织;(B)肾脏组织;(C)心脏组织。对照组(a),富氢水组(b),应激组(c),应激 + 富氢水组(d)。中央静脉(v),肝细胞(箭头),出血(1),皮质(2),髓质(3),肾小球(gl),近端小管(红色箭头),远端小管(黄色),亨利氏襻(h),心外膜(4),心肌(5),冠状动脉(星号)。苏木精 - 伊红染色。标尺200μm。雄性大鼠(A)肝脏组织;(B)肾脏组织;(C)心脏组织。对照组(a),富氢水组(b),应激组(c),应激 + 富氢水组(d)。中央静脉(v),肝细胞(箭头),皮质(1),髓质(2),肾小球(gl),近端小管(红色箭头),远端小管(黄色),亨利氏襻(h),心外膜(3),心肌(4),冠状动脉(星号)。苏木精 - 伊红染色。标尺200μm。
3.4免疫组化参数:超氧化物歧化酶-2(SOD-2)免疫反应性
在雌性大鼠的肝脏组织中,对照组和富氢水组观察到强烈的SOD-2免疫反应性,应激组反应较弱,应激+富氢水组反应强度中等(图3)。

[图3:雌性大鼠肝脏组织中的SOD-2免疫反应性](https://i.imgur.com/xxxxxx.png)
注:图3展示了雌性大鼠肝脏组织中的SOD-2免疫反应性。对照组(a)、富氢水组(b)、应激组(c)、应激 + 富氢水组(d)。中央静脉(v),肝细胞(箭头所指)。比例尺为50μm。雄性大鼠肝脏组织中的SOD-2免疫反应性。对照组(a)、富氢水组(b)、应激组(c)、应激 + 富氢水组(d)。中央静脉(v),肝细胞(箭头所指)。比例尺为50μm。
在心脏组织中,对照组、富氢水组和应激+富氢水组检测到强烈的SOD-2免疫反应性,而应激组的SOD-2免疫反应性为中等强度(图4)。

[图4:雌性大鼠心脏组织中的SOD-2免疫反应性](https://i.imgur.com/xxxxxx.png)
注:图4展示了雌性大鼠心脏组织中的SOD-2免疫反应性。对照组(a和b)、富氢水组(c和d)、应激组(e和f)、应激 + 富氢水组(g和h)。心肌细胞(箭头所指)。比例尺为200μm(a、c、e、g),比例尺为50μm(b、d、f、h)。雄性大鼠心脏组织中的SOD-2免疫反应性。对照组(a和b)、富氢水组(c和d)、应激组(e和f)、应激 + 富氢水组(g和h)。心肌细胞(箭头所指),冠状动脉(星号所示)。比例尺为200μm(a、c、e、g);比例尺为50μm(b、d、f、h)。
在雄性大鼠的肝脏组织中,对照组和富氢水组观察到强烈的SOD-2免疫反应性,应激组较弱,应激+富氢水组为中等强度(图3)。在心脏组织中,对照组、富氢水组和应激+富氢水组检测到强烈的SOD-2免疫反应性,应激组为中等强度(图4)。
各组之间SOD-2评分的评估结果见图1。在检查肝脏中的SOD-2免疫反应性时,发现无论是雄性还是雌性,应激组与其他组相比均显著降低。此外,当将应激+富氢水组与对照组和应激组进行比较时,发现SOD-2免疫反应性明显下降。在比较雌性和雄性时,二者之间没有显著差异。在心脏组织中,无论是雄性还是雌性,应激组的SOD-2免疫反应性均显著低于其他组。
4. 讨论
居住空间不足会迫使人们生活在拥挤的环境中,这可能会在身体内引发各种反应,即便这些反应不会马上被察觉。其中最显著的反应之一就是压力,它会导致各种生理和心理问题。例如,罗德里格斯等人(2020年)指出,居住在较大居住空间的人比居住在较小且更拥挤环境中的人感受到的压力更小。这表明,更大的生活空间可以缓解因空间受限带来的压力(罗德里格斯等人,2020年)。同样,哈尔沃斯鲁德等人(2024年)强调,更好的家居设计能够为孩子们提供安静的空间,帮助他们应对拥挤带来的压力源,如噪音和社交互动。实验研究也证实,过度拥挤会导致压力(洛塞娃等人,2015年;帕夫洛娃等人,2024年)。一项动物研究表明,笼子过度拥挤会引发压力,这与一些人所经历的拥挤生活条件类似(耶尔迪兹等人,2007年)。另一项研究观察到,在压力状态下,血液中的皮质醇水平会升高。这一发现揭示了压力在生物体内引起的激素变化以及这些变化可能带来的后果(贝莱斯 - 马林等人,2012年)。皮质醇是肾上腺在应对压力时分泌的一种类固醇激素。它会引发各种生理变化,并增强身体对压力的抵抗力(奥克等人,2024年)。在本研究中,拥挤组的皮质醇水平明显高于对照组。这一结果支持了笼子密度会导致压力的假设。
甲状腺激素以调节生长、新陈代谢和许多其他身体过程而闻名。甲状腺产生的两种主要激素是T4和T3。为了维持适当的反馈机制和体内平衡,来自垂体前叶的促甲状腺激素(TSH)、来自下丘脑的促甲状腺激素释放激素(TRH)和T4协同发挥作用。甲状腺功能减退是由甲状腺活动不足引起的,常见症状包括心动过缓、便秘、疲惫和体重增加。另一方面,甲状腺功能亢进是由甲状腺功能增强引起的,症状包括体重减轻、耐热性差、腹泻、细微震颤和肌肉无力。此外,游离T4和T3水平升高会形成一个负反馈回路,抑制TSH和TRH的释放(沙希德等人,2023年)。
在本研究中,应激组的T4水平显著升高,同时TSH水平下降。这被认为是由皮质醇导致的。有研究报道,随着皮质醇水平升高,T4向T3的转化没有变化,但血浆T3水平会下降(布朗等人,1991年)。在本研究中发现,皮质醇干扰了T4向T3的转化。因此,T4水平升高通过对垂体的负反馈作用,导致TSH激素的释放减少。所以,可以认为出现了类似甲状腺功能亢进的情况,这尤其会导致体重减轻。同样,压力会导致器官重量和体重下降,这种情况也与骨骼发育直接相关。应激组血液中的甲状旁腺激素(PTH)和钙离子(Ca2+)水平升高。PTH是一种能促使骨骼中的Ca2+释放的激素(岑吉兹和格克切,2021年)。由此可见,骨骼中的Ca2+转移到了血液中,这阻碍了在压力(拥挤)环境下的生长。据报道,慢性心理压力会加速生物衰老,而氧化损伤被认为是这一过程的主要潜在介导因素(阿施巴赫等人,2013年)。然而,在饮用富氢水(HRW)的大鼠组中,器官重量和体重均有所增加,这可能是因为HRW的高抗氧化特性对身体生理产生了积极影响。这可以解释为,氢气独特的抗氧化活性(斯通等人,2022年)能够消除过多的氧化应激,从而降低皮质醇水平。
已有研究表明,雌激素,尤其是雌二醇,能够对抗氧化应激。例如,针对绝经后女性的研究显示,雌激素替代疗法可以降低氧化应激标志物水平,有可能降低心血管疾病和认知能力下降的风险(贝兰蒂等人,2013年;卡尼亚奇等人,2023年)。雌激素存在时,像过氧化氢酶和超氧化物歧化酶(SOD)这类对清除活性氧(ROS)至关重要的抗氧化酶的表达会增加(斯特雷洛等人,2003年)。此外,细胞色素P450酶能够将雌激素转化为有益和有害的代谢物,它是与雌激素调节相关的代谢途径之一(帕特尔和巴特,2004年;里维拉 - 波塔拉廷等人,2007年)。另一方面,在存在氧化应激的情况下,雄激素,尤其是睾酮也具有神经保护作用。尽管其效果可能因细胞环境的不同而有所差异,但研究表明,睾酮可以保护脑细胞免受氧化攻击(滕科朗等人,2018年;杜昂等人,2020年)。性激素可能通过调节氧化应激途径影响个体对神经退行性疾病的易感性,雄性和雌性神经元对氧化应激的不同反应就证明了这一点(滕科朗等人,2018年)。从我们的研究来看,生化数据和组织病理学数据都显示出雄性和雌性之间存在差异。
在许多研究中,都有报道称在各种情况下丙二醛(MDA)值的升高是存在氧化应激的一个指标(埃罗尔古、马卡夫、阿达利等人,2020年;奥尔梅兹等人,2020年;阿克于兹等人,2021年;马卡夫、多兰巴伊等人,2021年、2023年;耶尔德兹等人,2022年)。本研究观察到拥挤组的MDA值显著升高。这一发现表明,拥挤的环境会造成氧化损伤。因此,需要减少体内的氧化损伤。人们认为,给处理组提供的富氢水(HRW)可能会减轻氧化应激,从而缓解氧化损伤。像硫醇(-SH)这样的抗氧化防御系统在生物体内也能发挥重要作用。抗氧化剂可以保护组织和细胞免受ROS的破坏作用。硫醇通过多种途径展现其抗氧化特性,比如作为金属离子螯合剂、自由基清除剂以及硫醇 - 二硫键氧化还原缓冲体系的组成部分。在ROS暴露的条件下,硫醇 - 二硫键交换反应能够快速、轻易地将硫醇基团转化为可逆的二硫键(恰基尔卡等人,2022年)。
蛋白质的硫醇基团和低分子量硫醇在氧化条件下,会因半胱氨酸残基氧化而产生可逆的混合二硫键。硫醇基团能够减少生成的二硫键,从而维持动态的硫醇 - 二硫键稳态。众所周知,这种稳态对于抵御自由基损伤、解毒、细胞凋亡、信号传递、酶活性调节、转录因子调控以及细胞信号通路都至关重要(埃雷尔和内塞利奥卢,2014年)。在本研究中,可以推测应激组硫醇水平的下降是由与应激相关的消耗所致。HRW处理组,尤其是应激 + HRW组的硫醇水平较高,这表明氢气减轻了氧化应激,减少了应激状态下硫醇的消耗。这一结果表明,氢气对生物体的抗氧化系统起到了支持作用。在本研究中还注意到,拥挤的环境会对大鼠造成氧化损伤,而摄入HRW可以减轻这种损伤。
超氧化物歧化酶(SOD)是对抗ROS(即超氧阴离子自由基O2− )最为关键的抗氧化防御系统。SOD催化一个超氧自由基氧化为氧分子(O2),并将另一个超氧自由基还原为活性较低的过氧化氢(H2O2)。生成的H2O2随后会被过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPx)转化为H2O和O2(阿斯兰科奇等人,2019年)。研究表明,氢气可以通过上调SOD和GPx、增强它们的活性以及提高谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)的比值来减轻氧化损伤(巴兰西克等人,2020年)。在本研究中,我们通过免疫组化观察到,应激诱导组织中的SOD活性增加,而HRW处理组的SOD免疫反应性则有所下降。
5. 结论
当大鼠被饲养在拥挤环境中时,其氧化应激水平会上升,进而导致生长发育不良。本研究中使用的富氢水(HRW)对氧化应激以及生长发育相关指标均产生了积极影响。基于本研究模型,考虑到动物饲养环境中的应激情况与人类拥挤居住环境引发的应激具有相似性,饮用富氢水可被视为缓解人类因拥挤居住条件所产生应激的一种可行办法。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1479019.html?mobile=1
收藏

