哺乳动物仅铁氢酶样蛋白的体外产氢
氢气医学生物学是一门新学科,所谓新学科,是因为过去没有,刚刚建立的学科。为什么没有?因为过去没有发现氢气在高等生物世界的作用,2007年的研究率先发现,奠定了这一基础,产生了这个学科。任何学科都有一些科学问题或疑问需要回答,否则也就不存在学术研究的必要,也就无所谓学科了。那么氢气生物医学还存在什么科学问题没有回答?当然有,例如氢气生物学效应的分子基础是什么,虽然有关于抗氧化的观点,也有血红素的新认识,但距离完全清楚仍然有距离。氢气能用于什么疾病的临床治疗,作为一种应用技术,应用的目标和场景当然是重要问题。现在仍然没有很好回答。相关的问题还有如何使用、剂量控制、治疗周期和禁忌症等等问题。其实这些问题都比较容易认识和了解,几乎人人明白的道理。也有一些问题非常要命,例如,氢气为什么会有生物学作用?动物细胞为什么不能产生氢气或者动物细胞能不能产生氢气?另外一个非常重要的问题是,真核细胞能否分解或利用氢气能量?这些问题也是非常要命非常核心。当然这些问题都是在发现氢气效应的基础上才逐渐受到重视的,也是整个学科的学术基础。

最近南京农业大学沈文飚教授团队在BBRC发表论文,就动物细胞产生氢气提供了新观点和证据。该研究认为,动物细胞可以产生氢气,并对产生氢气的蛋白基础或产氢气的酶进行了初步描述。这是氢气生物医学领域的核心问题,能体现中国学者今天在科学研究方面的自信和能力。当然,科学研究的特点就是,回答一个问题必然带来更多的问题。而且是否能带来新问题和新研究,也是评估一项研究价值的重要依据。例如本研究,首先需要对这种现象进行验证,因为这是具有颠覆性意义的新发现。新发现往往需要同行的验证和确认才能被公认。如果现象确认,接下来需要回答,动物细胞是否存在自然产氢气的情况,例如在缺氧或中毒情况下是否可以。是否存在更多类型的产氢气途径和代谢路线。产氢气蛋白的生物学功能和氢气产生是否存在关联,在发育或病理过程中是否具有作用。在生物进化过程中,氢气的代谢是如何随着进化不断变化的。
摘要
尽管越来越多的证据表明外源性施加的H₂在哺乳动物体内积极调节许多生理和病理反应,但哺乳动物细胞是否以及如何内源性地产生H₂仍然不清楚。在这里,我们首次报告了重组的人类(智人,Homo sapiens)和猪(猪,Sus scrofa)核层前识别因子(Narf)样蛋白(也称为人类仅铁氢酶样蛋白1 [HsIOP1] 和猪胞质铁硫组装组分3 [SsCIAO3],属于[FeFe]类氢酶样蛋白家族),当在原核系统中表达时,可以在体外潜在地催化H₂的产生。明显观察到厌氧诱导。进一步调查转录组数据库揭示了这些蛋白质在人类和猪组织中的广泛存在。序列和结构分析揭示,HsIOP1和SsCIAO3可能包含四个保守的半胱氨酸残基,形成类似于已知莱茵衣藻[FeFe]氢酶的[4fe4S]簇。根据在大肠杆菌中产生的HsIOP1和SsCIAO3的氢酶活性观察,以及Narf样蛋白在真核生物中的普遍存在,我们提出H₂产生可能是真核生物中的一种普遍现象。基于进化树的结果,进一步假设氢代谢可能在真核细胞的进化和发育过程中被忽略了相当长的时间。
1. 引言
1.1 引言
一个普遍的理论认为,早期地球的大气富含分子氢(H₂)[1][2][3]。目前,许多细菌和古菌可以利用H₂作为低电位电子的来源,或者,与一些原生动物和真菌(通过称为氢化体的独特细胞器)一起使用它来重新氧化细胞的氧化还原池[4][5][6]。尽管越来越多的证据表明外源性施加的H₂在哺乳动物体内积极调节许多生理和病理反应[7, 8],但哺乳动物细胞是否以及如何内源性地产生H₂仍然不清楚。
氢酶,催化质子(H⁺)的可逆还原生成H₂,在20世纪30年代被发现[9]。几乎所有类型的原核生物、一些厌氧微生物真核生物、单细胞绿藻和高等植物中都发现了产氢现象[10][11][12]。广泛的基因组测序工作揭示了在有氧真核生物中编码的类氢酶样蛋白与三种氢酶(包括[NiFe]氢酶、[Fe]氢酶和[FeFe]氢酶)之间的意想不到的发现和复杂的进化联系[13, 14]。尽管观察到厌氧产氢系统([NiFe]氢酶)与厌氧能量生成系统(线粒体复合体I)之间的氨基酸同源性[15][16][17],但[FeFe]氢酶与几种同源的真核生物蛋白(类氢酶样蛋白)之间的序列同源性更高[5, 18, 19]。在包括酵母、蠕虫、昆虫、植物、哺乳动物和人类在内的真核生物基因组中编码的多份类氢酶样蛋白显示出与[FeFe]氢酶的显著同源性[5, 16]。其中,人类基因组包含两个[FeFe]氢酶同源基因,包括人类仅铁氢酶样蛋白1和2(HsIOP1和HsIOP2)(也称为核层前识别因子[Narf]样蛋白),这两者分别与缺氧诱导[20]或核层组装[21]功能相关。相比之下,除了在肠道微生物群中检测到的氢酶活性[22],动物细胞特别是哺乳动物细胞中是否也发生依赖氢酶的氢产生仍然不清楚,尽管在呼吸测试中检测到了H₂[23]。
当在原核系统中表达时,我们发现重组的人类(智人)和猪(猪)Narf样蛋白(HsIOP1和SsCIAO3)可以在体外催化H₂的产生。明显观察到厌氧诱导。基于Narf样蛋白在真核生物中的普遍存在,我们推测H₂产生可能是真核生物中的一种普遍现象。进一步假设氢代谢可能在真核细胞的进化和发育过程中被忽略了相当长的时间。
2. 材料和方法
2.1 真核生物Narf样蛋白的序列和结构分析
获取并排列了莱茵衣藻HYD1(登录号Q9FYU1)、褐藻ADK77883.1(登录号E7BYE2)、斜生栅藻AJ271546.1(登录号Q9AR66)、阴道滴虫XP_001330775.1(登录号Q27094)、拟南芥核结构相关1(AtNAR1,登录号Q94CL6)、酿酒酵母NAR1(ScNAR1,登录号P23503)、HsIOP1(登录号Q9H6Q4)和SsCIAO3(A0A4X1SVH8)的氨基酸序列,并使用AlphaFold 3根据其蛋白质序列和US数据中心全球蛋白质数据银行(RCSB PDB,www.rcsb.org/alignment)在线工具的成对结构排列进行分析。
2.2 质粒构建
使用Pcold质粒克隆了在大肠杆菌中表达HsIOP1(Q9H6Q4)、SsCIAO3(A0A4X1SVH8)、ScNAR1(P23503)、ScADH(P00330)、GFP(P42212)和mCherry(X5DSL3)的构建体。HsIOP1、SsCIAO3和ScNAR1的序列经过密码子优化(补充材料中提供),并由北京青科生物科技有限公司人工合成。
2.3 原核蛋白表达和细胞水平的H₂产生活性
在大肠杆菌BL21(DE3)菌株中进行原核蛋白表达,根据先前描述的方法[17]进行了一些修改。将含有200 μg/mL氨苄青霉素的10 mL LB培养基在37°C下振荡培养过夜,直到吸光度值达到0.4。接下来,将10 mL的前培养基加入到1 L新鲜的LB培养基中,培养至A600达到0.4。对于诱导,加入新鲜氯化铵铁(1 M)至最终浓度为2.5 mM,并加入IPTG至最终浓度为1.5 mM,在16°C下密封培养过夜。
然后将LB分为两部分,其中一部分从厌氧环境(VGB-1S厌氧手套箱;常熟通润电子科技有限公司,江苏,中国)中取出置于空气中6小时,另一部分置于厌氧环境中指定的时间点。通过气相色谱(GC)分析了瓶中顶空的H₂,并从培养在LB中的大肠杆菌中释放气体。
2.4 氢含量分析和氢酶活性测定
使用BCA方法测定蛋白质含量。随后进行了动力学常数和相关分析。
为了测定酶活性,在血清瓶中准备了10 mL的电子供体缓冲液。此外,向10 mL缓冲液中(PBS 20 mM,pH 8,5%甘油,KCl 0.25 M)加入了亚硫酸钠和甲基紫精(MV)(均购自上海麦克林生化科技有限公司),以获得20 mM亚硫酸钠和10 mM MV的储备溶液。溶液摇动20分钟以去除血清瓶中的残余氧气。反应溶液(1 mL)在类似的缓冲液中准备在10 mL血清瓶中。随后,将电子供体缓冲液和50 μL样品蛋白溶液使用气密注射器注入血清瓶中,混合后置于37°C水浴中4小时。
记录小瓶因甲基紫精(MV)而产生的颜色变化,如图S2所示,并且通过将1毫升样品注入气相色谱仪(天美GC7980)来测量氢气含量。将煮沸的蛋白质溶液、甲基紫精、连二亚硫酸钠和缓冲液用作空白对照。对于蛋白质表达而言,酶活性以每毫克蛋白质每小时产生氢气的纳摩尔数(nmol H₂/ h mg Pro)来表示,使用以下公式进行计算:C(H₂) * (V₍小瓶₎ - V₍溶液₎)/(m₍蛋白质₎ * 时间) 。 (注:其中C(H₂) 代表氢气浓度,V₍小瓶₎代表小瓶体积,V₍溶液₎代表溶液体积,m₍蛋白质₎代表蛋白质质量)。
3. 结果
3.1. 哺乳动物中的类氢化酶蛋白家族
类Narf蛋白的预测序列是从已发表的基因组数据库中获取的。进行了序列比对分析,以鉴定与已知功能的真核生物[FeFe]-氢化酶(莱茵衣藻HYD1、棕鞭藻ADK77883.1、斜生栅藻AJ271546.1和阴道毛滴虫XP_001330775.1)相近的假定同源物。如图1A和B所示,人类(仅含铁氢化酶样蛋白1 [HsIOP1])、猪(胞质铁硫组装组件3 [SsCIAO3])、酵母(酿酒酵母,ScNAR1)和拟南芥(拟南芥,AtNAR1)的类Narf蛋白(图1B)包含与这些已鉴定的功能性真核生物[FeFe]-氢化酶的催化部分(绿色长杆)相似的氨基酸序列 [16]。这些类Narf蛋白具有排列相似的蛋白质结构域,带有四个完全保守的半胱氨酸(绿色长杆中的黄色块表示围绕三个与H-簇配位的半胱氨酸的保守序列),此前认为这些半胱氨酸与这些功能性真核生物[FeFe]-氢化酶的近端簇关键催化位点结合 [24]。然而,序列分析表明,这些类Narf蛋白在第一个H-簇中缺少一个必需的半胱氨酸残基(红色虚线框),而这个残基存在于功能性[FeFe]-氢化酶(莱茵衣藻HYD1)的保守氨基酸序列中。重要的是,第一个H-簇中的保守半胱氨酸残基对于产氢过程中的质子转移至关重要 [16,21]。
此外,据推测,类Narf蛋白缺乏氢化酶活性是由于在用于结合近端簇的四个现有保守半胱氨酸之间存在大量的插入或缺失(图1A中的红色块),这一点已通过先前的序列和结构分析得到了初步验证 [13,24,25]。
相比之下,使用AlphaFold 3进行的进一步结构分析显示,功能性氢化酶(莱茵衣藻HYD1和棕鞭藻ADK77883.1)与人类和猪的类Narf蛋白之间具有相似的三维结构(图1C)。尽管关于配体的详细数据还需要进一步探究,但这些结果表明,类Narf蛋白中的这四个保守半胱氨酸可能形成一个相同的[4Fe4S]簇,类似于两种功能性[FeFe]-氢化酶的重要催化位点 [5,24,26]。这些结构生物学结果表明,类Narf蛋白可能在氢气产生过程中发挥作用。
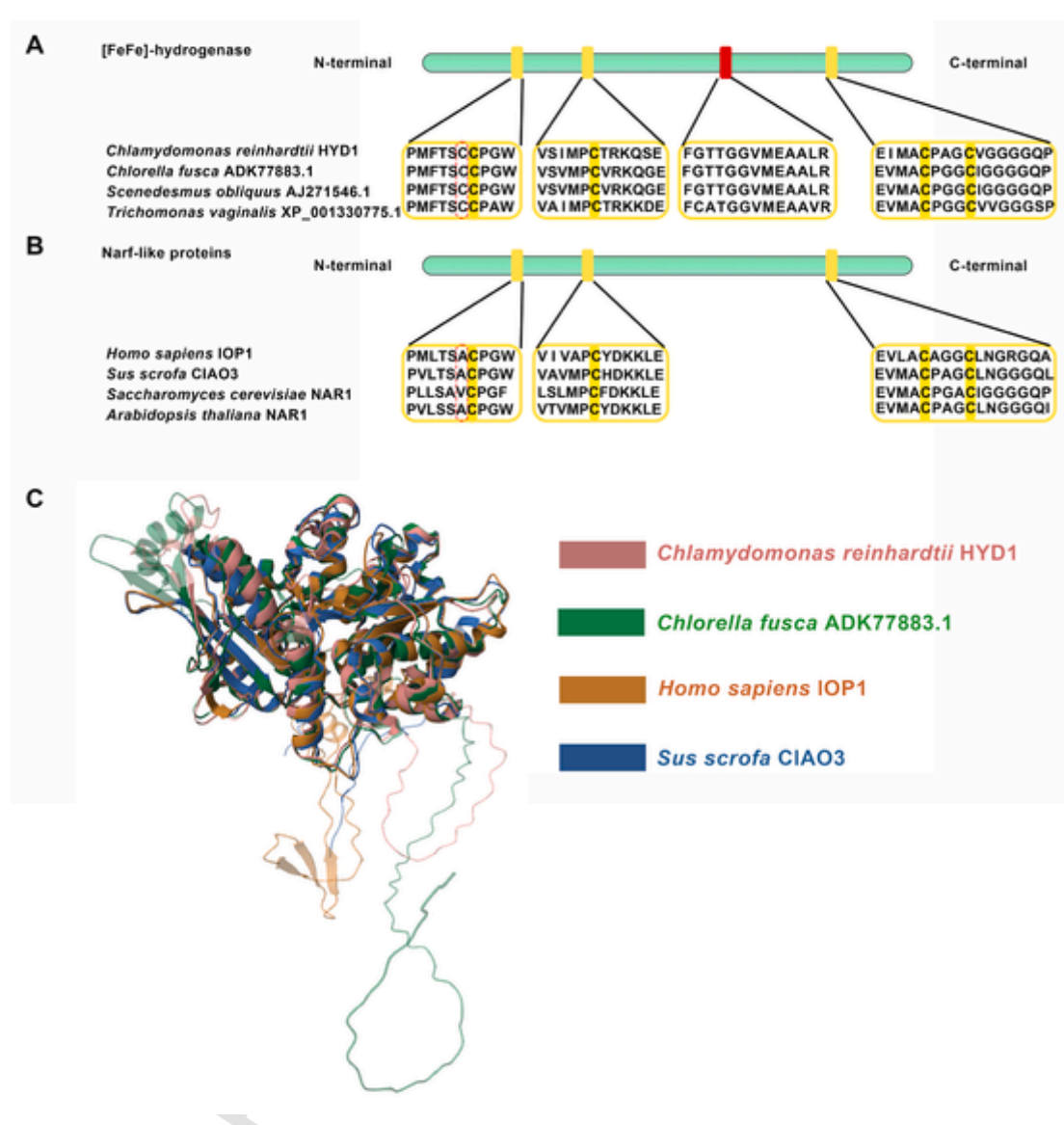
图1. 真核生物类Narf蛋白的序列和结构分析
[FeFe]氢化酶类别(A)和类Narf蛋白(B)的比较。这两类蛋白家族都包含具有保守半胱氨酸残基的相似结构域。绿色长杆代表蛋白质的催化部分。绿色长杆内的黄色块标记了围绕三个与H-簇配位的半胱氨酸的保守序列。在(A)中,先前认为在产氢过程中对质子转移至关重要的半胱氨酸残基用红色虚线标出,但在(B)中没有。在四个现有保守半胱氨酸中的红色块(A)在类Narf蛋白(B)中也不存在,这表明与功能性氢化酶(A)相比存在大量突变。根据蛋白质序列,使用AlphaFold 3分析了莱茵衣藻HYD1(AF-Q9FYU1–F1-v4)、棕鞭藻ADK77883.1(AF-E7BYE2-F1-v4)、HsIOP1(AF-Q9H6Q4-F1-v4)和SsCIAO3(AF-A0A4X1SVH8–F1-v4)的三维结构,并通过美国全球蛋白质数据库数据中心(RCSB PDB,www.rcsb.org/alignment)的在线工具进行了成对结构比对分析(C)。(关于本图中颜色引用的解释,读者可参考本文的网络版本。)
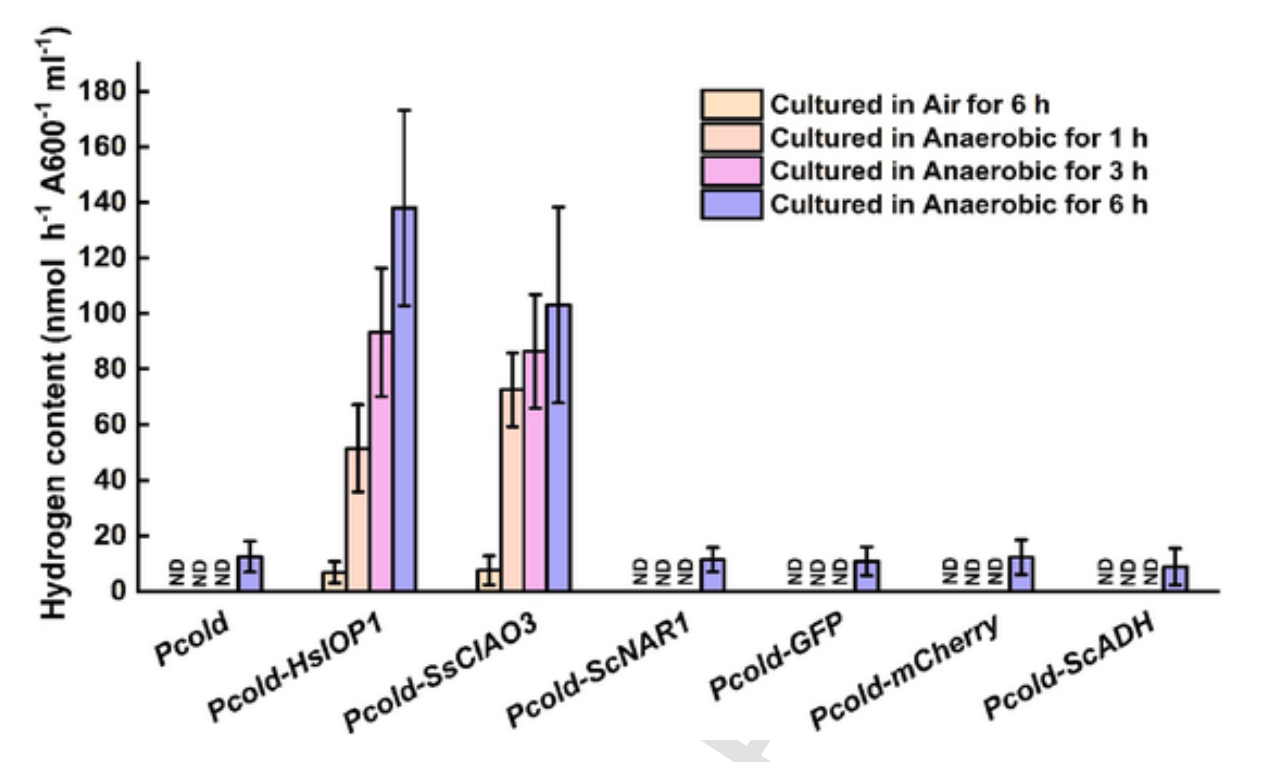
图2。在大肠杆菌中合成重组HsIOP1和SsCIAO3后h2的厌氧诱导 采用气相色谱法准确定量将含有Pcold(空载体)、HsIOP1、ssciao3、GFP-GFP或GFP的各种表达质粒培养到空气或厌氧条件下培养后产生的H2量。测定了顶空中的h2含量。垂直条表示SD
3.2. 重组的HsIOP1和SsCIAO3仅在厌氧条件下是有活性和功能的氢化酶
为了确认这两种类Narf蛋白是否具有氢化酶活性,进行了重组实验和功能分析。通过两种方法评估了甲基紫精依赖的氢化酶活性催化的氢气产生:1)颜色可视化和2)气相色谱法 [27]。先前的研究已经揭示了绿藻 [28] 和微生物 [29] 中氢化酶依赖的氢气产生对氧气的敏感性。因此,将包括HsIOP1、SsCIAO3和酿酒酵母NAR1(ScNAR1)在内的三种类Narf蛋白的编码序列克隆到原核表达系统(大肠杆菌BL21)中,然后分别在有氧和厌氧条件下进行培养。
与ScNAR1的反应情况不同,当HsIOP1和SsCIAO3在大肠杆菌中表达时,通过气相色谱法检测到更多的氢气从溶液中排放到气相中(图2) [27]。当厌氧条件持续6小时时,这种增加的趋势呈现出时间依赖性。相比之下,用Pcold(空载体)、Pcold-GFP、Pcold-mCherry和Pcold-ScADH转化的大肠杆菌产生的氢气量极少,且仅在厌氧处理6小时后才能检测到。这些结果证实,在体外条件下,HsIOP1和SsCIAO3催化的氢气产生是由厌氧条件诱导的。结合先前的研究结果 [28,29],我们认为生物产氢一直被忽视,至少部分原因是其形成过程对氧气敏感。在生物系统中,质子、负氢离子和氢气(氢代谢的三个主要成分)之间可能存在的相互转化也可能被忽视了。
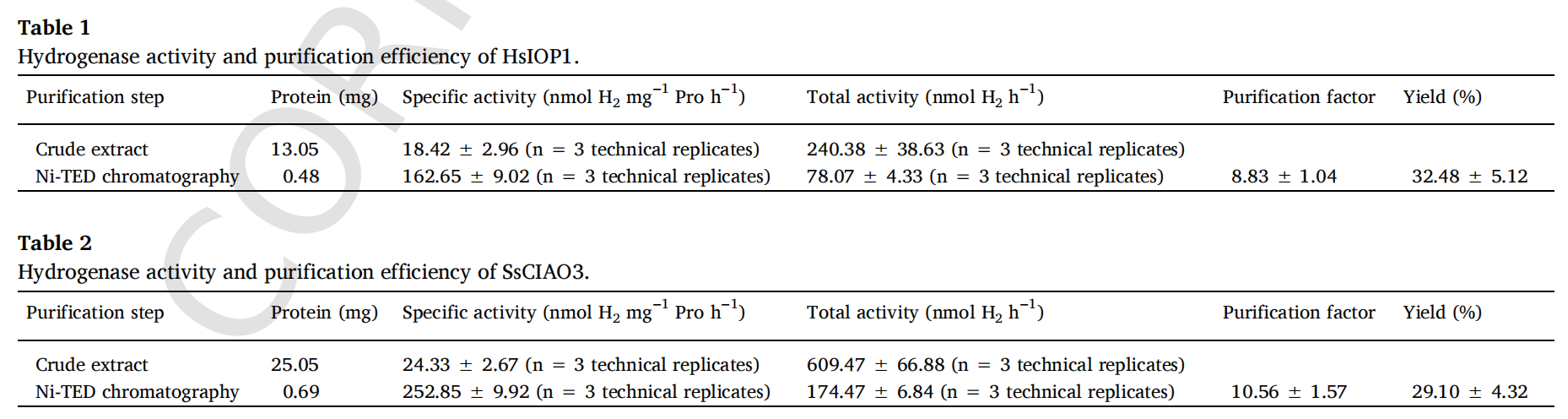
在用Ni-TED色谱法进行进一步的部分纯化后(图3A-C),生化实验表明,在IPTG诱导后在大肠杆菌中表达的重组SsCIAO3和HsIOP1,用抗His抗体进行蛋白质免疫印迹分析显示出一条大约55 kD的条带。纯化方案总结如下(表1和表2)。在重组HsIOP1和SsCIAO3存在的情况下进行的颜色可视化实验也支持了这些结果,显示出由于电子供体数量减少而导致的蓝色减弱(图S2)。
正如预期的那样,酶活性分析证实了重组氢化酶蛋白的纯化效果。检测到重组SsCIAO3和HsIOP1的氢气合成活性,从25.05毫克粗蛋白中纯化的倍数约为10.56倍,从13.05毫克粗蛋白中纯化的倍数约为8.83倍。两种纯化后的蛋白质的比活性分别为252.85±9.92和162.65±9.02 nmol h⁻¹mg⁻¹Pro(表1和表2)。这两种重组蛋白的最适pH值约为7.0,最适温度约为35℃(图3D和E)。剂量依赖性分析显示,SsCIAO3和HsIOP1产生氢气的动力学相似(图3F)。如图3G和H所示,还得到了连二亚硫酸钠(Na₂S₂O₄;作为电子供体的底物)的米氏常数(Km)以及SsCIAO3和HsIOP1的最大反应速率(Vmax)(对于SsCIAO3,Km = 12.18±3.67 μM,Vmax = 397.36±51.48 nmol h⁻¹mg⁻¹蛋白;对于HsIOP1,Km = 13.39±4.40 μM,Vmax = 343.36±50.41 nmol h⁻¹mg⁻¹蛋白)。总之,这些结果反映了其显著的潜在酶学性质。需要注意的是,在有氧环境下的纯化过程中,无论是否重新引入低氧环境,氢化酶的大部分活性可能都会丧失。
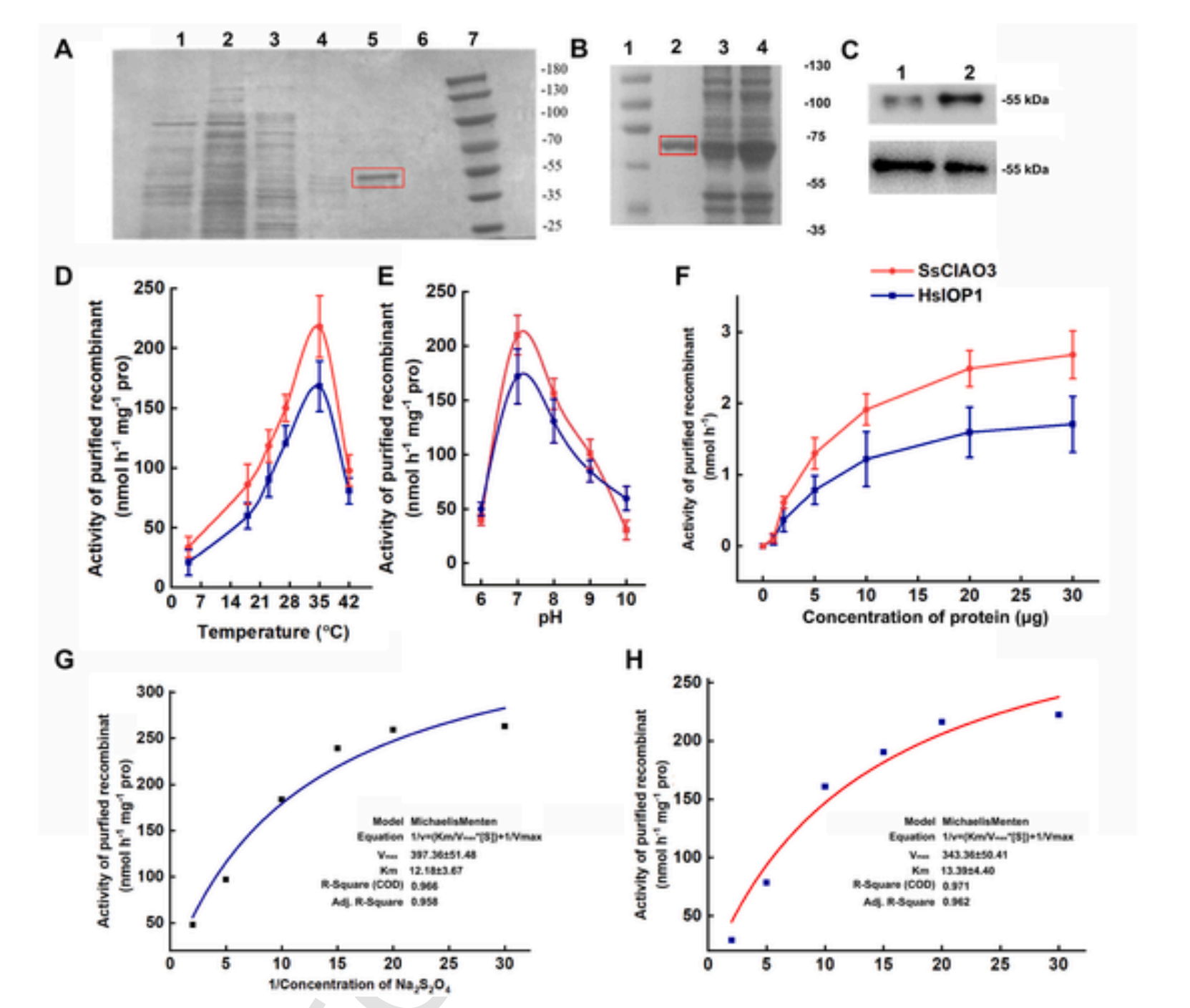
图3. HsIOP1和SsCIAO3的纯化及其酶动力学分析
纯化后的SsCIAO3的SDS-PAGE图谱(A)(泳道1:未添加IPTG;泳道2:IPTG诱导;泳道3-6:诱导后的纯化蛋白;泳道7:分子标记物)和HsIOP1的SDS-PAGE图谱(B)(泳道1:分子标记物;泳道2:纯化蛋白;泳道3:IPTG诱导;泳道4:未添加IPTG),以及使用抗His标签抗体进行的蛋白质免疫印迹分析(C)(上方为SsCIAO3,下方为HsIOP1,两次重复)。最适温度(D)和pH值(E)。剂量依赖性反应(F)。SsCIAO3(G)和HsIOP1(H)的酶动力学常数。竖线表示标准差(n = 3,技术重复)。
4. 讨论
在自然界中,氢气的摄取和产生往往紧密相关,这引发了一种观点,即它们的融合促成了真核细胞的出现 [30]。考虑到这种进化联系以及氢气在人类和其他动物体内已知的生物学功能 [7,8],合理的推测是,这些真核细胞可能从肠道微生物中摄取和产生氢气 [22],但并非仅仅来源于肠道微生物。因此,科学界需要回答一些基本的科学问题,即真核细胞,尤其是哺乳动物细胞是否以及如何内源性地产生氢气。
在这里,我们确定了来自人类(仅含铁氢化酶样蛋白1 [HsIOP1])和猪(胞质铁硫组装组件3 [SsCIAO3])的类Narf/氢化酶样蛋白先前未知的特定功能,它们作为两种潜在的产氢酶,表现出相对较低水平的氢气合成活性。当前的研究结果表明,基于氢化酶的氢气产生可能在所有生物体内发生,而不仅限于先前在原核生物或绿藻中发现的情况 [15,16,28,31]。本研究结果通过在大肠杆菌中的原核表达(图2)以及纯化后的酶动力学分析(图3,表1和表2)得到了证实,并且体外的产氢活性与HsIOP1和SsCIAO3在大肠杆菌中的表达相关。序列和结构分析揭示了氢化酶蛋白与真核生物(包括人类[HsIOP1]和猪[SsCIAO3])中的类Narf/氢化酶样蛋白之间可能存在的进化联系和空间结构相似性(图1)。这两种蛋白先前被认为缺乏氢化酶活性 [5]。然而,我们观察到,HsIOP1和SsCIAO3在大肠杆菌中表达的氢化酶活性远低于已知的氢化酶(约为其活性的0.1%;图S2)[32],而这些差异可能是由于缺乏H-簇合成机制造成的,该机制依赖于真核生物中特定的生物发生因子(如HYDE/F/G)[5,24,26]。对HsIOP1/SsCIAO3依赖的氢气产生的厌氧诱导的进一步评估以及纯化后的酶动力学分析表明,至少在体外实验条件下,SsCIAO3和HsIOP1都具有潜在的氢化酶活性(图2和图3)。功能性氢化酶蛋白(莱茵衣藻HYD1)与上述类Narf/氢化酶样蛋白(HsIOP1和SsCIAO3)之间活性的差异,在未来需要仔细阐明。
当酵母类Narf蛋白(ScNAR1)在大肠杆菌中表达时,未观察到氢化酶依赖的氢气产生(图2)。与NiFe-氢化酶中的阳性反应不同 [33],外源提供的谷胱甘肽无法保持和恢复类Narf/氢化酶样蛋白的氢化酶活性对氧气的敏感性,这反映了不同类型氢化酶的酶学复杂性 [13,14]。根据先前研究中提出的气体递质的六项标准 [34],我们的发现可能为氢气作为一种气体递质提供了一个可能的标准,因为它可能在哺乳动物细胞中由特定的底物(电子和质子)和酶(类氢化酶蛋白)内源性产生。考虑到类Narf蛋白在几乎所有生物体和组织中普遍存在(图S3和S4)[16,18],显然,尽管其催化机制以及在体外和体内的潜在功能尚未完全阐明,但我们在理解哺乳动物细胞中氢代谢的特定酶促途径以及特定的细胞和分子靶点(气体递质的另一个重要标准)方面还处于非常早期的阶段。
考虑到氢体(一般认为源自线粒体)[30,35]、光合作用系统 [28,36] 以及滴虫、藻类和微生物中的氢化酶之间的联系,因此我们提出,由氢化酶蛋白或类Narf/氢化酶样蛋白催化的氢气产生,可能不仅在真核生物甚至所有生物体内普遍存在(图1和S1),而且还与真核细胞的出现密切相关,尤其是叶绿体、线粒体和细胞核的起源过程,以及对氧气的适应 [30,37]。此外,缺氧越来越明确的生物学和医学功能 [38] 也可能表明氢气与缺氧之间存在某种关系。这一推测在细胞和环境层面开辟了新的视角。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1476793.html?mobile=1
收藏

