 精选
精选
氧化应激和大脑功能
氧化应激(OS)是众多神经退行性疾病病理生理学中的一个重要因素,如帕金森病、多发性硬化症、脑血管疾病或阿尔茨海默病。氧化应激也显著影响着各种神经退行性疾病的进展。活性氧(ROS)的形成与人体中和这些有毒副产物的能力之间的失衡,使得大脑易受氧化损伤。活性氧含量的增加可导致细胞功能障碍、细胞凋亡和神经退行性变。它们也是线粒体功能障碍的一个重要因素,而线粒体功能障碍是神经退行性疾病的一个典型特征。理解氧化应激的基本机制,以及它与线粒体功能、神经炎症和细胞保护途径的相互作用,对于制定针对性的治疗方案以维持大脑健康并减轻神经退行性变的影响至关重要。我们将阐述氧化应激在大脑功能中所起作用的最新研究要点,内容涉及氧化应激对神经元健康的重要性以及对神经退行性疾病进展的影响。
1. 引言
大脑特别容易受到氧化应激(OS)的影响,因为它对能量的需求很高,并且含有铁和铜等金属,这些金属与过氧化氢结合会产生羟基自由基。羟基自由基是最具反应活性和破坏性的自由基之一,能够严重损害蛋白质、脂质和DNA等重要的细胞成分 [1,2,3]。
在慢性氧化应激条件下,活性氧(ROS)的产生与中和之间的平衡被打破,导致它们在细胞和组织中积累。神经元由于耗氧量高且抗氧化物质有限,对氧化应激十分敏感,容易受到损伤并出现功能障碍,这促进了神经退行性疾病的发生和发展。活性氧或具有氧化还原活性的金属过载受到细胞防御机制和天然抗氧化剂的调节,这些在大脑中具有重要的生理作用 [4,5,6,7]。
线粒体功能障碍是大脑中氧化应激的主要原因之一。神经元因其代谢活动增强以及对需氧呼吸的依赖,特别容易受到氧化攻击,而需氧呼吸会产生活性氧作为副产物。活性氧生成增加会导致脂质过氧化、蛋白质氧化和DNA损伤,所有这些都会导致神经元损伤和死亡 [8]。
此外,大脑独特的脂质组成,其特征是多不饱和脂肪酸浓度较高,使其特别容易受到氧化损伤。脂质过氧化是一个重要过程,当活性氧以脂肪酸为靶点时就会发生,从而产生反应性醛类物质,这些物质会加剧氧化应激和脑损伤 [8]。氧化脂质和蛋白质的积累会形成一个不良循环,持续加剧氧化应激,并促进包括阿尔茨海默病(AD)和帕金森病(PD)在内的神经退行性疾病的发展 [9]。
炎症是大脑中氧化应激的一个主要促成因素,因为神经炎症反应可以激活胶质细胞,使其产生促炎细胞因子和活性氧 [10]。这种炎症状态会损害神经元细胞,并破坏血脑屏障(BBB) [10]。
此外,外部因素,包括环境污染物、压力和创伤,都可能潜在地加剧大脑中的氧化应激。创伤性脑损伤也与活性氧生成增加以及随之而来的氧化损伤有关 [11]。心理压力与大脑中氧化应激指标的增加相关,这表明急性和慢性应激源都可能加剧氧化过程 [12,13]。
大脑中氧化应激的来源是多方面的,包括线粒体功能障碍、脂质过氧化、神经炎症和外部应激源,所有这些都延续了氧化损伤的有害循环,这是各种神经系统疾病的一个核心病理生理方面,我们将进一步讨论。
理解大脑对氧化应激的适应机制,对于制定针对各种疾病(如帕金森病和痴呆症(尤其是阿尔茨海默病))以及脱髓鞘疾病(如多发性硬化症(MS))的治疗方案至关重要。脑血管疾病和中风后的康复也代表着重要的病理生理方面。
除了传统的抗氧化剂,人们正在研究采用纳米技术和靶向递送系统的创新方法,以提高抗氧化治疗的效果。单原子纳米酶已被设计用于吸附活性氧和活性氮(RNS),为降低大脑中的氧化应激提供了一种新方法 [14]。
尽管抗氧化剂在治疗神经系统疾病方面的潜力令人鼓舞,但在将这些发现应用于治疗环境中仍然存在障碍。个体对抗氧化治疗反应的差异,以及不同神经系统疾病中氧化应激途径的复杂性,需要更多的研究来优化治疗方案,并确定哪些患者群体可能从抗氧化干预中获得最大益处 [15,16]。
2. 大脑适应氧化应激的病理生理机制
大脑对氧化应激的反应是一个涉及多个途径的复杂过程。氧化应激被定义为活性氧生成与抗氧化防御之间的失衡,它显著促成了神经退行性疾病和认知能力下降。中枢神经系统(CNS)设法适应的机制涉及某些途径以及各种特定蛋白质的作用,这些正引起人们的关注并在持续研究中。
谷氨酸是一种主要的兴奋性神经递质,参与突触可塑性和兴奋性毒性细胞死亡。它与受体结合,如N-甲基-D-天冬氨酸受体(NMDAR),这是一种位于突触和突触外部位的钙通道。钙通过突触外的NMDAR进入线粒体,导致线粒体钙超载,进而导致神经元死亡。钙稳态的破坏会引发神经元死亡,导致诸如阿尔茨海默病和帕金森病等疾病的发生 [17]。
大脑主要通过激活神经保护信号通路来适应氧化应激。核因子E2相关因子2(Nrf2)通路对于细胞抵御氧化作用至关重要。Nrf2的激活会诱导多种抗氧化基因的转录,从而增强大脑对抗氧化应激的能力 [18]。三七皂苷R1可以激活Nrf2通路,对神经元损伤起到神经保护作用。同样,对氧磷酶2(PON2)通过激活Nrf2来调节氧化应激反应,从而与神经保护相关 [18,19]。DJ-1(一种与帕金森病相关的蛋白质)和PON2之间的相互作用凸显了这两条通路在神经元存活中的重要性 [20]。
磷脂酰肌醇3-激酶(PI3K)/Akt信号通路与Nrf2通路一样,是神经保护的关键机制。这条通路与细胞存活和抗凋亡信号传导有关。硫代黄酮激活PI3K/Akt通路,在氧化应激条件下抑制细胞凋亡并增加细胞存活率 [21]。这条通路的激活受到性激素(包括睾酮和雌激素)的影响,这些性激素已被证明对神经元细胞具有保护作用 [22]。这些信号通路之间的相互作用实际上凸显了大脑的适应性反应。
特定蛋白质在促进神经保护方面的作用值得关注。DJ-1在应激条件下会发生氧化,这对其神经保护功能至关重要 [23]。DJ-1的氧化增加了它与PON2的相互作用,从而促进了氧化应激条件下神经元的存活 [20]。PON2的表达水平受性别影响,女性体内的表达水平较高,这表明激素差异可能会影响大脑的易损性 [24]。这种性别特异性反应表明,大脑的适应机制受到生化因素和生物性别的共同影响。
神经保护化合物的作用是大脑适应氧化攻击的另一个关键方面。槲皮素和虾青素等天然化合物具有抗氧化特性,可能会减少大脑中的氧化损伤。槲皮素通过调节PON2水平,增强了大脑缓解氧化应激诱导的毒性的能力 [25]。虾青素已被证明可以通过降低氧化应激和提高脑源性神经营养因子(BDNF)水平来减缓大脑衰老,而BDNF对神经元的健康和功能至关重要 [26]。这些发现表明,饮食和药物干预可以提高大脑对氧化应激的抵抗力,因此,我们会在专门的子主题中讨论它们。
促红细胞生成素(Epo)及其变体(包括EpoL)的神经保护作用引起了人们的关注,因为它们能够激活抗凋亡通路并降低神经元细胞中的活性氧水平 [27,28]。促红细胞生成素的作用机制包括激活促红细胞生成素受体(EpoR),这会导致信号分子的磷酸化,从而增强细胞存活。这种受体介导的神经保护强调了针对这些通路的治疗药物在改善大脑适应性反应方面的潜力。内源性大麻素的存在会影响大脑对氧化应激的反应,显示出对氧化损伤的保护作用。内源性大麻素可以影响神经祖细胞的反应,表明在应激条件下,它在维持神经元健康方面具有保护功能 [29]。
神经保护作用可能是通过激活许多增强细胞存活和减少细胞凋亡的信号通路来实现的。此外,大脑的抵抗力与其代谢状况有关。多巴胺在特定脑区(包括纹状体)的代谢,与多巴胺代谢过程中产生活性氧所导致的氧化应激增加相关 [24]。这种内在的敏感性需要强大的抗氧化防御,通常由PON2等蛋白质来促进,这些蛋白质会相应增加 [19]。理解不同区域反应的差异,可以为神经保护的专门治疗方法提供更多的见解。
炎症通路的启动会导致神经元损伤并加剧神经退行性机制,例如核因子κB(NF-κB)的激活,NF-κB是一种与炎症反应相关的转录因子,已被证明与神经系统中的氧化应激相关 [30]。NF-κB具有神经保护特性,表明它在大脑的反应中具有双重作用 [30]。这种复杂性凸显了深入理解氧化应激、炎症和神经保护之间相互作用的必要性。这就是饮食抗氧化剂在提高大脑抵抗力方面发挥作用的背景。源自天然来源的化合物,如贻贝中的甾醇,显示出抗氧化特性,可增强神经保护作用 [31]。这样的发现表明,饮食的改变可能会显著影响大脑对氧化应激的反应,有可能为预防神经退行性疾病提供方法。
简而言之,导致大脑中多种病理事件级联发生的主要机制可以综合在图1中。具体而言,大脑对氧化应激的反应基于信号通路、特定蛋白质和神经保护剂之间的复杂相互作用。然而,不仅是Nrf2和PI3K/Akt等通路的激活,或者像DJ-1和PON2等蛋白质的作用,调节着大脑对氧化应激的反应,而且饮食中的抗氧化剂以及不同研究化合物的神经保护特性,在神经退行性疾病的预防和治疗方面也越来越受到关注。
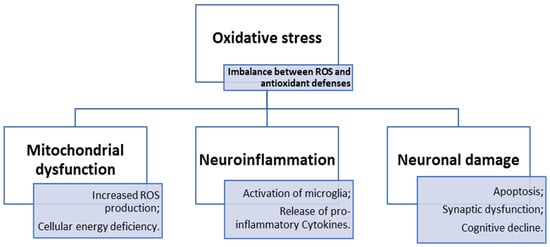
图1. 氧化应激在神经退行性疾病中的作用示意图
3. 帕金森病中的氧化应激
黑质致密部的退化是帕金森病的病理特征,当产生多巴胺的神经元大约损失60% 后,会出现特定的运动症状 [32]。当黑质内的多巴胺能神经元细胞发生损失时,纹状体中特定的多巴胺神经末梢数量减少,运动的执行在僵硬和运动不能方面会发生改变。多巴胺的耗竭会导致皮质-纹状体-苍白球-丘脑-皮质回路的直接通路活动减弱,间接通路活动增强 [32,33]。初级输出核的去抑制和丘脑皮质系统抑制的增强会导致特征性的搓丸样震颤 [32]。
帕金森病中多巴胺能神经元的减少会降低苍白球内侧部(Gpi)和黑质网状部(SNr)的活动,导致Gpi和SNr的抑制性输出增强。多巴胺缺乏会解除对与苍白球外侧部(Gpe)形成突触的纹状体苍白球神经元的抑制,从而降低抑制性苍白球丘脑底神经元的活动。多巴胺耗竭通过投射到γ-氨基丁酸(GABA)能神经元来增强纹状体的活动,进而放大对Gpe的作用。此外,多巴胺的耗竭还会导致丘脑底核的去抑制 [32,33,34]。
活性氧促成了帕金森病中的神经元退化。氧化应激显著促成了黑质中多巴胺能神经元的退化。单胺氧化酶B对多巴胺的酶促氧化会产生羟基自由基,尤其是在铁存在的情况下,而铁在基底神经节中普遍存在 [35,36]。这种机制会导致多巴胺耗竭,并产生毒性代谢产物,加剧神经元损伤。多巴胺能神经元因其固有的代谢特征(如存在产生活性氧的酶,如酪氨酸羟化酶),对氧化应激的易感性加剧。这种脆弱性表明,氧化应激是帕金森病病因学中的一个关键因素,会导致神经元细胞死亡以及与该病症相关的标志性运动症状。
有特定的信号通路调节着帕金森病中的反应。Nrf2通路是最重要的通路之一,因为它控制着抗氧化蛋白的产生,这些蛋白可保护细胞免受氧化损伤 [37]。Nrf2的激活已被证明能够纠正散发性帕金森病患者来源细胞中的代谢缺陷,表明它作为治疗靶点的可行性 [37]。此外,帕金森病患者中Nrf2的失调与氧化应激水平升高相关,这表明增强这条通路可能具有神经保护益处 [37,38]。
除了Nrf2,沉默调节蛋白1(SIRT1)在帕金森病氧化应激方面的重要性也得到了强调。SIRT1因能减少神经元细胞死亡而为人所知,并且在帕金森病中其表达下调 [39]。调节SIRT1的活性可能是一种可行的方法,以尽量减少氧化应激对多巴胺能神经元的有害影响。此外,与神经炎症的关系也已得到证实,持续的炎症会加剧帕金森病中的神经元损失 [40,41]。
小胶质细胞的激活和促炎细胞因子的分泌会加剧氧化应激,形成一个有害的循环,加速神经退行性变 [42]。帕金森病中的线粒体功能衰竭与这些过程密切相关。线粒体既是活性氧的产生者,也是其作用靶点,因为线粒体功能障碍可能导致神经元中氧化损伤加剧 [43]。
帕金森病中,线粒体复合物I的损伤似乎很常见,这会导致活性氧的积累并进而导致神经元死亡 [44]。线粒体功能障碍与氧化应激之间的相关性凸显了关注线粒体健康作为帕金森病潜在治疗策略的重要性。环境因素,包括接触百草枯和鱼藤酮等农药,已知通过与氧化应激相关的途径与帕金森综合征有关 [45,46]。这些化学物质通过损害线粒体活性和增加活性氧的产生发挥作用,导致多巴胺能神经元退化。流行病学研究表明,接触农药与患帕金森病的几率增加有关,这强调了在这种情况下进一步探索导致氧化应激的环境因素的必要性 [45]。
N-乙酰半胱氨酸(NAC)也是一种公认的抗氧化剂,它可以恢复谷胱甘肽水平,并在多种脑损伤和神经退行性病变模型中展现出神经保护特性 [47]。在潘迪亚(Pandya)等人进行的一项研究中,N-乙酰半胱氨酸在创伤性脑损伤(TBI)后,显示出对生物能量学的改善和行为学结果的提升,强调了其作为治疗药物的潜力 [47]。同样,白藜芦醇作为另一种抗氧化剂,已有文献记载,它能保护帕金森病小鼠的多巴胺能神经元,使其免受氧化应激诱导的细胞凋亡 [48]。这些发现凸显了药物抗氧化剂在治疗与氧化应激相关的神经系统疾病方面的治疗潜力。
包括姜黄素在内的膳食多酚,也因其在帕金森病模型中降低氧化应激和促进神经元存活的能力而被研究 [49]。这类化合物可能会增强大脑的抗氧化防御能力,并为传统药物治疗提供一种补充策略。确定帕金森病中氧化应激的生物标志物,对于早期诊断和追踪疾病进展至关重要。有研究表明,接受左旋多巴治疗的帕金森病患者体内,半胱氨酰甘氨酸水平的降低可作为氧化应激的间接生物标志物 [50]。这些生物标志物可以通过在临床环境中评估氧化应激水平,实现及时治疗并改善患者的预后。
4. 多发性硬化症中的氧化应激
多发性硬化症(MS)的炎症方面会影响大脑和脊髓,目前人们正在研究众多与之相关的遗传因素,同时也在努力减缓疾病进展,尤其是通过预防复发来实现。多发性硬化症中的神经退行性变和症状归因于离子通道功能障碍 [51]。在急性炎症发作期间会出现病理性的钠离子(Na⁺)通道阻滞,同时钠离子通道表达的增加在神经退行性级联反应中也发挥着作用。脱髓鞘过程也基于钾离子(K⁺)通道的病理生理学以及对快速钾离子电导的控制;换句话说,轴突兴奋性的改变恢复到正常水平时,症状会得到改善 [52]。
多发性硬化症中与维生素D缺乏相关的病理生理机制表明,包括饮食摄入和阳光照射在内的维生素D来源,与多发性硬化症的发病率之间存在关联。考虑到与维生素D水平低相关的环境因素,以及对与维生素D相关的脱髓鞘病理动物模型的各种研究,再结合免疫和遗传方面的观点,越来越明显的是,维生素D通过参与氧化应激和炎症过程,在多发性硬化症的治疗中发挥着重要作用 [53,54]。维生素D缺乏与多发性硬化症患者体内促炎细胞因子水平升高和氧化应激指标上升相关 [55]。这表明维生素D不足可能会加剧中枢神经系统(CNS)的氧化损伤,从而导致临床症状和疾病发展。此外,人们认为维生素D可以增加抗氧化酶的表达,从而减少氧化应激及其相关危害 [56]。
在多发性硬化症的实验模型中,补充维生素D可以降低氧化应激指标,并提高抗氧化状态 [57]。维生素D调节钙稳态和影响线粒体活性的能力,也可能在其对抗氧化应激的保护作用中发挥作用 [57]。维生素D受体(VDR)的激活对于介导这些作用至关重要,因为已证明VDR的激活会增加与抗氧化防御系统相关基因的表达 [58]。
尽管如此,氧化应激在多发性硬化症中的作用很复杂,涉及免疫细胞(如巨噬细胞和小胶质细胞)的激活,这些细胞在炎症过程中会产生活性氧(ROS)。这些活性氧会导致线粒体功能障碍、神经炎症,并最终造成神经元损伤 [59,60]。氧化损伤很常见,尤其是在早期脱髓鞘区域,在那里经常能检测到凋亡的少突胶质细胞。这种氧化损伤会破坏髓鞘的完整性,并营造出促炎环境,从而加剧疾病进程 [61,62]。沿着多条信号通路增加的活性氧可以激活丝裂原活化蛋白激酶(MAPKs),放大炎症反应 [59,60]。
氧化应激和炎症的这种恶性循环导致了多发性硬化症的慢性化,因为炎症介质会持续造成氧化损伤,进而导致神经元功能下降和死亡 [63,64]。人们还研究了脂质过氧化产物(如丙二醛)的存在,这表明脂质代谢可能在疾病进展中起着关键作用 [60,62]。此外,大脑在产生能量方面高度依赖线粒体功能,在这样的病理生理背景下,氧化应激会导致线粒体损伤,进而导致中枢神经系统的能量供应不足 [64,65]。这种能量缺乏对少突胶质细胞尤其有害,因为少突胶质细胞对于髓鞘的维持和修复至关重要。在脱髓鞘过程中,受损髓鞘释放出的铁会进一步加剧负面影响,因为游离铁可以通过芬顿反应催化形成高反应活性的羟基自由基 [65,66]。由此产生的氧化损伤不仅会影响髓鞘,还会导致神经元退化,这凸显了氧化应激、线粒体功能障碍和神经炎症在脱髓鞘过程中的相互关系和影响。
激活控制抗氧化蛋白表达的Nrf2通路,被认为是增强大脑抗氧化防御能力的一种方法 [66]。应用刺激Nrf2激活的药物,可能会通过减少多发性硬化症中的氧化损伤和炎症,提供神经保护益处 [66]。
此外,减轻氧化应激的膳食抗氧化剂和药物,可能会作为标准治疗的辅助疗法,从而改善患者的预后 [67,68]。
确定与多发性硬化症中氧化应激相关的生物标志物,对于理解疾病进展和治疗效果至关重要。评估氧化应激标志物(包括谷胱甘肽和丙二醛),可能会让我们深入了解多发性硬化症患者的炎症状况 [63,69]。多发性硬化症患者中氧化应激与损伤之间的相关性,凸显了将追踪氧化损伤作为评估疾病严重程度和治疗效果的一种可能措施的必要性 [62,69]。
血清中维生素D水平升高与患多发性硬化症的几率降低相关,并且也可能与患者临床结果的改善相对应 [70,71]。尽管有大量证据表明维生素D缺乏与氧化应激和多发性硬化症之间存在联系,但到目前为止,关于这种相关性的强度,也存在一些不确定的结果。王(Wang)等人发现,在特定群体中,维生素D缺乏与氧化应激之间的相关性非常小,这表明其他因素(如年龄和已有的疾病状况)可能会影响这些联系 [72]。补充维生素D可能会调节氧化应激,并为多发性硬化症患者提供治疗益处;然而,仍需要更多的研究来确定合适的剂量和治疗方案。理解多发性硬化症中连接维生素D和氧化应激的通路,对于制定针对性的治疗方案以改善患者预后至关重要。
5. 中风中的氧化应激
氧化应激在缺血性中风的病理生理学中也起着重要作用,它会导致细胞损伤,在缺血事件发生前后,对神经元损伤有显著影响,尤其是与脑血流中断相关。这会导致缺氧以及随后的再灌注损伤。与此同时,自由基的产生也会增加 [73]。脑细胞中的缺氧就是通过这种方式增加了脑血管事件的风险,特别是通过加剧炎症现象 [74]。
血管结构,尤其是 Willis 环的存在,会影响血流分布和缺血性损伤的程度,因为脑血管解剖结构的差异会影响中风的风险和预后,所有这些都表明,某些解剖结构可能会使个体在脑血管事件发生时更容易受到更严重的氧化应激 [75,76]。此外,大脑对氧化损伤的独特易感性,部分是由于其高代谢率和耗氧量:缺血事件发生后,烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶(尤其是NOX4)的诱导显著增加,这会导致氧化应激和神经退行性变 [77]。
中风患者的氧化应激水平可以通过生物标志物来评估,丙二醛(MDA)是最常被提及的生物标志物之一。丙二醛是脂质过氧化的副产物,是氧化攻击的可靠指标,因为丙二醛水平升高与中风后患者的肌肉力量和身体机能下降相关 [74]。此外,过度的氧化应激会导致不稳定的动脉粥样硬化斑块的形成,而这是缺血性中风的重要先兆 [78]。因此,这是脑缺血中神经元损失的一个重要介导因素,会导致损伤的扩散 [79]。这种氧化损伤在半暗带区域尤为明显,在那里细胞存活与死亡之间的平衡很不稳定。这些发现强调了氧化应激在中风急性期和慢性期的多方面作用,尤其是因为硫氧还蛋白(一种用于评估急性缺血性中风氧化损伤的血液生物标志物)可以用于诊断和预测 [80]。
这些参数在出血性中风患者中也显著升高,这进一步证实了氧化应激是脑血管事件中的一个常见途径 [81]。血液外渗到脑组织中会引发一系列炎症反应,并在导致血脑屏障破坏、水肿和神经元细胞功能障碍的整个变化过程中产生活性氧,从而加剧初始损伤 [82]。活性氧产生与抗氧化防御之间的失衡会导致血管损伤,尤其是在高血压的情况下 [83]。
氧化攻击在中风后的最初几天内达到峰值,生物标志物(如F2-异前列腺素,它是脂质过氧化的指标)会显著增加 [84]。这一时间因素对于理解旨在降低氧化影响的治疗干预的时间窗口至关重要。此外,急性出血性中风患者中氧化应激水平升高与脯氨酰肽酶活性增加之间的相关性表明,氧化应激会对参与组织修复和重塑的酶促途径产生影响 [85]。
抗氧化剂在治疗出血性中风中的氧化应激方面的作用正受到越来越多的关注,尤其是富含多酚的绿茶提取物,人们认为它在出血性中风模型中通过降低氧化活性和炎症发挥神经保护作用 [86]。当然,这与膳食抗氧化剂在调节氧化影响和改善中风患者预后方面的潜力是一致的 [87]。饮食干预或补充抗氧化剂可能是一种可行的策略,以促进出血性中风患者的康复并减少继发性脑损伤。
脑出血(ICH)后氧化应激与神经炎症之间的相互作用,会导致神经元凋亡和坏死 [88]。这种关系强调了需要针对氧化损伤和炎症途径制定治疗策略,以改善临床结果。血红素氧合酶-1(HO-1)作为生物标志物和治疗靶点的潜力也值得考虑,因为血清中HO-1水平升高与脑出血患者更好的预后相关 [89]。
回到作为中风病因的缺血问题,氧化应激相关基因的遗传变异及其对缺血性中风易感性的影响,也是最近备受关注的一个概念,因为个体对氧化活动的反应可能不同,这有可能为个性化治疗策略提供参考 [90]。另一方面,氧化应激与线粒体功能障碍之间的相互作用已有记载,因为线粒体DNA的氧化损伤会导致细胞功能受损,也会促进缺血性中风的发病机制 [91]。针对氧化应激的治疗策略,通过使用抗氧化剂和其他药物,作为中风治疗的潜在干预措施正越来越受到关注 [92]。
多酚作为抗氧化补充剂的潜力,也在脑血管疾病中得到了探索,有证据表明它们可能通过对抗氧化反应来提供神经保护 [93]。鉴于越来越多的证据表明氧化应激与中风康复后的不良功能结果相关,这条治疗途径尤为重要 [94]。
氧化应激不仅会损害细胞结构,还会促进炎症反应,这会进一步加重缺血性中风后的脑损伤。氧化应激的这种双重作用需要一种多方面的治疗方法,同时解决氧化损伤和炎症途径的问题 [95]。
酒精诱导的毒性被认为是许多神经系统疾病(包括中风和相关的痴呆综合征)的一个重要风险因素,它可能会加剧病情恶化。最近,乙醇神经毒性研究中的线粒体功能障碍,为理解神经元功能障碍机制和减少乙醇诱导的神经元损失的潜在药物靶点开辟了新途径,这会影响突触传递、记忆和学习,导致神经元损伤和死亡 [96]。
脑疾病(急性疾病或慢性疾病的恶化)的另一个风险因素(与长期饮酒或暴饮暴食相关)是创伤。创伤性脑损伤可能造成损害,导致潜在的慢性疾病过早发展。卡瓦哈尔(Carvajal)、马丁森(Mattinson)和塞尔帕(Cerpa)断言,基于N-甲基-D-天冬氨酸受体(NMDAR)分布的改变,NMDAR的分布在慢性疾病(如阿尔茨海默病、帕金森病,甚至亨廷顿病和肌萎缩侧索硬化症)的恶化中很重要。突触外的NMDAR会被谷氨酸溢出激活,导致与兴奋性毒性、神经元损伤和死亡相关的钙超载。参与中间过程的信号传导会发生改变,特别是钙介导的信号传导以及与各种途径的相互作用,因此提供了一系列潜在的治疗靶点,以调节与NMDAR相关的神经毒性 [97]。 6. Dementia and Oxidative Stress Modulation by Medication and Natural Antioxidants
与帕金森病、MS或脑血管疾病一样,通过OS激活的病理生理机制,痴呆对治疗策略以及药理解决方案和饮食观点进行了深入研究(算法见图2)。
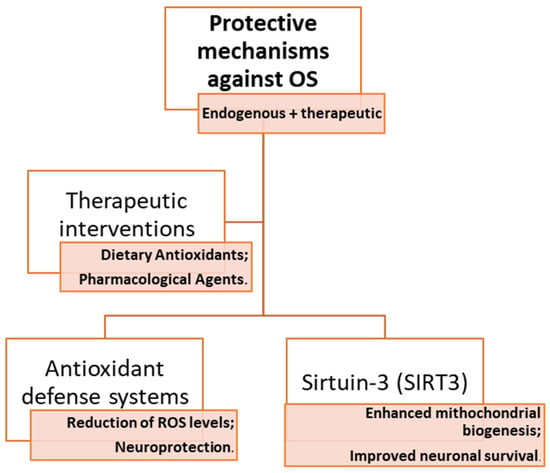
图2. 大脑对抗氧化应激影响的保护机制
线粒体脱乙酰酶,即沉默调节蛋白3(Sirtuin-3,SIRT3),被认为在与痴呆相关的氧化应激机制中起着关键作用。有证据表明,阿尔茨海默病(AD)患者存在线粒体损伤,因为其SIRT3的表达发生了改变 [98]。根据韦尔(Weir)等人的研究结果,SIRT3似乎在调节神经元内活性氧(ROS)水平方面起着至关重要的作用 [99]。在淀粉样蛋白β(Aβ)毒性作用下,SIRT3的增加表明存在一种补偿机制,能够抵消氧化应激的影响。SIRT3还负责介导超氧化物歧化酶2(SOD2)的去乙酰化,进而增强SOD2的活性,促进对活性氧的清除 [100,101]。对于保护神经元免受在痴呆相关疾病中常见的氧化损伤而言,这一功能非常必要。此外,研究表明SIRT3在调节tau蛋白水平方面也发挥着作用 [98,99]。SIRT3的保护作用还源于其对线粒体完整性和功能的增强 [98]。任(Ren)等人发现,SIRT3功能的下降与特定神经元群体的凋亡和退化之间存在关联 [102]。尽管如此,SIRT3作为维持神经保护和氧化应激之间平衡的介质,发挥着重要作用,这凸显了它作为痴呆治疗靶点的潜力。
在过去的几十年里,针对帕金森病(PD)、多发性硬化症(MS)以及痴呆(尤其是阿尔茨海默病)等神经退行性疾病的药物研发引起了广泛关注,在这些疾病中,氧化损伤的靶点包括脂质、蛋白质和DNA [14,15,36]。
用于治疗阿尔茨海默病的主要药物包括胆碱酯酶抑制剂和N-甲基-D-天冬氨酸(NMDA)受体拮抗剂。胆碱酯酶抑制剂,如多奈哌齐、卡巴拉汀和加兰他敏,其作用机制是通过抑制乙酰胆碱酯酶来增强胆碱能神经传递,乙酰胆碱酯酶负责降解突触间隙中的乙酰胆碱 [103]。乙酰胆碱水平的升高与轻至中度阿尔茨海默病患者认知能力和日常生活活动能力的改善相关,且这三种药物在患者中具有良好的耐受性 [103,104]。这些药物可以改善认知和功能结果,尽管个体之间的疗效可能存在差异。与维生素E联用也可能增强协同作用,产生更好的效果 [103]。
胆碱、磷脂酰丝氨酸、胞磷胆碱和复方牛胎肝提取物片有助于记忆巩固。胆碱是形成磷脂的关键成分,也是乙酰胆碱的前体。神经元中磷脂酰胆碱水平的降低也可能导致认知能力下降 [105]。胞磷胆碱是合成磷脂酰胆碱所必需的一种化学物质,当身体需要增加乙酰胆碱的合成时,胞磷胆碱可能会被消耗。缺血性中风似乎会破坏磷脂酰胆碱的合成,使个体患痴呆的风险增加一倍 [106]。对于轻度血管性认知障碍患者,每天补充500毫克胞磷胆碱,持续9个月,是有益的 [106]。
除了胆碱酯酶抑制剂,治疗阿尔茨海默病的主要谷氨酸能疗法是使用非竞争性NMDA拮抗剂美金刚,它对NMDA受体具有适度的亲和力,其特点是起效快、作用消退快,通常用于治疗中至重度阿尔茨海默病 [107]。米拉(Mira)和塞尔帕(Cerpa)认为,虽然在培养的神经元中,通过NMDA受体(很可能主要是通过突触外NMDA受体)的钙内流是导致钙诱导的线粒体功能障碍的主要来源,但这在病理组织中尚未得到证实,这表明这两种机制密切相关,不过可以通过间接方法进行评估 [17,108]。
谷氨酸是与学习、记忆和认知相关的主要兴奋性神经递质。次优浓度的Aβ寡聚体可促进特定谷氨酸受体的激活,特别是代谢型谷氨酸受体5(mGlu5)和携带GluN2B亚基的NMDA受体 [109]。这种激活可能会升高细胞内Ca2+ 水平,从而促进兴奋性毒性和神经元凋亡。谷氨酸能刺激也可能会抑制α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)受体的长时程增强(LTP) [109]。AMPA受体数量的减少会减弱快速兴奋性传递,并可能导致突触丧失 [109,110]。
美金刚调节谷氨酸的活性,改善学习和记忆机制。美金刚可能通过抑制谷氨酸的过度激活来减少神经元损伤并增强认知功能 [104,107]。除了认知能力外,它还有助于整体功能的改善,特别是对于目前正在接受胆碱酯酶抑制剂治疗的患者 [103,107]。
与单一疗法相比,胆碱酯酶抑制剂和美金刚的联合使用可以提供更大的益处。与单独使用这两种药物的患者相比,联合使用多奈哌齐和美金刚在改善认知能力和日常生活活动方面表现更优,这表明综合治疗策略可能有助于应对阿尔茨海默病的复杂症状 [103,111]。
关于烟碱型激动剂,α7-烟碱型乙酰胆碱受体(α7-nAChR)的激活可能有助于精确控制大脑中的胆碱能传递,有可能改善认知能力并缓解阿尔茨海默病的症状 [112]。
目前还在研究旨在改变疾病进程的新治疗靶点和分子。针对淀粉样蛋白β的治疗方法,包括单克隆抗体,正在被研究其减少大脑中淀粉样斑块沉积的能力,而淀粉样斑块沉积是阿尔茨海默病发病机制的一个特征。
在已被研究其神经保护作用的膳食天然抗氧化剂中,芒果(Mangifera indica)等水果中含有的多酚类物质,在中度认知障碍的动物模型中已证明具有增强认知功能和降低氧化应激的能力 [113]。芒果果实提取物中的酚类化学物质与改善记忆表现和减少氧化损伤相关,这表明饮食干预可能有助于神经保护 [114]。
此外,核桃(Juglans regia)被认为是天然抗氧化剂的来源,可能具有神经保护特性,其调节氧化应激和炎症的能力证明了这一点 [115]。
研究抗氧化剂对特定神经系统疾病的影响,也进一步证实了它们在临床环境中的有效性。维生素E作为一种公认的抗氧化剂,与老年人和阿尔茨海默病患者的认知能力改善相关 [116]。考虑到神经退行性疾病中氧化负荷的增加,其对氧化影响的预防作用尤为重要。此外,激活Nrf2通路被认为是一种增强大脑抗氧化防御能力的治疗方法,如萝卜硫素等物质在帕金森病的临床前模型中已显示出潜力 [117]。
生活方式的改变,如认知训练、体育锻炼或社交互动,可能会提高痴呆患者(尤其是阿尔茨海默病患者)的认知功能和生活质量,因为将非药物治疗技术与药物治疗相结合,可能会提供更全面的疾病管理策略。
7. 体育锻炼与大脑中的氧化应激
李(Lee)等人认为,活性氧可能对细胞功能至关重要,尽管其确切作用仍未完全明确。他们的研究表明,抗氧化系统可能有助于活性氧的可控释放,这对于正常的大脑功能是必要的。活性氧虽然通常与氧化损伤相关,但似乎在生理过程中也发挥着有益作用(图3),有助于细胞信号传导并维持氧化还原平衡 [118]。

图3. 体育活动与大脑功能中的氧化应激
为了对抗活性氧(ROS)的破坏作用,人体形成了一个复杂的抗氧化防御系统,该系统分为三道防线。第一道防线由抗氧化酶组成,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPx),它们在中和自由基方面发挥着关键作用,从而保护细胞免受氧化损伤。第二道防线依赖于饮食中的外源性抗氧化剂,它们补充了酶的作用,有助于维持氧化平衡。第三道防线涉及受损生物分子的修复机制,从而确保在氧化应激(OS)情况下细胞的完整性和身体的功能 [119]。
拉达克(Radak)等人声称,运动增加了活性氧的产生,但矛盾的是,它却能改善肌肉健康,并降低患心脏病、血管疾病、某些癌症和2型糖尿病的风险 [2,120]。定期运动对大脑功能也有有益影响,在中风、阿尔茨海默病和帕金森病的预防和治疗方面发挥着作用。这些作用包括神经发生、血管生成增加、氧化损伤减少以及蛋白水解降解增强 [121,122,123]。
川村(Kawamura)和村冈(Muraoka)强调了急性运动过程中产生的活性氧和自由基的双重作用,既有健康益处,也存在风险。虽然人们普遍认为运动可提高自由基水平,但由于这些物质的反应活性高且半衰期短,直接测量它们具有挑战性;因此,研究人员通常依赖氧化应激的间接标志物。运动诱导的氧化反应程度在个体之间可能存在显著差异,这使得对研究结果的解释变得复杂,因此有必要全面检查个体的氧化还原状态。此外,作者强调活性氧的来源不仅限于骨骼肌,还包括血液和其他器官,这表明要全面理解其潜在机制,必须采用综合的研究方法 [124]。
孟(Meng)和苏(Su)(2024年)对运动如何影响氧化应激和亚硝化应激进行了综述,重点关注抗氧化剂。通过分析2004年至2024年间发表的41项研究的数据,他们发现适度运动通过 hormesis(毒物兴奋效应)增强了身体的抗氧化防御能力,而过度运动则会增加氧化应激。尽管天然膳食抗氧化剂有益,但高剂量的补充剂可能会抵消运动带来的积极适应性变化。该综述强调,需要制定个性化的运动和营养计划,考虑年龄、性别、种族和社会经济地位等因素,以优化运动员和普通人群的健康状况 [125]。
鲍尔斯(Powers)等人(2023年)也进行了一项系统综述,研究了耐力训练对骨骼肌中氧化应激和抗氧化酶活性的影响。他们的研究结果表明,耐力训练显著提高了超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶的活性,这些酶对于防止运动诱导的氧化负面效应至关重要。临床前研究表明,阻力训练可提高啮齿动物骨骼肌中超氧化物歧化酶(包括SOD1)和谷胱甘肽过氧化物酶的含量和活性。临床证据进一步支持,阻力训练可提高人类肌肉中SOD1、SOD2、谷胱甘肽过氧化物酶和过氧化氢酶的活性,强调了其在提高肌肉抗氧化能力方面的作用。虽然耐力训练和高强度间歇训练(HIIT)也能增加这些酶的活性,但该领域的研究有限,这表明迫切需要进一步研究 [126]。
在早期的研究中,雷巴克(Rybak)、索马尼(Somani)等人对运动训练对大鼠不同脑区抗氧化系统的影响提供了有价值的见解。他们的研究结果显示,谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)的水平以及抗氧化酶(包括超氧化物歧化酶和谷胱甘肽过氧化物酶)的活性存在显著差异。值得注意的是,脑干和纹状体等区域在运动训练后,超氧化物歧化酶和谷胱甘肽过氧化物酶的活性明显增加 [127]。最近,扎伊奇克(Zaychik)等人(2021年)研究了高强度持续训练(HICT)对自身免疫性神经炎症的神经保护作用,特别是在多发性硬化症及其实验性自身免疫性脑脊髓炎模型(EAE)的背景下。健康小鼠在被注射致脑炎性T细胞以诱导EAE之前,先在跑步机上进行HICT。与久坐不动的小鼠相比,进行HICT的小鼠EAE症状较轻,临床严重程度降低,T细胞和神经毒性巨噬细胞/小胶质细胞的浸润减少,髓鞘和轴突的损失也减少。HICT在不改变驻留小胶质细胞特征的情况下减少了其数量,并导致活性氧产生减少以及促炎细胞因子(如白细胞介素-6(IL-6)和单核细胞趋化蛋白)的分泌减少。HICT通过减少小胶质细胞产生的活性氧和神经毒性反应,保护中枢神经系统免受自身免疫性神经炎症的侵害,强调了运动强度在神经保护中的作用及其对多发性硬化症的潜在治疗意义 [128]。
尽管在过去十年中,有几项研究已经开始探索阻力训练的神经保护作用,但很少有研究专门探讨它与氧化应激的关系。这表明需要进一步研究,以全面了解阻力训练如何影响氧化活动和大脑健康。
陆(Lu)等人(2021年)进行了一项系统综述,研究了高强度运动(HIE)对未经训练个体的氧化应激和抗氧化状态的影响。在分析了21项研究后,他们发现有力的证据表明,高强度运动后会立即发生急性氧化反应,但这种影响是短暂的,由于内源性抗氧化系统的激活,通常会在24小时内恢复。较高的健康水平与较低的氧化应激相关,这表明定期进行体育活动可提高抗氧化能力和整体健康水平。高强度运动的强度和持续时间是影响氧化应激水平的关键因素,而个人特征(如健康水平和年龄)也起着重要作用。高强度运动可以促进未经训练个体的健康,建议有效增强抗氧化能力的运动强度应高于最大摄氧量(VO₂max)的70% [129]。
有氧运动训练在人类和动物研究中都得到了广泛的探讨,证明了它在降低氧化应激、维持大脑氧化还原平衡和提高脑源性神经营养因子(BDNF)水平方面的有效性 [130,131,132]。有氧运动对大脑氧化还原系统的影响已有充分的文献记载,突出了它对氧化反应和神经元健康的有益作用。然而,阻力训练对大脑的影响仍不太明确,因为这方面的研究近年来才开始受到关注 [133,134,135,136]。
弗雷塔斯(Freitas)等人(2018年)研究了六周的高强度间歇训练(HIIT)对年轻雄性Wistar大鼠海马体中氧化应激、炎症标志物和神经营养因子的影响。结果表明,HIIT减少了海马体中的氧化损伤,并增加了酶促(超氧化物歧化酶)和非酶促抗氧化防御能力。此外,HIIT降低了促炎细胞因子(肿瘤坏死因子-α(TNFα)、白细胞介素-6、白细胞介素-1β和白细胞介素-10)的水平,同时提高了脑源性神经营养因子的水平。研究结果表明,HIIT通过减少氧化应激和炎症、增加抗氧化活性和神经营养支持,对海马体的氧化还原平衡产生了积极影响。这是第一项证明HIIT在降低海马体氧化应激和促进神经保护方面有益的研究 [137]。
罗查-戈麦斯(Rocha-Gomes)等人(2023年)探索了高强度间歇训练(HII)对去卵巢成年大鼠(一种模拟更年期相关变化的模型)行为和海马体神经化学的影响。将大鼠分为四组:久坐不动且未去卵巢组(SHAM-SED)、久坐不动且去卵巢组(OVX-SED)、训练且未去卵巢组(SHAM-HIIT)和训练且去卵巢组(OVX-HIIT)。结果表明,OVX-SED组的脑源性神经营养因子和抗氧化酶水平较低,这与记忆障碍相关。相比之下,HIIT组的海马体中脑源性神经营养因子水平和抗氧化活性增加,记忆表现得到改善。然而,HIIT也导致血浆皮质酮水平升高和类似焦虑的行为增加,这表明虽然HIIT可以提高去卵巢大鼠的认知功能,但它也可能引发与压力相关的反应 [138]。
虽然阻力训练调节大脑氧化应激的具体细胞机制尚未完全明确,但有理由相信,阻力训练在肌肉中引起的适应性变化,可能会通过各种蛋白质和途径导致抗氧化防御的上调和大脑氧化还原平衡的调节 [125,139]。这一过程中的关键参与者包括哺乳动物雷帕霉素靶蛋白(mTOR),这是一种丝氨酸/苏氨酸激酶,对大脑中的细胞生长、增殖和存活至关重要;以及环磷酸腺苷反应元件结合蛋白(CREB),它调节对多巴胺能神经元功能至关重要的基因的表达 [140,141]。mTOR和CREB都通过蛋白激酶B(AKT)的磷酸化促进翻译起始的增强,从而导致肌肉和大脑中脑源性神经营养因子的表达和激活增加。这些途径表明,在促进大脑健康方面,阻力训练、氧化应激调节和神经营养支持之间存在复杂的相互作用 [142,143,144]。
李(Li)等人(2022年)证明,脑源性神经营养因子通过激活两种主要受体,即原肌球蛋白受体激酶B(TrkB)和p75神经营养因子受体(p75NTR),在中枢神经系统中发挥着关键作用。它参与多种生理过程,包括神经发生、突触可塑性和神经元存活。脑源性神经营养因子水平的改变与疾病的进展有关,这突出了它在疾病机制和治疗策略中的潜在作用 [145]。
这些途径共同增强了脑源性神经营养因子的分泌,并通过激活核因子Nrf2,对阻力训练对大脑功能的有益影响做出了贡献,Nrf2调节各种解毒酶和抗氧化剂的表达。这种调节对于保护脑细胞免受氧化损伤、维持线粒体功能和确保细胞氧化还原平衡至关重要。在氧化应激或亲电修饰的刺激下,Nrf2会转移到细胞核中,并与DNA中的抗氧化反应元件(ARE)结合,促进细胞保护基因(如血红素氧合酶-1(HO-1)、超氧化物歧化酶和谷胱甘肽S-转移酶(GST))的转录。这一机制突出了细胞保护途径之间的相互作用,强调了体育活动在增强大脑健康和抵御氧化应激能力方面的潜力 [146,147]。
肌肉收缩过程中脑源性神经营养因子的释放,在神经元信号传导和神经保护中起着关键作用。当脑源性神经营养因子到达大脑时,它会与TrkB结合,启动一系列信号通路,包括磷脂酰肌醇3-激酶(PI3K)/AKT/mTOR、PI3K/AKT/CREB、PI3K/细胞外信号调节激酶(ERK)/CREB以及磷脂酶Cγ(PLCγ)/钙/钙调蛋白依赖性蛋白激酶II(CamKII)/CREB [148,149,150,151]。
最近的研究表明,PI3K/AKT信号通路在神经退行性疾病和情绪障碍中都起着至关重要的作用,影响着细胞存活、神经炎症和突触可塑性等过程。在抑郁症中,该通路的激活可能有助于恢复神经递质平衡并促进神经发生,这表明它有可能成为抗抑郁的靶点。对于帕金森病和阿尔茨海默病等神经退行性疾病,该通路通过减少氧化应激、细胞凋亡和炎症来提供神经保护,从而维持神经元的健康。激活PI3K/AKT的天然化合物在治疗这些疾病方面显示出了潜力,特别是在保护帕金森病中产生多巴胺的神经元以及对抗阿尔茨海默病的病理症状方面 [152,153,154]。
体育锻炼刺激胰岛素样生长因子1(IGF1)等生长因子的分泌,这些生长因子会激活PI3K/AKT通路,促进细胞生长、存活和代谢。在骨骼肌中,PI3K/AKT的激活通过胰岛素调节的葡萄糖转运蛋白(GLUT4)的转位来增强葡萄糖摄取;提高胰岛素敏感性对于控制胰岛素抵抗和2型糖尿病等病症至关重要。运动过程中PI3K/AKT的激活有助于肌肉生长、提高胰岛素敏感性、促进心血管健康并减轻代谢紊乱 [155,156,157,158]。
苏扎(Souza)等人(2022年)强调了Nrf2和ARE信号通路在调节细胞抗氧化防御中的关键作用,这对于维持线粒体功能和体内平衡至关重要。体育锻炼会增强这一通路,特别是在大脑和骨骼肌中,尽管其潜在机制尚未完全明确。越来越多的证据表明,四氢生物蝶呤(BH4)通路和表观遗传变化(如DNA甲基化)有助于运动诱导的抗氧化反应。运动激活Nrf2与细胞的保护反应相关,包括抗氧化剂的产生、抗炎作用和线粒体功能的增强,这使得它成为治疗神经退行性疾病的一个有前景的途径。研究表明,定期进行体育锻炼可以改善帕金森病和阿尔茨海默病等疾病的症状,支持了它作为一种非药物神经保护工具的作用 [159]。
西鲁帕蒂(Thirupathi)等人(2024年)指出,帕金森病涉及氧化应激,这导致了大脑中多巴胺能神经元的丧失,而铁死亡(一种铁依赖性细胞死亡过程)由于大脑氧化还原状态的失衡也在其中起了一定作用。运动通过激活Nrf2和脑源性神经营养因子信号通路来帮助减少氧化损伤,这些通路调节抗氧化防御。运动的这种抗氧化作用可能会减轻铁死亡,从而有可能减缓疾病的进展 [160]。 8. Oxidative Stress and Vagal Stimulation
如今,在探讨氧化应激(OS)与迷走神经刺激的关系时,主要关注其治疗潜力。研究表明,迷走神经刺激在多种器官系统中对氧化反应具有保护作用。例如,在大鼠心肌缺血模型的研究中,迷走神经刺激显著减少了活性氧(ROS)的产生,这表明烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶(Nox)通路参与了这一保护作用 [161]。在该研究中,作者认为迷走神经刺激激活了腺苷酸活化蛋白激酶(AMPK)和蛋白激酶C(PKC)通路,这两条通路对细胞能量稳态和氧化还原平衡至关重要。这一发现与迷走神经活动可以调节氧化应激反应的观点一致,这为治疗以氧化损伤为特征的疾病提供了一种潜在的治疗途径。
迷走神经刺激在炎症背景下也被证明会影响氧化应激。通过迷走神经通路进行的胆碱能刺激改善了实验性心肌梗死模型中的氧化反应和炎症情况 [162]。该研究强调,迷走神经刺激导致超氧化物歧化酶和谷胱甘肽过氧化物酶等抗氧化酶的活性增加,这些酶在减少氧化损伤方面发挥着关键作用。这表明迷走神经刺激可能会增强处于氧化应激状态下组织的抗氧化防御机制。
众所周知,自主神经系统,特别是由迷走神经介导的副交感神经分支,在调节身体对压力的生理反应中起着至关重要的作用。迷走神经刺激可以调节自主神经反应,从而影响体内的氧化应激水平 [163]。
经皮迷走神经刺激(tVNS)等干预措施已被证明对情绪调节和压力反应有显著影响,而这些与氧化应激通路密切相关。此外,无创性迷走神经刺激可降低创伤后应激障碍(PTSD)患者的交感神经反应性,这表明迷走神经刺激可能通过这一潜在机制减轻压力诱导的氧化损伤 [164]。通过增强迷走神经张力,这些干预措施可能有助于恢复自主神经系统的平衡,从而减轻身体的整体氧化负担,因此具有临床意义,例如在创伤性失血性休克模型中调节肠道损伤或肺通透性,这些情况通常与氧化应激升高有关 [165]。观察到的保护作用与炎症细胞因子反应的减少有关,这进一步支持了迷走神经刺激在减少氧化活动方面的作用。甚至膈下迷走神经刺激似乎也能减轻高血压的发展,而高血压常常因氧化应激而加重,这对出血性中风的风险也有影响 [166]。对孤束核转录网络的调节表明,迷走神经刺激可能会影响调节心血管反应和氧化应激水平的中枢神经系统通路。
目前,人们正在考虑通过调节慢性氧化应激来治疗心力衰竭、糖尿病和其他神经退行性疾病。无创性迷走神经刺激技术(如经皮迷走神经刺激)的发展为临床应用提供了一个令人兴奋的机会,因为无创方法可以作用于迷走神经投射,可能为调节不同患者群体的氧化反应性提供一种可行的方法 [167]。
胆碱能抗炎通路也被认为是迷走神经刺激影响氧化应激和炎症的一种机制,它在免疫系统和中枢神经系统之间建立了功能联系,能够调节常常因氧化损伤而加剧的炎症反应 [168]。这表明,通过减少全身炎症,迷走神经刺激可能间接减轻神经系统疾病中的氧化影响。
包括南非醉茄(Withania somnifera)在内的各种药用植物的抗氧化特性,可能在治疗氧化应激诱导的神经行为障碍方面与迷走神经刺激起到互补作用 [169]。草药干预与迷走神经刺激相结合,可以增强抗氧化防御能力,改善神经系统的预后。此外,在创伤性脑损伤的动物模型中,迷走神经刺激可以增强神经可塑性和认知功能 [170]。因此,迷走神经刺激可能促进神经系统的恢复和适应。
在过去二十年里,氧化应激与迷走神经刺激在耐药性癫痫病例中的关系得到了广泛研究。活性氧的产生会导致癫痫发作活动加剧,并促进癫痫相关并发症的发展。通过促进兴奋性毒性,活性氧的产生成为癫痫发作的一个关键机制 [171]。高水平的氧化应激标志物(如丙二醛(MDA))和抗氧化酶活性降低,表明存在一种失衡状态,这也可能会促进癫痫发作活动 [171,172]。
通过评估特定类型癫痫(如Dravet综合征和其他癫痫性脑病)中癫痫发作的严重程度和认知障碍程度,氧化应激在这些疾病中的作用已得到证实,这表明针对氧化应激可能是一种可行的治疗策略 [173]。此外,癫痫中氧化影响与炎症之间的关系也很重要,因为炎症过程会进一步加剧氧化损伤,形成一个恶性循环,使癫痫的治疗变得更加复杂 [174]。
迷走神经刺激(VNS)已成为耐药性癫痫患者一种有前景的辅助治疗方法。1997年,迷走神经刺激被美国食品药品监督管理局(FDA)批准,研究表明,它能在很大一部分患者中降低癫痫发作频率,约55%的患者癫痫发作频率降低超过50% [175,176]。
迷走神经刺激发挥作用的机制是多方面的。人们认为,迷走神经刺激可以调节神经递质的释放,增强神经可塑性,并降低癫痫易发脑区的兴奋性。迷走神经刺激还可能使大脑中的异常电活动失去同步,从而降低癫痫发作的频率和严重程度 [177]。这种对大脑活动的调节也可能影响氧化应激水平,因为迷走神经刺激与改善抗氧化防御和减少炎症有关 [178]。
氧化应激与迷走神经刺激在癫痫中的相互作用是一个新兴的研究领域,主要关注其潜在的神经保护作用。迷走神经刺激可以降低耐药性癫痫患者的氧化应激标志物水平 [179]。
迷走神经刺激影响自主神经系统的潜力,也可能在管理氧化反应性方面发挥作用。通过增强迷走神经张力,迷走神经刺激可能有助于恢复自主神经系统的平衡,而癫痫患者的自主神经系统常常失调。这种平衡的恢复可能会改善氧化应激反应和整体大脑健康 [180,181]。
岸(Kishi)和广冈(Hirooka)提出了一个有趣的观点,即交感神经系统(SNS)的激活是高血压发生的一个关键事件,同时大脑中由血管紧张素II 1型(AT(1))受体和烟酰胺腺嘌呤二核苷酸磷酸(NAD (P) H)氧化酶产生的氧化应激也与之相关。作者研究了氧化应激在高血压大鼠延髓头端腹外侧区(RVLM)中的作用,发现AT(1)受体和NAD (P) H氧化酶诱导的氧化应激会导致交感神经兴奋。高盐摄入和高热量饮食等环境因素可能会增加氧化应激,从而增加患高血压的风险 [182]。
陈(Chan YHJ)和陈(Chan HHS)的另一篇综述也涉及延髓头端腹外侧区,该区域受到氧化应激和亚硝化应激的影响,会导致神经源性高血压,这拓展了我们对脑干死亡的理解。作者认为,这些应激源不能相互替代,未来的抗氧化治疗应该考虑交感缩血管紧张的产生、维持、调节或调控。针对延髓头端腹外侧区亚硝化应激的研究转变,可能会为减缓向脑干死亡发展的进程提供新的治疗干预措施 [183]。
9. 关于氧化应激和饮食因素的最终思考
全球范围内神经系统疾病的增加与饮食变化有关,尤其是在工业化国家,这导致帕金森病、阿尔茨海默病、多发性硬化症和其他神经退行性疾病的发病率上升。如前所述,饮食选择可能会影响神经递质的功能,从而控制大脑的能量代谢并减少氧化应激。
饮食对记忆和认知功能有很大影响,某些食物和补充剂,如ω-3多不饱和脂肪酸、核桃、浆果和类黄酮,可以显著改善心理表现和记忆力。多酚通过抗炎途径参与大脑代谢 [184]。将饮食中的能量转化为神经活动的过程对大脑的最佳功能至关重要。神经元中的能量调节会影响突触活动,进而改变代谢能量。这表明认知过程在细胞层面上与生理功能之间存在双向联系 [185,186]。营养物质使大脑能够发挥各种关键功能,如维持神经元的健康和活力、产生神经冲动、合成神经递质、维持脂质膜的不对称性和完整性、支持突触可塑性,以及调节与能量产生相关的代谢过程。这些机制对大脑健康至关重要,并且与认知功能密切相关 [186]。
某些食物与认知功能下降相关,包括饱和脂肪(与后期患痴呆症有关)和高脂肪乳制品(与认知能力下降和认知能力衰退风险增加有关) [187]。另一方面,来自瘦肉和鱼类的蛋白质和氨基酸是重要神经递质(包括血清素、多巴胺和去甲肾上腺素)的前体,这些神经递质对情绪、动机和注意力的调节至关重要。此外,海鲜中富含的乙酰胆碱和谷氨酸对学习和记忆功能至关重要 [186]。
全谷物和豆类提供复杂碳水化合物、纤维和维生素E,总体而言,食用它们与患痴呆症的风险降低有关;然而,精制谷物的摄入与认知能力下降和认知能力衰退增加相关 [186]。
B族维生素对认知功能也至关重要,因为它们有助于抑制过度兴奋,降低焦虑和抑郁的发生率。烟酸(维生素B3)存在于含有色氨酸的食物中,如肉类、全谷物、乳制品、花生、三文鱼和蘑菇。经常喝咖啡也能增加烟酸的摄入量。保持最佳的烟酸水平很重要,因为缺乏烟酸可能会导致糙皮病,其特征为痴呆、皮炎、腹泻,有时甚至会导致死亡。在他汀类药物广泛应用之前,烟酸甚至被用于治疗血脂异常,剂量高达每天3000毫克 [188,189]。在饮食中摄入色氨酸时,应考虑一些特定的措施,因为色氨酸在小肠中被吸收,同时摄入其他重要的中性氨基酸可能会限制色氨酸的吸收和利用。饮食中的碳水化合物可以通过刺激胰岛素分泌来降低色氨酸水平,胰岛素的分泌会促进非色氨酸氨基酸的优先摄取。色氨酸大多与白蛋白结合,通过L型氨基酸转运体穿越血脑屏障(BBB)并进入中枢神经系统(CNS),该转运体有助于运输大型中性氨基酸 [190]。
维生素B6(吡哆醛、吡哆胺和吡哆醇)对认知功能和情绪状态的调节至关重要。缺乏维生素B6与血液中同型半胱氨酸水平升高相关,而同型半胱氨酸是脑血管疾病的一个风险因素。维生素B6缺乏还与神经精神疾病有关,包括癫痫发作、偏头痛、慢性疼痛或抑郁。维生素B6缺乏在老年人群中很普遍,与之相关的高同型半胱氨酸血症可能与痴呆的病因有关,因此需要补充维生素B6 [191]。
虽然维生素B6缺乏症很少见,但亚临床缺乏仍然很常见,这可能会导致认知功能下降,因为维生素B6可以作为抗氧化剂,直接中和自由基,并间接增强谷胱甘肽抗氧化防御系统。维生素B6缺乏可能会损害中枢神经系统内的神经递质代谢,特别是γ-氨基丁酸和血清素的代谢 [191]。
氧化应激导致神经酰胺和胆固醇酯的积累,这与运动神经元变性有关,这表明脂质代谢与影响中枢神经系统的遗传因素一起,参与了疾病的发生机制 [192]。因此,线粒体功能障碍和活性氧的形成(对肌萎缩侧索硬化症(ALS)中的运动神经元有毒性)与关键基因(包括超氧化物歧化酶1(SOD1))的突变密切相关 [193]。SOD1基因突变与约20%的家族性肌萎缩侧索硬化症有关 [194]。除了SOD1基因,FUS和TDP-43基因的突变会损害RNA代谢和蛋白质稳态,从而加剧运动神经元中的氧化损伤 [195,196,197]。这些遗传变化与氧化应激之间的相互作用形成了一个恶性循环,氧化损伤导致神经元受损,而由于细胞修复机制受损,又会进一步加剧氧化反应 [198,199]。旨在减少肌萎缩侧索硬化症中氧化应激的饮食策略包括摄入富含多酚的食物、遵循抗炎饮食方案(如地中海饮食),以及可能补充烟酰胺腺嘌呤二核苷酸(NAD+) [200,201]。这些方法旨在提高抗氧化防御能力,减少氧化损伤,这对肌萎缩侧索硬化症的治疗至关重要。
除了在帕金森病、阿尔茨海默病、多发性硬化症和脑血管疾病等主题中讨论的与大脑相关的饮食方面,氧化应激与饮食成分之间的相互作用仍然很复杂,数据表明饮食中的抗氧化剂在增强大脑健康方面起着保护作用。从预防医学的角度来看,富含水果、蔬菜和其他抗氧化剂来源的饮食可能会减轻氧化应激和炎症,有可能降低患神经退行性疾病的风险。饮食模式影响氧化反应的机制也开始为制定专门的神经保护饮食干预措施提供依据。
10. 结论
我们认为,抗氧化剂的使用时机和剂量是影响治疗效果的关键因素,这凸显了开展精心设计的临床试验以确定有效治疗方案的必要性。
氧化应激、线粒体功能障碍和神经炎症之间的相互作用,凸显了帕金森病和其他中枢神经系统疾病发病机制的复杂性,以及其在神经退行性变之外的潜在影响。神经保护不仅可以通过创新的药物研发来实现,还可以通过使用具有抗氧化特性的天然化合物来实现,这些天然化合物在减少氧化攻击和改善预防医学概念下的治疗效果方面已显示出潜力。针对氧化应激的治疗策略,结合饮食和生活方式上的身体活动改变,将继续被探索其在神经退行性疾病模式中的神经保护作用。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1475860.html?mobile=1
收藏

