氢气(H₂)作为宇宙中最简单且最普遍存在的分子,在过去二十年中因其具有成为有效抗氧化剂和抗炎剂的潜力,引发了科学界的浓厚兴趣。传统上,氢气被认为是惰性的,如今其独特的生物活性特性正被重新评估。氢气能够有选择性地中和活性氧和活性氮物质,减轻氧化应激,同时又不干扰细胞的基本功能。因此,本综述旨在对氢气的生物活性进行理论评估,重点关注其药代动力学,包括在生物系统中的吸收、分布和留存情况。氢气的药代动力学特征对于理解其潜在治疗应用至关重要。氢气与蛋白质口袋的相互作用尤其值得关注,因为这些位点可能成为氢气的储存库或活性位点,进而影响其生物活性和留存时间。此外,本文还将探讨氢气对细胞信号通路(包括调节葡萄糖代谢和氧化应激反应的通路)的影响,以深入了解其作为代谢和氧化还原稳态调节剂的潜力。最后,氢气在生物环境中与铁磁性分子的相互作用,以及对细胞信号传导机制的影响,为其生物学作用增添了另一层复杂性。通过综合当前研究成果,本综述旨在阐明氢气发挥治疗作用的潜在机制,同时确定进一步研究的关键领域。理解这些方面对于全面描述氢气的药效学特征以及评估其在治疗氧化应激相关疾病中的临床潜力至关重要。
Russell, Grace1,2,*. Theoretical evaluation of the biological activity of hydrogen. Medical Gas Research 15(2):p 266-275, June 2025.
引言
对氢气(H₂)作为治疗性分子的探索可追溯到几十年前,但直到最近其重要性才得到认可。最初,氢气被认为在生物学上是惰性的,在生理或治疗方面没有实质性作用。1975年,多尔等人发表了一项具有里程碑意义的研究,表明高压氢气疗法对治疗小鼠鳞状细胞癌具有有益效果,这一观点开始发生改变。尽管这些发现很有前景,但该研究并未立即引起广泛关注,在随后的几十年里,氢气的治疗潜力在很大程度上被忽视。然而,2007年,大泽等人发表了一项关键研究,表明吸入氢气能够在啮齿动物脑缺血 - 再灌注损伤模型中有选择性地减少细胞毒性氧自由基,这重新点燃了人们对氢气作为治疗剂的兴趣。这项研究标志着一个重要的转折点,证明氢气可以作为一种选择性抗氧化剂,能够中和高活性的羟基自由基(•OH),而不影响参与正常细胞信号传导的其他重要活性物质(如过氧化氢(H₂O₂))。 自2007年以来,氢气的治疗应用迅速扩展,研究探索了其以多种形式发挥的作用,包括富氢水(HRW)、吸入以及静脉注射饱和氢气的生理盐水(HRS)。氢气具有多功能性,且能够扩散到组织和细胞中而不会积累到有毒水平,这使其成为一系列疾病治疗干预的有前景的候选物质。如今,氢气因其潜在的治疗特性,尤其是作为抗氧化剂,而受到认可。
随着研究热度不断增加,国际研究机构和商业企业都投入时间和资源来了解氢气如何影响细胞以及更广泛的躯体生理机能。通过整合当前研究并探索氢气在生物系统内的分子相互作用,此类分析旨在全面理解如何利用氢气改善健康状况。 氢气由两个氢原子结合而成,H - H键能为107千卡/摩尔(4.64电子伏特),相对于标准氢电极,其氧化还原电位(2H + 2e⁻ → H₂)为 - 0.421电子伏特(pH值为7)。尽管氢气在生物系统中的主要作用方式尚未明确,但一种普遍的假设是,氢气能够通过与自由基和离子物种(如羟基自由基(•OH)和过氧亚硝酸盐(ONOO⁻))直接相互作用,减少过量的活性氧和活性氮物质(分别为ROS/RNS)。然而,尽管氢气疗法的临床优势现已得到充分记录,但围绕氢气的分布以及与氢气生物活性相关的精确分子机制仍存在许多问题。这些问题包括:氢气如何到达靶组织?氢气相互作用的主要生理靶点是什么?氢气如何长期维持其影响? 本综述旨在探讨氢气分布、留存和活性的潜在机制,并批判性地审视氢气作为治疗性分子逐渐显现的作用。这种探索不仅突出了氢气作为医用气体的潜力,还确定了进一步研究的领域,以全面阐明其在人体生理学中的作用。通过综合当前关于氢气分子机制的研究并确定未来研究的关键领域,本综述旨在解决关键问题。通过探索这些领域,本综述旨在增进我们对氢气改善健康状况潜力的理解。
方法
检索策略包括对以下科学数据库进行全面搜索:Scopus、谷歌学术和PubMed。使用了以下关键词的各种组合:“hydrogen”(氢气)、“molecular hydrogen”(分子氢)、“H₂”、“HRW (hydrogen - rich water)”(富氢水)、“distribution”(分布)、“calcium”(钙)、“glucose/glycogen”(葡萄糖/糖原)、“phosphorylation”(磷酸化)、“modality”(方式)、“mechanisms”(机制)和“signaling”(信号传导)。根据与氢气分布、分子机制、临床结果以及氢气在疾病治疗中的应用的相关性来选择研究。纳入标准要求研究为可免费获取的全文、经过同行评审、以英文发表,并且通常在过去二十年中发表,以确保考虑到最新的研究结果。
氢气的分布与留存
药代动力学
药代动力学研究的是药物在给药后机体的反应,对于确定治疗的剂量、频率和持续时间至关重要,确保药物以合适的浓度在合适的时间内到达体内的靶点,从而发挥疗效并将副作用降至最低。 对猪模型中氢气分布的药代动力学分析表明,由于氢气在静脉血中的半衰期延长,这种双原子气体很可能在血浆中运输,并简单地扩散到组织结构中。氢气的物理和化学特性(如低分子量、非极性性质和电化学中性)使其能够通过生物流体、细胞外基质、细胞膜和细胞溶质区室扩散。然而,这种扩散机制是否能够解释在远端器官中观察到的效应尚未确定。例如,当通过腹腔注射给予HRS时,在胰腺和脾脏等近端部位记录到大量的氢气,而远端器官则呈现出从中心向外逐步减少的情况。 对于氢气分布的一种解释是,在摄入、吸入或注射后,氢分子扩散到血液中进入循环系统,从而得以扩散到所有身体系统。2014年刘等人进行的早期研究支持了这一理论。在啮齿动物模型中,研究了含有1.25 ppm、2.5 ppm和5 ppm/H₂(分别为0.62、1.25和2.5 mM)的富氢水,通过以下两种方式给药:一是腹腔和静脉注射HRS,二是吸入不同浓度(1%、2%和4%)的氢气。在给予富氢水、静脉注射HRS和吸入氢气后,血液、大脑、肠道、肾脏、肝脏、胰腺、骨骼肌和脾脏中的氢气浓度均有所增加(表1)。
Table 1: Summary of phase studies on LBN
尽管这项研究表明,腹腔注射饱和氢气生理盐水(HRS)可使所分析的大多数组织中的氢气(H₂)含量升高,但这种方法并不能有效地将大量氢气输送到血液或更广泛的心血管系统中,不过在将氢气输送到包括肠道、肝脏、胰腺和脾脏在内的近端器官方面却非常有效(表1)。有趣的是,当通过吸入方式输送氢气时,虽然主要受益器官通常在附近(如大脑、呼吸系统和心脏),但在吸入氢气30分钟后,脾脏和骨骼肌中的氢气浓度也显著增加。这些结果表明,氢气倾向于通过简单扩散进行分布;然而,这仍然无法解释为何在未检测到血液中氢气水平升高的情况下,大脑等远端器官中的氢气水平却有所升高(表2)。
Table 2: The timing (min) of peak concentrations and retention of H2
一项关于100%氢气吹入(向体腔内吹入物质的操作)效果的研究表明,氢气很可能留存于血浆中 。然而,要达到这种情况,为了呈现出如此广泛的效果和分布模式,氢气的饱和水平必须大幅提高。由于生理压力仅比大气压(760毫米汞柱,101.32千帕)高约120毫米汞柱(16千帕),因压力增加而提高氢气的饱和水平不太可能。此外,仅通过血浆的简单扩散无法解释为何骨骼肌中氢气会逐渐增加并留存,也无法解释为何氢气不仅在靠近输送部位的器官中发挥作用。其中一个原因可能是,在实验方案中,仅记录了溶解在血浆中的氢气。血浆对氢气的饱和点约为1.6毫克/升 ;因此,吸入提供的氢气量很可能超过了血液能够溶解的量。于是就产生了以下问题:在治疗后长达1小时的时间里,足够的氢气是如何通过血液运输,从而在静脉血和远端器官中仍能检测到的呢?如果氢气暂时存在于红细胞血红蛋白内形成的微孔或口袋中 ,或者如下面所讨论的,氢气能够被悬浮在血清中的分子(如碳水化合物、无机离子、糖原和钙)暂时保留,那么这个问题就可以得到解释。
葡萄糖与糖原
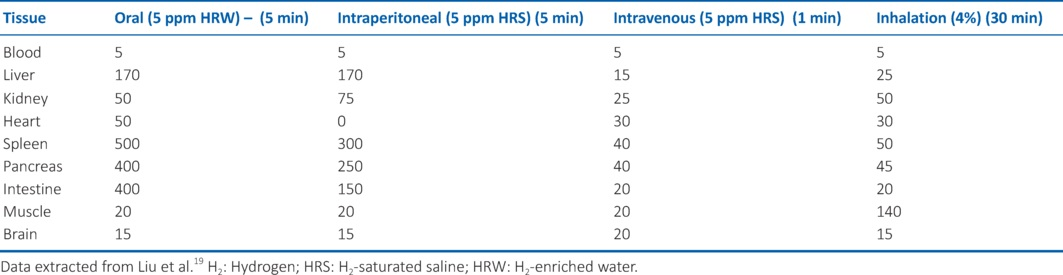
葡萄糖是一种六碳单糖,化学式为C₆H₁₂O₆,在动物、细菌、真菌、植物和原生动物中普遍被用作能量来源,在这些生物体内,葡萄糖是有氧代谢和无氧代谢的关键底物 。另一方面,糖原是一种大型支链多糖储存复合物,由众多葡萄糖部分通过两种糖苷键连接而成:一是α - 1,4 - 糖苷键,二是α - 1,6 - 糖苷键。在植物中,有一种类似的结构,称为淀粉,具有储存碳水化合物的功能。与糖原的支链结构不同,淀粉由两种聚合物组成:一是直链淀粉,形成线性和盘绕的链;二是支链淀粉,形成分支链 。尽管糖原和淀粉的结构形式不同,但它们在化学上是相同的,在各自的生物体中都起着能量储存的作用 。也许由于这种化学相似性,糖原和淀粉很可能具有相似的储氢能力。
糖原复合物已被证实是有效的储氢分子,在啮齿动物的肝脏和骨骼肌中均有体现 。在耐力运动的实验室模型中,饮用富氢水被证明可减少肝脏中糖原的利用 ,这表明氢气可能抑制糖原催化作用,或者促进葡萄糖转运进入细胞,从而减少对葡萄糖释放的需求。
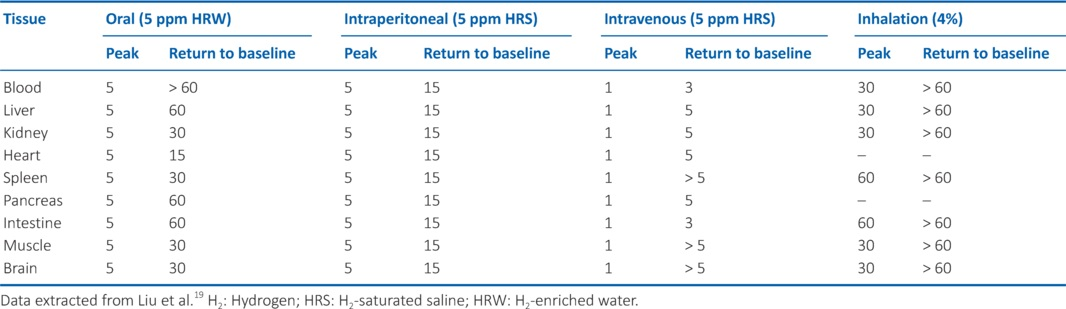
在血浆或血清等水溶液中,葡萄糖分子由于其高含量的氢键而变得黏稠(即有黏性) ;因此,氢气可能会暂时与糖原或糖蛋白的碳水化合物部分结合(图1),也可能与红细胞表面的碳水化合物结合(图2)。可以假设,氢气能够与糖原的葡萄糖成分(或蛋白质的葡萄糖部分)形成弱的非共价连接,将氢分子包裹在结构内,这可以解释为何在远端部位以及肝脏和骨骼肌系统中氢气含量升高 。此外,如果黏稠化是氢气能够(或许是暂时地)附着于碳水化合物分子的一种机制,那么可以合理假设,在植物中,淀粉也会出现相同的效果(图1)。如果葡萄糖部分能够保留氢气,那么也可以合理推测,氢气能够与游离葡萄糖或糖蛋白(如红细胞表面的血型糖蛋白A - D)结合,这或许会阻止糖基化或其他翻译后修饰。考虑到解离作用,这样的弱化学相互作用可能会被血流速度消除(图2),从而在远端器官附近释放氢气。然而,如果要验证上述理论,这种推测还需要进行实证评估。
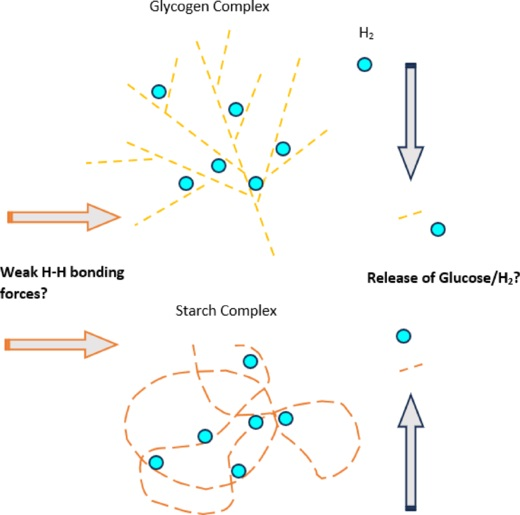
图1糖原和淀粉复合物中氢气保留与释放背后的理论机制。展示了葡萄糖储存分子如何捕获和释放氢气的示意图。上图:糖原(动物、细菌、真菌)。下图:淀粉(植物)。使用Microsoft Word(版本2409)制作。H₂:氢气。
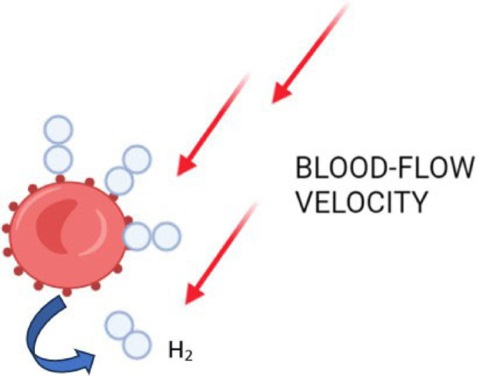
图2通过瞬时葡萄糖结合实现氢气分布的理论机制。展示了红细胞上糖脂/蛋白质的糖基部分如何捕获和释放氢气的示意图。使用BioRender.com制作。H₂:氢气。
蛋白质口袋和腔穴
蛋白质是具有复杂三维结构的动态大分子,其结构中包含口袋和腔穴,这些结构通常参与结合小分子、配体和离子。这些口袋对于各种生物过程至关重要,包括酶催化、配体储存、信号转导和分子识别。[30,31]这些腔穴的结构特性,如大小、形状和静电环境,决定了它们对不同分子的结合亲和力和特异性。[32]
像氙(Xe)这样的稀有气体与蛋白质口袋有独特的相互作用,这主要是由于它们的惰性以及能在疏水和亲水环境中溶解的能力。特别是氙,因其麻醉和神经保护特性而被广泛研究。[33]此外,已证明氙能结合在蛋白质的疏水腔穴内,改变其构象状态并影响其生物学活性。[34 - 36]例如,研究表明,氙通过与特定的蛋白质位点结合发挥作用,如N - 甲基 - D - 天冬氨酸受体,稳定受体的关闭状态并防止兴奋性毒性。[37]这种结合通常较弱且可逆,这对于需要精确调节蛋白质功能而不造成长期干扰的治疗应用是有利的。[38]鉴于氢气的小尺寸和非极性性质,氢气与这些蛋白质口袋和腔穴相互作用的可能性是一个有趣的假设。这种相互作用可以促进氢气在全身的靶向分布,提高其治疗效果。此外,与蛋白质结合的氢气分子可能通过稳定蛋白质构象或影响细胞信号通路中涉及的蛋白质 - 蛋白质相互作用来参与调节蛋白质功能。例如,氢气可能通过与含有合适口袋或腔穴的钙离子(Ca2⁺)结合蛋白相互作用,影响钙离子(Ca2⁺)/钙调蛋白信号传导,这是各种细胞活动中的关键过程。通过稳定这些蛋白质或改变其构象,氢气可以间接调节钙通量和相关的信号级联反应,从而影响肌肉收缩、神经传递和细胞增殖等过程。[39]同样,氢气可能与参与磷酸化信号通路的激酶相互作用,如丝裂原活化蛋白激酶(MAPK)和磷酸肌醇3 - 激酶/蛋白激酶B(PI3K/Akt)通路,[40 - 42]这些通路对于细胞存活、增殖和凋亡至关重要。通过影响特定的蛋白质位点,特别是富含组氨酸、丝氨酸、苏氨酸或酪氨酸的位点,[43]氢气可以调节激酶活性,导致对细胞信号传导和应激反应至关重要的磷酸化事件发生改变。
有观点认为氢气可能至少暂时存在于蛋白质口袋中,对此提供支持的是,出于工业储存目的,对储氢材料的研究往往集中在氢气分子的结构吸附上,这很有启发性。在燃料电池中,碳纳米管[44,45]、富勒烯纳米笼[46,47]和钯纳米晶格颗粒[48,49]因其卓越的可逆储氢性能而被广泛使用。含金属离子的有机晶体结构被认为具有较高的储氢能力。金属有机框架是利用生物相容性金属离子(如Ca2⁺、Cu2⁺、Mn2⁺、Zn2⁺)通过有机配体连接而成,形成能够大量储氢的微孔结构。[50,51]
从生物学角度来看,这种微孔复合材料的使用很有趣,因为其结构通常提供与折叠蛋白质结构相似的微口袋。因此,根据氢气活性和分布的氙口袋理论,[22,23]氢气有可能存在于这样的腔穴中,也许是通过金属 - 金属相互作用。如果这样的过程确实在生理上存在,那么可以推断类似的过程可能发生在其他蛋白质单元中。此外,如果这种现象发生在除血红蛋白以外的蛋白质中(例如参与生物分子合成、DNA修复和复制以及/或代谢和能量产生的蛋白质)(表3),[52 - 59]这可以解释氢气的多效性作用,并解释氢气在组织内的移动。氢气活性的蛋白质口袋机制可能具有一定的合理性。
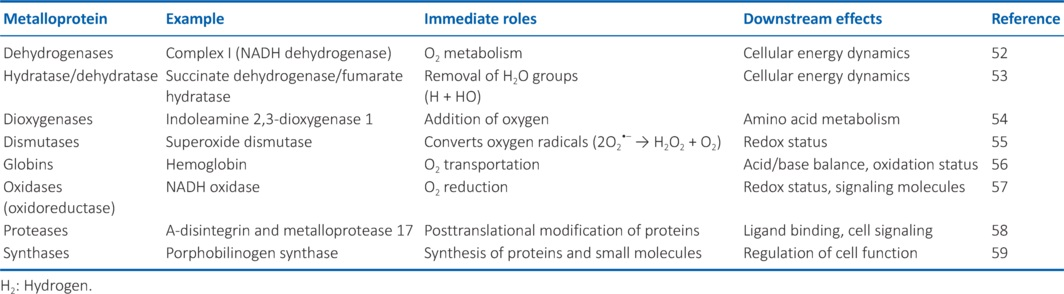
表3:可能受H₂影响的金属蛋白的下游效应,明确可能受H₂影响的金属蛋白的直接作用和下游效应
H₂作用的相关理论
细胞内信号传导
H₂是一种非极性双原子分子,这一特性虽降低了其在生物流体中的溶解度 ,但增强了其穿越生物膜并影响细胞内信号转导、基因表达,或许还有蛋白质活性及/或构象等过程的能力 。在考虑细胞信号传导事件时,带正电的Ca2⁺和带负电的磷酸根离子(PO₃2⁻)无疑是调节细胞活动的两种最主要信使 。Ca2⁺调节广泛的细胞活动,包括细胞收缩与运动、能量代谢以及神经元活动;而PO₃2⁻则负责蛋白质的可逆翻译后修饰(由激酶催化添加PO₃2⁻,磷酸酶催化去除PO₃2⁻),这一过程会使蛋白质的极性从疏水(非极性)转变为亲水(极性),从而实现蛋白质 - 蛋白质相互作用 。
Ca2⁺信号传导对细胞的最佳功能至关重要,且能在细胞质、细胞器及细胞外环境中产生广泛影响。Ca2⁺信号传导是许多细胞类型(包括内皮细胞和上皮细胞)典型应激反应的基础,这些细胞直接或间接地依赖Ca2⁺通过膜结合离子通道内流 。细胞对Ca2⁺信号传导的反应在很大程度上取决于Ca2⁺的浓度、空间取向和物理化学特性。Ca2⁺分子移动性很强,在盐溶液中的移动速度可达40纳米/毫秒 。因此,Ca2⁺信号传导受到严格调控,以确保信号在高度受限的空间内传递,细胞通过一系列蛋白质逆向转运体、离子通道和泵来螯合、分隔或排出Ca2⁺,从而控制局部浓度 ,而这些过程中的任何一个或全部都可能受到H₂的影响。
有趣的是,在工业生产中,为增强和巩固H₂的吸附,制备储氢纳米颗粒时可在预制结构上包覆一层Ca2⁺ ,这表明H₂可能直接与这类离子相互作用。从头算计算表明,H₂可通过弱电子给予力与氧化钙中的Ca2⁺成分结合,电子从H₂占据的σ轨道转移到Ca2⁺未占据的3δ轨道 。若这种结合在生理条件下发生,那么可以合理假设Ca2⁺与H₂之间存在强亲和力,H₂可能会影响Ca2⁺ - 钙调蛋白的结合能力,这一事件将对基因转录、免疫反应和肌肉收缩产生重大的下游效应。钙调蛋白是一种高度保守的Ca2⁺传感器,在细胞信号传导中起着基础性作用 。双叶结构的钙调蛋白分子最多可结合四个Ca2⁺分子,每个结合区域对蛋白质构象产生独立影响,进而影响后续的Ca2⁺结合和靶标识别 。
尽管关于H₂与Ca2⁺及Ca2⁺衍生的信号级联反应相互作用的证据稀少,但Iuchi等人在2016年证明,在纯化学体系中,H₂可防止不饱和脂肪酸的自氧化,这一作用会降低Ca2⁺信号转导及下游Ca2⁺调控的基因表达 。该团队推测,对Ca2⁺信号传导的影响可能是激动剂诱导物或拮抗剂抑制剂减少的结果,不过他们并未推测H₂是否能直接与钙离子相互作用。H₂与Ca2⁺的直接相互作用也可能影响活性氧(ROS)的产生和活性,因为Ca2⁺过载会对 Krebs循环酶的功能产生负面影响,引发产生活性氧的酶(如α - 酮戊二酸脱氢酶)的激活,并通过间接激活一氧化氮合酶,有效抑制细胞色素c氧化酶(复合物IV)的功能,增加电子泄漏,最终导致线粒体功能障碍 。因此,如果H₂直接与Ca2⁺相互作用,很可能会同时影响活性氧的产生和细胞信号传导。
另外,H₂可能通过上游效应间接影响钙信号传导。例如,H₂可能影响离子通道功能。倘若如此,H₂的作用特性会与针对金属蛋白和酶所讨论的作用机制类似吗?例如,利用蛋白质口袋的氙(Xe)可抑制钙信号传导 ;那么,H₂会利用类似或不同的机制来调节Ca2⁺信号传导吗?
为解决这一难题,Itoh等人提出,H₂处理可抑制巨噬细胞中脂多糖诱导的凋亡信号调节激酶1及其下游效应蛋白(如c - Jun氨基末端激酶、p38)的磷酸化,且不影响烟酰胺腺嘌呤二核苷酸氧化酶 - 1产生活性氧 。因此,H₂相互作用的潜在靶点可能存在于受体蛋白或其紧邻的下游位置。这些发现很有意思,因为它们表明:其一,Ca2⁺无论是直接还是间接,都可能是H₂的作用靶点,细胞内Ca2⁺水平直接受跨膜离子通道和逆向转运体的构型,以及Ca2⁺的大小、形状和亲电状态影响;其二,H₂的主要作用机制可能与H₂的直接还原能力无关,而是通过调节Ca2⁺内流或活性来实现。因此,“H₂是否通过调节Ca2⁺内流来抑制活性氧/活性氮(ROS/RNS)的产生?”这一问题值得思考。
蛋白质磷酸化
蛋白质磷酸化是真核细胞内传递信息的另一重要机制。磷酸化过程涉及通过添加或去除一个PO₃2⁻磷酸基团,对氨基酸(丝氨酸、苏氨酸、酪氨酸或组氨酸)进行可逆的翻译后修饰 。向蛋白质残基添加PO₃2⁻分子会改变修饰后蛋白质的构象结构,进而影响其功能。
已知激酶会形成级联反应,即前一个蛋白质的磷酸化会导致下游蛋白质的顺序磷酸化。丝裂原活化蛋白激酶(MAPK)/细胞外信号调节激酶级联反应就是一个很好的例子,它在细胞对一系列刺激(包括细胞因子、生长因子、有丝分裂原物质如病原体相关化合物(如脂多糖)和氧化应激)的细胞外和细胞内反应之间起介导作用。MAPK/ERK是与信号转导相关的一类蛋白质超家族的术语,在整个真核生物物种中高度保守。MAPK通路利用众多具有独特特征的蛋白质(如细胞外信号调节激酶1/2、c - Jun氨基末端激酶、p38)将信号通过细胞传递至可诱导元件(如核因子红细胞2相关因子2(Nrf2))或转录元件(如抗氧化反应元件),从而进一步影响细胞活动。例如,细胞外刺激或鸟苷三磷酸结合蛋白对丝氨酸/苏氨酸MAPK3的激活,会诱导MAPK2的磷酸化及随后的激活。然后,MAPK2参与MAPK激活环内保守的Thr - X - Tyr基序的双重磷酸化。MAPK会在脯氨酸上游的氨基酸残基上磷酸化靶底物(如Thr - X - Tyr - X - Pro)。这种机制赋予了信号转导特异性,鉴于已知有超过13000种人类蛋白质会通过磷酸化/去磷酸化事件发生改变,这一特异性至关重要。已知促氧化的细胞环境会启动MAPK通路信号传导,通过激活细胞分化、运动、增殖和存活通路,促使细胞做出保护和维持自身的反应。因此,如果H₂直接影响蛋白质的磷酸化/去磷酸化,可能会产生显著的下游效应。
p38是一种在进化上高度保守的MAPK蛋白,尤其与炎症反应加剧相关。例如,p38活性增加与更高的恶性肿瘤风险相关,而MAPK/p38抑制剂可减轻炎症,炎症是肿瘤疾病的一个标志。在体外实验中,利用体细胞培养和配子研究均表明,H₂能够抑制MAPK/ERK/c - Jun氨基末端激酶/p38信号传导。然而,目前尚不清楚观察到的H₂应用效果,是由于磷酸酶活性增加、因NFκB/TNF - α活性降低导致的激酶活性降低,还是其他尚未明确的机制所致。
如果H₂能够通过积聚在蛋白质口袋中,或直接作用于磷酸基团或磷酸化靶点(如丝氨酸、苏氨酸等),也许是通过量子力(如伦敦色散力)来抑制磷酸化级联反应,那么这可能为当代文献中提到的H₂的多效性效应提供一个统一的理论解释。
血红素
血红素是一种含铁血卟啉辅基,存在于细胞色素和红细胞中。血红蛋白在生物气体(如氧气(O₂)、一氧化氮(NO)、一氧化碳(CO)和二氧化碳(CO₂))的运输和交换中起主要作用,它通过与血红素辅基的直接相互作用以及对硫醇和胺基团的共价修饰来实现这些功能。血红蛋白由四个独立的亚基组成,每个亚基都能够结合一个氧分子。在血红蛋白和肌红蛋白中,铁离子(Fe2⁺)由卟啉环内的五个氮原子配位,第六个配位位置用于结合氧气(图3)。
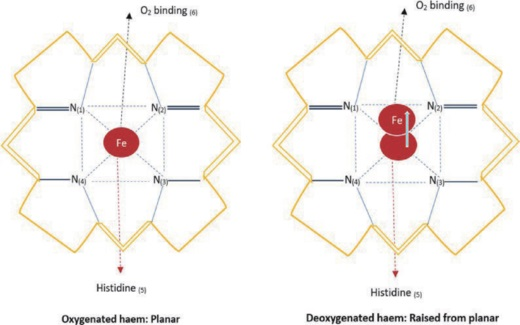
图3:含血红素的卟啉环**
左图:氧合血红素(松弛态)。右图:去氧血红素(紧张态),此时铁与卟啉环的距离增加0.06纳米。括号表示结合位置。His代表蛋白质(如血红蛋白)中与Fe2⁺/3⁺结合的组氨酸残基。使用Microsoft Word(版本2409)绘制。
血红素具有多种存在状态,每种形式的含量都会影响生理过程。例如,亚铁(Fe2⁺)存在于去氧(脱氧 - )血红素和氧合(氧 - )血红素中,而三价铁(Fe3⁺)存在于(高铁 - )血红素中,这是一种不结合氧的构型。此外,血红蛋白的构象与铁的离子状态也有显著差异。例如,去氧血红蛋白被称为“紧张态”,因为球蛋白从卟啉环向远端移动了0.06纳米。此外,氧合血红蛋白被定义为“松弛态”,此时球蛋白分子更靠近卟啉环(图3)。氧化为Fe3⁺(高铁血红素)会导致血红素口袋几何形状的改变,使其更倾向于松弛位置,从而氧气无法再结合。
血红素的铁磁性也可能影响气体的结合特性。对亚铁自旋状态的计算机模拟分析表明,Fe - N键距离从低自旋状态下的2.01埃增加到高自旋状态下的2.1埃。因此,由于高自旋状态下的Fe2⁺可能从卟啉环延伸得更远,高自旋状态的Fe2⁺可能比低自旋状态的Fe2⁺更有效地将O₂(和H₂)吸引到血红素辅基上。结构表征进一步确定了高自旋和低自旋的铁 - 卟啉衍生物,研究表明三价铁(Fe3⁺)也可以存在于这两种自旋状态。此外,发现高自旋Fe3⁺的键长增加了0.4 - 0.5埃,从卟啉的氮基团开始的键长为2.04埃,而低自旋Fe3⁺的键长为1.99埃。因此,就产生了H₂的相互作用是否更倾向于高自旋状态的Fe2⁺/3⁺的问题。
H₂是通过延长Fe2⁺/3⁺键的长度、通过与Fe2⁺/3⁺辅基部分直接相互作用来稳定蛋白质结构以优化O₂吸附,还是与人类血红蛋白的组氨酸93(以及其他蛋白质中的相应基团)相互作用来发挥其作用,目前尚未阐明。正如Ostojic等人和Gaboreau等人所报道的,H₂也可能阻碍O₂从Fe2⁺上解离,从而提高O₂饱和度。在研究H₂对血红素利用可能产生的影响时,发现每日给予富氢水(8 mM/天)可提高中年女性和新冠康复患者的O₂饱和度。考虑到血红素辅基的松弛态和紧张态,为了合理思考这种效应可能的发生方式,H₂可能通过三种方式影响血红素的氧合作用。首先,H₂可能通过双边Kubas作用(涉及两个氢原子同时向铁中心提供电子)保护Fe2⁺不被氧化;其次,通过不对称键合,Fe2⁺/H•排列可能直接还原•OH自由基和/或其他活性物质(如Fe/H• + •OH → H₂O)(图4)。第三,如果Fe2⁺的高自旋状态能够增加Fe2⁺ - N键的长度,那么H₂可能通过延长2.0埃的Fe2⁺ - N键,改善氧气与低自旋亚铁血红素辅基的结合。
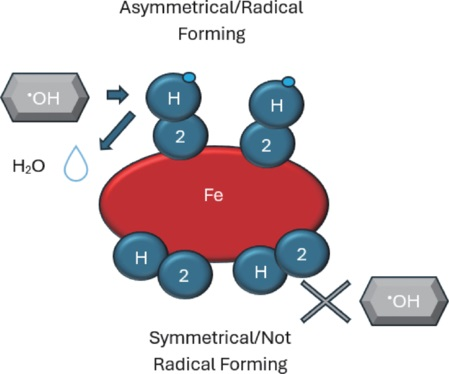
图4:H₂与铁的结合及•OH的还原
示意图展示了羟基自由基(•OH)直接还原及防止铁氧化的可能机制。使用Microsoft Word(版本2409)绘制。H₂:氢气。
磁电化学
对生物磁学(即对生物体产生的磁场的研究)的探索已颇为成熟,其中磁力会影响电子自旋动力学。92, 93 本节讨论的是,与诸如血红蛋白(Fe2⁺/3⁺)、超氧化物歧化酶(Mg2⁺、Cu2⁺)或钙(Ca2⁺)中的铁磁辅基相关的量子力,是否会影响自旋状态,进而调节H₂的生物活性。
电磁学
近期研究表明,H₂的热极化倾向于三线态电子状态,在室温下,大多数H₂分子以正氢(即三线态)状态存在(约75%正氢/25%仲氢自旋)94 (图5)。鉴于正氢自旋的H₂表现出弱抗磁特性,会产生排斥力,95 正氢自旋的H₂不太可能直接还原活性氧(ROS),因为这种排斥力很可能会阻碍此类相互作用。然而,H₂的正氢自旋态仍可能影响诸如基因表达、蛋白质构象或信号转导等细胞过程。尽管这只是推测,但详细探究影响H₂在生物系统内相互作用的量子力,可能会带来有价值的见解。

图5:电子自旋如何影响H₂的生物活性?
左图:单线态电子自旋,电子反向自旋,产生磁力(被铁吸引),这可能提供直接的抗氧化活性。
右图:三线态电子自旋,电子同向自旋,产生抗磁力(不被铁吸引),这可能具有间接的抗氧化活性(通过稳定蛋白质结构实现)。使用Microsoft Word(版本2409)制作。H₂:氢气。
尽管在生理条件下,抗磁性的H₂占主导,但H₂的仲氢或单线态(约占生理状态下H₂的25%)也可能具有重要意义。仲氢自旋态会产生弱顺磁性,这有可能使其与金属蛋白和辅基发生磁 - 电化学相互作用。例如,在线粒体复合物I中观察到的电子传递抑制,会导致自由基形成并随后产生活性氧(ROS)。黄素 - 超氧自由基对(FH• + O₂•⁻)的反应体现了电子自旋在ROS形成中的作用,其中单线态会导致F + H₂O₂的形成,而三线态则会产生两个自由基,即FH•和O₂•⁻ 。因此,正如Hancock等人所提出的,如果处于仲氢自旋态的H₂与蛋白质中的过渡金属相互作用,那么可以想象,这些金属基团可以通过降低游离H₂的解离能(从约4.64电子伏特降至约2.35电子伏特)并形成受体/H•复合物,来促进自由基的还原。这种相互作用可能使H•自由基中和诸如•OH等氧化剂,不过这将取决于H₂和相应自由基在空间和时间上的可用性。Najera和Fout通过核磁共振、红外光谱以及单晶X射线衍射证实,低自旋的Fe2⁺能够与仲氢发生反应,这支持了仲氢自旋态的H₂可能与铁相互作用的假设。
对于H₂的磁电化学效应,还需进一步考虑抗氧化酶(如过氧化氢酶和超氧化物歧化酶)的金属催化中心,据报道,这些酶在暴露于H₂后活性会增强。可以推测,仲氢自旋态的H₂也可能通过提供额外的H•并保持催化金属元素的还原能力来改善此类酶的功能,尽管这尚未得到实证验证。
对H₂在血红蛋白中作用的计算机模拟分析预测,H₂通过与原卟啉的相互作用产生抗氧化活性是可行的。作者报告称,H₂分子可以通过二氢键不对称地与血红蛋白内的铁(Fe2⁺)结合,并通过双边电子转移(称为Kubas键)对称地结合(图4)。在生理条件下,由于不对称结合的活化能略低(分别为2.04和2.14电子伏特),因此这种结合方式更为有利。作为回应,Fe2⁺应降低H₂双原子内H - H键的解离能,形成Fe2⁺/H•复合物,其中H•能够还原高反应性离子和自由基。经计算,Fe2⁺/H•复合物的解离能相对较低,为2.78电子伏特,这将使结合的H•自由基能够中和另一个相邻的反应性亚硝化或氧化物质。因此,作者指出,这种假设的活性可能解释了生物系统中•OH的直接还原。因此,由于所涉及的弱磁力作用,仲氢自旋态的H₂分子可能具有抗氧化作用,而正氢自旋态的H₂分子可能影响细胞活动,如细胞信号传导、基因调控和代谢活动。
未来研究方向
在全球卫生机构将H₂视为一种可处方的疗法之前,需要考虑许多方面。H₂生物化学中尚未明确的因素,如扩散速率和反应性、与含金属基团(如血红素)的相互作用以及磁自旋状态等,都可能产生影响。还需要确定H₂相互作用的主要靶点,以便确定其分子机制。此类研究将为临床数据提供支持,并可能表明H₂疗法是否可能存在任何长期或有害影响。
为了推进对H₂生物化学的理解,应在不同的真核细胞中采用多种分析方法。例如,电子顺磁共振光谱结合蛋白质特异性自旋标记,可检测与特定ROS或RNS反应的捕获剂上的自由基或离子加合物。当与化学发光分析结合使用时,这种方法适用于体外和离体研究,可对H₂对•OH的清除活性进行比较评估。Halliwell等人还开发了一种经济高效的脱氧核糖测定法,用于确定抗氧化剂与•OH的反应速率常数。通过在该测定中添加还原•OH的抗氧化剂,它们会与脱氧核糖(•OH氧化的主要靶点)竞争,并抑制生色团的形成。然后,分光光度分析可以推断出抗氧化剂与羟基自由基的反应速率常数。
考虑到H₂可能存在于蛋白质口袋中或影响血红素动力学的假设,使用X射线晶体学、计算机模拟(如X - PLOR)和核磁共振光谱等进一步研究,有助于确定蛋白质表面口袋或蛋白质内通道中H₂可能相互作用的区域。通过生物信息学方法比较氙结合口袋与潜在的H₂结合位点,特别是在含血红素的蛋白质中,这可以揭示这些结构是否保守,以及H₂在维持细胞和生物体氧化还原状态中是否具有重要作用。还可以使用包括红外光谱、蛋白质膜电化学和全细胞生化测定等技术。此外,基因编辑/突变、转录组分析和质谱等先进方法可以识别H₂作用的分子区域,为了解H₂的功能效应提供有价值的见解。
为了探索H₂对钙(Ca2⁺)信号传导的潜在影响,可以采用诸如基于绿色荧光蛋白的基因编码钙指示剂传感器等Ca2⁺特异性荧光探针技术。为了研究H₂对磷酸化事件的影响,酶联免疫吸附测定可以通过检测磷酸化位点的抗体结合,对磷酸化蛋白质进行半定量分析。或者,可以使用结合磷酸基团的Phos - Tag™/十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳测定法。此外,放射性标记、质谱和蛋白质印迹分析以及各种激酶活性测定,有助于确定H₂是否与蛋白质磷酸化上游的信号通路相互作用。应用这些分析将有助于更深入地了解H₂是否直接影响这些信号级联反应。
结论
总之,H₂一旦通过血液循环分布,可能会被葡萄糖部分或分子口袋选择性保留,这可以解释为什么在骨骼肌和远端组织中发现高浓度的H₂,以及为什么H₂会在肝脏等器官中保留。H₂通过血液循环分布后,可能会被葡萄糖或蛋白质口袋或腔选择性保留。也有可能H₂通过电子自旋状态的影响,靶向诸如Ca2⁺、Fe2⁺等铁磁性离子,从而影响细胞信号级联反应和ROS水平。
考虑到H₂的直接抗氧化潜力,铁磁性可能吸引单线态的H₂,血红素可能通过调节ROS的产生和还原,在其抗氧化能力中发挥关键作用,而三线态的H₂可能是细胞信号传导和蛋白质稳定所不可或缺的。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1469763.html?mobile=1
收藏

