氙气是仙气?不只是痴呆
已知小胶质细胞的异常调节与阿尔茨海默病(AD)的发生发展有关。布兰多等人现在报告称,吸入氙气(Xe)可在AD小鼠模型中促进小胶质细胞产生保护性反应。吸入氙气可诱导小胶质细胞的吞噬作用,减少淀粉样变性、神经突营养不良和炎症,同时促使小胶质细胞呈现保护性表型。在患有tau蛋白病的小鼠中,它还增强了干扰素 - γ(IFN - γ)信号传导,抑制了炎症,并减轻了脑萎缩。在AD的5xFAD小鼠模型中,氙气调节了CD8 + T细胞,促进了IFN - γ的产生,而阻断IFN - γ则会削弱这种效果。这些发现表明,吸入氙气可能是一种调节小胶质细胞活性、减轻AD神经退行性变的治疗策略。——奥拉·史密斯
摘要
阿尔茨海默病(AD)是最常见的神经退行性疾病。抗淀粉样蛋白抗体治疗仅能适度延缓由AD引起的轻度痴呆的疾病进展。越来越多的证据表明,大脑免疫系统的稳态失调,尤其是由小胶质细胞介导的失调,在疾病的发生和发展中起着重要作用。因此,一个主要问题是如何调节小胶质细胞的表型和功能来治疗AD。氙气(Xe)是一种惰性气体,在人类患者中用作麻醉剂和治疗脑损伤的神经保护剂。氙气能够穿透血脑屏障,这使其有可能成为一种有效的治疗手段。为了评估氙气对小胶质细胞和AD病理的影响,我们设计了一个定制的氙气吸入舱,并使用氙气处理了几种AD小鼠模型。氙气处理诱导小鼠小胶质细胞进入一种我们称为“神经退行前期小胶质细胞(pre - MGnD)”的中间激活状态。这种小胶质细胞表型转变在急性神经退行性变和淀粉样变性小鼠模型(APP / PS1和5xFAD小鼠)以及tau蛋白病小鼠模型(P301S小鼠)中均有观察到。在APP / PS1和5xFAD小鼠模型中,这种小胶质细胞状态增强了淀粉样斑块的紧实度,并减少了营养不良性神经突。此外,吸入氙气减轻了P301S小鼠的脑萎缩和神经炎症,并改善了其筑巢行为。从机制上讲,吸入氙气通过IFN - γ信号传导,促使稳态的脑小胶质细胞向pre - MGnD状态转变,在APP / PS1和5xFAD小鼠中维持小胶质细胞的吞噬反应,同时在P301S小鼠中抑制小胶质细胞的促炎表型。这些结果支持将吸入氙气作为一种治疗AD的方法进行转化研究。
引言
阿尔茨海默病(AD)以及原发性tau蛋白病,如进行性核上性麻痹和由tau蛋白病引起的额颞叶痴呆,会导致进行性神经退行性变,最终导致死亡。目前,抗淀粉样蛋白抗体治疗仅能适度延缓由AD引起的轻度痴呆的疾病进展。因此,需要其他疗法来更有效地减缓或阻止疾病进展。鉴于仅AD在全球就影响着5000万人,预计到2050年这一数字将增至1.5亿,迫切需要能够减轻或缓解该疾病中神经退行性变和神经炎症的神经保护治疗方法。AD的潜在机制尚未完全明确。然而,由淀粉样β(Aβ)斑块和tau蛋白缠结的异常蛋白积累诱导的小胶质细胞介导的炎症和氧化应激增加,与AD的进展有关。我们发现,神经退行性小胶质细胞(MGnD),也称为疾病相关小胶质细胞(DAM),在不同的神经退行性模型,包括AD小鼠模型中,受到转化生长因子 - β(TGFβ)的相互抑制和载脂蛋白E(APOE)信号的诱导调节。全基因组关联研究(GWAS)确定小胶质细胞是中枢神经系统(CNS)中主要的细胞类型,其基因表达模式与晚发性AD相关。然而,目前尚无针对小胶质细胞调节的治疗方法。
多种医用气体已安全用于麻醉和高压氧治疗。氙气(Xe)是一种惰性气体,也是最不活泼的化学元素之一,其具有完整的价电子层,使其稳定且不易发生反应。自20世纪中叶以来,氙气一直被用作全身麻醉剂,但其分子靶点仍不明确。其对谷氨酸能神经递质系统,尤其是N - 甲基 - D - 天冬氨酸(NMDA)受体的影响研究最为深入。然而,氙气潜在神经保护特性的表现机制仍不清楚。通过NMDA受体的兴奋性谷氨酸能神经传递对于突触可塑性和神经元存活至关重要。然而,过度的NMDA受体活性可能导致兴奋性毒性并促进细胞死亡。一些研究表明,NMDA受体通道的功能与AD中观察到的神经毒性和变性相关。氙气是一种NMDA受体拮抗剂,能够通过血脑屏障(BBB)进入脑实质,使其成为一种有效的中枢神经系统治疗药物。许多体内和体外研究已经考察了氙气在创伤性脑损伤(TBI)、缺氧、缺血性脑损伤和神经元损伤模型中的疗效。然而,吸入氙气对AD中的淀粉样变性、tau蛋白病理、神经退行性变和神经炎症的影响尚未得到研究。吸入氙气作为多种神经系统疾病和神经退行性疾病的潜在治疗方法正在临床试验中进行探索,但仍需进一步了解吸入氙气的效果和分子机制。
我们目前的研究使用了多种模拟不同淀粉样变性和tau蛋白病特征的小鼠模型,探究了吸入氙气对AD和tau蛋白病的治疗潜力。APP / PS1和5xFAD小鼠被用作具有Aβ斑块积累的淀粉样变性模型,而表达APOE4的P301S小鼠(TE4)则用于探索在人类APOE4背景下tau蛋白诱导的神经退行性变。为了研究人类小胶质细胞的反应,我们使用了植入诱导多能干细胞(iPSC)衍生的人类小胶质细胞的人源化5x - MITRG小鼠。将凋亡神经元注射到成年小鼠大脑中的急性神经退行性变模型用于研究氙气对早期小胶质细胞激活的影响。此外,为了评估MGnD在控制Aβ积累和营养不良性神经突中的作用,我们构建了一种能够靶向Clec7a + MGnD的Clec7a - CreERT2小鼠模型。为了研究干扰素 - γ(IFN - γ)信号如何响应氙气调节稳态小胶质细胞向MGnD的转变,我们使用了Cx3cr1 - CreERT2:Ifngr1Flox(Ifngr1 - cKO)小鼠。总之,这些小鼠模型为全面了解氙气对AD样病理、小胶质细胞调节和神经免疫相互作用的影响提供了帮助。
结果
1. 吸入氙气可诱导神经退行性病变小鼠的小胶质细胞吞噬反应并抑制神经炎症特征**
为了确定吸入氙气是否能调节神经退行性小胶质细胞(MGnD),我们使用了一种急性神经退行性病变小鼠模型来诱导产生MGnD。简要来说,将凋亡神经元注射到未经处理的C57BL6J小鼠的大脑皮层和海马体中,这会促使小胶质细胞向注射部位募集,并使其形态和表型从M0(稳态)转变为MGnD特征。利用这个模型,我们测试了四种不同浓度的氙气,起始浓度分别为6%、12%、30%和35%(图S1A)。为了给小鼠吸入氙气,我们构建了一个特殊的气舱,用于控制氙气和氧气(O₂)的供应。这个闭路系统通过苏打石灰泵送循环气体以吸收二氧化碳(CO₂),并持续监测CO₂和O₂的浓度。气体混合物在外部容器中预先混合并保持过压状态。当O₂浓度降至18%以下时,会从混合容器中补充额外的气体混合物。该系统经过优化,一个气舱最多可同时处理12只小鼠。我们使用细胞分选仪分离小胶质细胞,随后使用我们特定的小胶质细胞抗体——抗FCRLS(Fc受体样S)抗体(图S1B)。比较不同浓度的氙气时,流式细胞术结果表明,30%和35%浓度的氙气能促进更多的神经元吞噬作用(图S1C)。对具有吞噬作用的小胶质细胞进行转录组分析显示,30%浓度的氙气增加了与干扰素特征相关基因(Ifitm1、Ifit2和Stat4)以及与溶酶体和吞噬功能相关基因(P2ry10、Cd36和Mrc1)的表达,同时降低了与核因子κB(NF - κB)反应相关基因(如Il1a、Il6ra和Jun)的表达(图S1D)。Ingenuity通路分析(IPA)表明,过氧化物酶体增殖物激活受体(PPAR)和类视黄醇X受体(RXR)的活性、髓鞘形成信号传导以及抗炎性白细胞介素 - 10(IL - 10)信号传导均上调。此外,吸入30%浓度的氙气后,与神经炎症增加相关的衰老通路(包括Toll样受体(TLR)、IL - 8和CXCR4信号传导)均下调(图S1E和F)。
氙气是一种惰性气体,对其进行测量非常困难,通常需要专门的技术。为了解决这个问题,我们开发了一种能够准确检测氙气浓度的传感器。我们对该传感器进行校准,以检测氙气和O₂二元混合物中氙气的百分比。我们的测试表明,该传感器在0%至100%的氙气浓度范围内都可靠且准确(图S1G至I)。为了确定氙气对小胶质细胞的影响能持续多长时间,我们使用了APP / PS1小鼠,这是一种会积累Aβ和出现MGnD的动物模型,与急性神经退行性病变小鼠模型相比,它可以进行更长时间的观察。我们用单剂量30%的氙气处理3个月大的APP / PS1小鼠40分钟。在处理后的第3天、第7天或第14天对小鼠实施安乐死,然后通过流式细胞术和RNA测序(RNA - seq)对分离出的小胶质细胞进行评估(图S2A)。我们发现,处理后第7天是小胶质细胞反应的高峰期,此时差异表达基因(DEGs)的数量最多(图S2B)。IPA分析表明,在这个时间点,CREB、IL - 15和一氧化氮是氙气诱导的主要信号通路(图S2C至G)。这种动态评估显示,处理后第3天小鼠体内的激活开始,处理后第14天氧化磷酸化代谢恢复(图S2D)。此外,对稳态和MGnD特征的评估表明,吸入氙气诱导了MGnD基因亚群(如Gpnmb、Gas7、Clec7a、Axl和Itgax)的表达,但同时维持了一些稳态基因的表达,如Tgfbr2和Nr3c1表达的增加就表明了这一点(图S2E)。上游调控因子IPA预测肿瘤坏死因子(TNF)和补体系统(C3、IKZ1和APP)受到抑制,而TGFβ上调(图S2F)。因此,氙气处理抑制了炎症基因,同时维持了与吞噬功能相关基因的上调(图S2G)。为了验证氙气增强小胶质细胞吞噬反应的能力,我们用30%的氙气处理野生型C57BL / 6J小鼠40分钟。吸入氙气7天后,我们将荧光标记的Aβ(1 - 42)注射到大脑皮层和海马体中,4小时后,使用流式细胞术评估小胶质细胞的吞噬活性(图S2H和I)。我们的结果表明,氙气处理显著增加了吞噬Aβ的小胶质细胞的百分比(P = 0.0009)(图S2H)以及小胶质细胞能够吞噬的Aβ的量(P < 0.0001)(图S2I)。
2. 吸入氙气可抑制APP / PS1小鼠中与AD病理和神经突营养不良减轻相关的小胶质细胞炎症表型**
为了评估吸入氙气在恢复AD中稳态小胶质细胞功能方面是否具有保护性免疫调节作用,我们制定了一项治疗APP / PS1小鼠的方案。我们从2个月龄(淀粉样蛋白沉积开始时)开始用氙气进行治疗,每周进行一次40分钟的治疗,共持续8周。值得注意的是,这些APP / PS1小鼠在6周龄时开始出现淀粉样斑块,8个月左右达到饱和。在每个组中,我们将动物分为氙气(30%)治疗组和吸入空气对照组。我们通过荧光激活细胞分选(FACS)分离出FCRLS⁺小胶质细胞,并进行RNA - seq分析。吸入氙气抑制了经典的MGnD基因Clec7a、Clu、Lgals3和Apoe的表达。此外,稳态基因上调,包括编码糖皮质激素受体的Nr3c1和对维持小胶质细胞稳态特征至关重要的Spi1(PU.1)(图1A)。随着MGnD特征基因表达的降低,IPA分析显示与神经元保护相关的信号通路富集,而与炎症和氧化应激相关的信号通路减少(图1B和C)。IPA和组织病理学分析表明,吸入氙气使小胶质细胞中的突触发生基因富集,这减少了Lamp1⁺营养不良性神经突(P = 0.0026)(图1C至E)。我们还证实了MGnD的表面标志物Clec7a⁺的表达降低(P = 0.0319)以及Aβ斑块积累减少(P = 0.0452)(图1F和G)。此外,呈现Lamp1⁺营养不良性神经突的Aβ斑块的数量和大小均减少,尤其是较大尺寸的斑块(P = 0.0245)(图1H和I)。
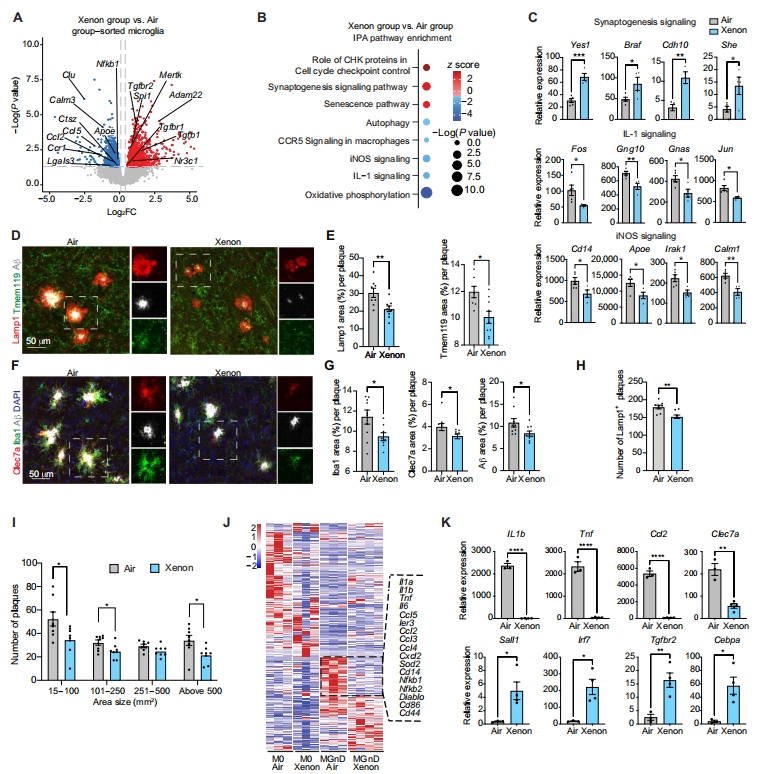
图1. 吸入氙气抑制APP / PS1小鼠中具有炎症表型的小胶质细胞,并减轻AD病理和神经元营养不良
(A)从氙气处理或空气处理的APP / PS1小鼠中分离出的小胶质细胞之间差异表达基因(DEGs)的火山图(每组n = 5只雌性小鼠)。(B)氙气组与空气组小胶质细胞的IPA分析中受影响最大的信号通路。(C)氙气组与空气组小胶质细胞中关键受影响基因表达的标准化数据;受影响的基因包括与突触发生、IL - 1信号传导和iNOS信号传导通路相关的基因(每组n = 5只雌性小鼠)。(D)APP / PS1小鼠经氙气或空气处理后,脑切片中Lamp1、Tmem119和HJ3.4B(Aβ斑块)染色的代表性共聚焦图像。(E)每个淀粉样斑块中Lamp1阳性区域百分比的定量分析(每组n = 8或9只雌性小鼠,来自三个独立实验)。(F)APP / PS1小鼠经氙气或空气处理后,脑切片中Clec7a、Iba1、4',6 - 二脒基 - 2 - 苯基吲哚(DAPI)和HJ3.4B(Aβ斑块)染色的代表性共聚焦图像。(G)每个淀粉样斑块中Clec7a阳性区域百分比、Iba1阳性区域百分比和HJ3.4B(Aβ斑块)阳性区域百分比的定量分析(每组n = 8或9只雌性小鼠,来自三个独立实验)。(H)APP / PS1小鼠暴露于氙气或空气中,大脑皮层中表达Lamp1的Aβ斑块数量的定量分析(每组n = 8或9只雌性小鼠,来自三个独立实验)。(I)APP / PS1小鼠暴露于氙气或空气中,按大小分类的大脑皮层Aβ斑块数量的定量分析(每组n = 8或9只雌性小鼠,来自三个独立实验)。(J)吸入氙气影响的主要差异表达基因热图;虚线表示MGnD氙气组与MGnD空气组之间的差异(每组n = 3或4孔,P值 < 0.05)。(K)MGnD中与稳态和神经退行性特征相关的关键受影响基因表达的标准化数据(每组n = 3或4孔)。数据以平均值±标准误表示。采用双尾无配对学生t检验;*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001。
虽然我们已经表明在急性和慢性神经退行性病变小鼠模型中,吸入氙气可抑制MGnD并恢复M0小胶质细胞,但我们尚未探讨氙气治疗是否直接调节小胶质细胞。我们之前发现,粒细胞 - 巨噬细胞集落刺激因子(GM - CSF)在体外可诱导成年小胶质细胞产生几种MGnD分子,包括Il1b和Clec7a。为了评估氙气对小胶质细胞的直接影响,我们用以下条件培养成年小鼠小胶质细胞5天:(i)含人TGFβ(50 ng/ml)的M - CSF(10 ng/ml)以诱导稳态特征,或(ii)GM - CSF(10 ng/ml)用于MGnD分化。在第6天,暴露于氙气24小时后去除所有细胞因子。RNA - seq分析证实,氙气能够直接抑制GM - CSF诱导的MGnD样小胶质细胞的神经炎症反应,包括抑制Il1b、Tnf、Nfkb1和Ier3的表达(图1J)。此外,氙气处理抑制了与MGnD相关的基因(如Clec7a、Ccl2和Tnf),并诱导了M0小胶质细胞调节因子(如Sall1和Tgfbr2)的表达(图1K)。
3. 吸入氙气在小鼠AD早期诱导产生保护性MGnD
动态实验表明,在氙气处理后第7天,与MGnD相关的基因(包括Clec7a)的表达增加(图S2E)。组织学分析在蛋白质水平上证实了这种增加(P = 0.0014)(图2A至C)。为了评估这种小胶质细胞转变是否有利于控制Aβ积累和营养不良性神经突,我们构建了一种能够靶向Clec7a⁺ MGnD的Clec7a - CreERT2小鼠模型。由于Clec7a在MGnD中特异性表达,而不在大脑中的任何其他神经细胞中表达,因此Cre重组酶仅在Clec7a⁺ MGnD中具有活性,这使我们能够在AD小鼠中特异性追踪和清除MGnD。为了验证我们的小鼠模型对靶向MGnD的特异性,我们将Clec7a - CreERT2:ROSA26TdTomato小鼠与APP / PS1小鼠进行杂交。在3个月龄时,给动物按每千克体重75毫克的剂量注射他莫昔芬。一个月后,对动物实施安乐死并评估其大脑。我们发现,TdTomato的表达特异性定位于与Aβ斑块相关且共表达Clec7a的小胶质细胞(图S3A和B)。为了确认这些TdTomato⁺细胞的MGnD特征,我们通过流式细胞术对它们的细胞因子进行定量分析。我们发现,TdTomato⁺小胶质细胞的主要组织相容性复合体II类(MHC - II)(P = 0.0271)、GM - CSF(P < 0.0001)和TNFα(P < 0.0001)表达增加,而潜伏期相关肽(LAP)(TGFβ信号传导)表达降低(P < 0.0001)(图S3C)。RNA - seq分析证实了MGnD基因(如Apoe、Spp1、Gas7和Axl)的表达增加,以及稳态基因(如Tmem119、P2ry12、Cx3cr1和Csf1r)的相互抑制(图S3D)。基因本体论(GO)分析支持这一特征,预测胶质细胞分化、抗原呈递和免疫反应增加(图S3E)。与男性相比,女性除了年龄增长和APOE4基因型外,患晚发性AD的风险更高。与此一致的是,与雄性APP / PS1小鼠相比,雌性APP / PS1小鼠的可溶性和不溶性Aβ增加。我们观察到,4个月龄的雄性小鼠中Clec7a - TdTomato小胶质细胞的表达低于雌性小鼠(P < 0.0001)(图S3F和G)。组织学分析表明,在这个时间点,这种差异与雄性小鼠中Aβ斑块和Lamp1⁺营养不良性神经突的负荷降低有关(图S3H)。线性回归分析证实,TdTomato⁺小胶质细胞与Aβ积累(P < 0.0001)(图S3I)和营养不良性神经突(图S3J)(P < 0.0001)呈正相关。
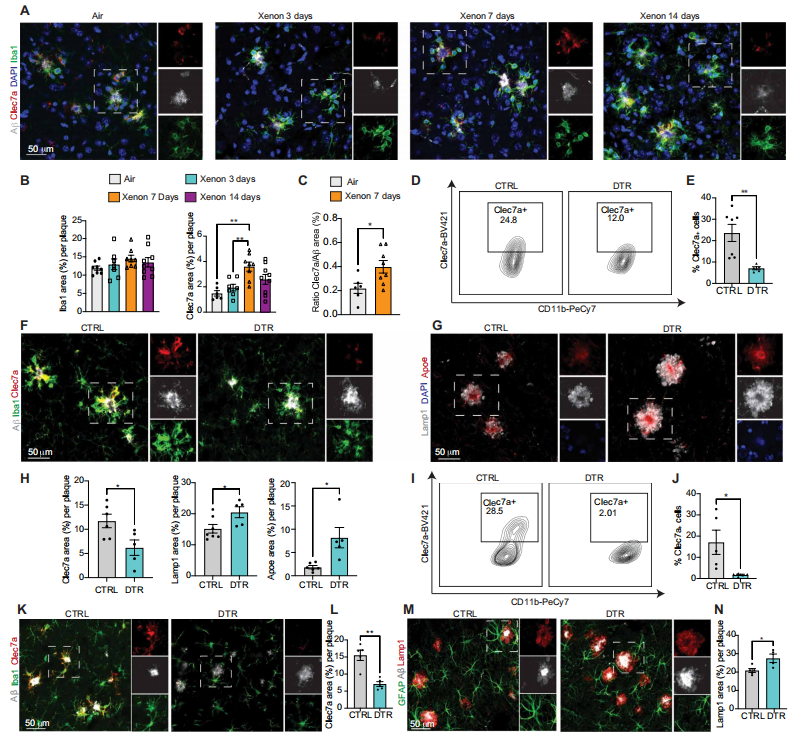
图2. MGnD减少AD小鼠模型中的营养不良性神经突
(A)APP / PS1小鼠经氙气或空气单次处理后,在处理后第3天、第7天或第14天进行评估,脑切片中Clec7a、Iba1、DAPI和HJ3.4B(Aβ斑块)染色的代表性共聚焦图像。(B)使用单因素方差分析对每个淀粉样斑块中Clec7a阳性区域百分比和Iba1阳性区域百分比进行定量分析(雌性和雄性小鼠混合,每组n = 8或9只)。(C)氙气或空气处理后7天,小鼠脑切片中Clec7a区域与HJ3.4B区域标准化百分比的定量分析。采用双尾无配对学生t检验(雌性和雄性小鼠混合,每组n = 8或9只)。(D)APP / PS1:Clec7a - CreERT2:DTRFlox小鼠(DTR)与APP / PS1:DTRFlox对照小鼠(CTRL)脑小胶质细胞的代表性流式细胞术等高线图。展示了小胶质细胞(CD11b⁺、Ly6Clow和FCRLS⁺)中Clec7a的表达。(E)Clec7a⁺小胶质细胞的定量分析(雌性和雄性小鼠混合,每组n = 5至7只,来自两个独立实验)。(F)DTR小鼠与CTRL小鼠脑切片中Clec7a、Iba1和HJ3.4B(Aβ斑块)染色的代表性共聚焦图像。(G)DTR小鼠与CTRL小鼠脑切片中Lamp1、DAPI和Apoe染色的代表性共聚焦图像。(H)每个淀粉样斑块中Clec7a、Lamp1和Apoe阳性区域百分比的定量分析(雌性和雄性小鼠混合,每组n = 5至7只,来自两个独立实验)。(I)5xFAD:FIRE杂合子(CTRL)与5xFAD:FIRE纯合子(DTR)小鼠移植Clec7a - CreERT2:DTRFlox小胶质细胞后脑小胶质细胞(CD11b⁺、Ly6Clow和FCRLS⁺)中Clec7a表达的代表性流式细胞术等高线图。(J)小胶质细胞群体中Clec7a⁺细胞的定量分析(雌性和雄性小鼠混合,每组n = 5只)。(K)DTR小鼠与CTRL小鼠脑切片中Clec7a、Iba1和HJ3.4B(Aβ斑块)染色的代表性共聚焦图像。(L)每个淀粉样斑块中Clec7a阳性区域百分比的定量分析(雌性和雄性小鼠混合,每组n = 5只)。(M)DTR小鼠与CTRL小鼠脑切片中GFAP、Lamp1和HJ3.4B(Aβ斑块)染色的代表性共聚焦图像。(N)每个淀粉样斑块中Lamp1阳性区域百分比的定量分析(雌性和雄性小鼠混合,每组n = 5只)。图(C)、(E)、(H)、(J)、(L)和(N)采用双尾无配对学生t检验进行分析。数据以平均值±标准误表示。*P < 0.05,**P < 0.01。
为了探究Clec7a阳性的髓样细胞(MGnD)特异性消融对疾病进展和病理的影响,我们将APP/PS1:Clec7a - CreERT2小鼠与ROSA26 - DTRFlox小鼠进行杂交。在这个小鼠模型中,白喉毒素受体(DTR)在MGnD中特异性表达,使得在给予白喉毒素后能够清除这一细胞群体。我们在2.5月龄时,对APP/PS1:Clec7a - CreERT2:ROSA - DTRFlox小鼠开始使用他莫昔芬和白喉毒素进行治疗。治疗方案为连续5天给予他莫昔芬,随后连续3天给予白喉毒素,此过程重复3次,共持续3.5周。流式细胞术显示,Clec7a阳性的小胶质细胞数量减少(P = 0.0067)(图2,D和E)。对Clec7a阳性/Iba1阳性的小胶质细胞进行免疫组织化学染色,证实了这一减少(P = 0.0276)(图2,F至H)。Clec7a阳性的MGnD的基因消融导致与Aβ斑块沉积相关的Lamp1阳性营养不良性神经突(P = 0.0380)和APOE(P = 0.0116)积累增加(图2,G和H)。然而,经过4周的持续治疗后,APP/PS1:Clec7a - CreERT2:ROSA - DTRFlox小鼠的存活率下降,这表明Clec7a - CreERT2可能影响了其他细胞。我们发现,即使在无疾病状态下,Clec7a - TdTomato在不同组织,特别是肺和肠道组织中高表达(图S3,K和L),更具体地说,在髓样细胞,如单核细胞和中性粒细胞中高表达(图S3M)。对不同髓样细胞中Clec7a表达的评估显示,100%的肺泡巨噬细胞表达Clec7a - TdTomato(图S3N)。为了具体研究Clec7a阳性的MGnD在阿尔茨海默病(AD)小鼠中的作用,我们将从Clec7a - CreERT2:DTRFlox小鼠(2月龄)分离出的小胶质细胞,移植到出生后P1至P3阶段缺乏小胶质细胞的5xFAD:FIRE(CSF1r - KO)小鼠体内。作为对照,使用fms内含子调控元件(FIRE)基因型的杂合小鼠作为受体,因为它们保留宿主小胶质细胞(24)。在2.5月龄时,我们给这些小鼠注射白喉毒素。我们通过流式细胞术(P = 0.0278)(图2,I和J)和原位检测(P = 0.0010)(图2,K和L)验证了Clec7a阳性细胞的减少。这种小胶质细胞的清除增加了营养不良性神经突(P = 0.0261)(图2,M和N),证实了MGnD的清除是有害的,并加速了疾病的发作。
氙气(Xe)吸入抑制APP/PS1小鼠中MGnD前体细胞亚群的促炎细胞因子并促进干扰素反应
为了确定Xe如何调节小胶质细胞及其亚型,我们对从4月龄经Xe处理或空气处理的APP/PS1雌性小鼠大脑中分离出的CD45阳性/CD11b阳性髓样细胞进行单细胞RNA测序(scRNA - seq)。scRNA - seq揭示了13个无监督聚类(图S4,A和B),这些聚类根据小胶质细胞激活状态(M0、MGnD前体细胞和MGnD)、细胞周期以及边界相关巨噬细胞进行注释(图3,A至D,以及图S4C)。边界相关巨噬细胞是根据已确定的标记基因Mrc1和Clec12a进行分类的(图S4B)(25, 26)。总体而言,MGnD前体细胞下调了M0基因(Tmem119和P2ry12)。此外,与M0小胶质细胞相比,某些激活基因上调:(i)MGnD前体细胞 - 细胞因子类上调了Ccl2、Il1a和Nfkbia;(ii)MGnD前体细胞 - 核糖体类显示核糖体基因Rps29、Rps27和Rpl30富集;(iii)MGnD前体细胞 - 干扰素类上调了Isg15、Stat1和Ifit3;(iv)MGnD前体细胞 - 热休克蛋白(HSP)类富含HSP基因(图3C)。通路分析进一步明确了小胶质细胞亚群(图3D)。Xe处理主要影响MGnD前体细胞群体的比例(图3B)。MGnD前体细胞 - 细胞因子表型减少,而干扰素、HSP和核糖体MGnD前体细胞表型增加。M0小胶质细胞略有增加,而MGnD减少(图3B)。对MGnD聚类的详细研究显示,有一小部分细胞群体富含抗原呈递基因,如H2 - Aa、H2 - Eb1和H2 - Ab1,以及MHC - II信号通路,这些仅在Xe处理后出现(图3,C和D)。Xe处理后小胶质细胞状态比例的变化反映在整体转录组的转变上,干扰素、HSP和核糖体基因以及抗原呈递基因(Hspa1a、Rps27、Ifi27l2a和H2 - Q7)上调,促炎基因(Ier2、Ccl3、Ccl4和Ccrl2)和核心NF - κB信号调节因子(Sgk1和Nfkbiz)下调(图3E)。基因模块分析(每个聚类中前50个富集基因,校正P < 0.05)显示,吸入Xe后,干扰素和HSP的MGnD前体细胞基因模块富集,而MGnD前体细胞 - 细胞因子基因模块减少(图3F)。京都基因与基因组百科全书(KEGG)通路富集分析显示,细胞因子信号传导、NF - κB信号传导和TNFα信号传导一致下调。同时,蛋白质加工、核糖体活性和抗原呈递上调(图3G)。为了在原位验证这些细胞群体,我们测定了经Xe处理的APP/PS1小鼠大脑中信号转导和转录激活因子1(Stat1)(MGnD前体细胞 - 干扰素)和MHC - II(MGnD - 抗原)的蛋白表达。我们证实Xe处理增加了Stat1(P = 0.0285)和MHC - II(P = 0.0159)的表达(图3,H和I)。
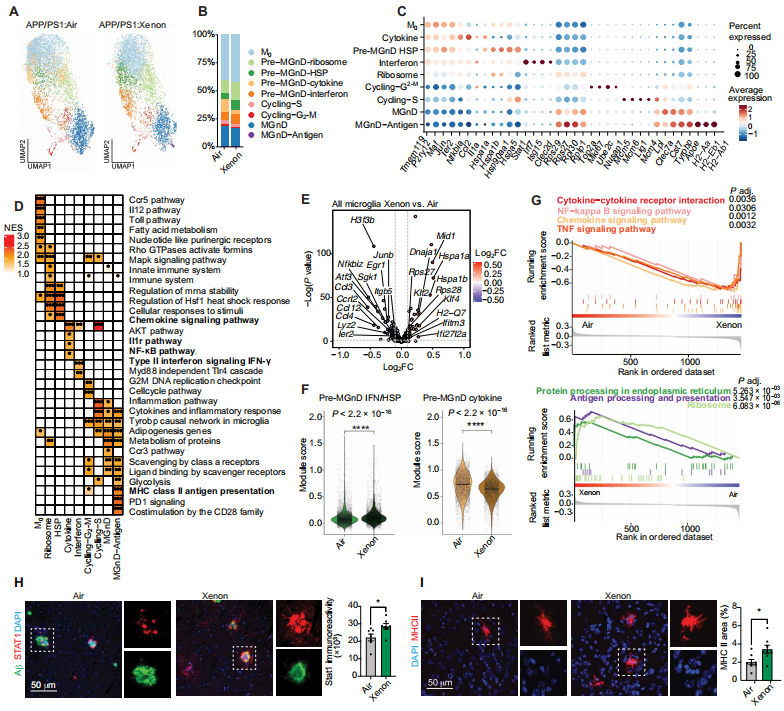
图3. 氙气吸入抑制MGnD前体细胞亚群的促炎细胞因子产生并促进干扰素反应
(A)展示了4月龄APP/PS1小鼠在接受每周Xe或空气处理2个月后,已鉴定的脑小胶质细胞状态的均匀流形近似与投影(UMAP)图(每组n = 2只雌性小鼠)。(B)显示了小胶质细胞亚聚类状态的相对百分比。(C)确定了所有小胶质细胞亚细胞状态的标记基因表达[P < 0.05,使用Benjamini - Hochberg方法校正错误发现率(FDR)]。(D)展示了所有小胶质细胞亚聚类状态的KEGG通路富集情况(*P < 0.05,**P < 0.025,***P < 0.01)。(E)展示了Xe处理和空气处理的APP/PS1小鼠所有小胶质细胞之间差异表达基因(DEGs)的火山图(P < 0.05)。(F)显示了MGnD前体细胞亚群的细胞因子和干扰素反应的基因模块富集情况。(G)展示了所有小胶质细胞DEGs的基因集富集分析(GSEA)通路富集情况(P < 0.05,使用Benjamini - Hochberg方法校正FDR)。(H)展示了经Xe或空气处理的APP/PS1小鼠脑切片中Stat1和HJ3.4B(Aβ斑块)的代表性共聚焦图像及定量分析(每组n = 8或9只雌性小鼠,来自三个独立实验)。(I)展示了经Xe或空气处理的APP/PS1小鼠脑切片中MHC - II的代表性共聚焦图像及定量分析(每组n = 8或9只雌性小鼠,来自三个独立实验)。数据以平均值±标准误表示。采用双侧非配对Student's t检验,*P < 0.05。
为了研究Xe处理后小胶质细胞从M0向MGnD转变的潜在变化,我们进行了拟时间轨迹分析,并确定了两条转变谱系。谱系1显示通过MGnD前体细胞 - 核糖体聚类进行转变,而谱系2表明小胶质细胞最初通过MGnD前体细胞 - HSP状态,随后通过MGnD前体细胞 - 干扰素状态向MGnD表型转变。我们观察到,Xe处理加速了谱系2向MGnD前体细胞 - 干扰素状态的转变,且Stat1更早上调。与谱系2相比,谱系1显示MGnD基因Clec7a的上调加速。此外,Xe处理促进谱系2向MGnD的转变,类似于谱系1,但最终阶段为MGnD - 抗原(图S4,D和E)。这些结果表明,Xe处理促进了小胶质细胞激活从神经炎症细胞因子激活向干扰素介导的激活转变。
氙气吸入增强人源化5xFAD小鼠中人小胶质细胞的IFN - γ信号传导并抑制炎症表型
接下来,我们研究Xe处理是否对人小胶质细胞有类似影响。我们选择了表达绿色荧光蛋白(GFP +)的人诱导多能干细胞衍生的小胶质细胞(iMG)(27)。iMG是通过一种方法生成的,该方法产生的培养物纯度>97%,表达常见的小胶质细胞基因(图S5A),并且与培养的成人和胎儿人小胶质细胞高度相似(28)。与我们对小鼠小胶质细胞培养物的实验类似,Xe处理的iMG显示出与神经炎症和活性氧相关的促炎基因表达降低,如IL3RA、CCL1、CSF2和IRAK3(图S5,B和C)。IPA分析表明,Xe处理使胆固醇生物合成途径富集,包括肝脏X受体和PPAR相关反应,并抑制神经炎症(图S5D)。
为了评估Xe吸入是否也能在体内调节人小胶质细胞,我们将人iMG祖细胞移植到出生后早期(P1)的免疫缺陷5xFAD - MITRG(5x - MITRG)小鼠体内(19)。先前的研究表明,这种方法会导致人iMG广泛植入,这些iMG表现出与人类活检来源的体外小胶质细胞相似的形态、功能和转录特性(26, 29 - 31)。最近的研究表明,在4月龄时,约5%的人小胶质细胞呈现出类似MGnD的转录特征,到6月龄时,当淀粉样斑块更为普遍时,12% - 15%的人小胶质细胞表达MGnD特征(27)。因此,我们在4月龄时开始Xe处理(Xe,30%;每周一次,每次40分钟),并持续每周一次治疗直至6月龄。我们证实iMG祖细胞移植导致表达GFP的人小胶质细胞在大脑前部大量植入(图4A),这些细胞通过对CD11b + /GFP +细胞进行分选得以分离(图S5E)。此外,这些移植到转基因5x - MITRG小鼠体内的细胞,使得我们能够仔细研究人小胶质细胞、小鼠小胶质细胞和Aβ斑块之间的相互作用(图4B)。对Xe作用的评估显示,通过流式细胞术(P = 0.6729;0.9329)(图S5,F和G)和组织学分析(P = 0.4315)(图4C),植入的iMG的百分比和数量没有差异。我们发现,Xe吸入减少了Aβ斑块负荷(P = 0.0338)(图4,D和E)以及皮质中的营养不良性神经突(P = 0.0294)(图4,F和G)。此外,它减少了皮质(P = 0.04938)(图4H)和海马体(P = 0.0070;0.0016)(图4I)中Aβ斑块的数量和大小,包括那些含有营养不良性神经突的斑块(P = 0.0083;0.0153)(图4,J和K)。RNA测序分析表明,Xe抑制了人小胶质细胞中与MGnD相关的基因,包括CLEC7A和ITGAM,而与小胶质细胞迁移相关的基因,包括CXCL10和ICAM1,以及IFN - γ信号传导相关基因(ISG15、EIF2K2和IFI27)被诱导(图4L)。IPA分析表明,RNA激活蛋白激酶在干扰素诱导和抗病毒反应中的作用是Xe诱导的主要途径(图4M),该途径可被IFN - γ激活(32)。此外,上游调节因子分析预测STAT1作为小胶质细胞调节因子被激活(图4N),这通过蛋白质定量得到验证(P = 0.0023)(图4,O和P),与小鼠小胶质细胞单细胞分析结果一致(图3C)。
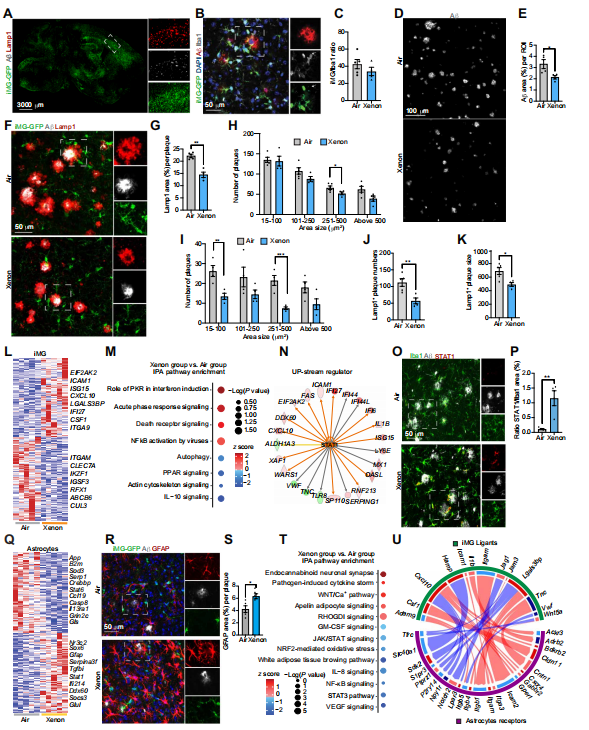
图4. 氙气吸入增强5x - MITRG小鼠中与AD病理相关的人小胶质细胞的IFN - γ信号传导并抑制炎症表型
(A)6月龄5x - MITRG小鼠大脑中人iMG分布的代表性图像。白色方块表示感兴趣的放大区域(ROI)以及iMG与Lamp1和6E10(Aβ斑块)染色的共定位。(B)6月龄5x - MITRG小鼠大脑中iMG和小鼠小胶质细胞(GFP - 和Iba1 +,白色箭头)与Aβ斑块(HJ3.4B)相互作用的代表性图像。(C)6月龄5x - MITRG小鼠皮质中iMG占总小胶质细胞的百分比。(D)每周接受Xe或空气处理2个月的5x - MITRG小鼠皮质中Aβ斑块(用HJ3.4B染色)的代表性共聚焦图像。(E)每个ROI中HJ3.4B阳性(Aβ斑块)面积的百分比定量,按每只动物标准化(每组n = 4或5只雌性小鼠)。(F)接受Xe或空气处理的5x - MITRG小鼠皮质中Lamp1、Aβ斑块(HJ3.4B)和iMG染色的代表性共聚焦图像。(G)每个淀粉样斑块中Lamp1阳性面积的百分比定量,按每只动物标准化(每组n = 4或5只雌性小鼠)。(H)皮质Aβ斑块数量按大小的定量分析(每组n = 5只雌性小鼠)。(I)海马体Aβ斑块数量按大小的定量分析(每组n = 5只雌性小鼠)。(J)表达Lamp1的海马体斑块数量(每组n = 5只雌性小鼠)。(K)表达Lamp1的海马体斑块大小的定量分析(每组n = 5只雌性小鼠)。(L)热图显示从接受Xe与空气处理的5x - MITRG小鼠中分离的iMG群体中的前几位差异表达基因(每组n = 5只雌性小鼠,P < 0.05)。(M)使用从5x - MITRG小鼠中分离的iMG群体的Xe与空气比较的差异表达基因进行IPA分析得到的受影响最大的通路。(N)示意图显示STAT1(中心)作为IPA通路中的上游调节因子。(O)接受Xe或空气处理的5x - MITRG小鼠皮质中HJ3.4B(Aβ斑块)、iMG和Stat1染色的代表性共聚焦图像。(P)每只动物中Stat1面积/Iba1 +细胞百分比的定量分析(每组n = 4或5只雌性小鼠)(Q)热图显示从接受Xe或空气处理的5x - MITRG小鼠中分离的星形胶质细胞中的差异表达基因(n = 5只雌性小鼠,P < 0.05)。(R)接受Xe或空气处理的5x - MITRG小鼠皮质中GFAP、iMG和Aβ斑块(HJ3.4B)染色的代表性共聚焦图像。(S)每个淀粉样斑块中GFAP免疫反应性的定量分析,按每只动物标准化(每组n = 4或5只雌性小鼠)。(T)使用从接受Xe或空气处理的5x - MITRG小鼠中分离的脑星形胶质细胞的差异表达基因进行IPA分析得到的受影响最大的通路(每组n = 5只雌性小鼠)。(U)Circos图展示小胶质细胞配体与星形胶质细胞受体之间优先的相互作用。调节潜力表明吸入Xe后配体 - 受体相互作用增加(红色)或减少(蓝色)。数据为平均值±标准误。采用双侧非配对Student's t检验。*P < 0.05,**P < 0.01,***P < 0.01。
在AD动物模型中,星形胶质细胞也对神经退行性变做出反应,并与Aβ斑块相关(26)。此外,反应性星形胶质细胞在限制AD病理方面发挥有益作用。AD小鼠中星形胶质细胞的清除会增加斑块负荷、突触功能障碍和记忆丧失(33)。为了评估Xe是否影响星形胶质细胞,我们从5x - MITRG小鼠中分离出星形胶质细胞并进行Smartseq2分析。我们的结果表明,星形胶质细胞抑制了与AD病理相关的基因(App和Sod3)和炎症相关基因(Ccl19、Casp8和Il
为了进一步探究氙气(Xe)的作用是否依赖于小胶质细胞,我们使用CSF1R抑制剂PLX - 5622(Plexicon)耗竭5xFAD小鼠大脑中的髓样细胞(35)。我们在5xFAD小鼠4个月大时,将Plexicon掺入饲料中喂食,并持续治疗直至实验结束。在给予Plexicon一周后,我们按照与5x - MITRG小鼠相同的方案,开始每周一次Xe治疗,持续8周。流式细胞术分析证实,大脑中总髓样细胞数量减少了四倍(P < 0.0001)(图5,A和B)。此外,组织病理学分析证实,Aβ斑块周围的Iba1阳性小胶质细胞减少(P = 0.0012)(图5,C和D)。而且,Xe吸入减少了这些动物皮质中的Aβ斑块积累(P = 0.0463)和营养不良性神经突(P = 0.0437),但当大脑髓样细胞被耗竭时,这种效果消失了(P = 0.0210)(图5,E和F)。尽管Xe对皮质有影响,但它并未改变小鼠全脑可溶性和不可溶性Aβ的浓度(图5,G和H)。
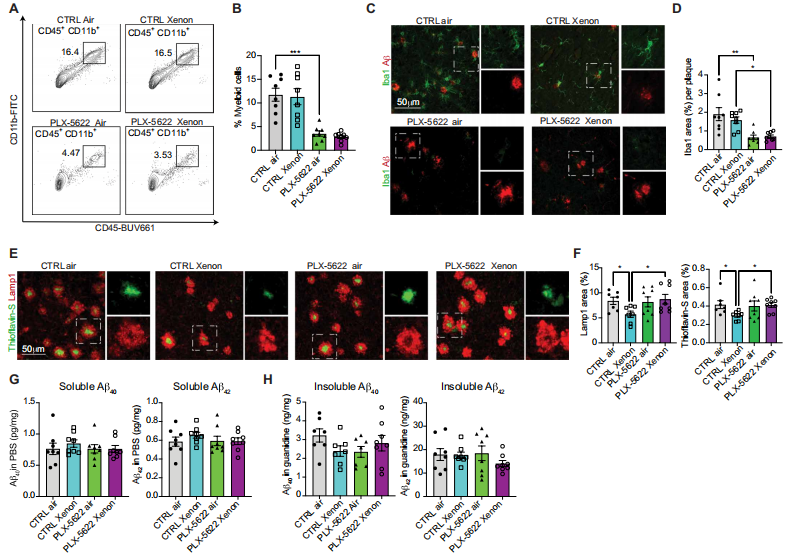
图5. 大脑髓样细胞是Xe发挥有益作用所必需的
(A)代表性的流式细胞术等高线图显示,在4至6个月龄期间,每周接受Xe或空气处理40分钟,同时喂食PLX - 5622(以耗竭小胶质细胞)的5xFAD小鼠大脑中髓样细胞(CD45阳性和CD11b阳性)的百分比。(B)显示了经PLX - 5622和Xe或空气处理后髓样细胞的百分比。采用单因素方差分析(每组n = 8只雌性小鼠)。(C)经PLX - 5622和Xe或空气处理的5xFAD小鼠皮质中,Aβ斑块(HJ3.4B)和Iba1染色的代表性共聚焦图像。(D)每只动物标准化后,每个淀粉样斑块中Iba1阳性面积的百分比定量分析(每组n = 8只雌性小鼠)。(E)经PLX - 5622和Xe或空气处理的5xFAD小鼠皮质中,硫黄素 - S(Aβ斑块)和Lamp1染色的代表性共聚焦图像。(F)每只动物标准化后,每个ROI中Lamp1和硫黄素 - S(Aβ斑块)阳性面积的百分比定量分析(每组n = 8只雌性小鼠),采用单因素方差分析。(G和H)经PLX - 5622和Xe或空气处理的5xFAD小鼠全脑中可溶性(G)和不可溶性(H)Aβ40和Aβ42的定量分析(每组n = 8只雌性小鼠)。数据以平均值±标准误表示。采用单因素方差分析。*P < 0.05,**P < 0.01,***P < 0.001。
在急性神经退行性病变小鼠模型中,阻断IFN - γ信号通路会削弱Xe对小胶质细胞的调节作用
为了确定在阿尔茨海默病(AD)背景下,Xe调节小胶质细胞反应的可能机制,我们重新分析了结果,以评估Xe是否影响谷氨酸离子型受体(图S6A),据报道该受体可被Xe处理抑制(7)。然而,我们在APP/PS1小鼠(图S6B)和5xFAD小鼠(图S6C)的小胶质细胞中,未发现谷氨酸受体基因表达的统计学差异,这表明Xe通过不同的机制起作用。
在不同的小鼠模型中,Xe处理始终能诱导小胶质细胞产生干扰素(IFN)反应(图3和图4)。先前的报告显示,血浆中较高浓度的IFN - γ与AD患者较慢的认知衰退、较少的tau蛋白积累和较少的神经退行性变相关(36)。此外,在3xTg - AD小鼠中过表达IFN - γ可减轻磷酸化tau蛋白病理(37)。由于小鼠和人类的小胶质细胞均显示出干扰素信号下游基因的增强,我们试图研究IFN - γ信号如何调节小胶质细胞从M0向MGnD的转变。为了解决这个问题,我们将荧光标记的凋亡神经元注射到先前用IFN - γ中和抗体或免疫球蛋白G(IgG)同型对照处理的C57BL / 6小鼠的皮质和海马体中,随后进行Xe吸入并分离小胶质细胞(图S7A)。IFN - γ定量证实,在IFN - γ中和抗体处理后,全身细胞因子被耗竭(P = 0.0009)(图S7B)。RNA测序分析显示,在Xe处理前全身阻断IFN - γ会抑制小胶质细胞中IFN - γ相关基因(Cebpb、Cxcl9和Akt2)的表达,同时通过上调Ccr2、Ccr5、Irak2和Mapk9增加促炎反应(图S7C)。IFN - γ阻断损害了通常由Xe吸入诱导的与神经胶质细胞分化、细胞运动和蛋白质成熟相关基因的上调(图S7D)。IPA分析表明,IFN - γ阻断损害了Xe对巨噬细胞经典激活信号传导和IL - 15产生的抑制作用,而神经炎症信号传导和IL - 1介导的RXR功能抑制增加(图S7E)。这些结果表明,在小胶质细胞对凋亡神经元的吞噬反应中,IFN - γ信号对于Xe的活性是必需的。
为了仅在小胶质细胞中证实IFN - γ的作用,我们在Cx3cr1 - CreERT2:Ifngr1Flox(Ifngr1 - cKO)小鼠中重复该实验。在注射凋亡神经元前1个月,用他莫昔芬处理这些小鼠以敲除Ifngr1基因。这种方法将Ifngr1基因的敲除限制在小胶质细胞和边界相关巨噬细胞等长寿细胞中。在Xe吸入14小时后,分离吞噬性和非吞噬性小胶质细胞进行RNA测序分析。通过基因表达证实了Ifngr1基因的抑制(P = 0.0006)(图6A),这与IFN - γ相关基因如Vamp3、Ifi208和Eif5a有关(图6,B和C)。在Ifngr1 - cKO小鼠中,约70%由Xe调节的差异表达基因(DEGs)消失了,包括促炎调节因子如Stat3、Nrp1和Tlr9,以及免疫检查点基因如Cd274(程序性死亡配体1,PD - L1)和Inpp5d的抑制(图6C)(38)。我们发现,Xe介导的IFN - γ信号负责调节白细胞分化和线粒体组织,这有助于控制细胞对TNF的反应。同时,Xe介导的IFN - γ信号降低了NF - κB活性、细胞因子介导的通路信号传导以及对运动性的负调控(图6,D和E)。IPA分析显示,线粒体功能受影响最大,其次是与炎症和细胞焦亡相关基因的诱导(图6F)。这些数据表明,在急性神经退行性变期间,IFN - γ信号对于调节Xe对小胶质细胞的作用至关重要。
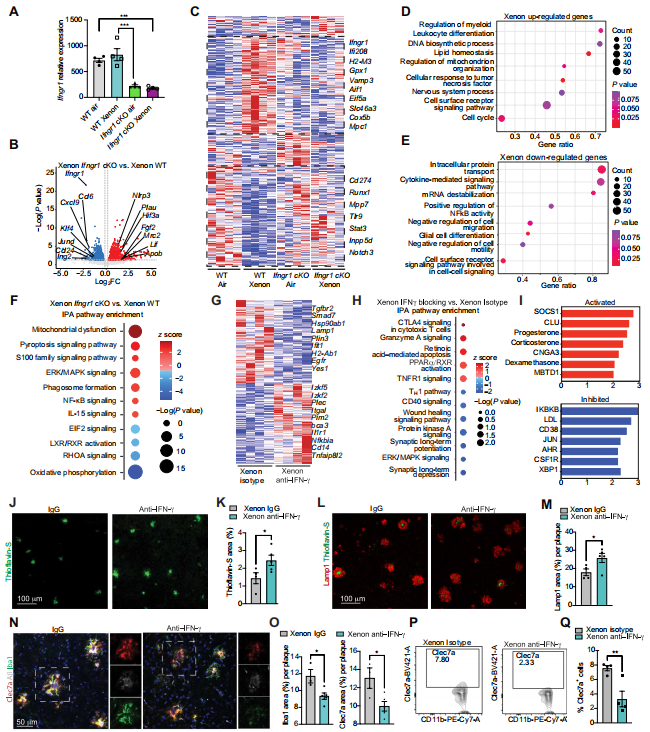
图6. 阻断IFN - γ信号通路会削弱Xe对小胶质细胞的调节作用
(A)野生型Cx3cr1 - CreWT:Ifngr1Flox小鼠(野生型,WT)和Ifngr1条件性敲除(Cx3cr1 - CreERT2:Ifngr1Flox)小鼠(Ifngr1 - cKO)脑小胶质细胞中Ifngr1基因表达的标准化计数。采用单因素方差分析(每组n = 4只雌性小鼠)。(B)Ifngr1 - cKO组与野生型组经Xe处理后,吞噬性小胶质细胞中差异表达基因的火山图(每组n = 4只雌性小鼠)。(C)热图显示由Xe诱导并由IFN - γ信号维持的吞噬性小胶质细胞差异表达基因(黑色虚线)。(D)Xe处理诱导的基因本体(GO)通路。(E)Xe处理抑制的GO通路。(F)基于Ifngr1 - cKO组与野生型组经Xe处理后的IPA分析,受影响最大的通路。(G)APP/PS1小鼠经IgG同型对照抗体或IFN - γ阻断抗体以及Xe或空气处理2周后,从大脑分离的小胶质细胞中基因表达的热图。(H)APP/PS1小鼠经IFN - γ阻断抗体或IgG同型对照抗体处理后,脑小胶质细胞中差异表达基因的IPA分析中受影响最大的通路(每组n = 4或5只雌性小鼠)。(I)IPA预测的激活和抑制的上游调节因子。(J)APP/PS1小鼠经IgG同型对照抗体或IFN - γ阻断抗体以及Xe或空气处理2周后,脑切片中皮质硫黄素 - S(Aβ斑块)染色的代表性共聚焦图像。(K)每只动物标准化后,每个ROI中硫黄素 - S(Aβ斑块)阳性面积的百分比定量分析(每组n = 4或5只雌性小鼠)。(L)APP/PS1小鼠经IgG同型对照抗体或IFN - γ阻断抗体以及Xe或空气处理2周后,脑切片中皮质Lamp1和硫黄素 - S(Aβ斑块)染色的代表性共聚焦图像。(M)每只动物标准化后,每个淀粉样斑块中Lamp1阳性面积的百分比定量分析(每组n = 4或5只雌性小鼠)。(N)APP/PS1小鼠经IgG同型对照抗体或IFN - γ阻断抗体以及Xe或空气处理2周后,脑切片中皮质Clec7a、Aβ斑块(HJ3.4B)和Iba1染色的代表性共聚焦图像。(O)每只动物标准化后,每个淀粉样斑块中Iba1和Clec7a阳性面积的百分比定量分析(每组n = 4或5只雌性小鼠)。(P)代表性的流式细胞术等高线图显示,APP/PS1小鼠经IgG同型对照抗体或IFN - γ阻断抗体以及Xe或空气处理2周后,大脑中小胶质细胞群体(CD11b阳性、Ly6C低表达和FCRLS阳性)中Clec7a的表达。(Q)Clec7a阳性细胞的定量分析(每组n = 4或5只雌性小鼠)。数据以平均值±标准误表示。图(K)、(M)、(O)和(Q)采用双侧非配对Student's t检验分析;图(A)采用单因素方差分析。*P < 0.05,**P < 0.01,***P < 0.001。
鉴于在我们的急性小鼠模型中难以观察到病理变化,我们评估了IFN - γ阻断剂在有淀粉样沉积的小鼠中的作用。我们在APP/PS1小鼠6个月大时,每周一次用IFN - γ中和抗体处理,持续2周,在Xe暴露前24小时腹腔注射。14天后,我们对动物实施安乐死,并评估小胶质细胞特征和疾病病理。我们的研究结果表明,阻断IFN - γ会增加小胶质细胞的促炎反应,这可通过Nfkbia、Il1r1和Cd14的上调(图6G)以及与颗粒酶和TNFR1相关的通路来证明。小胶质细胞促炎反应的这种增加与IFN - γ相关通路如辅助性T细胞1(TH1)通路的抑制有关,这是通过细胞因子信号抑制因子1(SOCS1)的增加实现的(图6,H和I)。此外,组织学分析显示Aβ斑块沉积增加(P = 0.0497)(图6,J和K)和营养不良性神经突增加(P = 0.0469)(图6,L和M)。在急性Xe暴露后,阻断IFN - γ信号会减少Clec7a阳性小胶质细胞(P = 0.0284)(图6,N和O)。这通过流式细胞术分析得到证实(P = 0.0097)(图6,P和Q),表明在存在淀粉样斑块的情况下,IFN - γ信号在诱导MGnD方面的作用(39)。
Xe吸入增加淀粉样变性小鼠CD8 T细胞中IFN - γ的产生
我们的研究结果表明,Xe诱导了一种由IFN - γ信号介导的MGnD前体中间小胶质细胞状态。我们最近发现,在淀粉样变性小鼠模型中,对IFN - γ有反应的MGnD前体可限制神经退行性病变(39)。作为一种全身性治疗,Xe预计会影响各种细胞群体,包括可能影响小胶质细胞极化的外周免疫细胞。对APP/PS1小鼠大脑的流式细胞术分析显示,有少量浸润的免疫细胞,包括T细胞(图S8,A和B),而T细胞是IFN - γ的主要来源之一(40)。然而,Xe处理并未改变浸润到小鼠大脑中的细胞数量,这表明血脑屏障(BBB)没有受到直接影响(图S8C)。为了探究Xe是否能在T细胞中诱导IFN - γ信号,我们进行了一项动力学实验,评估APP/PS1小鼠在Xe吸入后3天、7天和14天的脾脏T细胞特征(图S9A)。我们发现,在吸入后3天和7天,一些与IFN - γ信号相关的基因增加,包括Stat1、Cd74、Sirpa、Capg和Vamp8(图S9,B和C)。有趣的是,由差异表达基因数量所示的T细胞激活峰值,先于小胶质细胞激活峰值出现,小胶质细胞激活在吸入后3天达到峰值(图S9D)。IPA分析显示TH1和IFN - γ通路以及颗粒酶和GM - CSF增加,表明这些细胞的激活增加(图S9E)。然而,随着时间推移,一些通路显示出相反的效果,吸入后7天,内皮型一氧化氮合酶(eNOS)和AMP激活蛋白激酶(AMPK)信号被抑制,而在活化和无反应性T淋巴细胞中IL - 2表达的调节上调(图S9E)。上游调节因子分析表明GM - CSF(CSF2)增加且SOCS1受到抑制,这与吸入Xe后3天IFN - γ信号的增加相符(图S9F)。预测吸入后7天PD1(PDCD1)上调,这与T细胞的无反应性反应相关(图S9G)。
为了证实在疾病进展过程中T细胞内IFN - γ的表达增加,我们评估了经Xe处理后的5xFAD小鼠血液、脾脏和大脑中T细胞的IFN - γ表达情况(图S9H)。我们发现,在Xe吸入3天后,血液中CD8 T细胞的IFN - γ表达增加(P = 0.0289),但CD4 T细胞并无此变化(P = 0.3863)(图S9I);而在吸入7天后,这种CD8 T细胞内IFN - γ表达增加的现象消失(P = 0.1173)(图S9J)。在持续Xe处理2个月后,脾脏CD8 T细胞中的IFN - γ表达仍然增加(P = 0.0471)(图S9K)。此外,对小鼠大脑的评估显示,表达IFN - γ的CD8 T细胞百分比增加(P = 0.0221)(图S9,L和M),且这些细胞的IFN - γ表达量也增加(P = 0.0201)(图S9,N和O)。
Xe吸入可减轻TE4小鼠的脑萎缩、维持齿状回层厚度并减少星形胶质细胞增生
我们评估了Xe吸入是否能够改善P301S tau人APOE4敲入小鼠模型(TE4)中的tau蛋白病及相关神经退行性变(18)。这些实验的主要问题是,与暴露于大气空气相比,Xe暴露是否能减轻TE4小鼠的神经退行性变。从6个月龄tau病理开始发展时起,至9.5个月龄小鼠出现明显的tau病理、神经退行性变、神经胶质细胞激活和突触丧失时止,TE4小鼠每周接受30% Xe或大气空气(对照)处理40分钟。在这个实验范式中,接受大气空气处理的APOE4 KI(E4)小鼠被纳入作为另一个对照组。在9.5个月龄时,对小鼠实施安乐死并采集组织样本。我们首先评估了Xe吸入是否影响tau蛋白以及小胶质细胞介导的神经退行性变。已知TE4小鼠会出现明显的海马体和内嗅/梨状皮质萎缩,同时伴有脑室扩大(18, 41)。我们发现,Xe处理导致海马体体积有小幅但显著的增加(P = 0.0210),内嗅/梨状皮质体积也有增加的趋势(P = 0.0627)(图7,A和B)。与大气空气处理的对照组相比,Xe吸入还使脑室体积有减小的趋势(P = 0.0572)(图7,A和B)。此外,Xe处理组动物的齿状回颗粒细胞神经元层明显比对照组厚(P = 0.045)(图7,C和D)。在采集脑组织前两天,我们对这些小鼠进行了筑巢行为测试(42)。我们观察到,与吸入对照空气的小鼠相比,吸入Xe的TE4小鼠表现出更好的行为趋势(图7E)。在所有接受Xe处理或对照空气处理的TE4小鼠中,齿状回层厚度与海马体体积呈显著正相关(P < 0.0001)(图7F)。在这些实验中,展示了9.5个月龄无神经退行性变的E4小鼠的数据(图7,A至R)。然而,在进行的统计检验中,E4小鼠的数据并未直接与TE4小鼠的数据进行比较,因为E4小鼠未出现神经退行性变(它们仅作为参考展示)。
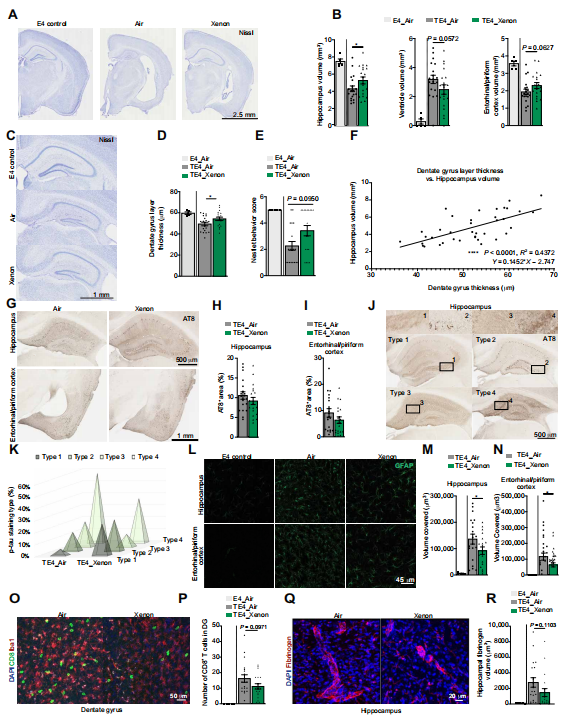
图7. Xe吸入减轻小鼠脑萎缩、挽救齿状回层厚度并减少GFAP阳性星形胶质细胞增生
(A)9.5个月龄TE4小鼠的代表性脑切片图像,这些小鼠在6至9个月龄期间每周接受40分钟Xe气体或对照空气处理,并用甲酚紫尼氏染色。比例尺,2.5毫米。(B)接受对照空气的E4小鼠(n = 5)、接受Xe气体的TE4小鼠(每组n = 19)和接受对照空气的TE4小鼠(每组n = 19)大脑中海马体、脑室和内嗅/梨状皮质体积的定量分析。(C)E4空气组、TE4空气组和TE4 Xe组小鼠脑切片经甲酚紫尼氏染色后显示齿状回(DG)颗粒细胞层的代表性图像。比例尺,1毫米。(D)三组小鼠大脑中DG颗粒细胞层厚度的定量分析。(E)三组小鼠在筑巢小测试中的筑巢行为定量分析。(F)暴露于Xe或空气的TE4小鼠中,DG颗粒细胞层厚度与海马体体积的相关性。(G)9.5个月龄接受Xe或空气处理的TE4小鼠脑切片,用AT8抗体对磷酸化tau(p - tau)进行免疫反应染色的代表性图像。海马体(上图;比例尺,500微米)和内嗅/梨状皮质(下图;比例尺,1毫米)。(H和I)接受Xe(每组n = 19)或空气(每组n = 19)处理的TE4小鼠大脑海马体(H)和内嗅/梨状皮质(I)中AT8阳性面积百分比。(J)9.5个月龄接受空气处理的TE4小鼠脑切片中,用AT8抗体染色的四种p - tau染色模式的代表性图像。比例尺,500微米。(K)接受Xe(每组n = 19)或空气(每组n = 19)处理的TE4小鼠中AT8 p - tau染色模式类型的定量分析。(L)9.5个月龄接受Xe或空气处理的TE4小鼠大脑海马体和内嗅/梨状皮质中GFAP染色的代表性图像。比例尺,45微米。(M)接受空气的E4小鼠(每组n = 5)、接受Xe的TE4小鼠(每组n = 19)和接受空气的TE4小鼠(每组n = 19)大脑中海马体GFAP阳性染色体积百分比的定量分析。(N)接受空气的E4小鼠(每组n = 5)、接受Xe的TE4小鼠(每组n = 19)和接受空气的TE4小鼠(每组n = 19)大脑中内嗅/梨状皮质GFAP阳性染色体积百分比的定量分析。(O)9.5个月龄接受Xe或空气处理的TE4小鼠齿状回中CD8阳性T细胞的代表性图像。比例尺,50微米。(P)E4组和TE4组小鼠齿状回中CD8阳性T细胞数量的定量分析。(Q)9.5个月龄接受Xe或空气处理的TE4小鼠海马体中纤维蛋白原染色的代表性图像。比例尺,20微米。(R)9.5个月龄接受Xe或空气处理的TE4小鼠海马体中纤维蛋白原体积的定量分析。每个点代表一只小鼠。除(B)使用单尾Student's t检验,(E)和(K)使用Fisher精确检验外,其他分析均使用双尾Student's t检验。*P < 0.05。数据以平均值±标准误表示。
在9.5个月龄时,P301S - tau转基因小鼠表现出大量tau病理特征,包括不可溶性tau升高、tau过度磷酸化和神经原纤维缠结。接下来,我们探究了Xe吸入如何影响TE4小鼠的tau病理。首先,我们通过AT8抗体免疫染色评估了海马体和内嗅/梨状皮质中的磷酸化tau(p - tau)。该抗体识别在丝氨酸 - 202和苏氨酸 - 205位点磷酸化的tau蛋白。我们未发现海马体或内嗅/梨状皮质中AT8 p - tau阳性面积百分比有显著差异(图7,G至I)。鉴于我们未观察到AT8免疫染色覆盖面积百分比的显著变化,接下来我们有兴趣评估tau蛋白疾病特异性构象修饰的标记物MC1(43)。在Xe吸入组和对照空气吸入组之间,海马体和内嗅/梨状皮质中MC1阳性面积百分比并无变化(图S10)。在9.5个月龄左右,由AT8染色的p - tau免疫反应性也可分为四种主要的p - tau染色模式,标记为1型至4型。这些染色模式也与脑萎缩和更严重的病理性tau密切相关,1型与保存最完好的脑组织相关,4型与最严重的脑萎缩相关(18)。当将AT8 p - tau免疫反应性分为这四种类型时,我们观察到,与3型和4型模式相比,吸入Xe的小鼠中1型和2型模式更为丰富。相比之下,吸入对照空气的TE4小鼠主要呈现与更晚期tau阶段和神经退行性变相关的4型模式,尽管这种差异并不显著(图7,J和K)。在另一项研究中,在tau蛋白病小鼠模型中,星形胶质细胞增生的程度与脑体积相关,并且在阿尔茨海默病中起着重要作用(18),因此我们接下来评估了Xe吸入是否影响海马体和内嗅/梨状皮质中的星形胶质细胞增生。我们观察到,Xe减少了海马体和内嗅/梨状皮质中星形胶质细胞[胶质纤维酸性蛋白阳性(GFAP +)]的阳性体积百分比(P = 0.034;0.0495)(图7,L至N),这表明吸入Xe后星形胶质细胞的激活减少。
Xe吸入及其对TE4小鼠齿状回中CD8 + T细胞的影响
研究表明,在tau蛋白病小鼠模型以及阿尔茨海默病患者的大脑样本中,T细胞存在于脑实质中,并且它们的富集与脑萎缩相关。这项研究提供了T细胞与疾病相关小胶质细胞亚群之间相互作用的证据(44)。我们的RNA测序分析显示,星形胶质细胞和小胶质细胞中几个与促炎反应相关的基因表达受到抑制。我们评估了Xe吸入是否影响TE4小鼠齿状回中CD8 + T细胞的数量(图7O)。与吸入空气的对照小鼠相比,吸入Xe的小鼠齿状回中CD8 + T细胞数量有减少的趋势(P = 0.0971)(图7P)。此外,我们对纤维蛋白原进行染色,这是一种通常被阻止进入脑实质的血液来源蛋白(图7Q)。在海马体中,我们未观察到Xe吸入后TE4小鼠的纤维蛋白原有任何显著变化(图7R)。
Xe吸入导致TE4小鼠神经元和突触基因上调、炎症基因下调
为了确定转录变化是否与TE4小鼠吸入Xe有关,我们对9.5个月龄接受Xe或空气处理的TE4小鼠海马组织进行了RNA测序分析。主成分分析(PCA)显示,所有三组(E4、TE4空气和TE4 Xe)之间存在特定的聚类,与TE4空气组小鼠相比,TE4 Xe组的特征与非tau转基因E4小鼠更为相似(图8A)。与对照空气吸入组相比,我们在Xe吸入组中鉴定出4390个差异表达基因(DEGs,校正P < 0.05),其中1860个基因上调,2530个基因下调。我们用前400个DEGs生成了一个热图,以直观展示显著影响。该分析显示,星形胶质细胞和小胶质细胞中几个与促炎反应相关的基因(C3、S100、B2m和Apoe)的表达受到抑制(图8B)。我们发现,一些免疫检查点基因表达降低,包括Inpp5d和Havcr2,这表明即使炎症反应降低,海马体细胞仍具有更活跃的表型(图8B)。IPA分析突出显示,Xe处理后谷氨酸受体和钙信号传导增加,同时神经炎症、IL - 15产生、一氧化氮和活性氧(ROS)受到抑制(图8C)。上游调节因子分析表明,BDNF和钙调蛋白被诱导,NF - κB、IL - 1和TNF信号传导受到抑制(图8D)。
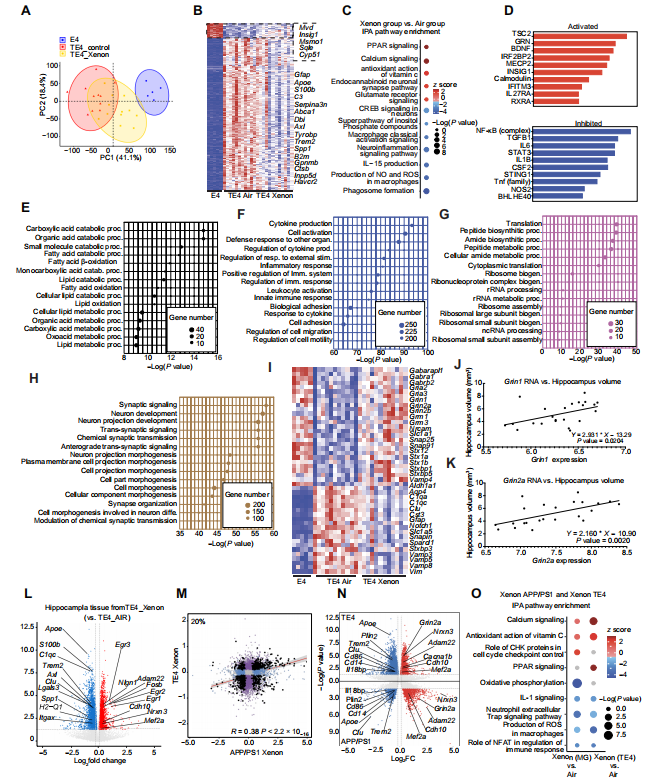
图8. Xe吸入下调TE4小鼠中炎症和氧化应激相关基因
(A)从28只动物的海马组织中分离RNA:APOE4背景下的非P301S - tau转基因小鼠(E4小鼠)接受空气(每组n = 5)、APOE4背景下的P301S - tau转基因小鼠(TE4小鼠)接受Xe气体(n = 12),以及接受空气的TE4小鼠(n = 11)。PCA显示了三组小鼠的聚类情况。(B)热图显示了由Xe吸入调节的前400个基因的表达。通过比较TE4对照空气组与TE4 Xe组,共鉴定出4390个DEGs(2530个基因下调,以蓝色显示;1860个基因上调,以红色显示)。(C)基于TE4 Xe组与TE4空气组的IPA分析中受影响最大的通路。(D)IPA预测的激活和抑制的上游调节因子。(E)加权基因共表达网络分析(WGCNA)中的黑色模块显示涉及的前15个基因本体(GO)生物学通路及基因数量。(F)WGCNA中的蓝色模块显示涉及的前15个GO生物学通路及基因数量。(G)WGCNA中的粉色模块显示涉及的前15个GO生物学通路及基因数量。(H)WGCNA中的棕色模块显示涉及的前15个GO生物学通路及基因数量。(I)热图显示选定的神经元、突触和星形胶质细胞的DEGs。(J和K)TE4小鼠中Grin1和Grin2 RNA表达与海马体体积的相关性(n = 23)。每个点代表一只小鼠。(L)TE4 Xe组与TE4空气组DEGs的火山图,突出显示与小胶质细胞对Xe反应相关的基因。(M)暴露于Xe的TE4和APP/PS1小鼠脑小胶质细胞中DEGs的相关性分析。(N)将TE4和APP/PS1小鼠脑小胶质细胞中DEGs相关联的组合火山图。(O)APP/PS1小鼠小胶质细胞Xe组与空气组以及TE4小鼠小胶质细胞Xe组与空气组中受影响最大的经典通路。(K)和(L)使用的统计检验为线性回归。PC,主成分。
接下来,我们通过加权基因共表达网络分析(WGCNA)对数据进行分析,该分析揭示了九个不同的聚类模块,这些模块确定了Xe处理后TE4小鼠中最关键的基因和通路。我们发现,与吸入空气的TE4小鼠相比,吸入Xe的TE4小鼠中有四个有趣的模块呈现相反方向的变化(图8,E至H)。黑色模块代表许多涉及脂质和脂肪酸代谢及分解功能的基因本体(GO)生物学过程;一些关键基因包括Hadh、Hadhb和Acadm(图8E)。蓝色模块代表许多涉及炎症反应的GO生物学过程(图8F)。正如预期的那样,该模块与疾病发展相关(TE4空气组与E4空气组相比),并且在接受Xe处理的动物中受到抑制。粉色模块包括肽和酰胺生物合成以及核糖体生物发生的GO通路(图8G)。棕色模块表明突触和神经元GO通路发生了变化(图8H);在E4小鼠和接受Xe处理的TE4小鼠中,该模块同样被诱导,这表明Xe可以恢复TE4小鼠的神经元功能。正如WGCNA所示,接受Xe处理的小鼠中许多神经元和突触基因上调,相反,炎症基因下调(图8I)。值得注意的是,这些基因包括许多γ-氨基丁酸(GABA)受体、谷氨酸α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)受体、谷氨酸N-甲基-D-天冬氨酸(NMDA)受体以及突触相关基因,如Snap25和Stx1a。最后,我们发现,在TE4小鼠的脑样本中,谷氨酸离子型受体NMDA亚基1(Grin1)和谷氨酸离子型受体NMDA亚基2A(Grin2A)的RNA表达与海马体体积呈正相关(P = 0.0204;0.002)(图8,J和K)。
为了研究TE4和APP/PS1小鼠模型对Xe反应的相似性,我们研究了Xe吸入在TE4小鼠中调节的小胶质细胞基因。我们发现,Xe处理抑制了几个MGnD经典基因,如Apoe、Itgax、Spp1、Lgals3、Axl和Trem2(图8L)。线性回归分析表明,在Xe处理的TE4和APP/PS1小鼠之间,20%的差异表达基因(DEGs)是相同的(图8M)。在同向调节的基因中,我们发现Grin2a、Mef2a、Adam22和Nrxn3表达被诱导(图8N),Nrxn3是一种突触前粘附分子,是突触发育和功能的主要调节因子(45)。Xe吸入还抑制了TE4和APP/PS1小鼠中Apoe、Trem2、Cd86、Plin2和Cd14基因的表达(图8N)。值得注意的是,CD14是一种辅助分子,它与TLR4协同作用,诱导NF-κB激活和促炎基因的表达(46)。在APP/PS1小鼠中,Cd14的缺失与小胶质细胞数量减少和Aβ斑块负担降低有关(47)。IPA分析表明,增加钙信号传导和维生素C的抗氧化作用,以及抑制IL-1和活性氧(ROS)的产生,是共同的通路(图8O)。
讨论
阿尔茨海默病的三个典型特征是Aβ沉积、tau蛋白缠结和小胶质细胞激活(48)。这些异常共同作用导致神经元损伤,进而产生该疾病的临床症状。抗淀粉样蛋白疗法是美国食品药品监督管理局(FDA)批准的首个用于治疗阿尔茨海默病的疾病修饰疗法,在疾病早期有一定效果(1)。淀粉样蛋白和tau蛋白都会导致小胶质细胞激活,这是阿尔茨海默病发病机制的关键组成部分。小胶质细胞调节异常在阿尔茨海默病的发病和进展中都起着重要作用,最近的研究结果表明,全基因组关联研究(GWAS)相关基因在小胶质细胞中特异性或高表达(5)。失调的小胶质细胞在神经退行性变的刺激下会获得MGnD/DAM表型(5)。尽管这种表型可能有助于促进Aβ清除,但它也是一种有毒表型,可能导致神经毒性。用于阿尔茨海默病治疗的理想小胶质细胞表型应该是,小胶质细胞能够有效改善Aβ病理而不引起细胞毒性。我们最近发现了一种称为“MGnD前体”的小胶质细胞表型(39)。这种表型由IFN-γ信号传导介导,与限制Aβ斑块、减少营养不良性神经突、减轻斑块相关的突触退化以及改善认知有关(39)。我们发现,在急性神经退行性变小鼠模型和Aβ沉积小鼠中,Xe吸入通过IFN-γ信号传导直接促进MGnD前体细胞亚型的产生。
IFN-γ是一种参与免疫反应的关键细胞因子,在先天免疫中至关重要(40)。IFN-γ是一种促炎细胞因子,因为它激活免疫反应,促进一氧化氮的产生和抗原呈递基因的表达,并改善吞噬反应。然而,在特定情况下,IFN-γ也可以发挥抗炎作用,调节和终止免疫反应,包括通过协同诱导IL-10和阻断NF-κB来抑制TNF和IL-1的表达(49, 50)。我们发现,Xe可以刺激外周免疫细胞,特别是CD8 T细胞,增加循环系统和大脑中的IFN-γ表达。这种IFN-γ表达的增强似乎在促进小胶质细胞转变中发挥作用。此外,对IFN-γ进行药理学和基因靶向干预有效地消除了Xe对小胶质细胞的调节作用,增加了它们的促炎反应以及Aβ斑块和营养不良性神经突的积累。值得注意的是,Xe吸入增加了MGnD基因特征,包括Clec7a、Itgax和Gpnmb的表达,同时维持了一些稳态基因的表达,包括Sall1、Tgfbr2和Nr3c1(一种糖皮质激素受体,可通过阻断NF-κB激活来抑制炎症反应)(51)。相反,以诱导IL-1、TNF、趋化因子和NF-κB通路为特征的MGnD前体细胞 - 细胞因子亚型减少。众所周知,IL-1和TNF会促进大脑中Aβ的产生和聚集(51, 52),因为过量的TNF、IL-1和ROS会直接损伤神经元,导致突触功能障碍、神经元通讯受损,最终导致神经元死亡(52)。
Xe可能具有潜在的治疗效果,特别是在调节阿尔茨海默病小胶质细胞方面,但其作用机制复杂。Xe作为NMDA受体阻滞剂的作用(53)及其在细胞线粒体自噬中的作用(54)表明,它可能影响特定的神经元和细胞过程。然而,之前的这些分析仅在有限的脑区或短时间内(3天)进行。这种局限性可能无法全面解释Xe作用机制的复杂性。鉴于小胶质细胞功能是阿尔茨海默病神经炎症和疾病进展的关键方面,Xe在阿尔茨海默病动物模型中对小胶质细胞调节的持续作用开辟了一个潜在的治疗窗口。为了全面了解Xe的潜力、机制及其在长期治疗中的适用性,研究Xe在更广泛的系统和时间范围内的作用至关重要。
在APP/PS1小鼠中,MGnD通过吞噬和降解Aβ斑块、压实斑块以限制Aβ毒性(4)以及从周围神经元隔离有毒蛋白质聚集体,在减轻淀粉样蛋白负担方面至关重要(55)。吸入Xe 2个月的APP/PS1小鼠表现出Aβ斑块压实增强,伴随神经毒性和营养不良性神经突减少。值得注意的是,Clec7a表达增加的MGnD特征与Aβ积累直接相关(3),减轻斑块负担也可以抑制这种特征。为了评估Xe处理结束时MGnD信号的降低是由于斑块负担减少还是Xe的直接调节作用,我们进行了一项短期治疗实验,证明了Xe对MGnD极化的影响。使用专门针对MGnD的Clec7a - CreERT2小鼠模型,我们验证了MGnD在疾病发作期间减少营养不良性神经突的重要性。
为了研究Xe吸入如何影响tau蛋白病理,我们使用了TE4 tau蛋白病小鼠模型。我们观察到,与吸入空气的对照动物相比,接受Xe处理的TE4小鼠脑海马体体积更大,齿状回神经元损失减少,这与筑巢行为改善的趋势相关。尽管我们没有评估这些小鼠的其他行为,但我们发现,TE4小鼠筑巢行为得分的改善与其他评估记忆方面的认知任务(如Y迷宫)以及情境和听觉线索条件反射测试中的表现相关(44)。尽管Xe吸入减轻了TE4小鼠的海马萎缩,但这些小鼠仍表现出相当程度的神经退行性变。Xe吸入不影响p - tau积累、tau蛋白的疾病特异性构象修饰或p - tau染色模式。然而,值得注意的是,我们之前的研究表明,与表达其他人载脂蛋白E(ApoE)异构体或敲除ApoE的小鼠模型相比,这种敲入人APOE4的小鼠模型会产生更严重的tau蛋白病理(18)。因此,APOE4异构体的存在可能会产生额外的影响,导致tau蛋白病理,而Xe吸入可能无法克服这些影响,这需要通过研究Xe对表达不同ApoE异构体的小鼠或缺乏ApoE的小鼠的影响来确定。
在基础条件下,星形胶质细胞在中枢神经系统(CNS)中产生大部分APOE。然而,在受到如脑损伤或神经退行性变等特定损伤时,小胶质细胞中的Apoe表达也会强烈上调(3)。最近,我们发现,在tau蛋白病理小鼠模型中,从星形胶质细胞中去除APOE4会导致神经退行性变、p - tau病理以及突触损失和小胶质细胞对突触元件的吞噬减少,这表明星形胶质细胞Apoe在突触退化中起关键作用(41)。我们发现,与5x - MITRG小鼠(19)不同,Xe抑制了TE4小鼠的星形胶质细胞增生(18)。根据我们的经验,这些相互矛盾的观察结果可能是由于不同的实验设计和比较造成的。尽管两种小鼠模型都接受相同浓度的Xe处理,但它们之间存在很大差异,包括年龄、分析的脑区(皮质与海马体)、人源小胶质细胞的存在以及5x - MITRG小鼠模型中适应性免疫细胞的缺失。相比之下,P301S小鼠表现出基于tau蛋白磷酸化和聚集的疾病,伴有明显的神经元损失、突触损失和脑萎缩。另一个重要区别是,我们的P301S小鼠是在人APOE4背景下构建的(18)。我们团队最近的一项研究表明,APOE4抑制小胶质细胞向MGnD极化,导致半乳糖凝集素 - 3表达降低,从而减少星形胶质细胞激活(39)。因此,APOE背景的差异可能在一定程度上调节了两种不同模型中Xe诱导的星形胶质细胞增生的差异。
突触损失在tau蛋白病小鼠模型中已有充分描述(56 - 58)。吸入对照空气的TE4小鼠显示许多突触和神经元基因下调。相反,吸入Xe的TE4小鼠显示类似基因上调,且基因表达谱与E4对照小鼠相似。与这些发现一致,之前一项对接受Xe治疗的创伤性脑损伤(TBI)小鼠模型的研究表明,星形胶质细胞增生减少(59)。我们的WGCNA分析显示,TE4小鼠吸入Xe后,脂质和脂肪酸基因下调,包括Plin2、Lamp1、Cd68、Lamp2、Grn和Gpnmb。我们最近发现,TE4小鼠出现大量脑溶酶体损伤和脂质积累(60)。我们的RNA测序结果表明,TE4小鼠中失调的通路在吸入Xe后在一定程度上朝着相反方向逆转。
我们评估了TE4和APP/PS1小鼠模型在吸入Xe后的相似性。我们发现,Xe抑制了一些MGnD经典基因的表达,如Itgax、Spp1、Lgals3、Axl和Trem2。已有研究表明,在tau蛋白病小鼠模型中,神经退行性变需要小胶质细胞介导的损伤,而非直接由病理性tau诱导的神经毒性导致(61)。这些结果表明,吸入Xe影响的是小胶质细胞相关通路,而非直接影响tau诱导的神经元损伤。
为了评估吸入Xe在阿尔茨海默病病理过程中对人源小胶质细胞调节的作用,我们使用了移植有人诱导的小胶质细胞(iMG)的人源化5xFAD小鼠模型(28)。这些细胞的基因表达谱和功能特性与原代人源小胶质细胞相似(62),并且已证明在5xFAD小鼠模型中能有效减轻Aβ负担并调节淀粉样蛋白病理(63)。我们发现,即使在这些病理特征已经充分形成后,吸入Xe仍能减少Aβ斑块负荷和营养不良性神经元。此外,RNA测序分析表明,Xe抑制了与MGnD相关的基因,如Clec7a和CD9(3),同时诱导了指示IFN - γ信号传导的基因表达特征。在5x - MITRG小鼠中,与人源小胶质细胞相关的星形胶质细胞显示出IFN - γ信号传导增强,同时与GM - CSF、IL - 8、IL - 6和NF - κB激活相关的基因受到抑制。
总之,我们的研究结果表明,吸入Xe可调节小胶质细胞,并改善淀粉样变性和tau蛋白病小鼠模型中的疾病状况。针对健康志愿者的Xe治疗临床试验将于2025年初启动。
材料与方法
研究设计
本研究旨在确定吸入Xe是否可用于治疗阿尔茨海默病小鼠模型。为评估吸入Xe是否能调节脑内小胶质细胞并确定最佳Xe浓度,我们使用了一种急性神经退行性变小鼠模型。在该模型中,将荧光标记的凋亡小鼠神经元注射到未处理的C57BL/6J小鼠的皮质和海马体中,随后用浓度范围为6%至35%的Xe对小鼠进行处理。在APP/PS1小鼠中也进行了确定导致小胶质细胞调节的Xe最佳治疗剂量和时间的实验,最终确定为30%。为评估吸入Xe在恢复阿尔茨海默病小鼠模型中小胶质细胞功能方面是否具有保护性免疫调节作用,我们在吸入舱中用30%的Xe处理APP/PS1、P301S - APOE4(TE4)和5xFAD小鼠(图S1I)。我们对APP/PS1小鼠的脑髓样细胞进行了单细胞RNA测序(scRNA - seq),以了解Xe如何调节小胶质细胞及其亚型。为进一步探究Xe的作用是否依赖于小胶质细胞,我们使用PLX - 5622耗竭5xFAD小鼠的脑髓样细胞。我们利用Clec7a - CreERT2小鼠评估MGnD对阿尔茨海默病病理的重要性。此外,我们将人iMG移植到5x - MITRG小鼠中,以评估吸入Xe是否能调节人源小胶质细胞。最后,通过使用针对IFN - γ的中和抗体和转基因小鼠(Cx3Cr1 - CreERT2:Ifngr1Flox),研究IFN - γ在调节小胶质细胞对Xe处理的反应中的作用。数据收集和分析未采用盲法。使用GraphPad异常值计算器去除异常值,该计算器采用稳健回归和异常值去除检验(ROUT)。所有动物实验程序均按照哈佛医学院布里格姆妇女医院、加州大学欧文分校和华盛顿大学医学院机构动物护理与使用委员会(IACUC)批准的指南进行。
实验小鼠
C57BL/6 - J(品系编号000664)、B6 - 5xFAD(品系编号034848 - JAX)、Cx3cr1 - CreERT2(品系编号021160)、Ifngr1Flox(品系编号025394)、ROSA26 - DTRFlox(品系编号007900)、ROSA26:TdTomatoFlox(品系编号007914)、P301S - tau转基因小鼠(品系编号008169)和Csf1r(ΔFIRE/ΔFIRE)(品系编号007914)小鼠购自杰克逊实验室。APOE4(E4)小鼠通过用两侧带有loxP位点的人类对应序列替换小鼠基因组中从外显子2的翻译起始密码子到外显子4的终止密码子的序列而构建(64)。APP/PS1(16)小鼠由M. Jucker(图宾根大学)提供。5xFAD - MITRG小鼠(28, 62, 65)由M.B. - J.的实验室(加州大学欧文分校)构建并进行异种移植。Clec7a - CreERT2小鼠由O.B.的实验室培育。
吸入Xe处理
使用由General Biophysics(www.generalbiophysics.com)提供的闭路气体吸入系统进行Xe实验或空气对照吸入处理。该系统包括一个带泵的气密密封小鼠舱,可实现气体连续再循环、配备气体浓度传感器以及一个二氧化碳吸收器(图S1I)。在本研究中,我们使用了该系统的两个版本。第一个版本的气密舱体积为4升,每次处理最多可容纳6只小鼠。它配备有二氧化碳和氧气气体监测器、再循环泵以及一个二氧化碳吸收器。气体混合物在一个单独的容器中通过高压混合制备,然后输送到处理舱,以达到所需的Xe和氧气平均浓度。第二个版本更为先进,每次处理最多可容纳12只小鼠,除了具备第一个版本的功能外,还配备了专有的Xe气体浓度监测器(www.generalbiophysics.com,型号A)。这使得当气体通过流量计直接从气瓶供应到处理舱时,能够完全控制气体浓度。在两个舱中,氧气和二氧化碳浓度均持续监测。一个二氧化碳吸收器有助于将第一个舱中的二氧化碳浓度维持在百万分之600至1500(ppm)之间,平均为900 ppm,第二个舱中维持在600至900 ppm之间。纯Xe气体由General Biophysics提供,由林德气体设备公司生产。Xe气体最低纯度为99.99%。氧气购自Airgas,纯度为100%。
统计分析
所有结果均以平均值 ± 标准误(SEM)报告,所有统计分析均在Prism 9(GraphPad)中进行。使用达戈斯蒂诺 - 皮尔逊正态性检验评估数据是否符合高斯分布。在正态分布下,两组之间的统计分析采用Student's t检验。对于两组分类数据的统计分析采用Fisher精确检验。多组间比较采用单因素方差分析(ANOVA)并结合Tukey多重比较校正。相关性通过线性回归评估。P值小于0.05(P < 0.05)被认为具有统计学显著差异。ns表示P > 0.05;*P < 0.05;**P < 0.01;***P < 0.001;****P < 0.0001。每组实验使用的小鼠数量(n)可在图注中找到。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1469743.html?mobile=1
收藏

