富氢水减轻睡眠呼吸暂停模型鼠血管损伤【加拿大硕士论文】
本文是加拿大温哥华THE UNIVERSITY OF BRITISH COLUMBIA科学硕士学位论文,题目为Hydrogen-rich water reduces vascular dysfunction in a mouse model of sleep apnea。论文作者Yuxi Wei本科2020年毕业于天津医科大学。天津医科大学是国际上从事氢气医学效应研究最多的学术研究机构之一,代表人物是其附属总医院ICU科谢克亮教授,毕业于第四军医大学,也是国际上较早期开展氢气医学效应研究的学者之一。主要从事氢气在围手术期器官保护方面的基础和临床研究,发表了数十篇相关研究论文。
摘要
阻塞性睡眠呼吸暂停(OSA)是一种慢性疾病,其特点是在睡眠期间上呼吸道反复塌陷,导致慢性间歇性低氧(CIH),可能引发氧化应激和慢性炎症,进而导致心血管疾病(CVD)。虽然持续正压气道压力(CPAP)治疗是OSA治疗的金标准,但在多中心临床试验中对于减少CVD几乎没有或没有任何益处。这一点,加上对CPAP治疗的依从性低,激发了人们对开发OSA替代治疗方法的兴趣。富含氢气的水(HRW)是添加了额外氢气的水,已被证明在多种疾病以及细胞衰老中具有抗氧化和抗炎特性。我们假设HRW通过抑制氧化应激、炎症和细胞衰老,改善暴露于CIH的小鼠的血管结果。20只8周大的野生型雄性CB57BL/6小鼠随机分配接受IH或正常空气8周,并随机分配到HRW和普通水。安乐死前一天收集尿液样本。安乐死后立即收集血液样本和胸主动脉。量化内皮功能、氧化应激、炎症和衰老的标志物。暴露于IH的小鼠内皮依赖性血管舒张受损(p < 0.05)、血管收缩增加(p < 0.05)、基础NO减少(p < 0.05)、不对称二甲基精氨酸(ADMA)增加(p < 0.01)、氧化应激(p < 0.01)和炎症标志物增加,以及衰老标志物增加,这些均通过HRW治疗得到减轻。这些发现表明,HRW可能是预防和减少OSA患者CVD的潜在有希望的治疗方法。
阻塞性睡眠呼吸暂停(OSA)是一种睡眠障碍,其特征是在睡眠期间重复出现间歇性缺氧(IH),从而引发氧化应激和全身炎症。未经治疗的阻塞性睡眠呼吸暂停与各种健康问题有关,包括心脏问题、代谢紊乱和记忆巩固不良。然而,目前对OSA的治疗,特别是持续气道正压通气(CPAP),在预防和减少OSA患者的心血管疾病(CVD)方面既不方便又无效。该项目研究了富氢水(HRW),一种具有抗氧化和抗炎特性的化学成分,如何保护OSA中的CVD。我们的研究结果提示,HRW可作为IH继发的内皮功能障碍的潜在治疗方法。
第1章:简介
1.1 阻塞性睡眠呼吸暂停
睡眠对我们的身体至关重要,它关系到从身体和精神功能到新陈代谢、免疫系统发育,以及我们抵抗疾病的能力等各个方面。在北美大部分地区春季调整时钟时,一小时的睡眠损失与显著增加的机动车事故和心脏事件数量有关。迄今为止,最常见的呼吸睡眠障碍是阻塞性睡眠呼吸暂停(OSA)。在OSA患者中,由于支撑喉咙软组织(如舌头和软腭)的肌肉张力丧失,睡眠期间上呼吸道会反复塌陷,导致呼吸中断。OSA的严重程度由呼吸暂停-低通气指数(AHI)定义,即每小时睡眠中呼吸停止和部分呼吸丧失持续10秒或更长时间的事件次数。根据AHI阈值,OSA的程度大致分为三类:轻度(5-15次/小时),中度(15-30次/小时),以及重度(不少于30次/小时)1。有研究表明,仅凭AHI不足以区分OSA严重程度更高的患者。在这种情况下,夜间缺氧是一个更大的风险因素,OSA可能导致一系列临床后果,尤其是心血管疾病(CVDs)2。(图1.1)。OSA的常见体征和症状包括打鼾、呼吸暂停发作、喘息、失眠、白天嗜睡、早晨头痛、注意力难以集中和易怒。反复的睡醒和低氧血症/再氧合刺激交感神经系统、氧化应激、全身炎症、高凝状态、代谢失调和内皮功能障碍2,3。
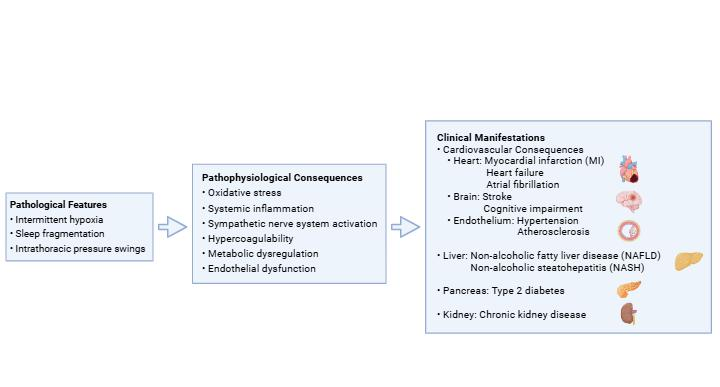
图1.1OSA与临床后果之间的联系
美国内科医师学院建议对疑似OSA的患者进行夜间多导睡眠图(PSG)诊断测试,并在无法获得PSG时,对无严重合并症的患者使用便携式睡眠监测器(PSM)作为替代方案4。与实验室内进行的PSG不同,PSG记录脑电波、血氧水平、呼吸运动以及眼睛和腿部的运动,而PSM则是无人值守的,通道较少,因此对身体的限制较少5。在一项针对儿科患者的小样本研究中,PSM获得的AHI与PSG获得的AHI有强烈的相关性6。在一项青少年初步队列研究中,尽管PSM测试倾向于低估AHI,但PSM与PSG之间的诊断一致性为80%7。尽管PSM缺乏PSG的敏感性和特异性,但由于其成本较低且对患者可能更为方便,因此越来越被使用8。
1.1.1 OSA的患病率
尽管报告的OSA患病率各不相同,但普遍认同OSA是最常见的睡眠相关呼吸障碍。北美男性和女性OSA的估计患病率分别约为15-30%和10-15%(定义为AHI > 5次/小时)9,10。采用更严格的AHI阈值(例如,AHI ≥ 5次/小时加上症状或AHI ≥ 15次/小时),OSA的估计患病率在男性和女性中都会下降,但男女比例仍保持在1.5:1。全球范围内,使用AHI阈值5和15的患者OSA患病率估计显示,约9.36亿年龄在30-69岁的人患有轻至重度OSA,另有4.25亿人患有中至重度OSA14。OSA的患病率也随种族而异,并随着年龄的增长而单调增加。35岁及以下的非洲裔美国人比同龄组的白人美国人有更高的OSA发病率15,16。韩国人的肥胖率较低,但OSA的发病率与美国相似17。Kripke及其同事报告了老年人群睡眠呼吸暂停的患病率为24%至62%18,19,20。美国和英国的研究报告显示,过去二十年OSA的患病率有所增加21,22,这可能是由于OSA检测率的提高以及患者自我认识的增强。尽管如此,北美和其他国家的未诊断人群仍然很高23。此外,肥胖率的增加扩大了可能受OSA影响的人群基础。肥胖定义为体重指数(BMI)≥ 30,在过去二十年中使OSA的估计患病率增加了14-55%24。鉴于该病的高患病率及其相关的不良健康和安全结果,加拿大OSA的社会经济损失可能每年高达数十亿加元。
1.1.2 OSA的风险因素
肥胖,尤其是中心性肥胖,是OSA最普遍的风险因素。大约40%的肥胖患者患有OSA,而约70%的OSA患者是肥胖的25,26。肥胖通过脂肪沉积在上呼吸道、胸壁和腹部直接对呼吸系统产生影响,同时也会引起全身炎症27。胸腔-腹部区域的结构性变化限制了膈肌活动和肋骨运动,这促进了呼吸系统动态的变化,降低了其顺应性,导致呼吸肌肉的机械功能障碍28。此外,肥胖和OSA之间存在双向关联。一项为期12年的前瞻性队列研究表明,体重增加10%预计会导致AHI增加约32%,而体重减少10%预计会导致AHI减少约26%29。研究还表明,相对于稳定体重,体重增加10%会使发展成中度至重度睡眠呼吸障碍(SDB)的风险增加六倍29。睡眠质量差导致的慢性疲劳会引起不活跃的生活方式,进而减少卡路里消耗并促进肥胖。激素变化是食欲增加和食物摄入量增加的基础,例如瘦素增加、脂联素减少和饥饿素水平增加,这些变化发生在OSA患者身上29,30。关于OSA患病率的性别差异在基于临床和社区的研究中经常被报道。从解剖结构上看,男性较长的气道长度和较大的软组织增加了塌陷的易感性31。此外,男性往往有更多的体脂沉积,而女性则倾向于有较低的体脂分布。据报道,夜间液体从腿部转移到颈部会导致打鼾和OSA32。有趣的是,男性显示出比女性更大的液体位移,这导致了男性气道狭窄倾向和OSA患病率更高33。此外,关于性激素在OSA中的作用的报告相互矛盾且不确定。这是因为给低睾酮男性补充睾酮会增加AHI34。一个可能的解释是,睾酮增加了对低氧和高碳酸血症的通气反应,这增强了通气不稳定性并增加了患睡眠呼吸暂停的倾向35,36。然而,患有OSA的男性与没有OSA的年龄匹配对象相比,睾酮水平较低37。肥胖加剧了OSA,并且可能在OSA中发挥了睾酮的作用。肥胖人群中睾酮水平较低,而减重与睾酮水平的改善有关38。更年期被认为是女性SDB的风险因素,其中绝经后妇女患OSA的风险比绝经前妇女高出2到3倍,这与体质指数、年龄和其他风险因素无关39。对绝经后妇女给予雌激素和孕激素治疗有助于维持上呼吸道的稳定性40。然而,在妊娠期间,睡眠呼吸暂停的严重程度会增加,这种情况的特点是雌激素和孕激素水平升高41。激素与OSA之间的联系需要进一步研究。OSA的其他风险因素包括年龄增加42、上呼吸道和颅面异常43、家族史/遗传44,45、吸烟46以及使用酒精或镇静剂和肌肉松弛剂47。
1.1.3 心血管疾病与阻塞性睡眠呼吸暂停(OSA)
OSA与心血管疾病(CVD)相关,包括高血压、中风、心力衰竭、冠状动脉疾病、心房颤动等。OSA患者不仅患CVD的风险增加,而且预后更差。多项研究表明,CVD和OSA之间存在独立关系。在一项为期10年的随访研究中,对1300名确诊为OSA的患者进行了致命性(因心肌梗死或中风死亡)和非致命性(心肌梗死、中风、冠状动脉旁路手术和经皮冠状动脉介入治疗)心血管事件的跟踪调查。未治疗的重度OSA患者在控制混杂因素后,致命事件(OR = 2.87)和非致命事件(OR = 3.17)的风险均增加。轻至中度OSA患者发生事件的风险没有显著增加。在另一项队列研究中,怀疑患有OSA的受试者被推荐进行PSG测试,并通过健康行政数据获取心血管事件的发生情况。在平均68个月的随访期内,10,149名受试者中有1172人发生了心血管事件。在完全调整模型中,除了AHI外,其他与OSA相关的变量也是CV事件的显著独立预测因子,包括氧饱和度<90%的时间(9分钟对比0;HR=1.50)、睡眠时间(4.9小时对比6.4小时;HR=1.20)、觉醒次数(35次对比18次;HR=1.06)、周期性腿部运动(每小时13次对比0次;HR=1.05)、心率(每分钟70次对比56次;HR=1.28)以及白天嗜睡(HR=1.13)。
1.1.4 OSA的动物模型
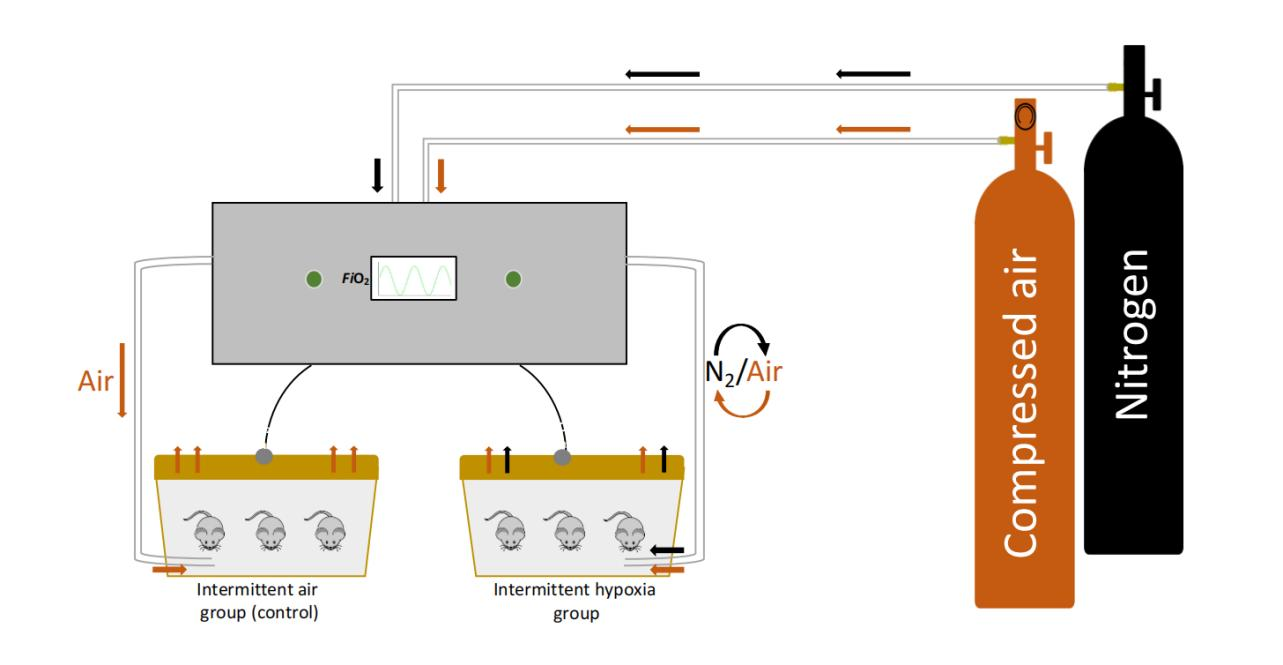
OSA患者通常伴有肥胖、糖尿病和高血压等共病,这些共病可能影响因果关系的研究。创建OSA动物模型可以最小化这些共病和行为变量的影响。最常用的OSA动物模型是基于间歇性低氧(IH)。Tagaito等人首次描述了一种代表OSA期间极端生理变化的小鼠模型。在这个模型中,小鼠被安置在定制的笼子里,笼子底部均匀分布有端口,允许气体从四个方向进入,达到垫料层的水平。一个气体控制系统调节房间空气、氮气和氧气流入定制笼子中的流量,从而根据IH剖面控制每个笼子内的吸入氧气分数(FiO2)水平(图1.2)。
图1.2: 小鼠间歇性低氧模型
1.2 OSA作为CVD的潜在风险因素
1.2.1 CVD的病理生理触发因素
间歇性缺氧、反复觉醒和胸腔内压力波动是OSA的主要特征。它们同时发生并且密切相关,因此对OSA相关CVD的发病机制起到了推动作用。以下部分将回顾这些在OSA中触发CVD的病理生理变化。
1.2.1.1 间歇性缺氧
间歇性缺氧(IH)是OSA的一个标志性特征,被认为是一把“双刃剑”。短时间暴露于轻度IH可引起适应性反应,从而具有心脏保护作用53,54。然而,频繁的短时间IH循环以及中度和重度OSA患者的长期暴露会导致血管后果,范围从血管功能障碍(动脉粥样硬化变化的早期迹象)到已形成的斑块形成。在一项细胞培养研究中,观察到IH导致内皮屏障功能受损,而暴露在常氧下的对照细胞则未出现此现象55。其他发现还包括IH引起的血管功能变化,包括内皮依赖性舒张受损和血管收缩增加,这些都早于动脉粥样硬化过程56,57,58。暴露于IH两周后,C57Bl/6小鼠主动脉出现了结构性血管重塑,表现为内膜-中层厚度增加59。
然而,只有在高胆固醇饮食的情况下,C57Bl/6小鼠暴露12周后才会发生确定的动脉粥样硬化,这表明其他风险因素加剧了IH诱导的动脉粥样硬化过程60。这些发现在ApoE基因敲除小鼠中得到了重复验证,其中IH加速了动脉粥样硬化的进程,而高胆固醇饮食进一步加重了这一过程61,62。IH对心血管系统的有害影响也扩展到心脏,其中IH增加了大鼠心肌梗死和缺血性心律失常的易感性63,64,65。除了急性后果外,IH还会导致心脏重构,表现为双心室肥厚、心脏纤维化和每搏输出量减少,从而揭示了OSA中心力衰竭发展的机制66,67,68,69,70。
1.2.1.2 反复睡醒
反复醒导致睡眠碎片化和白天嗜睡,是OSA的另一个特征。尽管醒的发生取决于不同个体的独特醒阈值,但它们通常由中断的呼吸和随之而来的缺氧、高碳酸血症以及重新建立呼吸所需的增加呼吸努力引起。醒与血压急剧上升有关,可高达80 mm Hg 71,72。然而,血压波动与系统性动脉高血压之间的关系仍有争议。在睡眠期间反复上呼吸道关闭的狗模型中发生了高血压,但在暴露于声刺激引起的反复醒的动物中未见此现象73。与狗研究一致的是,声刺激也没有在大鼠中引发血压升高74。Launois等人证实只有呼吸醒会导致血压升高75。因此,反复醒可能在OSA诱导的CVD的病理生理学中起叠加作用,但需要进一步研究以探索详细的作用。
1.2.1.3 胸腔内压力波动
在呼吸暂停期间,由于强迫吸气对抗阻塞的气道,产生了巨大的负胸腔内压力。这种压力变化的一部分通过心脏壁传递,降低了右心房压力,从而促进静脉回流增加和右心室负荷过重。
低心脏内压力还导致左心室后负荷增加,如通过收缩和舒张功能受损以及左心房慢性拉伸所表现的那样76,77,78。Orban等人评估了健康年轻人在Müller动作后的心脏结构和功能,该动作密切模拟了OSA中的胸腔内压力变化,并报告说负胸腔内压力导致了左心室后负荷增加,表现为收缩末期尺寸增加和射血分数降低79。此外,心房扩张引起了电生理改变,随后出现房性早搏和心房颤动80,81。值得注意的是,抗心律失常药物如索他洛尔和胺碘酮对胸腔内压力波动引起的心律失常电生理变化无效82,83。
1.2.2 OSA中CVD的机制
1.2.2.1 交感神经系统激活
三十余年前首次观察到严重OSA患者尿液中的儿茶酚胺水平升高,且这些变化在气管切开术后减少84。随后进一步研究确认了OSA患者和IH大鼠中儿茶酚胺水平的升高85,86,87,88。为了更好地理解OSA中的交感神经系统活动,发现与心力衰竭对照组89或肥胖对照组90相比,OSA患者的肌肉交感神经活动(MSNA)增加。血压升高伴随着儿茶酚胺水平91,92和MSNA的增加93。药理学和外科阻断交感神经系统消除了暴露于IH的大鼠的血压升高94,95。CPAP治疗也显示出降低儿茶酚胺水平96,97和MSNA的好处98。通过包括AHI范围广泛的受试者队列,Taylor等人确定醒指数是白天MSNA爆发发生率的最强预测因子,独立于呼吸暂停的频率或其严重程度99。
1.2.2.2 炎症
炎症参与了动脉粥样硬化的所有阶段100,并且在OSA中的CVD发病机制中也起着核心作用,因为IH是一种强效的炎症刺激物。在C57Bl/6和ApoE基因敲除小鼠中观察到响应IH的动脉粥样硬化变化,伴随白细胞滚动数量增加、炎性细胞渗透到血管壁以及促炎性细胞因子、趋化因子和粘附分子表达增加101,102。几项细胞培养和动物研究表明,核因子-κB(NF-κB)是炎症反应的主要转录调节因子,其激活是IH诱导的炎症的核心103,104,105。NF-κB的激活也是内皮功能障碍的OSA患者中内皮细胞的特征106。常氧恢复逆转了与动脉粥样硬化早期阶段相关的全身和血管炎症,表明它可能是一个潜在的治疗靶点107。CPAP治疗降低了OSA患者中NF-κB水平以及NF-κB激活的循环下游产物水平,这支持了NF-κB在OSA相关炎症中的关键作用以及常氧恢复的潜力108,109,110,111。
1.2.2.3 氧化应激
活性氧物种(ROS)是分子氧的反应性中间体,可以在生理条件下作为重要的第二信使调节各种细胞功能和生物过程112,113,114,115。然而,当ROS超过抗氧化防御系统的缓冲能力或抗氧化酶存在缺陷时,就会发生氧化应激,导致后续的细胞损伤116,117。大量的细胞培养和动物研究表明,氧化应激参与了内皮功能障碍的发病机制,主要是通过破坏介导血管炎症的血管保护性一氧化氮(NO)轴118。内皮功能障碍是动脉硬化发病机制的第一步,导致各种心血管并发症119。
普遍认为缺血再灌注通过产生ROS引起细胞损伤120。重复的缺氧发作随后再氧合类似于再灌注损伤,可能解释了氧化应激在OSA中的贡献。间歇性缺氧引起的ROS激增和脂质过氧化已在几个动物研究中报道,并且这些过程对CVD的贡献已被提出121,122,123,124。CPAP治疗对氧化应激的影响尚不确定,几项RCT未显示益处125,126,127。治疗时间相对较短在8周以内,加上对CPAP的依从性差可能是限制因素。抗氧化治疗是OSA中的一种新兴治疗选择,一些研究已经显示出对氧化应激有希望的结果。例如,α-硫辛酸有效地改善了暴露于间歇性缺氧的小鼠的内皮功能和全身氧化应激及炎症128。然而,需要大样本量的RCT来验证抗氧化剂的益处129。
CPAP治疗与心血管疾病
连续正压气道(CPAP)是治疗阻塞性睡眠呼吸暂停(OSA)的金标准,它通过一台机器提供持续的空气流,防止睡眠期间气道塌陷。CPAP可以减少呼吸中断并改善整体睡眠质量。使用CPAP可以逆转白天嗜睡和夜间症状,改善认知障碍,并预防OSA患者的机动车事故。观察性研究还表明,CPAP对心血管代谢结果有积极影响,如降低血压、减少致命和非致命心血管事件的风险、改善胰岛素敏感性和血脂异常;然而,CPAP的长期益处仍然不确定。
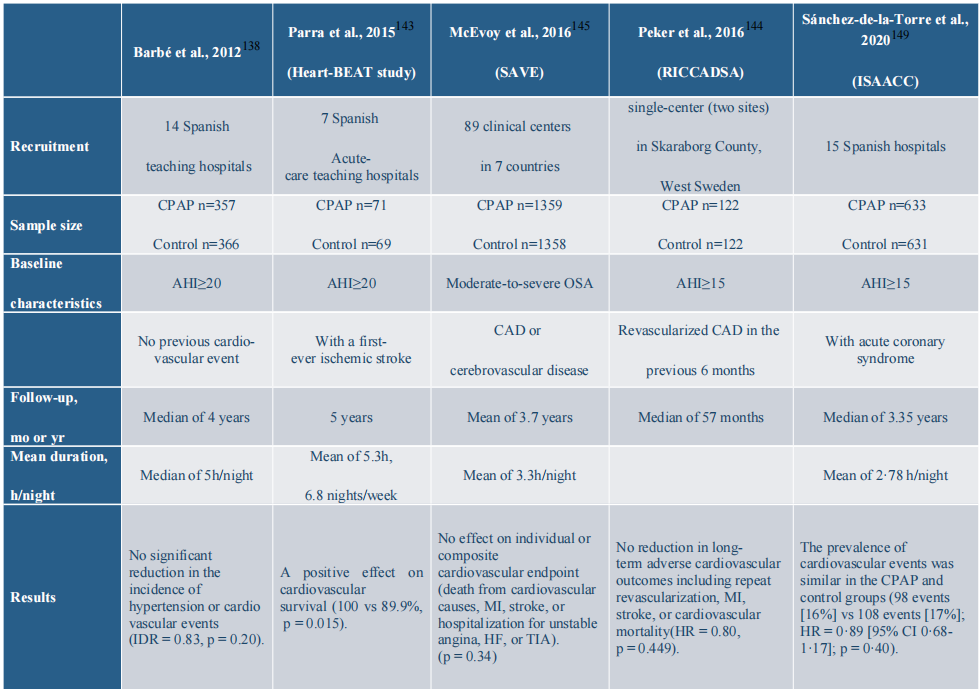
降低血压是一级心血管预防的关键因素。一项小型试验报告称,CPAP在患有前期高血压或隐匿性高血压的患者中降低了高血压。然而,在西班牙14家教学医院的大型多中心试验中,招募了723名患者,发现CPAP与常规护理相比,在意向治疗分析中并未显著降低高血压或心血管事件的发生率。按CPAP依从性分层的分析表明,每晚使用CPAP不少于4小时的患者比平均依从性少于4小时/晚的患者高血压或心血管事件的发生率明显较低(p = 0.04)。
就二级心血管预防而言,未治疗的中度至重度OSA患者在已确诊的冠状动脉疾病或心力衰竭患者中与增加的心血管发病率和死亡率相关。在Heart-BEAT研究(心脏生物标志物评估在呼吸暂停治疗中)中,与常规护理相比,CPAP显著降低了心血管疾病或多重心血管风险因素患者的血压。值得注意的是,研究中CPAP的平均使用时长为每周6.8晚5.3小时。在RICCADSA(随机干预冠状动脉疾病和OSA中的持续正压气道)研究中,与对照组相比,在中位随访57个月内,CPAP组在首次事件再血管化、心肌梗死、卒中和心血管死亡率方面没有显著差异。在多中心SAVE试验(睡眠呼吸暂停心血管终点)中,CPAP未能预防已确诊的冠心病或脑血管疾病及中度至重度OSA患者的主要终点事件(任何心血管原因导致的死亡、心肌梗死、卒中或急性冠状动脉综合征、心力衰竭或短暂性脑缺血发作的住院),平均随访3.7年(p = 0.34)。
在一项评估充分CPAP治疗(定义为每晚至少4小时)对主要不良脑血管和心血管事件(MACCEs)影响的荟萃分析中,Javaheri等人报道,充分使用CPAP与MACCEs的临床意义和统计学显著改善相关。然而,在分层分析中,充分的CPAP似乎仅对脑血管后果有显著的积极影响,而对心脏结果没有影响。一方面,脑血管床暴露于OSA相关的收缩压和舒张压的起伏,而心肌血流仅发生在舒张期,保护心脏免受收缩压的巨大波动。在冠状动脉疾病存在的情况下,发展了保护性侧支血管,由于冠状动脉循环仅在舒张期发生,因此心脏风险而非脑风险降低。另一方面,这也可能表明CPAP的心脏保护效应需要在整个睡眠期间超过4小时的治疗。实际上,由于副作用如鼻塞、口干、皮肤刺激、腹胀和打嗝等,OSA患者对CPAP的依从性较差。因此,除了CPAP之外的其他干预措施是非常需要的。
表1.1:大规模随机对照试验的CPAP
1.4 OSA与衰老
细胞衰老是由于氧化应激导致的正常细胞分裂停止,进而产生过量的活性氧(ROS),随后引发DNA损伤和促炎反应。细胞衰老很可能是OSA患者发展年龄相关疾病的主要原因。
端粒是染色体末端由重复的5′-TTAGGG-3′序列组成的区域。这些重复序列的主要功能是保护染色体末端附近的基因免受不完全DNA复制引起的降解。每次细胞分裂都会导致端粒缩短,经过多次分裂后,端粒减少会作为DNA损伤被检测到,并导致细胞周期停滞。
端粒缩短在各种研究中被用作衰老的标志。Barceló等人首次报告了OSA患者(n=256)与健康患者(n=148)之间的端粒长度(TL)差异,并对年龄和心血管风险因素进行了调整。类似的结果也在其他研究中被报道。一项较新的研究显示,经年龄校正后,端粒长度(TL)与OSA的严重程度(通过AHI和氧减饱和指数ODI检测)之间存在相关性。此外,与低和中等ODI组相比,高ODI水平的患者的端粒更短。尽管该研究仅包括男性(n=161),这是其局限性之一,但结果表明OSA的严重程度对TL有影响。
在OSA中,端粒缩短至少有三种可能的机制:氧化应激、炎症和缺氧。间歇性缺氧是OSA患者中ROS的主要来源之一。许多研究已经证明,氧化应激与细胞培养、动物模型和人类组织中的端粒缩短有关,而只有一项研究揭示了氧化应激与OSA患者端粒缩短之间的关联。Kim等人首次为氧化应激作为OSA患者端粒缩短的机制之一提供了基础。他们发现,OSA患者(n=43)的血浆过氧化氢水平高于对照组(n=34)。端粒对鸟嘌呤氧化敏感,由于ROS暴露导致的染色体末端8-氧代鸟嘌呤积累会引起DNA骨架的单链断裂。一方面,DNA骨架中的氧化损伤可能会抑制端粒酶的活性;另一方面,以8-氧代鸟嘌呤结尾的寡核苷酸(5′-TTA-8oxoG-3′)不能被端粒酶延长。尿中的8-OHdG是氧化应激诱导的DNA损伤的标志物,在OSA患者中增加,这支持了这一假设。
不平衡的氧化稳态引起的ROS增加会导致OSA患者的DNA损伤和脂质过氧化。氧化低密度脂蛋白结合到白细胞表面的CD36上,导致Iκβ激酶(IKK)的激活,然后磷酸化抑制因子κβ(Iκβ),导致其失活并与核因子-κβ(NF-κβ)解离。NF-κβ随后转移到细胞核并作为转录因子,靶向与衰老相关的分泌表型(SASP)元素。这些元素作为一个正反馈循环,进一步导致慢性炎症中的ROS过量产生。DNA损伤对NF-κβ的激活有类似的作用,但使用其他途径(图1.3)。
间歇性缺氧除了通过氧化应激和炎症引起的效应外,还直接影响端粒。缺氧诱导因子1(HIF-1)介导缺氧相关反应,它由两个亚基组成,其中亚基α在缺氧时稳定,在常氧时降解。OSA患者中HIF-1的表达增加。虽然没有来自OSA患者的证据,但癌症和细胞培养的研究发现,HIF-1活性增加增强了端粒酶逆转录酶(TERT,端粒酶的催化单元)的表达,从而导致端粒酶水平提高和端粒稳定性增强。然而,大多数OSA研究报告了端粒缩短。一个可能的解释是,间歇性缺氧产生大量的ROS,导致DNA损伤并扰乱端粒的T环结构。端粒构象的改变阻止了端粒酶的结合和端粒的再生。相比之下,儿童OSA患者报告了端粒延长。这可能是因为在儿童中,DNA损伤不如成人那么严重,使得端粒酶能够结合并再生端粒。
根据美国衰老研究联合会(AFAR)的定义,真正的衰老生物标志物是“以一种与年龄相关的方式预测一个人的生理、认知和身体功能,必须是可测试的且对受试者无害,并且应该在实验室动物和人类中同样有效”。
衰老生物标志物的候选物包括炎症标志物如CRP、IL-6和TNF-α,端粒长度以及DNA甲基化。白细胞端粒长度(LTL)随年龄增长而减少,并且已知会因加速衰老的活动(如吸烟)而缩短。然而,端粒长度的测量具有挑战性,并且在一生中的动态范围小于40%,出生时个体间存在显著变异。端粒长度可用于估计遗传性端粒短的患者的年龄,但并不能准确预测一般人群中的生物学年龄。与衰老相关的细胞因子如IL-6的表达随着衰老增加,并与年龄相关的发病率和死亡率有关。
与衰老相关的细胞因子
受炎症影响,急性感染和其他炎症状况的患者中观察到高表达水平。DNA甲基化最近也被认定为生物学衰老的标志。然而,所有DNA甲基化研究都旨在预测不同的终点,例如生物学年龄或死亡率,但尚未显示出临床实用性。
尽管自从Leonard Hayflick首次描述衰老现象以来,在过去50年中积累了大量的知识,但涉及衰老的分子途径尚未完全阐明。两个主要表征细胞衰老性质的途径是p16-pRB和p53-p21。这些途径主要调节周期依赖性激酶CDK4/6和CDK2,进而控制细胞周期并涉及细胞增殖依赖的生理过程,如发育、组织再生、衰老、细胞衰老和癌症。P16是CDK4/6的特异性抑制剂,通过阻止细胞从G1期过渡到S期来防止随后的增殖停滞,主要通过保持视网膜母细胞瘤蛋白(pRB)处于低磷酸化状态。在G1期开始时,CDK4/6-Cyclin D单磷酸化结合E2F转录因子的pRB。之后,当细胞通过限制点后,CDK2-细胞周期蛋白E过度磷酸化pRB,使pRB从E2F因子解离,从而激活S期。P16的表达符合AFAR验证的衰老生物标志物标准。它是一种周期依赖性激酶抑制剂,作用于CDK4/6激酶以防止视网膜母细胞瘤(Rb)家族蛋白的磷酸化,并导致G1细胞周期停滞,从而导致衰老。Ned Sharpless在北卡罗来纳大学进行的早期工作大部分涉及P16,这导致了基于p16的动物衰老模型的建立。与端粒相比,p16表达具有较大的动态范围,并且在迄今为止测试的所有哺乳动物物种中随年龄指数级增加。Hyman等人研究了536名患者的实际年龄与p16表达的关系,结果显示p16表达随着年龄的增加而显著增加数个对数倍,并且相似年龄的患者之间p16表达存在广泛变异。大量来自无偏倚的全基因组关联研究的数据表明,p16是人类衰老和与年龄相关疾病的关键决定因素。最近的一项研究还显示,活检肌肉内脂肪中的p16表达与肌肉力量减弱和行走能力下降独立相关,并且正在进行一些关于抗衰老疗法的小型探索性研究。尽管某些细胞类型主要依赖p16来诱导衰老,但在某些动物模型中,通过抑制p53和/或其上游调节因子ARF可以防止衰老。作为p53的目标基因的P21通常被认为是建立衰老的关键,而p16则更多地被认为涉及维持衰老表型。
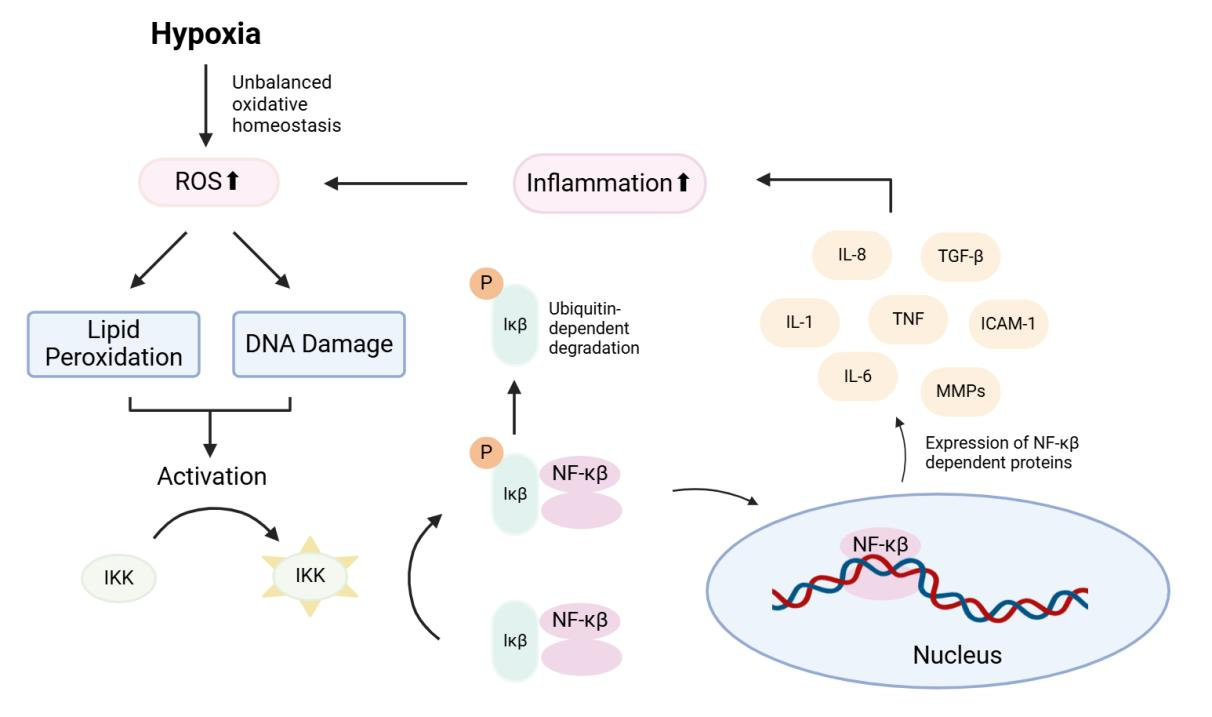
图1.3:OSA中的氧化应激、炎症和端粒缩短
OSA中端粒缩短的分子途径。间歇性缺氧产生大量ROS并发展成氧化应激。ROS损害许多细胞成分,如脂质和DNA,激活NF-κβ复合物。NF-κβ转移到细胞核内,作为转录因子调节SASP的表达。氧化性DNA损伤也通过干扰DNA结构直接导致端粒缩短。ROS:活性氧物种;IKK:Iκβ激酶;NF-κβ:核因子κβ;Iκβ:抑制性κβ;ICAM-1:细胞间粘附分子1;IL-1:白细胞介素1;IL-6:白细胞介素6;IL-8:白细胞介素8;MMPs:金属蛋白酶;TNF:肿瘤坏死因子;TGF-β:转化生长因子β1;SASP—衰老相关的分泌表型。
图1.4 细胞衰老的两条主要路径
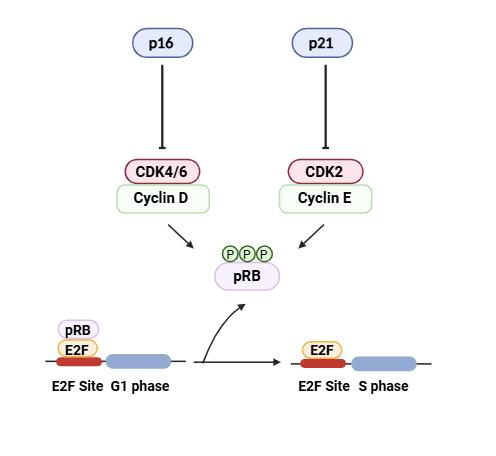
在p16-pRB通路中,p16抑制CDK4/6–Cyclin D复合物的形成并诱导后续的pRB低磷酸化。P21通过抑制CDK2–Cyclin E复合物与p16类似地工作,因此抑制了pRB的磷酸化。去磷酸化的pRB结合在E2F位点上的E2F转录因子,并阻止G1–S期过渡,阻断细胞周期。在没有p16和p21的情况下,高度磷酸化的pRB从E2F转录因子上脱离,从而激活S期,促进细胞周期进程。
1.5 氢分子
在证明了一氧化氮作为心血管系统中的信号分子的生物活性之后,利用内源性形成的低分子量气体化合物作为调节剂的前景开始显现。与此同时,提出了使用化学上不活跃但在标准条件下对细胞和组织具有调节作用的惰性气体的生物性质的想法224,225,226。这些想法为创新治疗技术的基础奠定,仍有待探索。
氢分子具有几个独特的特性,在医学气体疗法中占据独特地位。氢气由最轻的化学元素组成,分子量为2,远低于其他抗氧化剂(图1.5)。由于其体积小且分子量极小,氢分子能够穿透任何生物屏障227,228,229。与其他补充剂和抗氧化剂不同,氢分子不需要特定的转运体进入细胞并发挥其效果,这是由于其更小的分子量。氢分子的高生物利用度满足了任何药理活性剂产生生物效应的首要要求。
氢分子的治疗效果最初由Dole等人于1975年在一个皮肤鳞状细胞癌小鼠模型中报告230。2001年,氢分子的抗炎特性被提出并作为治疗肝脏寄生虫感染引起的肝炎的治疗方法得到证实231,不久之后,Ohsawa及其同事在2007年发现氢分子的抗氧化特性,他们报告说H2通过选择性中和羟基自由基(•OH)和过氧亚硝酸盐(ONOO-)来保护大脑免受I/R损伤和中风232。过去十年间,H2生物医学的知识体系一直在积极更新:截至2022年底,大约有100项随机对照试验和超过2000篇文章发表,涉及心脏233,234、神经学235,236、放射防护237,238以及肿瘤学效果239,240,241等领域。
氢分子选择性地清除羟基自由基(•OH)和过氧亚硝酸盐(ONOO-) 230,这些是强大的氧化剂,它们与核酸、脂质和蛋白质非特异性反应,导致DNA断裂、脂质过氧化和蛋白质失活。更重要的是,除了羟基自由基之外的ROS不会被氢去除,因为过氧化氢和超氧化物阴离子在体内具有正常的生理功能。值得一提的是,由于氢分子体积小,使其具有高度渗透性并能穿越任何生物屏障,因此中和自由基可以在细胞外空间以及包括血浆和线粒体膜在内的任何细胞隔室中进行242,243。氢分子的抗氧化特性已在调节人类疾病和啮齿动物模型中的氧化应激生物标志物如丙二醛(MDA)、8-羟基-2'-脱氧鸟苷(8-OHdG)、8-异前列腺素F2α和硫代巴比妥酸反应物质方面得到证明244,245,246,247,248。
氢气在体内短暂停留,然而即使氢气从体内移除后,其生物效应仍然持续存在249,这表明除了直接清除ROS之外,还存在其他机制250,251。氢气还可以通过刺激抗氧化酶来发挥抗氧化作用。2001年,Gharib等人展示了吸入氢气增强了超氧化物歧化酶(SOD)的催化特性252。氢气对过氧化氢酶、血红素氧合酶-1、髓过氧化物酶和谷胱甘肽活性的刺激作用也被注意到253,254,255。这种调控效应是由于Nrf2通路的诱导256,257,258。
流行病学证据表明高抗氧化水平与各种疾病的低风险相关联。由于仅靠饮食可能无法达到最佳抗氧化剂量,特别是在高风险人群中,通常会服用补充剂。然而,高剂量的抗氧化剂带来风险和危害。维生素E在减少细胞膜和血浆脂蛋白的脂质过氧化方面显示出益处,而高剂量维生素E(每天超过400 IU)往往会增加全因死亡率259。维生素E还与抗凝药物如华法林相互作用,从而增加出血风险260。高浓度的抗坏血酸由于与铁的氧化还原相互作用而加剧肝缺血再灌注损伤261。高剂量的β-胡萝卜素增加了吸烟者患肺癌的风险262。与其他抗氧化剂相比,即使在极高浓度下使用,氢分子也不会造成伤害。每天摄入5.5毫摩尔氢气6个月可以改善代谢综合征患者的血糖水平、血脂水平和炎症生物标志物,且没有副作用报告263。与作为膳食补充剂的抗坏血酸、维生素E和β-胡萝卜素不同,氢气是在大肠发酵过程中产生的264。饮食干预和锻炼都可以增加细菌产生的H2,从而提高呼出的氢气排放量265,266,267。内源性H2的增加也与更好的心血管代谢健康和积极的代谢适应(例如身体成分和VO2max)相关263,268。
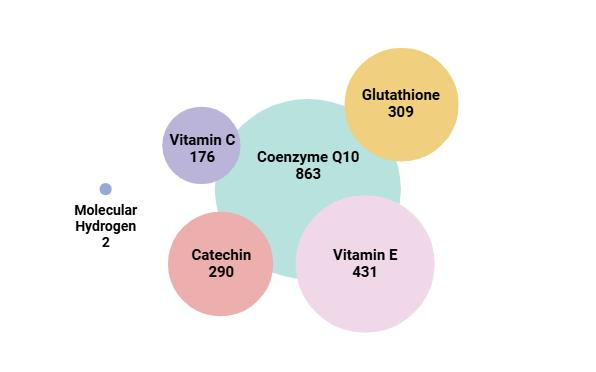
图1.5:氢气与其他抗氧化剂分子量的比较
1.6 研究理由与目标
流行病学和临床研究表明阻塞性睡眠呼吸暂停(OSA)患者患冠状动脉心脏病、心力衰竭和中风的风险增加。然而,解释OSA与心血管疾病之间关联的潜在机制尚未完全阐明。作为OSA的金标准治疗方法,持续气道正压通气(CPAP)治疗在降低心血管疾病发生率方面并未显示出任何益处,这可能是由于CPAP治疗依从性差。这种对CPAP的低依从性促使人们探索OSA的其他治疗策略。我们假设用氢分子治疗暴露于慢性间歇性缺氧(CIH)的小鼠可以通过减轻氧化应激、炎症和加速衰老来改善血管功能。我们通过对暴露于CIH的雄性C57Bl/6小鼠进行为期8周的HRW治疗来测试我们的假设,之后我们测量了内皮依赖性血管舒张、血管收缩、基础NO、氧化应激和炎症标志物、抗氧化剂和促炎细胞因子的基因表达,以及衰老标志物。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1457749.html?mobile=1
收藏

