博文
氢气疗法和阿尔茨海默病
|
阿尔茨海默病(AD)是一种进行性神经退行性疾病,主要影响老年人。虽然常规药物治疗仍然是 AD 的主要治疗方法,但其疗效有限,并且通常伴有显着的副作用。这凸显了探索替代性非药物干预措施的迫切需要。氧化应激已被确定为 AD 病理学的核心参与者,影响各个方面,包括淀粉样蛋白-β 代谢、tau 磷酸化、自噬、神经炎症、线粒体功能障碍和突触功能障碍。在新兴的非药物方法中,氢气疗法因其在缓解这些病理状况方面的潜力而受到关注。本综述全面概述了氢气在AD中的治疗潜力。我们深入研究了氢疗法的作用机制、给药途径,并讨论了当前的挑战和未来的前景,旨在为促进氢疗法在AD管理中的临床应用提供有价值的见解。
He J, Liu F, Xu T, Ma J, Yu H, Zhao J, Xie Y, Luo L, Yang Q, Lou T, He L, Sun D. The role of hydrogen therapy in Alzheimer's disease management: Insights into mechanisms, administration routes, and future challenges. Biomed Pharmacother. 2023 Oct 30;168:115807.
温州大学浙江省生命科学与生物医药协同创新中心研究院等5家单位的12名作者,共同撰写了这一篇综述文章,系统介绍了氢气在阿尔茨海默病治疗中的研究进展。
一、前言
全球人口老龄化趋势加剧了老年人面临的健康挑战,其中神经退行性疾病,尤其是阿尔茨海默病(AD),成为首要关注的问题。目前,全球约有5500万人受到AD的影响,而且这个数字还在令人担忧地上升。世界卫生组织报告称,每三秒钟就有一个新的AD病例被诊断出来,预测到2030年,受影响的人口将超过7800万,到2050年可能会增加两倍。AD病这种不断上升的流行突显了AD作为一个迫在眉睫的公共卫生危机,增加了社区和家庭的社会经济负担。
AD的治疗主要包括药物治疗和非药物治疗。传统的药物治疗主要涉及乙酰胆碱酯酶抑制剂(AChEIs)和N-甲基-D-天冬氨酸(NMDA)受体拮抗剂,已有研究证明有效。然而,这些药物效果有限,并且相当一部分患者会出现不良反应,近三分之一的患者对AChEIs不耐受。这些治疗限制促使研究转向非药物治疗,旨在减慢疾病进展并保留认知功能。
已经建立了淀粉样β(Aβ)肽和氧化应激之间的关键联系,其中Aβ肽诱导氧化应激,导致线粒体功能障碍和活性氧(ROS)产生激增。反过来,氧化应激下产生的氧化剂和氧化产物可以增加淀粉样前体蛋白(APP)的表达,导致Aβ的积累,并且循环会加剧病情。虽然抗氧化剂已被提出作为对抗氧化损伤的潜在治疗剂,但它们的临床疗效一直不一致。值得注意的是,一些抗氧化剂补充剂在预防癌症、心肌梗死和动脉硬化等疾病方面作用有限,甚至在某些情况下提高死亡率。因此,在开发有效抗氧化剂以预防与氧化应激相关疾病过程中,了解其副作用非常重要。在这种情况下,理想的抗氧化剂分子预计可在不破坏氧化还原平衡的情况下缓解过度氧化应激。换句话说,理想的抗氧化分子不应该降低信号分子如过氧化氢的水平,而应该有效地减少·OH和其他强毒性氧化剂。根据现有实验和上述要求,人们得出的结论是,氢气可能是最理想的抗氧化剂。
与传统抗氧化剂相比,氢气疗法是一种有前景的非药物治疗方法,已在疾病预防和治疗中显示出理想抗氧化剂的潜力。通过选择性地减少ROS中最有毒性的羟自由基,氢气可有效地保护细胞减少氧化损伤。吸入氢气显著抑制氧化应激对脑损伤的影响,因此氢气可用作有效抗氧化治疗。由于氢气出色的扩散能力,能快速穿过细胞膜,能够到达目标部位与细胞毒性ROS反应,保护细胞免受氧化损伤。考虑到氢气可分散脂溶性特性,可使用各种方式进行氢气治疗。吸入低浓度氢气可以保护脊髓、心脏、肝脏、肺部和肠道免受缺血再灌注损伤,喝富氢水可缓解关节炎症状。氢盐水注射在急性胰腺炎、失血性休克和急性听力损失模型中钧显示出良好疗效。在大鼠模型中,发现含氢气腹膜透析液可有效预防腹膜透析相关的腹膜纤维化。
在本综述中,我们深入研究了氢气作为天然抗氧化剂的作用,阐明了其在针对AD相关途径中的多面机制。我们旨在提供关于氢基治疗策略用于AD的全面概述,探讨其作用机制、给药途径,并强调当前的挑战和未来前景。我们的总体目标是提供有价值的见解,促进氢基干预措施在AD方面的临床转化(图1)。
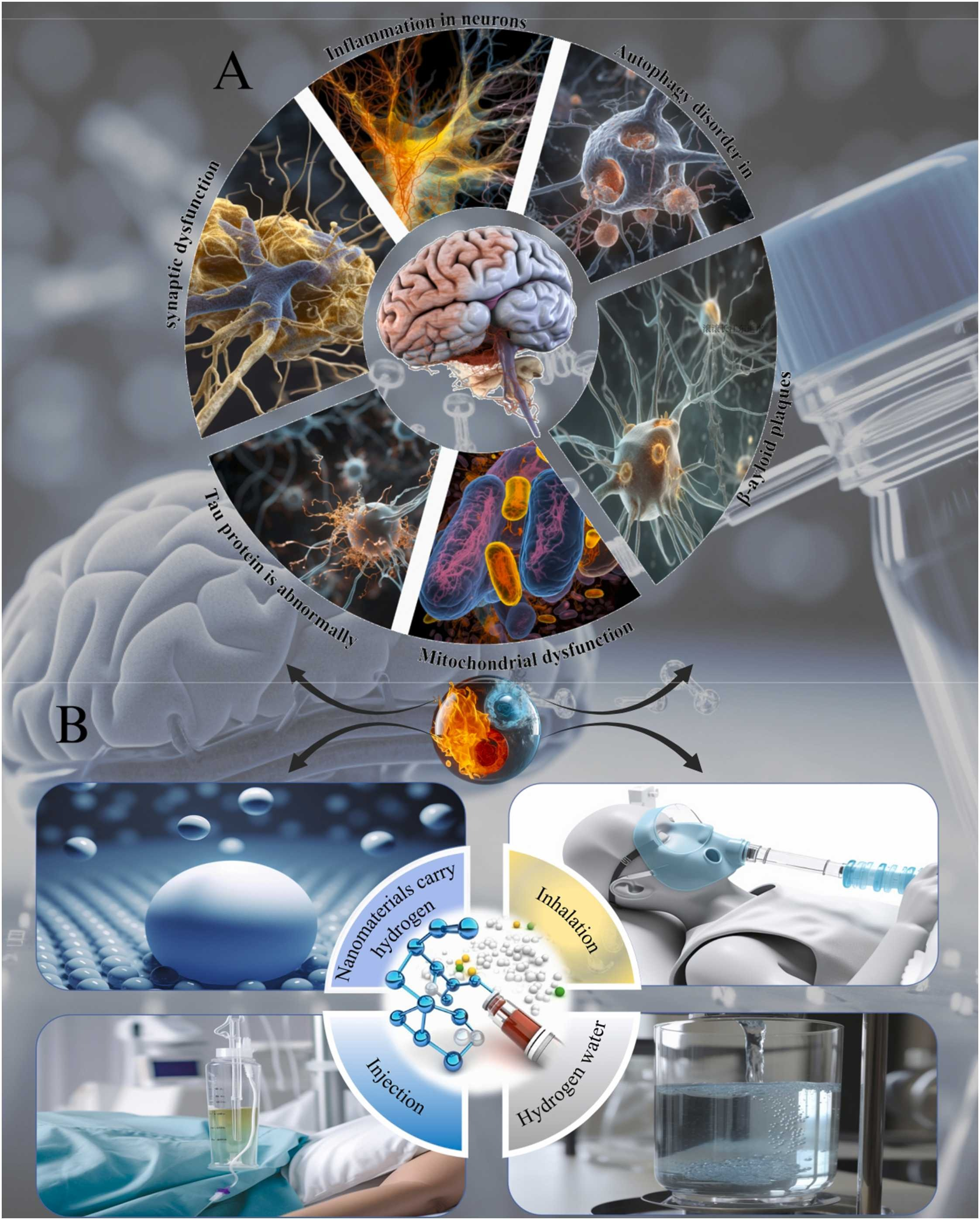
图1 氢气在减轻AD病理方面的治疗潜力。(A)阿尔茨海默病的主要病理特征:神经元炎症、自噬功能障碍、β-淀粉样斑块积累、线粒体功能障碍、tau蛋白异常和突触损伤;(B)氢治疗的多种给药途径:吸入、摄入富氢水、直接注射氢盐水和使用纳米材料靶向给药。
二、氧化应激在AD的进展中起着关键作用。
氧化应激是指自由基产生和身体对抗其有害影响的能力之间的不平衡,已被确定为AD发病的重要贡献因素。在AD小鼠模型和人类AD组织中都发现了氧化应激水平的升高,表明自由基生成与斑块形成之间存在强烈的关联。这种氧化环境被认为是在AD病理学之前出现的,影响Aβ沉积、神经原纤维缠结(NFTs)形成、血管异常和认知功能下降。值得注意的是,即使在老年斑和NFTs出现之前,已经在三重转基因AD小鼠模型中观察到了谷胱甘肽和维生素E等抗氧化剂的显著减少,同时伴随着脂质过氧化的增加。此外,氧化应激还被认为会加剧神经元中的tau过度磷酸化,特定的氨基酸如甲硫氨酸增强了Aβ序列中的氧化活性[28]。随着大脑的老化,由于其高氧消耗和有限的抗氧化防御能力,大脑尤其容易受到氧化应激的影响。当ROS的积累超过身体的抗氧化防御时,它可以对细胞大分子造成损害,破坏细胞功能,诱导线粒体释放促凋亡蛋白质,并最终导致中枢神经系统中的神经细胞凋亡。
2.1. 神经炎症
神经炎症是AD的标志之一,其特征是大脑中胶质细胞(主要是星形胶质细胞和小胶质细胞)的慢性激活[31]。在生理条件下,小胶质细胞处于静止状态,在维持大脑稳态方面发挥重要作用。然而,在AD环境中,Aβ和ROS等刺激物激活小胶质细胞,导致包括白细胞介素-1α(IL-1α)、白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)在内的促炎性细胞因子的释放。这种小胶质细胞的激活进一步引发其他神经免疫细胞的激活,特别是星形胶质细胞,启动先天免疫反应,最终导致一系列促炎事件的发生。
激活的小胶质细胞除了促进组织蛋白酶B的合成外,还会加重神经元功能障碍并加剧神经炎症状态,进一步复杂化AD病理学。与此同时,大脑中的主要免疫细胞星形胶质细胞也被激活。最近的研究表明,虽然激活的星形胶质细胞具有神经保护作用并能抑制Aβ聚集,但它们也会促进ROS的释放和炎性细胞因子的分泌,从而加速AD的进展。
2.2. 金属离子稳态失衡
金属离子,特别是铜、铁和锌,对于维持生理健康至关重要,是细胞功能和稳态的关键元素。然而,这些金属离子的失衡,无论是过量还是缺乏,都可能破坏线粒体稳态。这种破坏可能导致膜完整性的改变并干扰线粒体功能,如三羧酸循环(TCA循环)、氧化磷酸化和谷胱甘肽代谢。这种线粒体功能障碍会放大氧化应激并加速神经细胞凋亡,这两者都是AD发病机制中的关键过程。最近的研究发现了铁和铜在调节中枢神经系统(CNS)核心功能方面的积极作用,包括髓鞘磷脂生成、神经递质合成、突触信号传导和O2运输。这些功能主要通过蛋白质通道、酶和受体的结构调控和催化调控来实现。尽管铜和铁的氧化还原性质对于许多生物过程是必不可少的,但它们也是ROS的来源。ROS水平的升高可以通过促进蛋白质氧化、积聚和错误折叠来加速神经退行性变化,尤其是α-Synuclein等蛋白质。此外,ROS还可以诱导脂质恶化,将脂质转化为脂质过氧化物,这对神经元细胞有害,并且是铁依赖性细胞死亡(称为铁死亡)的关键因素。
2.3. 线粒体功能障碍
线粒体,通常被称为细胞的能量工厂,是许多重要生理过程的核心。它们在能量生产和细胞稳态中的关键作用使它们容易受到功能障碍的影响,这可能对细胞健康产生深远影响。最近的研究表明,线粒体功能障碍在AD的发病机制中起着重要作用,有证据表明其甚至在疾病的早期阶段就开始出现。
Aβ肽、Tau蛋白和ROS都是AD的标志物,已经证明它们通过多方面机制引发线粒体功能障碍。例如,与Aβ结合的酒精脱氢酶(ABAD)加剧了Aβ介导的线粒体应激,最终导致神经元应激和随后的认知功能受损。Aβ积累还与线粒体Ca2+过载有关,这是神经元凋亡的前兆[57],[58]。此外,Aβ与亲环蛋白D(Cyp D)之间的相互作用会引发线粒体渗透性转换孔的开放,导致线粒体肿胀、膜完整性受损以及轴突线粒体运输异常,所有这些都会导致神经元死亡。
同时,Tau蛋白,特别是当聚集或过度磷酸化时,可以破坏线粒体的分布,损害神经元中的突触功能,这表明线粒体功能障碍在AD发病机制中的早期作用。这种线粒体功能障碍通常伴随着一系列病理生理事件,包括代谢下降、Ca2+稳态紊乱、ROS产生增加、脂质过氧化以及在AD大脑中观察到的凋亡。
当ROS和抗氧化系统之间的微妙平衡被打破时,会引发氧化应激,影响葡萄糖代谢并导致离子梯度的损失。这种破坏可能会阻碍三磷酸腺苷(ATP)的产生,影响动作电位的产生和传播。升高的胞内Ca2+水平可以激活Ca2+依赖性核酸内切酶、磷脂酶和蛋白酶,释放细胞色素C和诱导凋亡因子,最终导致神经元凋亡。这种过量的胞内Ca2+也可能破坏微管组装,阻碍线粒体和神经递质囊泡运输,耗尽突触前能量终端,并减少神经传递,最终导致突触功能障碍、神经元死亡和认知缺陷。了解AD中线粒体功能障碍的复杂性为治疗干预和药物开发提供了有希望的途径,正如最近的研究所强调的那样。
2.4. Tau假说
Tau蛋白是一种与微管相关的蛋白质,它在稳定微管结构方面起着重要作用,从而促进有效的轴突运输。AD的一个标志性病理特征是细胞内NFTs的形成,主要由过度磷酸化的Tau(p-Tau)组成。这种过度磷酸化是由异常激酶和磷酸酶活性引起的,有趣的是,即使在AD的临床发作之前也观察到了这种积累。
最近的研究发现,氧化应激可以直接调节特定蛋白激酶的活性,特别是糖原合酶激酶-3(GSK3)。例如,暴露于过氧化氢的胚胎肾293/Tau细胞,在特定位点表现出过度磷酸化,如Ser396、Ser404和Tr231,这归因于GSK3活性提高。在病理情况下,ros诱导的Tau蛋白正常功能紊乱导致其与细胞周期蛋白依赖性蛋白激酶-5(CDK5)和糖原合酶激酶-3β(GSK3β)等激酶的相互作用。导致Tau蛋白的过度磷酸化,从而降低了其对微管的亲和力,促进了其解聚,并扰乱了神经信号传导。
此外,慢性氧化应激已被证明可以放大M17神经母细胞中的tau蛋白磷酸化,这与体内轴突损伤有关。在Tau相关疾病中,氧化应激可诱导神经元细胞周期异常和JNK介导的细胞凋亡。同时,Tau蛋白过度磷酸化、微管破坏和Tau蛋白积累可促进ROS的产生,进一步强化AD的发病机制。鉴于Tau蛋白、氧化应激和AD之间复杂的相互作用,深入了解Tau蛋白假说可以为新的治疗途径和疾病进展提供见解。
氧化性DNA损伤在AD的发病机制中起着关键作用。虽然AD主要特征是认知功能障碍和执行功能减退,但氧化性DNA损伤可能会损害基因转录、影响启动子功能并在关键基因中引发突变。这种损伤可能对突触功能产生深远影响,因为突触传递涉及超过1000种蛋白质的复杂过程,而AD和路易体病都观察到了大规模的突触损失,进一步加剧了这种情况。
最近的进展揭示了氧化性DNA损伤与AD之间复杂的关系。例如,已经发现组蛋白去乙酰化酶HDAC1可以调节老化大脑和AD中由OGG1启动的氧化性DNA损伤修复。此外,可卡因安非他明调控转录物(CART)在APP/PS1小鼠(一种被广泛认可的AD动物模型)中抵消氧化应激和DNA损伤的作用也得到了强调。
此外,由于DNA损伤激活的周期检查点蛋白激酶1(Chk1)被发现可以促进tau和APP过度磷酸化,通过CIP2A/PP2A信号通路导致AD中的认知功能障碍。这一发现突显了Chk1抑制剂在AD中的治疗潜力。此外,在加速衰老疾病和AD中都观察到了DNA修复缺陷导致的NAD+耗尽、线粒体自噬受损、受损线粒体积累、代谢失调和能量耗竭。这表明DNA修复和NAD+代谢在神经退行性疾病中存在共同机制。
鉴于这些发现,深入研究氧化性DNA损伤在AD中的作用并确定针对此途径的潜在治疗策略可能为这种令人衰弱的疾病的创新治疗铺平道路。
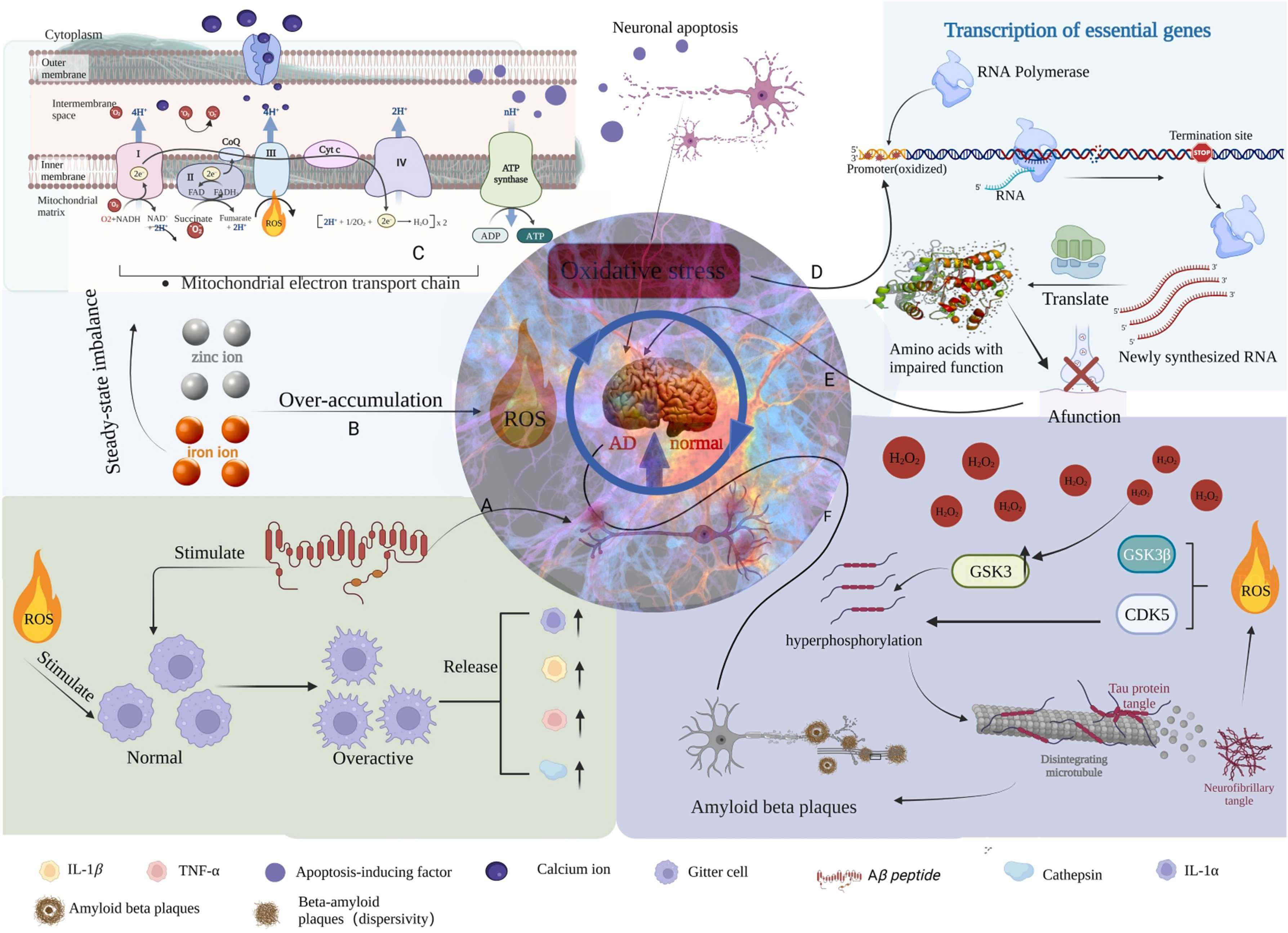
图2 各种因素引起的ROS氧化应激和神经炎症的机制过程,最终导致AD。(A) Aβ和ROS的刺激触发小胶质细胞免疫反应,最终导致神经炎症和神经元紊乱,加速阿尔茨海默病(AD)的发展;(B) 锌和铁水平失衡破坏线粒体稳定性,导致氧化应激、神经元凋亡和AD的加重;(C) 线粒体功能障碍加剧神经元压力,导致认知障碍和AD的进一步进展;(D-E) DNA的氧化损伤阻碍基因转录过程,引发关键基因突变,从而加剧认知缺陷;(F) 由游离H2O2诱导的GSK3表达会干扰神经信号传导,从而在AD的进展中发挥作用。
三、氢气的生物医学功能
氢气是一种无色无味的气体,是所有元素中最轻的质量,也是分子量最小的元素。它由单个电子和质子组成,在常温常压下溶解度很低,具有高度的生物相容性。氢气的生物医学意义最早在1975年被认识到,当时发现它可以有效地治疗白化小鼠的皮肤肿瘤。2007年,人们发现了它的选择性抗氧化特性。从那时起,氢气的治疗潜力在各个医学领域得到了探索。它在治疗和改善神经退行性疾病、心血管疾病、代谢综合征、糖尿病、急性软组织损伤和皮肤病变、肾脏疾病、炎症性疾病甚至癌症方面显示出了希望。
最近的研究表明,氢气作为关键的胞内信号分子[100]的角色。研究发现,氢气主要通过抗炎、抗氧化应激、抗凋亡以及调节自噬和激素信号通路来改善神经退行性疾病。氢气的独特性质,包括其能够迅速穿过膜的能力,使其成为有前景的治疗剂。
3.1. 抑制炎症水平
据报道,阿尔茨海默病患者脑组织中的炎症反应可以引起氧化应激和细胞凋亡[105],这可能导致线粒体功能障碍。
氢气已被证明可以减轻线粒体释放的ROS的数量,从而减少线粒体DNA过氧化,并抑制NOD样受体热蛋白结构域相关蛋白3(NLRP3)、胱天蛋白酶-1和IL-1β的表达以缓解炎症。同时,氢气可能通过还原反应将自由基(·OH)转化为水分子,消除脂多糖刺激下的线粒体产生的ROS。这个过程抑制了线粒体ROS介导的NLRP3去泛素化,揭示了氢气可能通过抑制线粒体活性氧引发的NLRP3产生激活的潜在机制。这些氢气的自然抗炎和抗氧化作用已被认为对AD的治疗有益。
同时,氢气可以通过哺乳动物靶点雷帕霉素(mTOR)信号通路调节小胶质细胞极化,从而减少脓毒症引起的神经炎症。通过激活腺苷酸5'-单磷酸(AMP)活化蛋白激酶(AMPK),富含氢气的盐水已被证明可以促进M2型小胶质细胞的分化,并防止神经元损伤和凋亡。
此外,最近的研究表明,氢气还可以通过减少神经母细胞瘤细胞中的氧化应激和凋亡来发挥神经保护作用。这些发现进一步强调了氢气作为AD管理中的潜在治疗剂的潜力。这些机制共同有助于减少炎症并预防神经元损伤和凋亡。
最近的研究表明,氢气在减轻这些代谢挑战方面具有潜力。氢气已经证明其能够减弱氧化应激和减少线粒体损伤,从而增强ATP合成并加强线粒体内的电子传递链。这不仅保护神经元免受潜在损伤,还增强了认知功能。
此外,氢气可以调节代谢能量途径的动态。例如,氢气已被确定可以减少线粒体释放的ROS,从而减少线粒体DNA过氧化,并抑制关键炎症介质的表达。实质上,氢气在调节能量代谢方面的多面性作用,加上其强大的抗氧化特性,使其成为对抗AD的有效治疗候选者。
3.3 减少氧化应激水平
3.3.1 激活抗氧化途径
Aβ肽是导致AD的主要因素之一,与ROS的过度产生有关。由Aβ引发的这种ROS激增加剧了线粒体功能障碍并推动细胞凋亡。这表明抗氧化治疗可能有效地预防与ROS相关的AD。最近的研究发现,富含氢的水(HRW)在对抗氧化应激引起的疾病方面具有潜在的治疗作用。HRW具有显著的能力中和多余的ROS,从而减轻氧化损伤。这种机制不仅减少了由Aβ引发的细胞死亡,而且减缓了AD的进展。例如,已经证明HRW可以通过激活AMPK和增强下游叉头框O3a(FOXO3)的抗氧化反应来抵消Aβ诱导的线粒体潜能损失和氧化应激。
此外,HRW在加强大脑的抗氧化防御系统方面起着关键作用。它提高了细胞内抗氧化酶的水平,特别是超氧化物歧化酶1(SOD1)和过氧化氢酶(CAT),因此成为一种减少AD风险和进展的神经保护剂。最近的一项研究还强调了HRW在改善AD小鼠模型中的神经病理损伤方面的作用,特别是通过减轻神经炎症。总之,HRW在激活抗氧化途径和随后的神经保护作用方面的多方面作用为AD的治疗干预提供了有希望的途径。
3.3.2 选择性减少高度有毒的羟基自由基和过氧亚硝酸根阴离子
氧化应激是由于氧化和抗氧化功能失衡而导致的细胞损伤的重要原因,尤其是在像AD这样的神经退行性疾病中。这种压力通常被强效氧化剂如羟基自由基(·OH)和过氧亚硝酸根(ONOO-)加剧,它们会与核酸、脂质和蛋白质发生无差别反应,导致DNA断裂、脂质过氧化和蛋白质失活。
氢气因其能够选择性清除这些有害自由基而成为有潜力的治疗剂。值得注意的是,氢气的潜在治疗作用首次在2007年由Ohsawa等人的研究中得到突出展示,他们证明了氢气在培养细胞中选择性地减少·OH和ONOO-以及在非细胞试验中减少参与氧化状态的大分子的作用。过量的自由基和ROS的产生导致氧化应激,从而引发神经炎症和凋亡,加剧了AD的进程。氢气对·OH和ONOO-的选择性减少已经在保护大脑免受缺血再灌注损伤和中风的影响方面显示出潜力,表明其在减少AD的发生率和进展方面具有潜力。这种降低AD发生率和进展的保护效果为新的治疗可能性提供了新的可能性。
3.3.3 激活细胞内源性抗氧化系统Nrf2
AD中的炎症反应可能是由于氧化应激信号通路失调引起的。炎症因子可以破坏血脑屏障,导致中枢神经炎症。激活Nrf2是调节抗氧化应激的重要调控器,它可以增加II相解毒和抗氧化酶基因的表达,增强抗氧化能力,从而减轻氧化应激和炎症。具体来说,Kelch样ECH相关蛋白-1(Keap1)/Nrf2/抗氧化应答元素(ARE)通路是细胞抗氧化防御系统的核心。在生理条件下,Keap1可以通过泛素化降解Nrf2。然而,当ROS产生和清除之间的平衡被破坏时,Keap1会被激活,导致Nrf2清除受阻,从而导致Nrf2过度积累和激活,然后转移到核并通过靶向ARE调节抗氧化应激基因。其中,Nrf2在防止大脑氧化应激方面发挥最积极的作用。因此,氢气通过激活Nrf2促进细胞对氧化应激的反应,抑制氧化应激信号通路的紊乱,并减缓AD的发展。
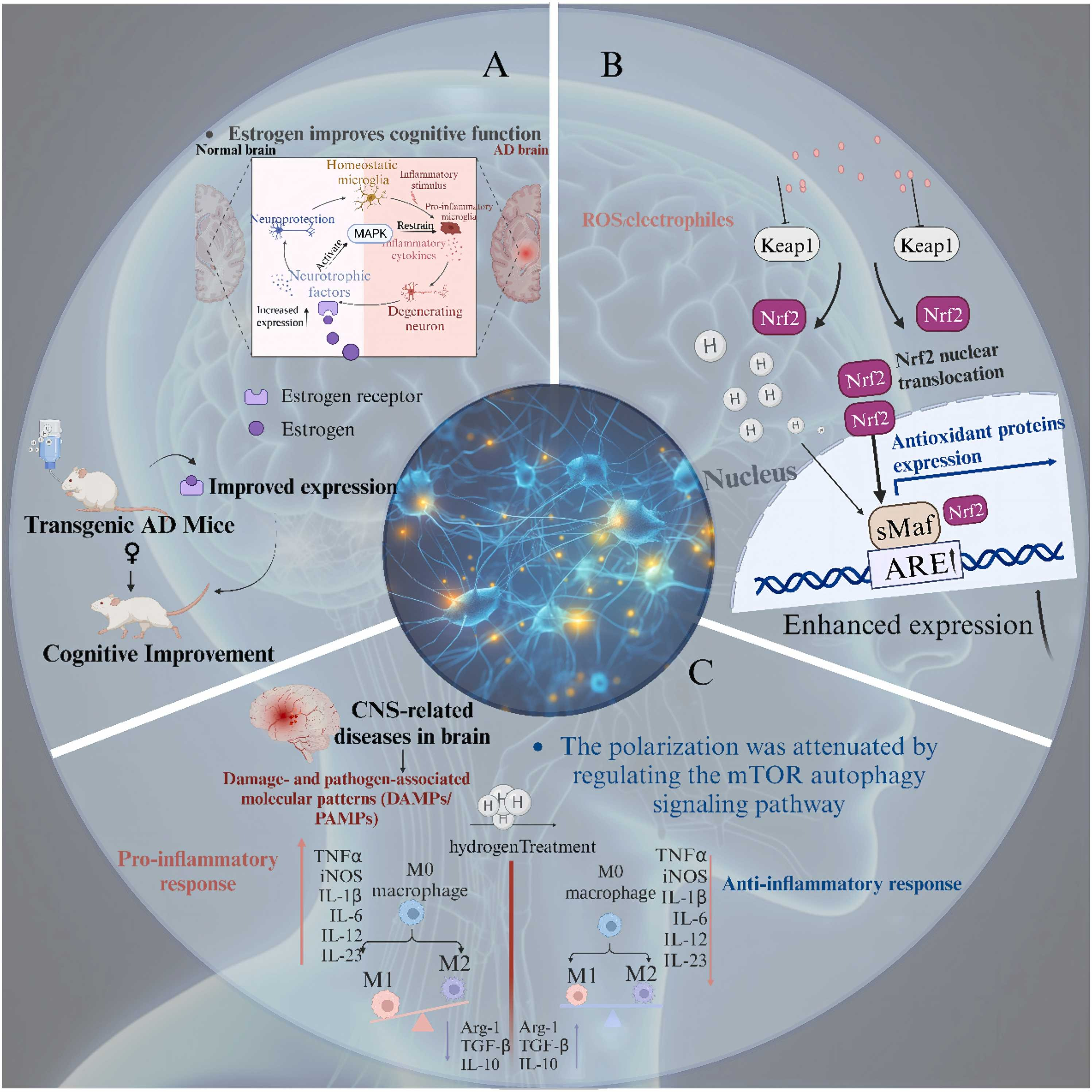
图3 氢气治疗AD的进展。(A)氢调节ERβ和BDNF的表达,增强认知功能;(B)氢通过激活细胞内源性抗氧化系统Nrf2来减缓AD的进展;(C)氢抑制小胶质细胞的过度活化,促进抗炎反应。

图4 氢在AD进展中的治疗作用。(A)氢抑制小胶质细胞的过度活化,促进抗炎反应;(B)氢调节ERβ和BDNF的表达,增强认知功能;(C)氢通过选择性减少OH和ONOO-的产生来减轻氧化应激和神经炎症;(D)氢通过减少氧化应激、防止线粒体损伤,促进线粒体ATP合成和电子传递链功能来减缓AD的进展;(E)氢通过激活细胞内源性抗氧化系统Nrf2来减缓AD的进展;(F)氢作为一种神经保护剂,通过上调FOXO3a下游的抗氧化反应,通过sirt1依赖通路中的AMPK减少Aβ诱导的线粒体电位损失和氧化应激,从而降低脑氧化应激水平;(G)氢将OH还原为水分子,从而减轻对线粒体的氧化应激损伤。
四、氢气的使用方法
氢的物理化学性质和生物医学功能推动了基础研究(表1)和临床应用(表2)的各种给药方法的发展。这些方法包括吸入气体、富氢水、纳米氢载体等。
4.1.直接氢气吸入
氢气是最小的分子,由两个质子和两个电子组成。氢气曾经被认为在哺乳动物细胞中是生理上惰性的。然而,当1975年氢气的治疗作用首次在小鼠皮肤鳞状细胞癌模型中得到证实时,这种观点开始改变。氢气的毒性优势比其他医用气体更为突出。即使在非常高浓度下,氢气仍然是无毒的,氢气的人体安全性已被潜水医学证实。研究还表明,吸入氢气对血压和其他血液参数(如pH值、体温等)没有影响,且无明显不良反应,这与近期对脑梗死和心脏骤停综合征患者的临床试验结果一致。根据目前研究进展,氢气吸入治疗正受到越来越多的关注。
氢本身是最方便、最安全的给氢方式,由于其优异的抗氧化性能和优异的抗炎性能,促进了氢生物医学的发展(图5)。
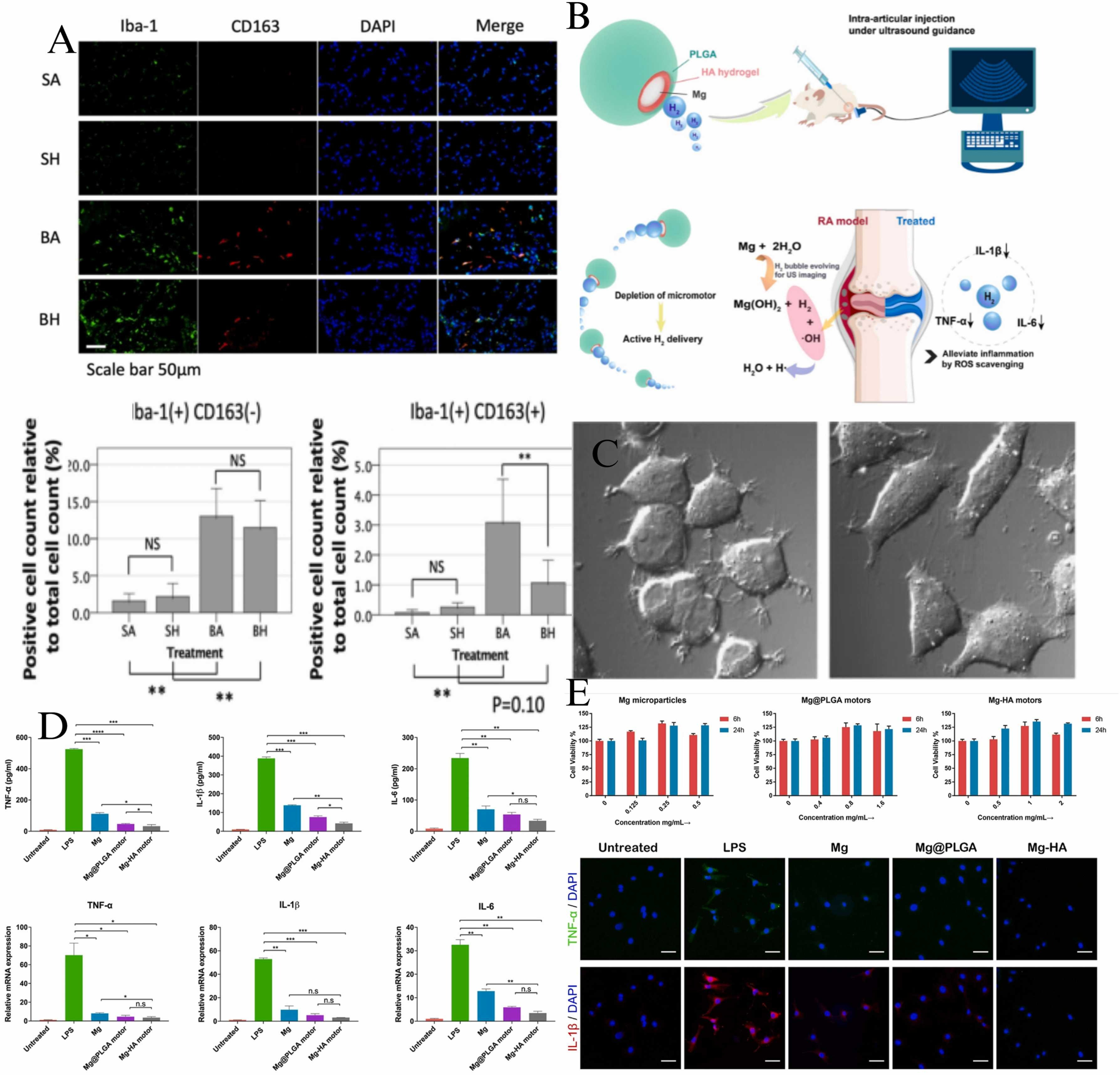
图5. 氢气的出色抗炎和抗氧化实验以及最新的驱动氢气去除ROS的新视角。(A) 吸入氢气7天后,观察到Iba-1阳性和cd163阳性细胞数量显著减少。版权©2021 BMC;(B) 新的Mg-HA氢气输送平台。(C) 当培养的PC12细胞通过抗霉素A处理受到氧化应激时,(I) 细胞在氧化应激下显著收缩并拉长短纤维,(I) 当细胞处于H2中时,细胞形态保持不变。(D-E) 对Mg-HA马达的体外评估显示,氢气可以通过不同的LPS刺激改善MH7A细胞中的炎症,通过定量炎症细胞因子来确定。
氢气可以通过氢气管输送到肺部,该氢气管可以连接到呼吸机回路、面罩或鼻导管上。这些方法允许氢气迅速扩散到全身,提供对抗急性氧化应激的保护,而不会影响血压。
4.2. 富氢水
近年来,富氢水的治疗效果引起了广泛关注,特别是在像AD这样的神经退行性疾病的背景下。电解、金属酸反应和高压溶解等技术的进步促进了富氢水的生产和应用。
富氢水是通过将氢气溶解在液体中产生的,为直接吸入氢气提供了一种方便安全的替代方案,但需要专门的设备。由于在0.8 mM条件下的高溶解度,富氢水提供了与直接吸入氢气相当的治疗浓度。
最近的研究表明了富氢水在AD中的多方面益处。它已被证明可以对抗认知衰退、减轻氧化应激并促进海马神经元生成。鉴于氧化应激在AD发病机制中的作用,这些神经保护作用至关重要。富氢水已显示出缓解Aβ诱导的学习记忆障碍、神经炎症和调节炎症通路的效果,特别是通过抑制JNK和NF-κB激活。此外,饮用富氢水可能减轻年龄相关的认知障碍,增强携带载脂蛋白E4基因型的个体的认知能力,甚至延长寿命。
此外,一项研究强调了富氢水在减弱Aβ诱导的细胞毒性方面的作用,通过AMP激活蛋白激酶在SK-N-MC细胞中上调Sirt1-FoxO3a通路[132]。另一项研究强调了APP/PS1小鼠在接受富氢水处理后性别依赖性的认知功能改善,而不影响Aβ清除。新出现的证据强调了富氢水在AD治疗中的治疗潜力,为干预提供了一个新的途径,该途径针对疾病进展中的核心氧化应激和炎症通路。
4.3. 纳米载体
纳米递送系统的最新进展为传统药物在治疗许多疾病方面的新应用提供了有力支持。该系统的代表性内容包括使用纳米载体将药物输送到病变部位。涉及的纳米载体包括脂质体、胶束、Nanogels和纳米粒子,这些已在临床前研究中广泛用于靶向药物递送。传统的吸入或气体加载等方法可能无法有效靶向病变部位,可能导致治疗持续时间延长和结果不理想。这就是纳米载体发挥作用的地方,它们具有优越的靶向性能。
钯(Pd),一种显著的优质纳米材料和传递平台,不仅在肿瘤靶向治疗中显示出潜力,而且作为一种强大的平台,可以增强生物纳米载体的传递效率。最近的突破性进展使钯氢化物(PdH)纳米粒子成为高负载氢气载体的焦点。这些纳米粒子能够原位持续释放生物还原氢气,标志着该领域的重要进步。PdH纳米粒子可以通过自我催化释放生物还原氢气,选择性地从AD模型细胞中去除高度有毒的自由基·OH,这可以改善线粒体功能障碍,促进细胞能量代谢并抑制细胞凋亡。PdH纳米粒子的施用抑制了APP、Beta-secretase 1(BACE1)和可溶性肽app(sAPP)的过度表达,从而减少了AD模型细胞和小鼠中的Aβ过度产生,并阻止了AD的进展。令人欣慰的是,将纳米技术整合到AD治疗中,特别是通过使用纳米载体,具有巨大的潜力。通过提高药物传递效率和靶向能力,这些系统可以彻底改变AD和其他神经退行性疾病的治疗格局。
五、AD氢疗法的未来方向和挑战
氢疗法在治疗AD方面的潜力是不可否认的。然而,其广泛应用受到几个挑战的阻碍。其中一个主要障碍是氢气在常温常压下的低溶解度,这限制了可以通过气体吸入引入血液中的有效剂量。以液体形式向特定大脑区域输送高浓度的氢气,特别是穿越血脑屏障,仍然是一个艰巨的挑战。此外,纳米制剂的长期生物相容性还有待确定。为了解决这些挑战,以下研究方向正在出现:
(I) 改进给药途径:氢眼药水可以显著改善视网膜缺血再灌注损伤[185],并且还可以影响颅神经病变。此外,选择具有高长期生物相容性的储氢材料可以使AD患者的大脑中持续原位释放高度还原的氢气,有效地穿越血脑屏障发挥其功能。
(II) 可持续氢气生产:迫切需要能够在特定位置可持续释放氢气的材料或微生物。陈等人的一项研究合成了一种共生藻类-细菌敷料,该敷料开发了一种可持续产生氢气的水凝胶用于糖尿病伤口愈合。同时,对生物活性化合物的受控和持续释放的研究广泛使用了水凝胶[188]。因此,这些研究为未来AD中的持续氢气输送提供了新思路,即具有良好的生物相容性的水凝胶可以共同携带能够靶向病变部位的产氢细菌发挥治疗作用。
(III) 氢气作为诊断标志物:氢气已被用作许多疾病的诊断标志物,并且氢气和甲烷浓度的呼吸测量已被用于诊断肠道细菌过度生长,从而诊断肝硬化的发生。欧洲范围的H2甲烷呼吸测试指标诊断已被用于提供新的见解,了解症状评估在诊断成人和儿童患者的碳水化合物(如乳糖)不耐受中的作用,并建议碳水化合物吸收不良的呼吸测试需要额外的经过验证的同时症状评估来识别碳水化合物不耐受。然而,针对神经退行性疾病的氢气标记物的诊断尚未出现,但基于肠道微生物和神经退行性疾病的研究已经取得了进展。在未来,基于产氢细菌的氢气标记物的诊断将为AD的诊断和预防提供新的视角。
六、结论
氢基治疗已成为AD治疗的一种很有前途的途径,研究显示了氢气在调节NLRP3炎症小体、调节能量代谢和保护神经元方面的潜力。值得注意的是,氢疗法的低副作用使其与众不同,为现有的AD干预提供了一种补充方法。然而,虽然初步研究结果令人鼓舞,但验证这些结果和建立可靠的治疗方案必须进行全面的临床试验。随着该领域的发展,基于氢气的策略有望重塑AD的治疗前景,为患者和护理人员提供了新的希望。
https://wap.sciencenet.cn/blog-41174-1408243.html
上一篇:迷幻疗法正在加速获得批准,但没有人知道它们的具体作用机制
下一篇:晕厥的神经机制被确定!