
英文原题:Customized molecular tools to strengthen metabolic engineering of cyanobacteria
作者:Stephan Klähn*, Franz Opel, Wolfgang R. Hess*
01 论文信息
论文信息
S. Klähn, F. Opel, W.R. Hess. Customized molecular tools to strengthen metabolic engineering of cyanobacteria[J]. Green Carbon 2024 2(2) 149-163.
论文关键词
Metabolic engineering; Cyanobacteria; Synthetic plasmids; Regulatory proteins; Sensors
论文网址
https://doi.org/10.1016/j.greenca.2024.05.002
论文下载
Customized molecular tools to strengthen metabolic engineering of cyanobacteria
中文解读原链接
Green Carbon文章│弗莱堡大学Hess教授、亥姆霍兹环境研究中心Klähn博士:定制化分子工具强化蓝细菌代谢工程
02 背景简介
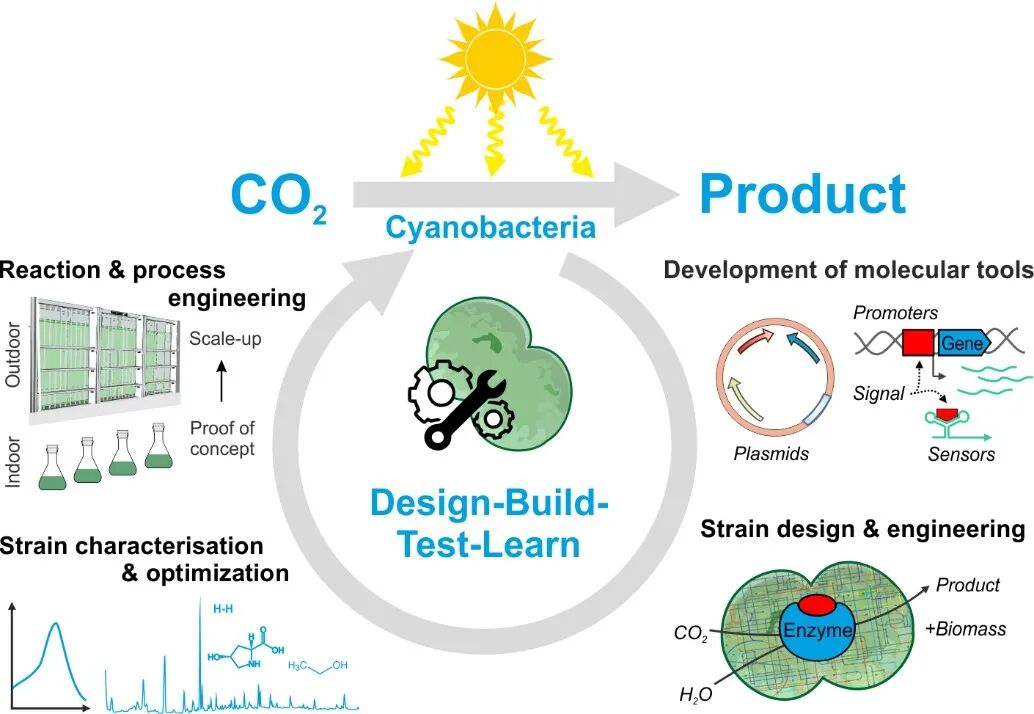
蓝细菌作为能够利用太阳能将二氧化碳转化为有机化合物的原核微生物,被视为理想的光合固碳合成生物技术研究平台。然而,在宏观层面,蓝细菌生物制造面临成本、效率、规模等问题,产业链尚未成熟;微观层面,由于蓝细菌的形态多样性、基因组多倍性和复杂性,其分子改造等基础遗传操作也面临诸多挑战。而定制化开发高效、便捷的遗传改造系统,发展成熟分子生物学工具箱,是突破蓝细菌合成生物技术微观瓶颈,发展蓝细菌光合生物制造产业的核心问题。
近日,来自德国弗莱堡大学的Wolfgang R. Hess教授和德国亥姆霍兹环境研究中心的Stephan Klähn博士于Green Carbon上联合发表标题为“Customized molecular tools to strengthen metabolic engineering of cyanobacteria” 的综述文章,以独特视角,针对蓝细菌代谢工程领域最新开发的“量身定制”型分子生物学工具进行了深入介绍。其中包括染色体外基因维持载体系统,小型调节蛋白在线资源,CRISPR干扰技术应用以及产品生物传感器集成筛选和检测等。
03 文章简介
蓝细菌代谢:生态视角与进化足迹
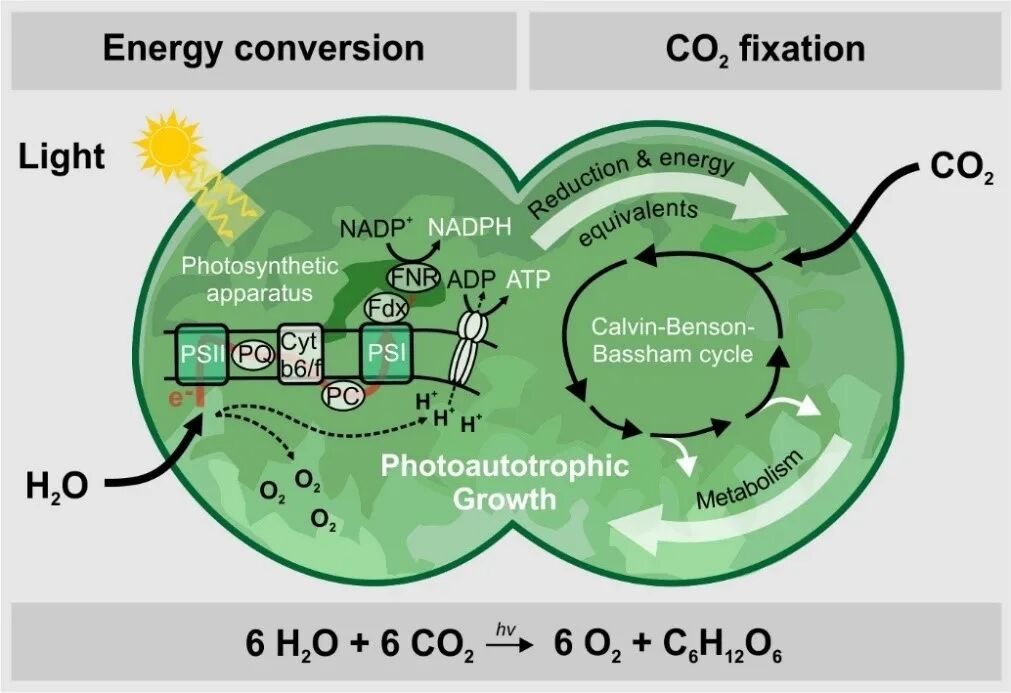
蓝细菌利用光合色素捕获太阳能,并借助一系列细胞色素和辅助蛋白质组成的电子传递链,将光子激发的电子传递到最终的电子受体,如NADP⁺,生成NADPH,并产生ATP以供能量需求,同时将二氧化碳转化为有机物质,在此过程中,氧气作为副产物被释放到大气中。蓝细菌通过其光合作用逐渐改变了地球的大气成分,是地球大氧化事件的关键推动者之一,对地球生态系统的演变产生了巨大影响。
该综述指出,蓝细菌在地球碳和氮元素循环中扮演关键角色。它们贡献的光合有机碳约占全球光合固碳总量的10%。以大西洋为例,其光合固碳总量的50%来源于优势蓝细菌,如海洋原绿球藻等。显示了蓝细菌在海洋生态系统中的主导地位。此外,像束毛藻等蓝细菌具备固氮能力,能将大气中的氮气转化为植物可利用的形式。据估计,它们贡献了约一半的海洋固氮量。
蓝细菌的生态和进化足迹不仅丰富了我们对地球生命演化历史的理解,还为利用其进行合成生物学研究和生物技术开发提供了重要的科学启示。
蓝细菌底盘细胞
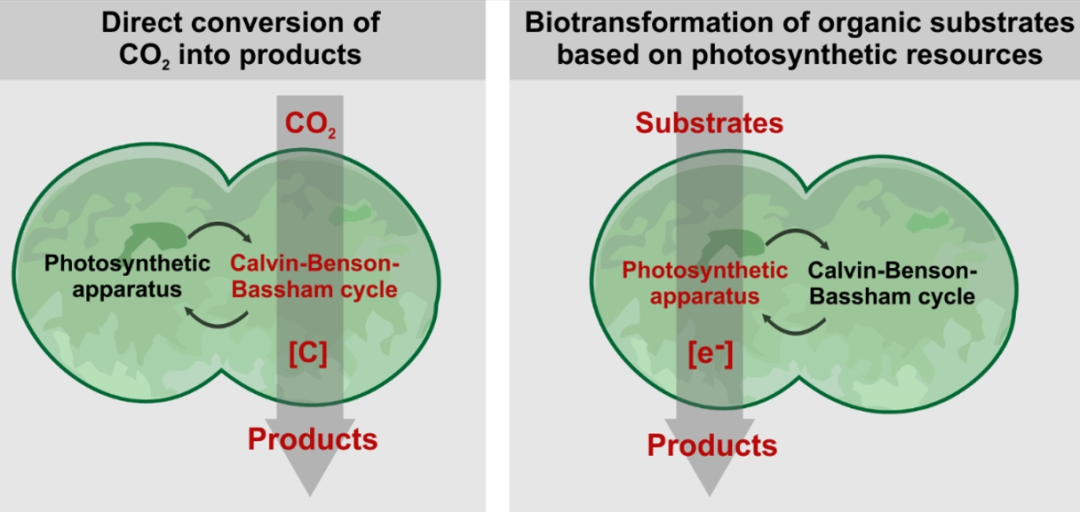
蓝细菌除了其进化和生态重要性外,在温室气体大量排放和全球变暖的背景下,发展其光合生物制造技术意义重大。蓝细菌作为底盘细胞的合成路线主要包括两个方面:(1)直接利用二氧化碳进行生物合成;(2)借助光系统的电子和辅因子,以有机物中间体为底物合成其他产品。通过研究蓝细菌底盘的营养需求、光合效率、单位产率,作者以顺式-4-羟基-L-脯氨酸为例,指出使用代表性蓝细菌生产特定化合物的工艺已达到了可与异养生物制造系统(如大肠杆菌)相媲美的效率水平。
该综述以集胞藻PCC 6803、细长聚球藻PCC 7942、聚球藻PCC 7002、鱼腥藻PCC 7120、细长聚球藻UTEX 2973等模式蓝细菌底盘为例,介绍了顺式-4-羟基-L-脯氨酸、海藻糖、果糖、葡萄糖、苯丙素类化合物、环己醇、ε-己内酯、琥珀酸、正丁醇、异丁醇、3-甲级-1丁醇、异戊二烯等化合物的光合生物合成的思路、方法和进展。此外,以蓝细菌作为底盘细胞合成氢气也是蓝细菌光合生物制造的重要研究方向。蓝细菌可借助两种不同的酶产氢:固氮酶和双向氢化酶。利用固氮酶产氢,每合成1 mol氢气需要消耗约16 mol ATP,是一个高度耗能的过程。此外,作者针对双向氢化酶的分类、产氢机制和代谢工程改造策略进行了较为系统的综述总结。
蓝细菌定制化分子生物学工具
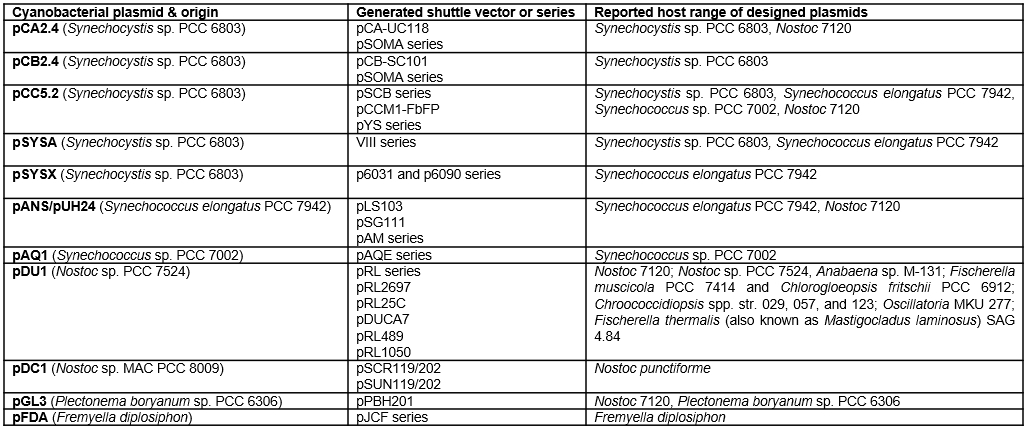
蓝细菌“传统”的遗传操作工具箱包括:基因导入方式、基因表达调控元件、元件组装标准化工具等几个方面。自然转化和接合转移技术是蓝细菌代谢工程常用的基因导入方式;针对基因表达调控,作者在指明代表性蓝细菌底盘基因组中性位点的基础上,重点介绍了目前已开发的蓝细菌自主复制型载体系统,这是该综述的一大亮点。简言之,目前已在蓝细菌体系中成功开发了11个系列的染色体外基因维持系统。作者指出人工合成的蓝细菌兼容的染色体外基因维持系统是未来蓝细菌代谢工程的重要发展方向。针对蓝细菌合成生物学元件的标准化,作者介绍了基于植物Golden Gate MoClo Kit开发的CyanoGate系统。
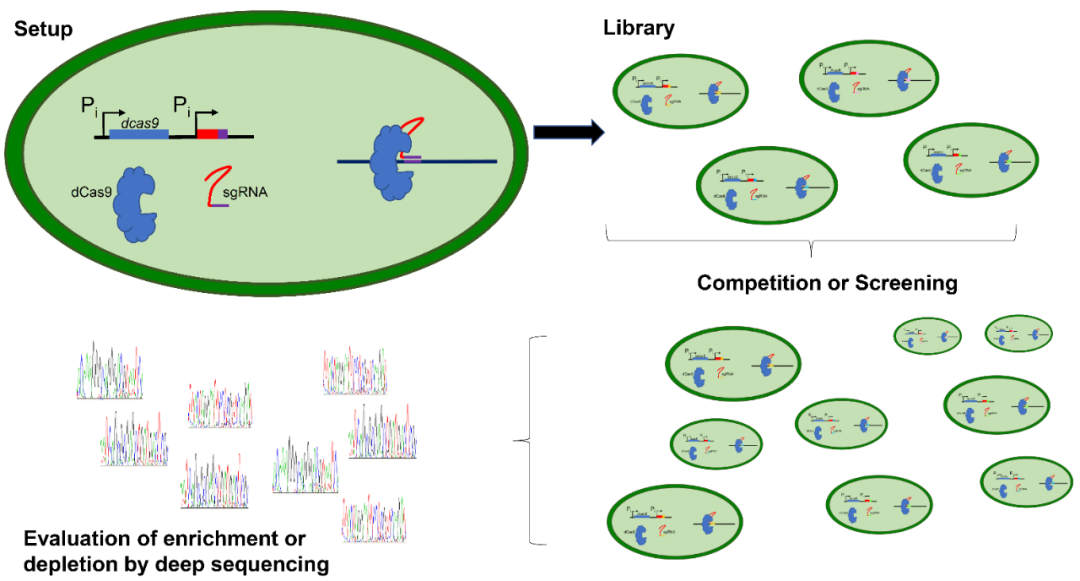
CRISPR干扰技术在蓝细菌中的应用是该综述重点推介的内容。无催化活性的Cas9(dCas9)在靶向蓝细菌启动子时,由于转录机制的空间位阻效应,会导致基因表达的抑制。这个过程被称为CRISPRi(CRISPR interference,CRISPR干扰)。作者以集胞藻PCC 6803为例,从dCas9和sgRNA文库组配、集胞藻CRISPRi文库构建、编辑蓝细菌竞争或筛选、深度测序确定发挥作用gRNA等四个方面探究了CRISPRi作为“传统”遗传操作工具,在蓝细菌代谢工程中的应用。该综述还总结了包括集胞藻CRISPR干扰产生的数据库在内的9个模式蓝细菌的全局性转录起始位点、蛋白互作、蛋白-RNA互作、非编码RNA等的在线数据集,同时也为可控启动子筛选、核糖体开关鉴定提供了宝贵的数据资源。
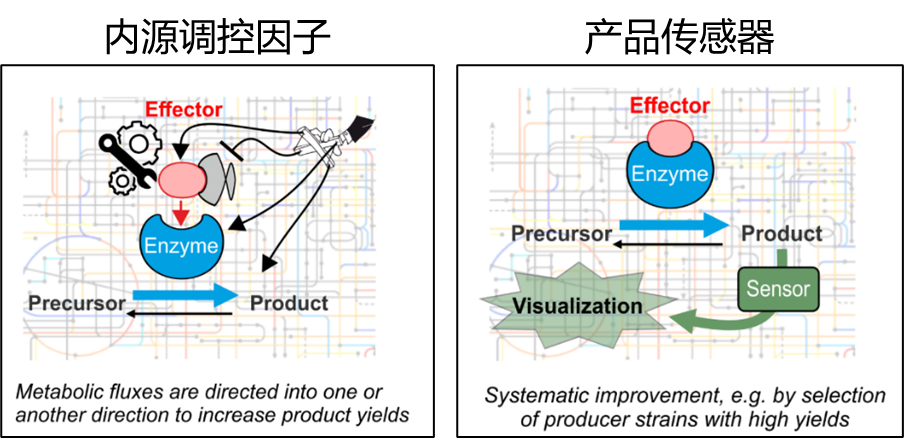
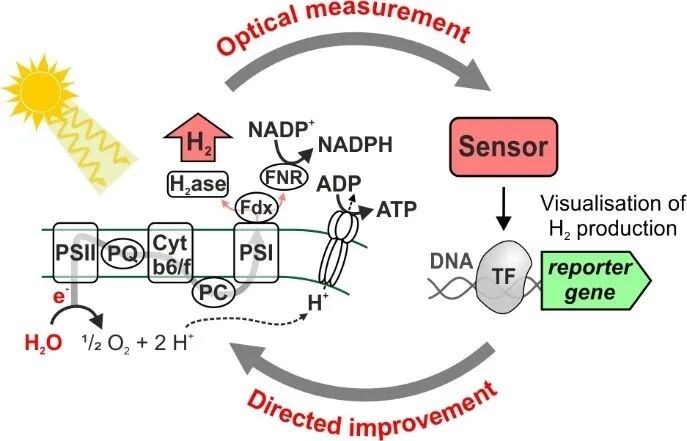
“量身定制”型分子生物学工具重点介绍了小调节蛋白、产品生物感应系统概况和氢气生物感应系统应用实例。经过统计,蓝细菌中已经探究应用的小蛋白调控因子包括AtpΘ、CP12、IF7、IF17、NblD、NirP1、PirA、PirC、CfrA等。文章详细总结了各个小调节蛋白的调控机制和应用场景。人工合成生物传感器原理上是基于使用蓝细菌信号转导系统来开发,是将胞内产物的信号人工耦合到一个报告基因上,从而实现依赖光学特征的可视化检测或者高通量数据采集。蓝细菌生物传感器的研究还处于萌芽阶段,作者在系统综述氢气生物传感器在其他异养体系应用的基础上,提出了蓝细菌氢气生物传感器的理论模型。
总结及展望
尽管与异养体系相比,蓝细菌光合生物制造技术仍处初级阶段,但近年来这一领域发展迅猛。新型染色体外自主复制载体的开发、定制型启动子和核糖体开关的调节、以及基于共分离技术的蛋白互作分析等,将成为蓝细菌代谢工程研究的新的增长点。未来,多维度整合生物技术的发展,包括结合CRISPR干扰与小蛋白的靶向调节,以及产品生物传感器进行高通量系统筛选的迭代循环开发,将为蓝细菌生物技术发展注入强劲动力。
04 文章摘要

Abstract
Cyanobacteria are promising oxygenic phototrophs for the production of various compounds. For their (photo)biotechnological exploitation, molecular tools are required, such as, for the introduction and expression of heterologous genes, or the modulation of enzyme activities or entire pathways. Concepts and strategies for the development of photosynthetic biomanufacturing technologies based on cyanobacteria have been extensively reviewed, as well as certain specialized aspects of their genetic manipulation. However, options for metabolic engineering of specific cyanobacterial cells are still less developed than those for other bacteria of biotechnological relevance. In addition to the standard genetic toolbox for “classical” metabolic engineering, we emphasize certain aspects, including recently developed vector systems for the extrachromosomal maintenance of genes and approaches based on clustered regularly interspaced short palindromic repeats (CRISPR) interference. We highlight the development of custom molecular tools for specific strains or products, discuss the emerging use of small regulatory proteins that appear promising for advanced metabolic engineering approaches to promote specific product formation, and provide an overview of suitable online resources. Furthermore, we discuss the current trends in this field and indicate their potential, such as using suitable product sensors that enable systematic screening, and optimization approaches.
05 作者简介

Walfgang R. Hess 教授
Wolfgang R. Hess, 德国弗莱堡大学教授,博士生导师,弗莱堡大学第三生物研究所所长,遗传及实验生物信息学团队负责人,Green Carbon编委。Wolfgang Hess教授主要以蓝细菌和光合细菌为研究模型,从事交叉学科研究,涉及生物信息学、合成生物学和系统生物学等领域。已经在Nature、Nature Biotechnology、Nature Plants、Nature Communications、Proceedings of the National Academy of Sciences 、ISME Journal、Plant Cell等知名期刊上发表学术论文240余篇,H指数64。

Stephan Klähn 博士
Stephan Klähn,德国罗斯托克大学分子生物学博士、德国弗莱堡大学博士后,现任德国亥姆霍兹环境研究中心太阳能材料生物技术部蓝细菌分子生物学团队负责人。曾在德国马普分子植物生理研究所、美国耶鲁大学、美国俄克拉荷马州立大学、中国科学院青岛能源所等机构访学。Stephan Klähn博士团队的主要研究方向为蓝细菌分子生物学和合成生物技术,已在Proceedings of the National Academy of Sciences 、Plant Physiology、New Phytologist、 Nucleic Acids Research、Environmental Microbiology等杂志发表论文50余篇。
06 Green Carbon
期刊官网:Green Carbon官网
投稿网址:Green Carbon投稿
公众号:Green Carbon公众号

转载本文请联系原作者获取授权,同时请注明本文来自GreenCarbon科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3620330-1501671.html?mobile=1
收藏

