博文
栾国栋研究员与Green Carbon │ 蓝细菌适应性进化与光驱固碳合成
||


2024年4月19日-21日,第一届Green Carbon青年编委会生物方向研讨会暨“合成生物技术与绿色生物制造——高版本底盘工程”学术沙龙在青岛召开。中国科学院青岛生物能源与过程研究所栾国栋研究员应邀出席并作题为“蓝细菌适应性进化与光驱固碳合成”的邀请报告。
蓝细菌适应性进化与光驱固碳合成
背景介绍
蓝细菌是研究光合、固碳、固氮等重要生命活动的模式体系,近年来,又作为光合生物制造的潜力平台而得到重视。在本次邀请报告中,栾国栋研究员系统介绍了研究组在蓝细菌光合抗逆和固碳合成两个方向的研究进展:应用合成生物技术和系统生物技术重塑聚球藻细胞的光合代谢网络,构建直接利用二氧化碳合成并分泌葡萄糖的细胞工厂,揭示了决定葡萄糖高产和分泌的分子机制;开发了新型蓝细菌可控超突变系统,成功获得高温高光耐受能力显著提升的聚球藻进化藻株,并揭示了影响蓝细菌高温高光耐受能力的关键功能靶点和作用机制。

栾国栋研究员在“合成生物技术与绿色生物制造——高版本底盘工程”学术沙龙上作邀请报告
报告内容
微藻是一类具有丰富种质和遗传多样性的光自养生物,在自然界中广泛存在,在医药、食品、环境等领域有着广泛的应用空间和潜力。在“双碳”目标背景下,以微藻为底盘,直接固定CO₂并转化为能源、化学品、医药产品等重要物资的光合生物制造技术得到进一步关注。蓝细菌是一类原核微藻,是地球上最古老的光合放氧生物,传统上被用作光合作用研究的重要模式体系,近年来也被视为极具潜力的生物固碳和绿色合成微生物平台。在报告中,栾国栋研究员主要介绍了研究组在蓝细菌光驱固碳合成和实验室适应性进化技术方面的相关工作进展。
以蓝细菌为底盘直接固定二氧化碳合成葡萄糖
葡萄糖是自然界含量最丰富的单糖,是细胞的基本能量来源,也是生物炼制工业的重要原料。目前,“植物-生物质-糖”路线在葡萄糖生产中占主导地位,然而该路线面临植物生长周期长、生物质采集半径大、预处理过程成本高等问题。针对日益加剧的全球气候危机与粮食短缺问题,发展高效、可持续的新型葡萄糖合成路线具有重要意义;在此背景下,利用二氧化碳直接合成葡萄糖的技术引起广泛关注。近年来,应用化学-生物化学、电化学-生物学以及体外级联酶促反应等手段,已经成功打通了二氧化碳向葡萄糖、葡萄糖前体以及葡萄糖衍生物的转化路线;然而,以光自养生物为底盘,基于天然光合作用过程直接实现葡萄糖合成的技术却尚未取得突破。
在植物和藻类的光合作用中,葡萄糖作为能量和碳素的载体而合成,并发挥着重要调节作用,葡萄糖的胞内积累会对光合活性形成显著抑制;因此,光自养细胞中葡萄糖极少以游离单体的形式进行合成和积累。本工作中,研究人员以聚球藻PCC 7942为出发藻株,对其代谢网络进行分析后发现其基因组上存在两个葡萄糖激酶(Glucokinase)基因,可能对后续改造不利,因此对两个基因进行了敲除。
聚球藻细胞代谢显示出对葡萄糖激酶活性的高度依赖性,经过反复传代和适应性进化后才分离获得葡萄糖激酶基因完全敲除的纯合重组藻株。出乎意料的是,该藻株直接具有了高效合成和分泌葡萄糖的能力,在柱式反应器中,其胞外葡萄糖产量达到1.5 g/L(占总葡萄糖产量的95%以上,比合成速率超出此前报道10倍),这意味着在未导入任何外源催化和转运模块的前提下,葡萄糖激酶的缺失直接“激活”了聚球藻中未知的葡萄糖合成和分泌机制。
栾国栋研究员带领研究组对聚球藻代谢网络进行分析,推测重组藻株中大量合成的葡萄糖可能来自蔗糖代谢途径,进而设计了一系列遗传改造实验,成功证实聚球藻PCC 7942中存在稳定运行的蔗糖代谢循环,葡萄糖激酶能够将蔗糖水解产生的葡萄糖磷酸化,使其重新进入中心代谢;而葡萄糖激酶活性的缺失阻断了该循环中葡萄糖的“再利用”并引发了后续的葡萄糖积累与分泌。此前,蔗糖合成被普遍认为是蓝细菌适应高盐胁迫的响应性保护机制,而本研究则刷新了对其机制与功能的相关认识。
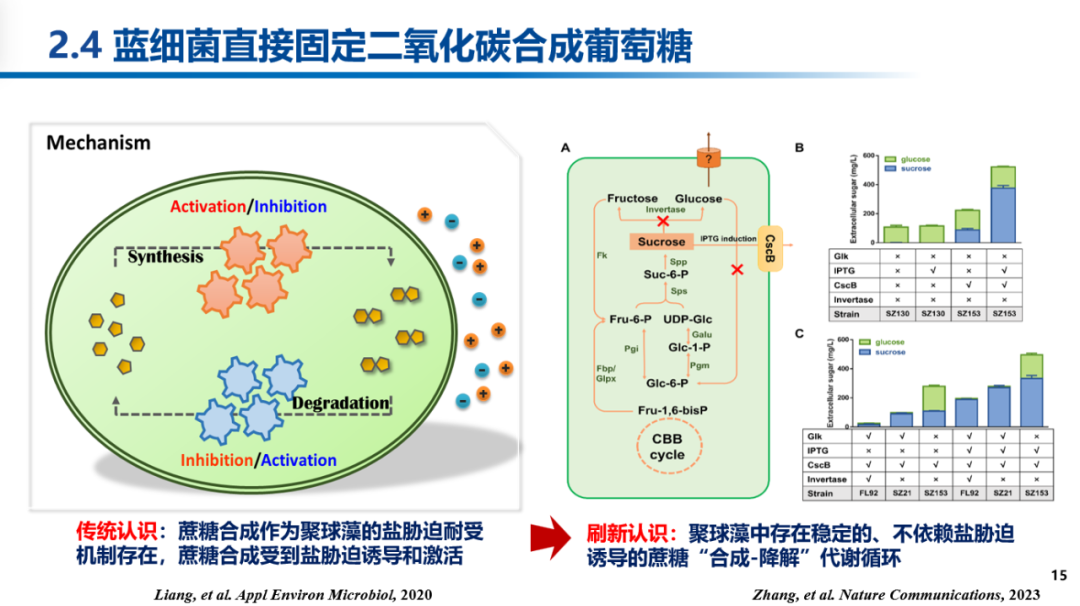
通过对重组藻株进行测序并结合靶向重构发现,葡萄糖激酶缺失株基因组上synpcc7942_1161基因的一个单点突变(G274A)是实现葡萄糖大量分泌的关键。该突变导致synpcc7942_1161基因表达量大幅上调,并发挥葡萄糖外泌蛋白的功能,其效果甚至超过蓝细菌代谢工程领域经典的糖转运蛋白GalP。结合葡萄糖激酶缺失导致的代谢表型以及菌株构建过程推测,敲除葡萄糖激酶导致聚球藻细胞中葡萄糖积累,对细胞代谢和光合生理产生抑制,促使细胞基因组产生突变,其中synpcc7942_1161-G274A突变实现了葡萄糖外泌,解除了代谢压力,进而实现了纯合藻株的获取。
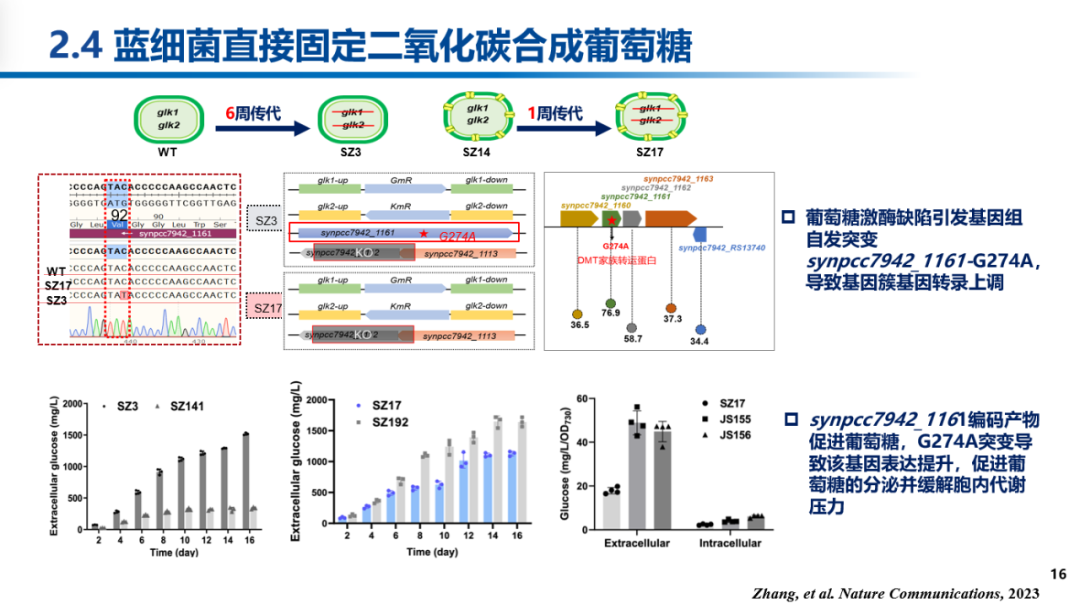
研究团队还对重组菌株的转录和代谢组学进行系统分析,制定了加强蔗糖合成途径、优化碳流分配的代谢工程策略,将重组藻株的葡萄糖产量提高至2 g/L,结合半连续培养策略,累积产量达到5 g/L。
该研究揭示了限制蓝细菌光驱固碳合成葡萄糖潜力的遗传与代谢因素,更新了对天然蔗糖代谢机制的认识,在没有异源催化或运输基因的情况下,通过葡萄糖激酶活性人工阻断和工程藻株基因组自发突变的结合,成功将光合作用固定的二氧化碳重定向至葡萄糖的合成和分泌途径中。基于相关发现构建了高效光驱固碳合成葡萄糖蓝细菌细胞工厂,并为未来发展更高效的葡萄糖定向生产技术及工业化利用奠定了基础。
蓝细菌可控超突变技术及高温高光耐受性进化
高温高光胁迫是影响蓝细菌及其它光合生物光合固碳效率与稳定性的严重威胁,因此,解析高温高光耐受机制、提高蓝细菌高温高光耐受性具有重要的科学和技术意义。理性的代谢工程策略难以实现细胞高温高光耐受性的有效提升,进化工程是改造此类复杂生理表型的有效手段。然而,微生物细胞基因组复制的高保真性和低突变率,导致经典的实验室适应性进化需要长时间连续传代以积累遗传多样性,周期长而且依赖反复人工操作。
栾国栋研究员带领研究组以蓝细菌模式藻株聚球藻PCC 7942为平台,系统鉴定了影响其基因组复制保真性的关键基因,并通过保真元件敲除-诱变元件表达的整合策略将重组藻株复制突变率提高了两个数量级。在此基础上,研究组还发现,环境胁迫同样可以影响聚球藻突变率,通过遗传保真机制缺陷与培养环境胁迫的耦合可以触发超突变状态,将细胞突变率提高三个数量级。根据上述结果,研究团队提出环境胁迫和复制保真机制缺陷的协同作用机制,并使用该系统对聚球藻高温高光耐受能力进一步优化。
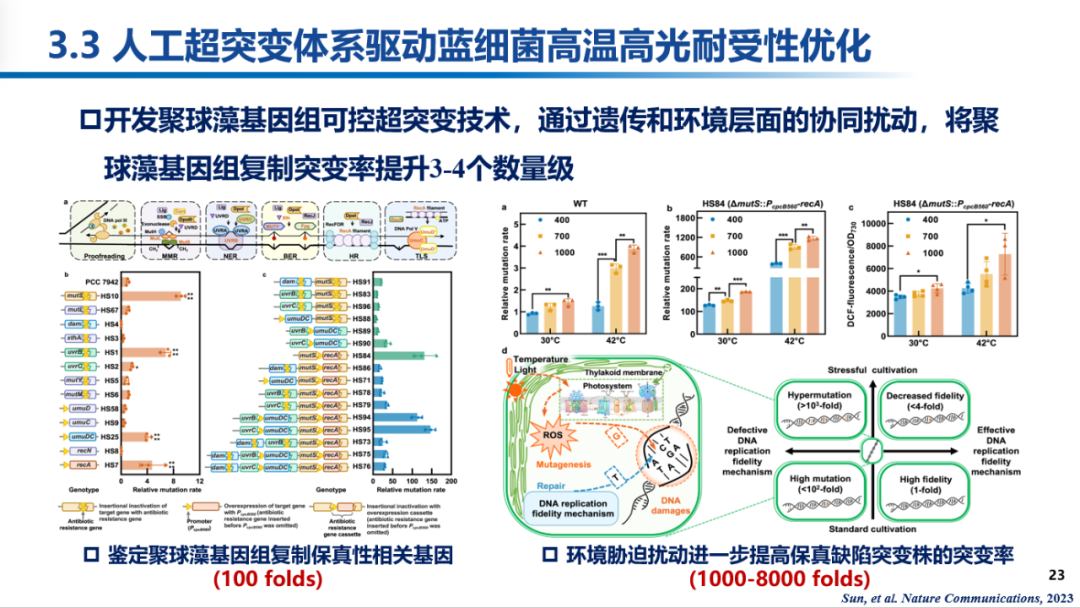
应用上述超突变系统,可在两周内即成功获得高温高光耐受能力大幅提升的聚球藻进化藻株,相比实验室适应性进化和常规化学诱变表现出效率上的巨大优势。在出发藻株无法生存的45 ℃高温和2500 μmol photons/m²/s光照条件下,聚球藻进化藻株表现出良好的适应性和快速生长能力。
经过对获得的23个高温高光耐受藻株进行了全基因组测序,并结合正向遗传学和反向遗传学策略的应用,栾国栋研究组锁定了赋予聚球藻高温高光耐受能力的主效突变为FoF1-ATP合成酶alpha亚基C252Y突变和莽草酸激酶启动子区域的NC2突变。其中,NC2突变通过提高莽草酸激酶表达水平从而导致聚球藻高温高光耐受性的机制为首次报道。研究组在集胞藻PCC 6803中对该机制进行了验证,通过莽草酸激酶的过量表达有效提升了重组藻株面对高温和高光胁迫的生长稳定性,表明该策略具有对不同蓝细菌菌株广泛适用的可能性。
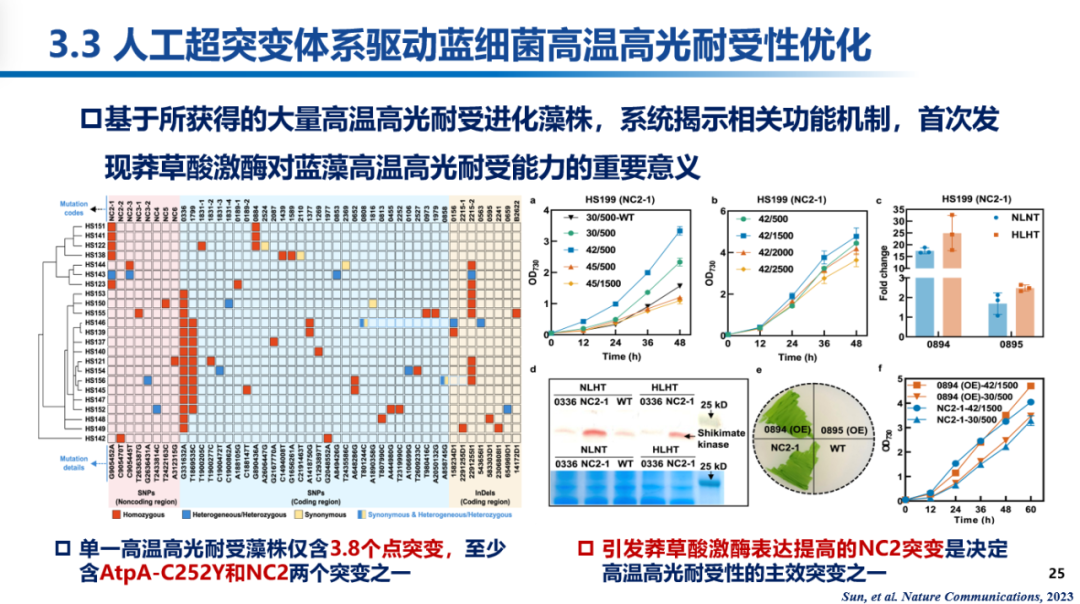
研究组进而对NC2突变通过上调莽草酸激酶表达提高聚球藻高温高光耐受能力的机制进行深入解析,结合转录组、蛋白组以及光合生理参数分析发现,该突变引发聚球藻光合和固碳系统的显著变化,减少了光能的过度吸收、增强了细胞循环电子流和氧化磷酸化活性并强化了糖原和蛋白合成,最终保证高效而稳定的光合固碳过程。
该研究发展了新型蓝细菌超突变系统并通过聚球藻高温高光耐受性改造证实了其有效性,为复杂光合生理表型的优化提供了可靠的工具;研究中所发现的莽草酸激酶表达提升引发蓝细菌高温高光耐受能力优化的现象,丰富了对光合生理代谢的认识,为未来高效蓝细菌底盘的人工设计提供了新的启示。
专家介绍

栾国栋 研究员
栾国栋,博士,研究员,中国科学院青岛生物能源与过程研究所微生物制造工程中心副主任、蓝细菌合成生物技术研究组组长,Green Carbon主编助理,Green Carbon青年编委。主要从事蓝细菌生理与合成生物技术研究,从光合抗逆与固碳合成两个层面提升底盘细胞的性能,构建高效光合细胞工厂并发展新型光合生物制造技术。基于相关研究,以第一作者和通讯作者身份在Nature Communications、ACS Synthetic Biology、Biotechnology Advances等期刊上发表论文20余篇;主持国家自然科学基金4项、国家重点研发计划课题1项;入选山东省泰山学者青年专家、中国科学院特聘研究骨干。
原文链接
栾国栋研究员与Green Carbon丨蓝细菌适应性进化与光驱固碳合成
Green Carbon
期刊官网:Green Carbon官网
投稿网址:Green Carbon投稿
公众号:Green Carbon公众号

https://wap.sciencenet.cn/blog-3620330-1499086.html
上一篇:Green Carbon绿碳文章 │ 中国科学院大连化物所吴小锋研究员:钯催化乙烯氧化双烷氧羰基化生成琥珀酸衍生物
下一篇:Green Carbon│华中农业大学晏水平教授、榆林学院梁飞虹副教授:沼液耦合生物质灰用于CO₂的绿色捕集及农业利用