
英文原题:Microbial L-malic acid production: History, current progress, and perspectives
作者:Yongyan Xi, Feiyu Fan*, Xueli Zhang*
01 论文信息
论文信息
Y.Xi, F. Fan, X. Zhang. Microbial L-malic acid production: History, current progress, and perspectives[J]. Green Carbon 2023 1(2) 118-132.
论文关键词
L-malic acid; Microbial biosynthesis; Metabolic engineering
论文网址
https://doi.org/10.1016/j.greenca.2023.10.005
论文下载
Microbial L-malic acid production: History, current progress, and perspectives
中文解读原链接
Green Carbon│中国科学院天津工业生物所张学礼研究员综述:生物合成左旋苹果酸的研究进展
02 背景简介
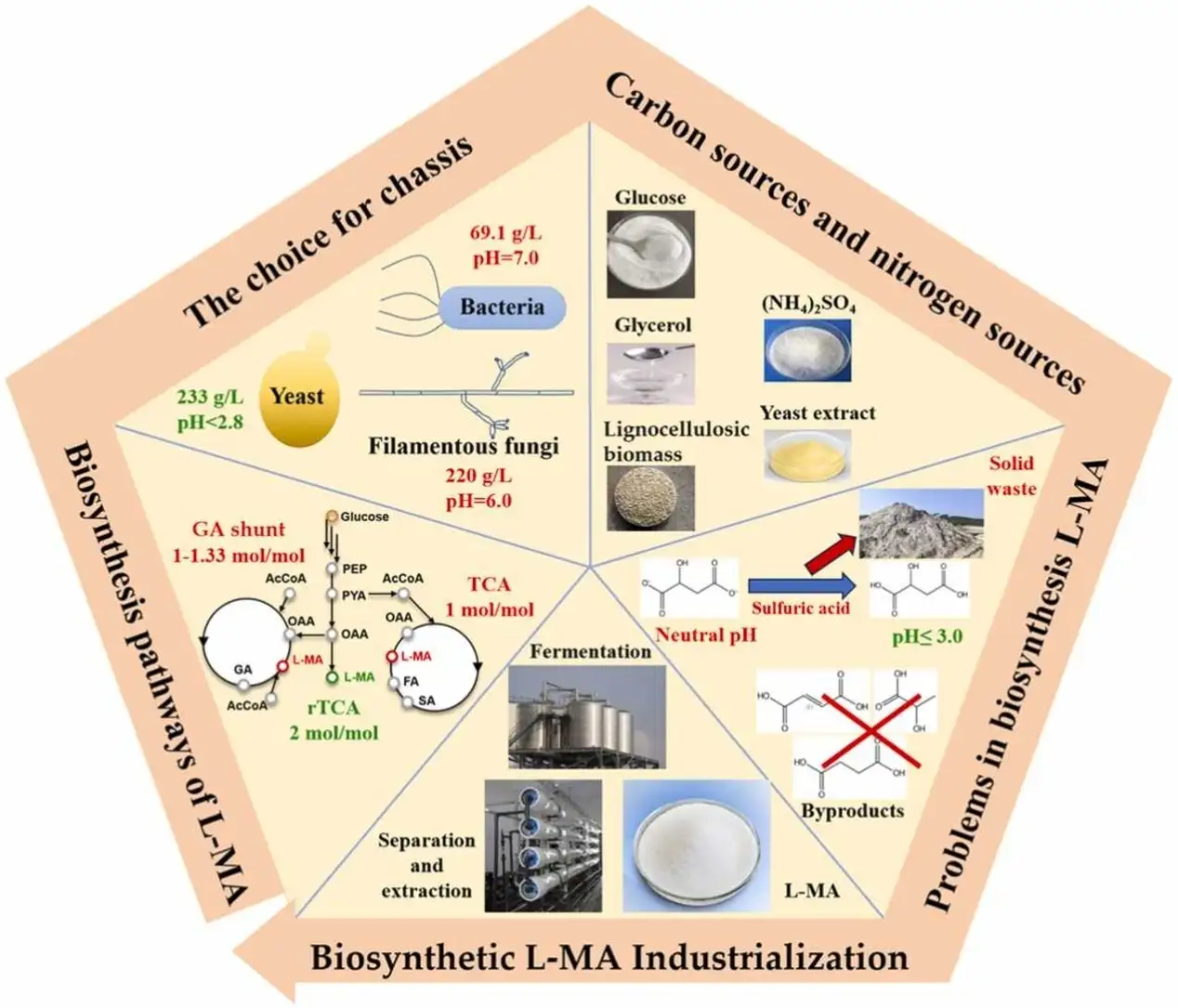
微生物生产L-苹果酸的相关技术示意图
苹果酸,也被称为2-羟基丁二酸,其分子结构中包含一个不对称的碳原子,因此被分为左旋苹果酸(L-苹果酸)和右旋苹果酸(D-苹果酸)。值得注意的是,由于D-苹果酸无法被人体消化吸收,美国已禁止其在婴幼儿食品中的使用。然而,L-苹果酸作为三羧酸循环中的关键中间体,广泛存在于生物体内。得益于其优越的理化性质,L-苹果酸在食品、制药和化工行业中有着广泛的应用。鉴于苹果酸具有显著的商业价值,美国能源部已将其列为12种重要大宗化学品之一。据估计,全球苹果酸市场规模每年约为6万吨至20万吨,预计年增长率为4%。随着合成生物学的快速发展,以及全球对绿色经济和可持续发展的需求,L-苹果酸的大规模生产正逐渐从传统的石油化工法过渡到微生物发酵法。为了推动生物合成L-苹果酸技术的发展,中国科学院天津工业生物技术研究所的张学礼团队在Green Carbon上发表了一篇题为“Microbial L-malic acid production: History, current progress, and perspectives”的综述文章。该文全面回顾了微生物合成L-苹果酸的历史背景和最新进展,论述了微生物发酵生产L-苹果酸工业化过程中所面临的挑战,并对相应的解决方案进行了总结。
03 文章简介
合成途径
微生物合成L-苹果酸的产业化主要涉及合成途径、底盘细胞的选择、碳氮源种类的选择和生物合成L-苹果酸亟待解决的问题四个方面。
合成途径决定了糖酸转换率的上限,微生物天然可以通过三羧酸循环(tricarboxylic acid cycle,TCA cycle)、乙醛酸旁路(glyoxylate shunt)和还原型三羧酸途径(reductive tricarboxylic acid cycle,rTCA cycle)合成L-苹果酸,这三种途径的最高理论转化率分别是1 mol L-苹果酸/mol葡萄糖、1.33 mol L-苹果酸/mol葡萄糖和2 mol L-苹果酸/mol葡萄糖,其中具备最高理论转化率的rTCA被作为首选的L-苹果酸合成途径,该途径包含丙酮酸羧化酶催化的羧化反应和苹果酸脱氢酶催化的还原反应。
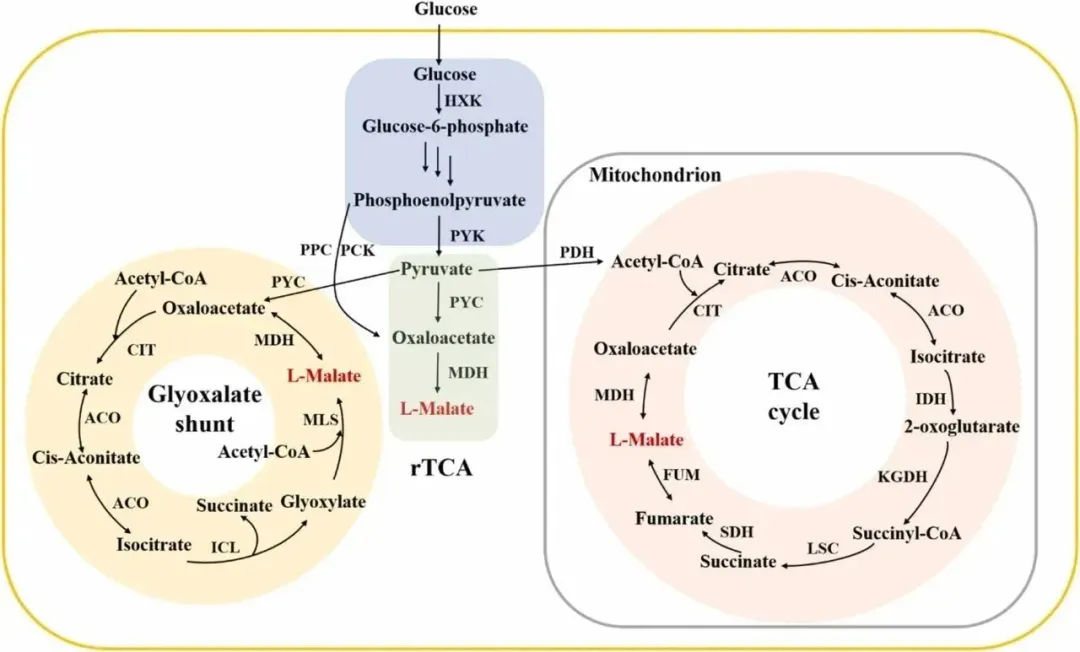
L-苹果酸的合成途径
底盘细胞
细菌
底盘细胞决定了改造后菌株生产L-苹果酸能力的上限。目前,用于改造合成L-苹果酸的底盘主要包含细菌、酵母和丝状真菌,其中大肠杆菌(Escherichia coli)和芽孢杆菌(Bacillus)等细菌具备遗传背景清晰、操作简单、易于培养和代谢速率快等优点,已经被应用于工业化生产丁二酸、L-丙氨酸和L-乳酸等大宗化学品。然而细菌生长需要中性环境,在生产L-苹果酸时需要添加大量的中和剂,且通过复杂的代谢改造后的L-苹果酸产量仍低于90 g/L,与工业化需求相差甚远,因此,细菌不是优选的生产L-苹果酸的底盘细胞。
酵母
与细菌相比,酵母具有优异的耐酸性状,代谢改造后的酵母可以在低pH条件下生产L-乳酸、L-苹果酸和丁二酸等有机酸。酵母的耐酸特性大幅度减小发酵产酸时中和剂的添加量,并简化下游分离提取的过程,从而降低生产成本。因此,酵母生产有机酸的能力具有天然优势。1924年,美国生物化学家Henry Drysdale Dakin首次在酿酒酵母产乙醇的发酵液中检测到L-苹果酸,然而除了鲁氏酵母(Zygosaccharomyces rouxii)外,大多数的酵母因为不同的原因而不具备大量积累L-苹果酸的能力,如野生的酿酒酵母因还原三羧酸途径中的苹果酸脱氢酶在葡萄糖存在的情况下容易被降解,导致菌株不能在发酵液中大量积累L-苹果酸;而不具备向胞外转运L-苹果酸的能力是限制野生的库德里阿兹威毕赤酵母(Pichia kudriavzevii)生产L-苹果酸的主要因素。通过改造酵母的代谢途径、优化辅因子供给、加强菌株向胞外转运L-苹果酸的能力,研究人员已经得到在pH 3.1条件下生产199 g/L L-苹果酸的库德里阿兹威毕赤酵母;类似地,通过适应性驯化、改造酵母的代谢途径、筛选向胞外转运L-苹果酸的转运蛋白突变体,得到了可以在无中和剂条件下生产233 g/L L-苹果酸的酿酒酵母菌株。
丝状真菌
与酵母相似,丝状真菌具有较好的耐酸性状,在工业上被用于生产衣康酸和柠檬酸等有机酸,且自然界中天然分泌L-苹果酸的微生物大多数是丝状真菌,其中以米曲霉(Aspergillus oryzae)生产L-苹果酸的性能最为突出。此外,丝状真菌具有代谢木糖、葡萄糖、蔗糖、甘油等多种碳源的优点,所以丝状真菌作为生产L-苹果酸的底盘细胞具有天然优势。但是丝状真菌发酵生产L-苹果酸存在发酵周期长、菌丝易结节和需要添加大量中和剂等缺点。为了解决以上问题,研究人员进行了大量的实验。目前可以通过加强还原型三羧酸途径、葡萄糖转运和糖酵解途径的限速步骤大幅度提升丝状真菌生产L-苹果酸的能力,并缩短发酵周期;结合失活副产物途径的关键酶或向胞外转运副产物的转运蛋白达到消除相应副产物的效果,经过以上两种策略改造的黑曲霉(Aspergillus niger)消除了副产物草酸和柠檬酸的积累,在中性条件下可以积累201 g/L L-苹果酸。通过优化搅拌、通气等发酵参数和酪氨酸蛋白磷酸酶CDC14、后期促进复合体/环体激活蛋白CDC20、细胞分裂控制蛋白CDC45等细胞分裂周期蛋白的表达,使米曲霉的细胞处于不易结节且高效生产L-苹果酸的形态,最终在中性条件下可以生产143 g/L L-苹果酸;此外,通过诱变技术及合适的筛选方法也可以得到不积累副产物的L-苹果酸的细胞工厂,如戴尔根霉(Rhizopus delemar)经诱变筛选后不再合成副产物乙醇和丁二酸,并能在中性条件下积累122 g/L L-苹果酸。然而,目前丝状真菌生产L-苹果酸均需要将发酵pH控制在中性,不能在低pH条件下生产高浓度L-苹果酸,且相关机制仍不清晰,所以丝状真菌生产高浓度L-苹果酸的技术仍需要迭代升级。
碳氮源种类的选择
碳源
葡萄糖作为自然界中含量最丰富的单糖,是大多数微生物代谢的碳源。因此,以往的研究工作主要集中在利用葡萄糖生产L-苹果酸。然而随着合成生物学的发展,生物基化学品逐渐替代传统的有机化学品,对于碳源的需求量逐年增加,所以开拓寻找更多发酵碳源势在必行。粗甘油是生物柴油的副产品,约占生物柴油生产总量的10%,所以粗甘油是一种适用于工业发酵且具有经济优势的碳源。目前通过生长筛选、适应性驯化得到的稗黑粉菌(Ustilago trichophora)利用甘油生产L-苹果酸的性能最佳,在中性条件下高密度发酵可以积累195 g/L L-苹果酸,但生产速率仅为0.74 g/L/h,存在发酵周期长的缺点。
另一种值得关注的碳源是木质纤维素生物质,由纤维素、半纤维素和木质素组成,其中纤维素由葡萄糖聚合而成,是自然界中最为丰富的多糖。目前利用纤维素生产L-苹果酸性能最好的菌株是改造后的嗜热毁丝菌(Myceliophthora thermophila),可以利用微晶纤维素生产181 g/L L-苹果酸,但会积累15.4 g/L丁二酸。木糖经由半纤维素的主要成分木聚糖水解而成,是木质纤维素生物质中含量第二高的糖类,目前转化木糖为L-苹果酸的最佳性能菌株是热带醋酸杆菌(Acetobacter tropicalis),在中性条件下积累L-苹果酸87 g/L,与工业化生产仍有较大差距。此外,研究人员也尝试利用淀粉、醋酸、甲醇等其他碳源生产L-苹果酸,为工业生产L-苹果酸的碳源提供了更多选择,但仍需要进一步提升相关菌株的生产性能。
氮源
氮源被认为是发酵培养基中仅次于碳源的第二大关键因素,氮源的添加量和种类对发酵结果有重要影响。氮源可分为有机氮源和无机氮源,前者比后者更有利于L-苹果酸的生产。例如与硫酸铵相比,胰蛋白胨作为氮源可以延长米曲霉的对数期,导致L-苹果酸的产量提升32.7%;类似地,使用酵母提取物替代硫酸铵作为氮源可以将毕赤酵母(Pichia pastoris)的L-苹果酸产量由不足1 g/L提升至2.79 g/L。此外,氮源的浓度对发酵结果具有显著影响。转录组显示在氮源匮乏时,米曲霉糖酵解和还原三羧酸途径的基因表达水平显著上调,而三羧酸循环相关基因表达显著下调,表明L-苹果酸在米曲霉中的积累是对氮源匮乏的应激反应。虽然过多的氮源使得菌株将碳源用于生长,导致L-苹果酸的产量与氮源浓度呈负相关,但是过少的氮源会严重限制菌株的生长和合成L-苹果酸途径相关酶的合成,也会导致L-苹果酸积累减少。所以需要探索底盘细胞对于氮源的需求量,才能使菌株生产L-苹果酸的性能处于最佳状态。
生物合成L-苹果酸亟待解决的问题
中和剂的使用
在大多数微生物发酵生产羧酸的过程中,需要添加大量的中和剂以维持中性pH环境,所得产物羧酸盐需要被无机酸(如硫酸或盐酸)置换以形成羧酸分子,这一过程伴随着大量工业废液、废固的产生。因此,使用中和剂不仅使下游分离提取工艺复杂化,还会带来环境污染和总生产成本增加的问题。例如,在丁二酸、L-苹果酸和乳酸工业生产中,添加大量中和剂使有机酸的分离提取成本占总成本的50%以上。
一些耐酸微生物宿主可在pH值为3.0的条件下进行发酵,此时羧酸主要以分子形式存在,从而简化了下游分离提取过程。目前,生产L-苹果酸主要以碳酸钙为中和剂,不仅可以控制发酵过程中pH,也为还原型三羧酸途径的羧化反应提供反应底物二氧化碳。在过去的六十年中,研究人员发现L-苹果酸的产量与中和剂的添加量呈正相关,如碳酸钙的用量从0 g/L增至60 g/L导致黄曲霉(Aspergillus flavus)的L-苹果酸产量由2.2 g/L增至53.6 g/L;而减少中和剂的添加导致发酵pH降低,当pH值由6.5降至4.5时,稗黑粉菌(Ustilago trichophora)的苹果酸产量由113 g/L降至9 g/L。因为目前未有丝状真菌在低pH条件下生产高浓度L-苹果酸的成功案例,所以导致该现象的相关机制仍不清晰。2023年,研究人员采用两种策略成功构建了两种在低pH条件下生产高浓度L-苹果酸的酵母菌株,一种策略是以天然耐酸菌株库德里阿兹威毕赤酵母为底盘细胞进行代谢改造,得到L-苹果酸细胞工厂,研究人员发现过表达大肠杆菌来源的可溶性吡啶转氢酶EcSthA是库德里阿兹威毕赤酵母低pH生产L-苹果酸的关键,通过转录组和代谢物组分析发现过表达EcSthA引发还原型辅酶II(NADPH)与氧化型辅酶II(NADP+)之间的循环,从而激活菌株磷酸戊糖途径,并增加胞质中还原型辅酶I(NADH)的浓度,为还原型三羧酸途径的苹果酸脱氢酶提供充足的辅因子NADH,使得菌株在pH值为3.1的条件下积累L-苹果酸199 g/L,相应的生产速率和转化率分别为1.86 g/L/h和0.94 g/g葡萄糖。因此,细胞质中辅因子NADH供应不足是限制库德里阿兹威毕赤酵母低pH条件下积累高浓度L-苹果酸的主要因素。另一种策略是将酿酒酵母模式菌驯化为耐酸菌株,再进行代谢改造得到无中和剂发酵生产L-苹果酸的细胞工厂,在pH值约为2.8的条件下积累L-苹果酸233 g/L,相应的生产速率和转化率分别为1.62 g/L/h和0.66 g/g葡萄糖。由于有机酸对菌株的胁迫是多方面的,目前低pH生产L-苹果酸的成功案例较少,所以研究人员对低pH条件下生产L-苹果酸的机制的了解仍然有限,需要进一步深入研究,以阐明相关分子机制。
副产物
转化率是工业化生产的重要指标,而副产物的积累不仅导致碳源浪费和转化率降低,也增加了下游分离提取的难度和成本。在生物合成L-苹果酸的过程中通常会积累丁二酸、富马酸、丙酮酸、柠檬酸和乙酸等副产物,这些副产物约占总产量的10-15%,所以减少副产物的积累对于生物合成L-苹果酸产业化至关重要。由于不同底盘细胞积累副产物的种类和机制存在差异,研究人员需要针对不同的底盘细胞采用合适的策略。
1. 改造底盘细胞的代谢途径
1)采用过表达相关酶的方式增强合成主产物的途径。
2)阻断副产物的合成途径。如果合成副产物的途径不是菌株生长和合成主产物所必需的,则敲除副产物合成关键酶以实现完全消除副产物,如乳酸、乙醇、甘油、乙酸和草酸等;但该策略并不适用于消除丙酮酸,因为丙酮酸是菌株生长必需的中间产物,且是合成L-苹果酸的前体。
3)增强消耗副产物的途径。如在米曲霉中过表达酿酒酵母来源的富马酸酶,促进富马酸转化为L-苹果酸,使得副产物丁二酸和富马酸的积累分别减少32.1%和54.3%。
4)优化辅因子的供给。针对不同底盘细胞的策略存在差异,如在库德里阿兹威毕赤酵母中增加NADH的供给,将副产物丙酮酸的产量降低63.3%,但不影响副产物丁二酸的积累;而在米曲霉中降低NADH的含量导致副产物丁二酸减少36.7%。
2. 调节底盘细胞的转运蛋白
1)筛选合适的外排L-苹果酸转运蛋白。如酿酒酵母、库德里阿兹威毕赤酵母等酵母偏好过表达粟酒裂殖酵母(Schizosaccharomyces pombe)来源的二羧酸转运蛋白SpMAE1,而黑曲霉、米曲霉、嗜热毁丝菌等丝状真菌更偏好利用米曲霉来源的二羧酸转运蛋白AoMAE1,特别是在嗜热毁丝菌中过表达SpMAE1对于L-苹果酸的积累毫无效果。此外,研究人员通过筛选合适的AoMAE1突变体使得嗜热毁丝菌的L-苹果酸产量提升68%,副产物丁二酸的积累减少26.8%。
2)通过失活细胞膜上副产物的转运蛋白减少或消除副产物的积累。如通过失活黑曲霉细胞膜上的柠檬酸转运蛋白消除柠檬酸的积累,但是该方法不适用于消除富马酸和琥珀酸等二羧酸,因为目前报道的二羧酸转运蛋白对L-苹果酸不具备严格的特异性。
3)合理利用线粒体膜上的羧酸转运蛋白。针对不同底盘细胞采用不同策略,在毕赤酵母中失活线粒体膜上的L-苹果酸转运蛋白ODC,使副产物丁二酸和富马酸分别减少71.8%和50.9%;在酿酒酵母中过表达线粒体膜上的丁二酸/富马酸转运蛋白SFC1,将副产物丁二酸和富马酸分别降低36.8%和46.6%。
3. 优化发酵参数
由于合成L-苹果酸是菌株对氮源匮乏的应激反应,所以通过控制发酵培养基的碳氮比,可以将米曲霉的副产物富马酸减少91.7%。此外,当米曲霉以乙酸作为碳源进行发酵时,产物的类型和比例随乙酸的浓度而变化。当乙酸浓度为10 g/L时,草酸占总产物的98.6%,而乙酸浓度增加到20 g/L时,L-苹果酸、丁二酸和草酸在总产物中所占的比例分别为35.6%、23.3%和37.1%。因此,当其他策略无法有效减少或消除副产物时,优化发酵条件可以产生意想不到的效果。
结论与展望
在过去100年中,利用微生物生产L-苹果酸取得了长足的进步。代谢工程和合成生物学的出现促进了各种微生物(包括细菌、酵母和丝状真菌)合成L-苹果酸的进程。在未来的研究中,结合生物信息学、人工智能和定量合成生物学等学科,更细致地了解微生物的新陈代谢,有助于合理设计理想的L-苹果酸细胞工厂。此外,结合下游工艺优化,如原位分离等技术,生物合成L-苹果酸工业化未来可期。
04 文章摘要

Abstract
L-malic acid (L-MA) is an important intermediate in the tricarboxylic acid cycle and a crucial bulk chemical with various applications in the food, pharmaceutical, and chemical industries. With the rapid advancements in metabolic engineering technology and the global commitment toward fostering a green economy and sustainable development, the large-scale production of L-MA is gradually transitioning from conventional petroleum-based approaches to microbial fermentation. This comprehensive review aims to provide a thorough overview of the historical background and recent advancements in the microbial fermentation production of L-MA, encompassing an in-depth introduction to diverse biosynthetic pathways and host strains. Moreover, this review elucidates the challenges encountered in the industrialization of microbial fermentation production of L-MA, offering a summary of potential solutions and prospects for future research directions. The anticipated outcome of this review is to contribute valuable theoretical guidance toward promoting technological innovation in L-MA production.
05 作者简介

张学礼 研究员
张学礼博士,中国科学院天津工业生物技术研究所二级研究员,博士生导师,Green Carbon编委会委员,入选多项国家级、省部级人才计划,并以第一完成人获中国轻工业联合会技术发明一等奖、中国专利优秀奖、安徽省科技进步二等奖、中国产学研合作促进会产学研合作创新成果奖等。主要从事应用合成生物学技术构建高效微生物细胞工厂,生产氨基酸、维生素、材料化学品和植物天然产物,以及运用基因编辑技术用于遗传疾病的基因治疗。在细胞工厂方面开发的14个化学品已完成技术转让,其中L-丙氨酸、丁二酸、D-乳酸、缬氨酸实现了万吨级产业化,新增产值49亿元,支撑一家企业在科创板上市。基因编辑方面开发的新型GBE碱基编辑技术,是国际上首次在哺乳动物细胞中实现碱基的颠换编辑。相关成果在Nature Biotechnology等期刊发表SCI文章110余篇,已布局包含国内外145项知识产权,其中获中国授权专利60项、国际专利12项。
06 Green Carbon
期刊官网:Green Carbon官网
投稿网址:Green Carbon投稿
公众号:Green Carbon公众号

转载本文请联系原作者获取授权,同时请注明本文来自GreenCarbon科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3620330-1492351.html?mobile=1
收藏

