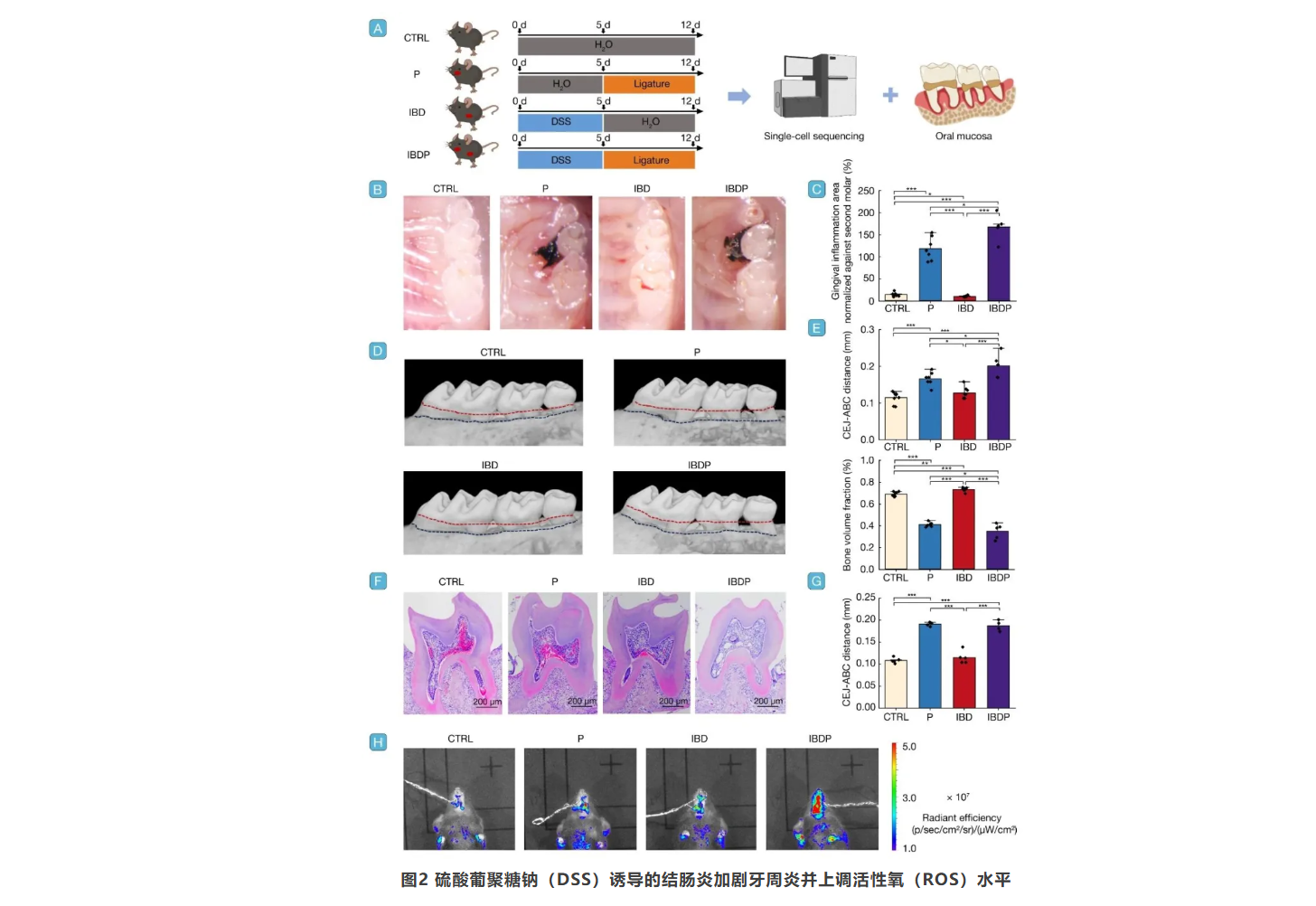
右旋糖酐硫酸钠(DSS)诱导的结肠炎加重牙周炎症
通过建立对照组(CTRL)、DSS诱导的结肠炎组(IBD)、非DSS处理但结扎诱导的牙周炎组(P)以及DSS诱导的结肠炎和结扎诱导的牙周炎组(IBDP)模型,发现DSS诱导的结肠炎确实加剧了牙周炎炎症。通过活体成像系统监测牙周组织中的活性氧(ROS)水平,发现结肠炎不仅加剧了牙周炎症,还显著提高了牙周组织中的ROS水平(图2)。
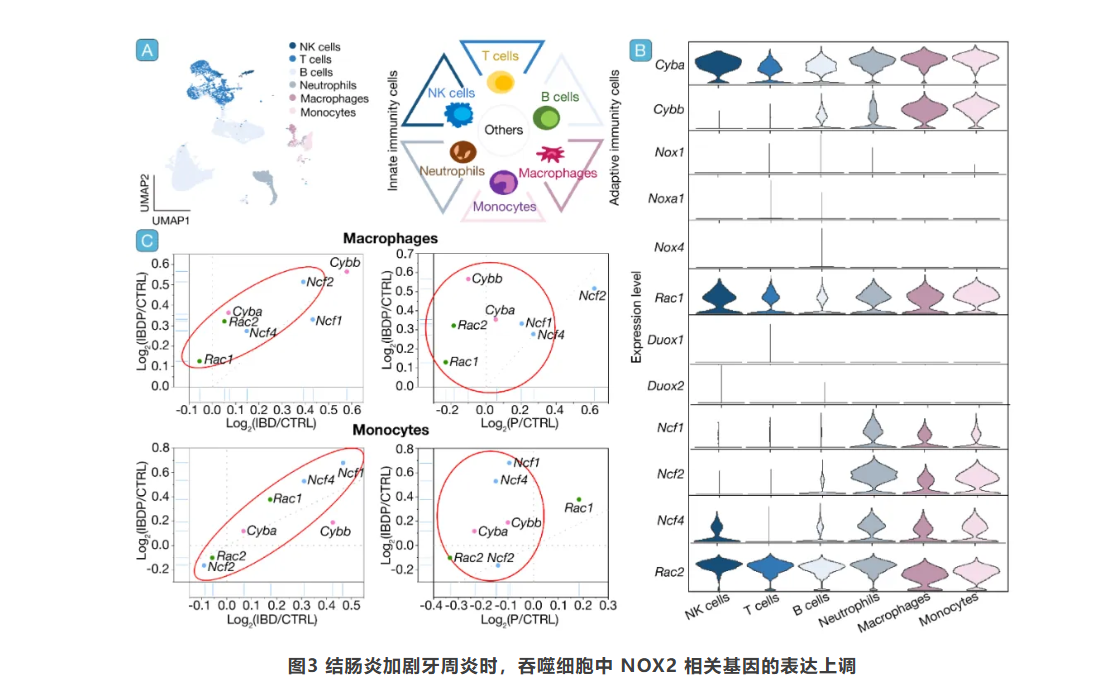
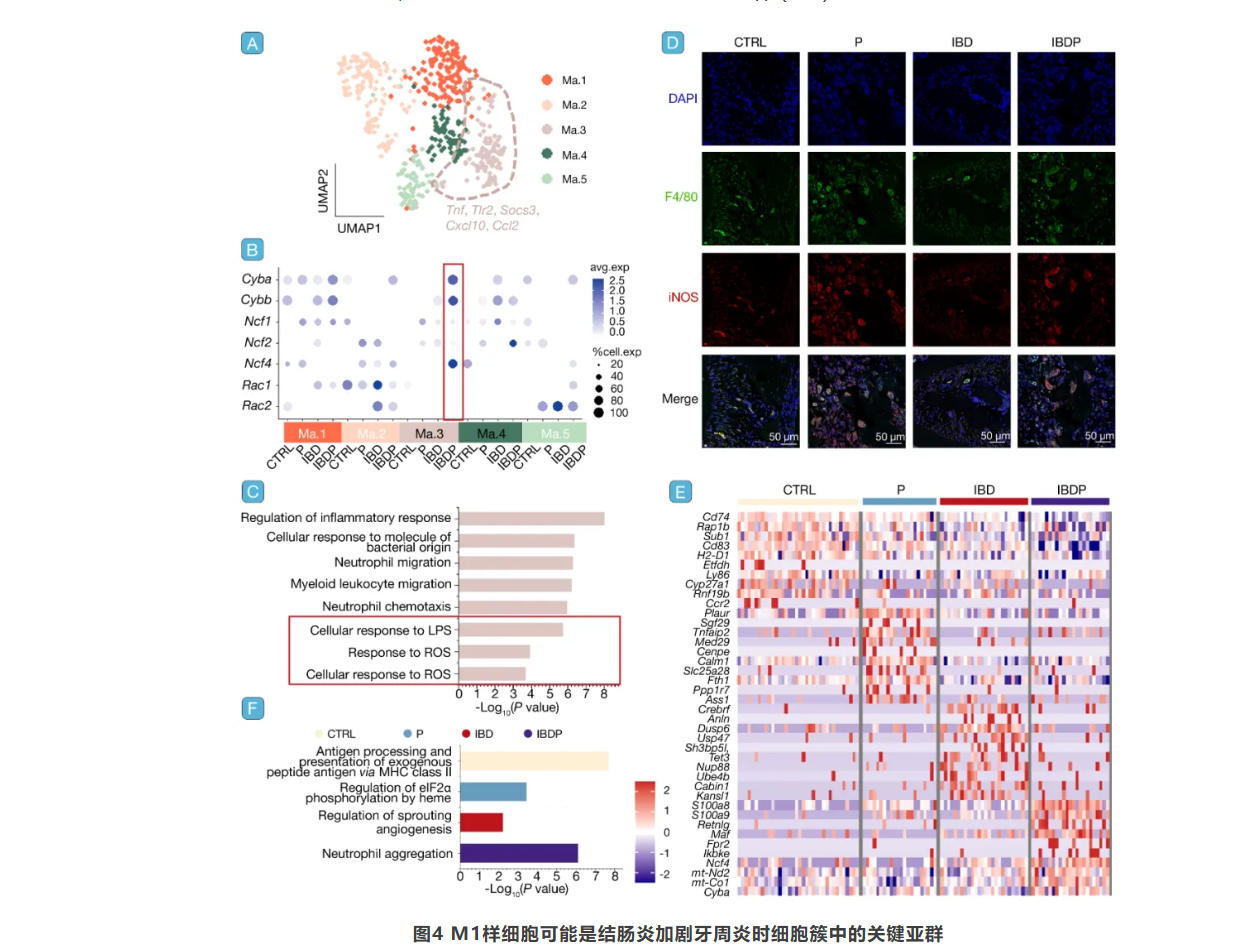
M1样巨噬细胞在牙周炎加剧中的关键作用
通过对巨噬细胞亚群的分析,发现Ma.3亚群在IBDP组中高表达NADPH相关基因,暗示其可能是加剧牙周炎的关键细胞群。Ma.3亚群高表达的基因包括炎症和先天免疫相关因子,且其显著富集的通路包括炎症反应调控、对细菌来源分子的细胞反应、中性粒细胞迁移等。免疫荧光染色进一步证实,IBDP组牙周组织中M1型巨噬细胞的浸润显著增加。此外,Ma.3亚群还表现出与中性粒细胞聚集相关基因的上调,这与ROS反应通路相关的基因特征一致(图4)。
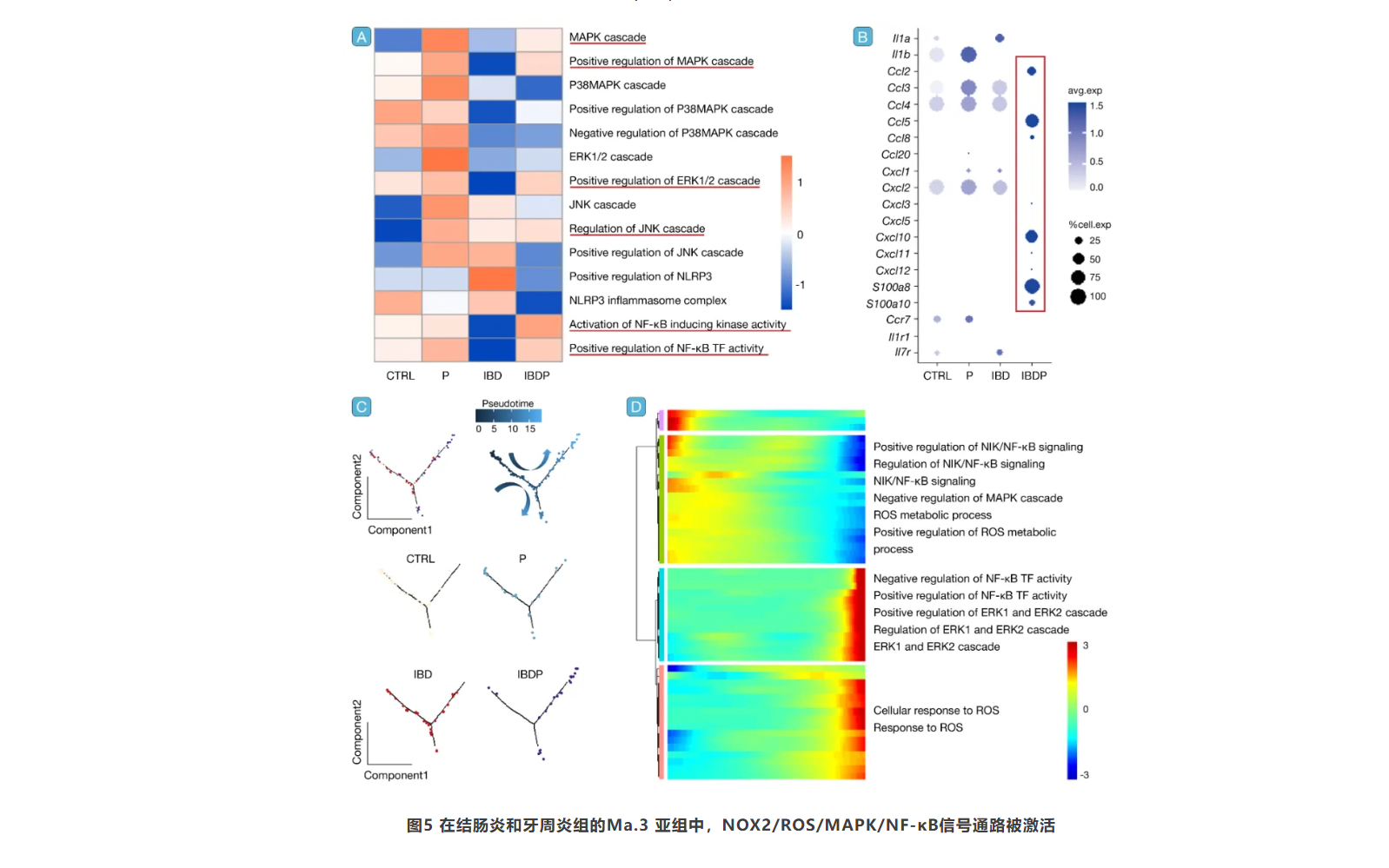
NOX2/ROS/MAPK/NF-κB信号通路的激活
研究进一步聚焦于NOX2/ROS通路,发现IBDP组中MAPK ERK1/2、JNK和NF-κB通路显著激活。结果表明,M1样巨噬细胞可能是NOX2/ROS/MAPK/NF-κB通路中加剧牙周炎的关键细胞,而PKCδ可能是潜在的上游调控因子(图5)。
NOX2抑制剂的治疗潜力
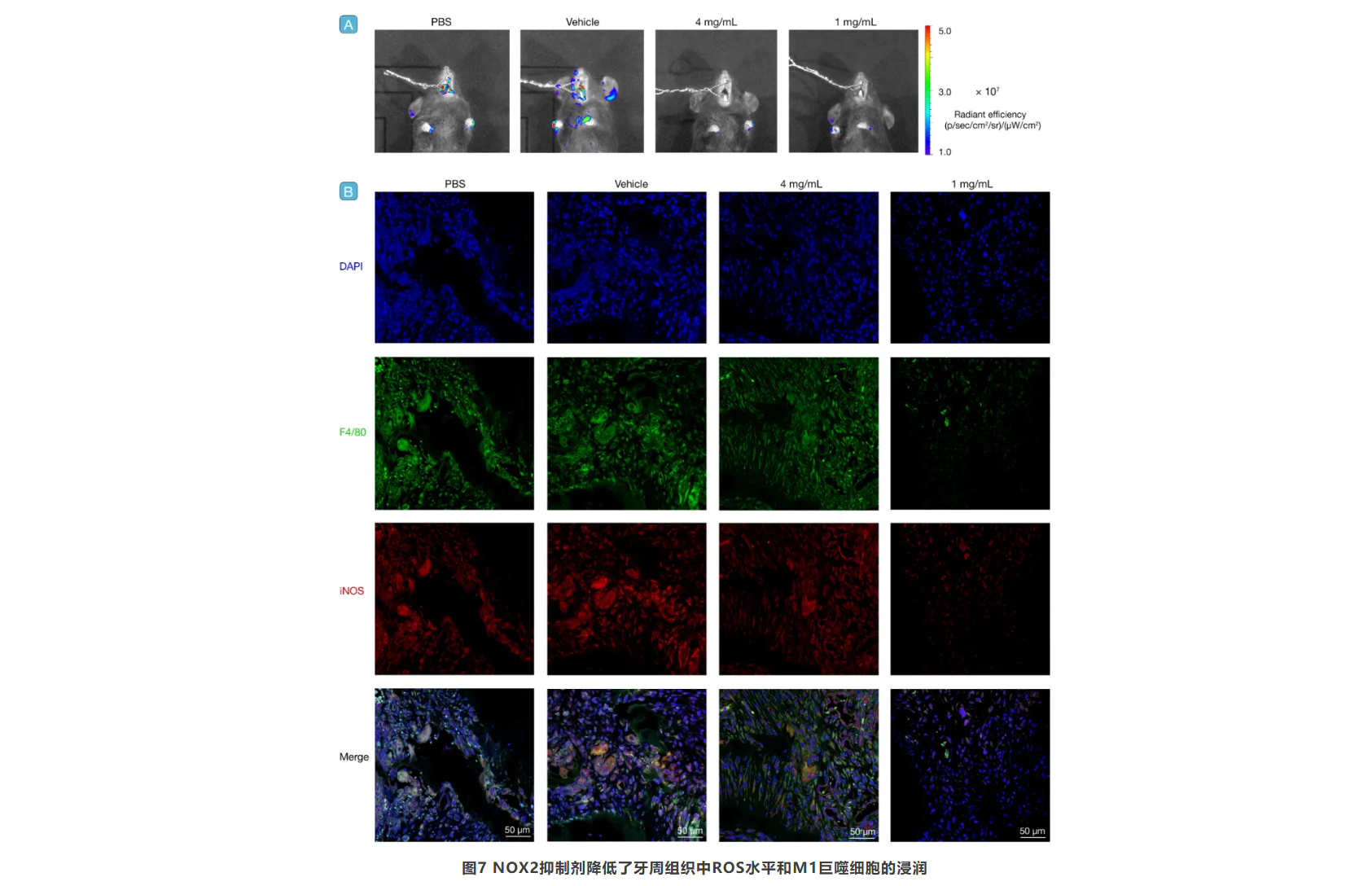
为验证NOX2/ROS轴的治疗潜力,研究团队在DSS诱导的结肠炎和牙周炎小鼠模型中使用了NOX2抑制剂。结果显示,NOX2抑制剂显著减轻了牙周炎引起的牙龈肿胀、炎症和牙槽骨破坏(图6)。活体成像和免疫荧光染色进一步证实,NOX2抑制剂显著降低了牙周组织中的ROS水平和M1型巨噬细胞的浸润(图7)。

NOX2 抑制剂的使用可减轻牙周和肠道微生物群的扰动
除此之外还发现,NOX2 抑制剂组口腔微生物群落多样性更高,口肠共享微生物类群减少(图8)。说明NOX2 抑制剂能够减轻牙周和肠道微生物群的扰动。
综上所述,本研究为理解牙周炎和IBD之间的相互作用提供了新的分子机制,并为开发新的治疗策略提供了潜在靶点。通过调控NOX2/ROS轴,未来可能能够有效减轻或预防由结肠炎加剧的牙周炎,从而改善患者的生活质量。
作者简介

徐田松 助理研究员
第一作者
机构:北京大学口腔医院
研究方向:口腔微生态及疾病研究

张丽琪 博士研究生
第一作者
机构:北京大学口腔医院
研究方向:口腔微生态及疾病研究

段成钢 副主任医师
通讯作者
机构:北京大学口腔医院
研究方向:口腔微生态与疾病研究

陈峰 研究员
通讯作者
机构:北京大学口腔医院
研究方向:口腔微生态与疾病研究(微生物宏基因组学与唾液蛋白/多肽组学)
引用格式:Xu T, Zhang L, Li M, et al. Dextran sulfate sodium-induced colitis exacerbates periodontitis via the NADPH oxidase 2/reactive oxygen species axis in M1-like macrophages. hLife 2025; https://doi.org/10.1016/j.hlife.2025.01.006.
期刊简介
hLife由高福院士、董晨院士和Jules A. Hoffmann教授(2011诺奖获得者)领衔,是中国科学院微生物研究所主办,中国生物工程学会,浙江大学陈廷骅大健康学院,西湖大学医学院,上海市免疫治疗创新研究院和广州霍夫曼免疫研究所联合支持,与国际出版商爱思唯尔合作的健康科学领域综合性英文期刊。
hLife聚焦健康科学领域的前沿进展,旨在促进基础研究与临床应用的融合发展。期刊发表与医学相关各研究领域最新成果,学科领域包括(但不限于)病原生物学、流行病学、生理学、免疫学、结构生物学、疾病监测、肿瘤、药物、疫苗和健康政策等。
hLife是一本金色开放获取期刊,月刊出版;2022年成功入选“中国科技期刊卓越行动计划高起点新刊”;2023年11月正式创刊; 2024年5月被DOAJ收录;2024年8月被Scopus收录。
2026年前hLife接收的稿件免收文章处理费(APC)。
期刊网址:
https://www.sciencedirect.com/journ
转载本文请联系原作者获取授权,同时请注明本文来自闫群科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3552961-1481125.html?mobile=1
收藏


