作者说· Award系列聚焦MDPI期刊获奖学者的优秀研究成果,从突破性成果的诞生历程、关键挑战的应对策略、到领域前沿的动态研判等,深度解析研究脉络。通过研究者第一视角的立体解读,还原学术成果的构建逻辑,与您共探创新科学研究的进阶范式。
-NO.1-
学者风采
2023 IJMS 期刊
杰出青年学者奖获奖学者
李文涛 教授
华中农业大学
华中农业大学动物医学院教授、博士生导师,分别在中国和荷兰取得预防兽医学和哲学博士学位。国家高层次引进人才、武汉英才。“狮山硕彦计划”拔尖人才A岗、华中农业大学动物疫病诊断中心主任、农业农村部兽用诊断制剂创制重点实验室副主任、国家自然科学基金同行评审专家、入选科睿唯安全球高被引科学家 (2022-2023年连续入选) 和全球前2%顶尖科学家榜单(2020-2024年连续入选),农业微生物资源发掘与利用全国重点实验室和湖北洪山实验室固定研究人员。
2008年毕业于四川农业大学动物医学院,获学士学位;2008-2014年就读于华中农业大学动物医学院,获农学博士学位;2013-2014年作为联合培养博士就读于荷兰乌特勒支大学兽医学院;2015-2018年就读于荷兰乌特勒支大学兽医学院,获哲学博士学位 (兽医病毒学方向,学科排名全球第3);2015-2021年任荷兰乌特勒支大学兽医学院博士后研究员。在 Nature 和 Science 期刊权威子刊 Nature Biotechnology、Science Immunology 和Nature Structural & Molecular Biology 等期刊发表90余篇研究论文,其中以第一或通讯作者 (含共同) 在PNAS (2篇)、Nat. Commun. (1篇)、Sci. Adv. (1篇)、Emerging Infect. Dis. (2篇)、J. Virol. (4篇)等国际主流权威期刊发表40篇文章,总引用达8900余次,H-index为38,其中9篇入选ESI高被引论文,1篇文章被选为 Nat. Commun. 最具影响力和创新性的新冠相关研究论文 (排名第1) 和2020年度最具影响力的50篇论文 (排名第3)。授权发明专利 (包含1项国际专利) 7项,参与获批国家新兽药证书2项。
代表性研究成果:
1、报道全球首株针对SARS-CoV-2的治疗性单克隆抗体和能有效抑制多个变异毒株的DARPin抑制剂,并解析了其与S蛋白的复合物结构,完成抗体和抑制剂的成果转化;研制用于SARS-CoV-2等人呼吸道冠状病毒的蛋白芯片,为相关冠状病毒的血清学调查提供了高通量手段;
2、首次报道高致病性PEDV变异毒株在中国的流行及其序列特征,并开展PEDV反向遗传改造、基因工程弱毒疫苗、灭活疫苗和亚单位疫苗的研究;
3、鉴定PDCoV的受体-氨基肽酶N (APN),并揭示该病毒的来源以及跨物种感染人的潜力;
4、鉴定MERS-CoV的辅助受体,解析其S蛋白与辅助受体复合物的结构,阐明其感染宿主的种属特异性和组织嗜性的分子基础。
研究方向:
1、非洲猪瘟、动物冠状病毒和动物源性痘病毒病等重大动物疫病的诊断技术、致病机制和新型疫苗的研究;
2、新病毒的鉴定、分离培养及入侵和致病机制研究;
3、重大动物疫病抗病基因的筛选与抗病育种;
4、治疗性单克隆抗体和小分子抗病毒药物的研发。
-NO.2-
研究解码
猪急性腹泻综合征冠状病毒 (Swine Acute Diarrhea Syndrome Coronavirus, SADS-CoV) 属于冠状病毒科 (Coronaviridae) α冠状病毒属 (Alphacoronavirus),主要感染7日龄以下的仔猪,引起腹泻、呕吐和脱水等症状。此外,SADS-CoV在多种人类细胞中表现出高效复制能力,且与蝙蝠冠状病毒具有密切的亲缘关系,这表明其存在潜在的跨物种传播风险,可能对人类健康构成威胁。在本研究中,我们利用SADS-CoV病毒颗粒作为免疫原,通过免疫Balb/c小鼠并结合细胞融合技术,成功制备了六株靶向SADS-CoV纤突蛋白(S) 的单克隆抗体 (1#、3#、20#、24#、25#和32#)。这些单克隆抗体与S蛋白的结合具有高亲和力,其平衡解离常数 (KDs) 介于2.84×10⁻⁸至1.67×10⁻⁷之间。其中,mAb 3#、24#和25#特异性结合S1A结构域,而mAb 1#、20#和32#则特异性结合S1B结构域。进一步研究表明,mAb 1#、3#、20#和24#在HeLa-R19细胞中表现出中和活性,而mAb 3#、20#和24#在A549细胞中也表现出中和活性,其中mAb 24#的中和活性最高。本研究首次发现SADS-CoV能够凝集人和大鼠的红细胞,且这种凝集作用依赖于红细胞表面的唾液酸受体。特异性结合S1A结构域的单克隆抗体mAb 3#和25#能够有效抑制SADS-CoV诱导的红细胞凝集,表明SADS-S1A是结合唾液酸的主要结构域。本研究不仅为理解SADS-CoV的S蛋白功能提供了重要信息,还揭示了S1A和S1B结构域是中和抗体的主要靶点。此外,通过发现SADS-CoV的血凝活性及其与S1A结构域的关系,为开发针对SADS-CoV感染的潜在治疗策略提供了新的方向。这些单克隆抗体有望成为研究SADS-CoV病理机制和开发疫苗及治疗药物的有力工具。
-NO.3-
访谈实录
一、请问您是如何确定选题的?是什么启发您选择这个特定的研究方向或问题?
我们一直密切关注动物冠状病毒,很多危害人类生命健康的冠状病毒都是来自于动物,比如大家所熟知的新冠病毒。SADS-CoV最初于2016年在中国广东的猪群中被发现,被认为是一种源自蝙蝠的冠状病毒。SADS-CoV对养猪业具有重大威胁,主要感染7日龄以下的仔猪,导致严重的腹泻、呕吐和脱水,甚至死亡。在2016年至2017年期间,SADS-CoV在中国广东的猪群中首次爆发,导致约25,000头仔猪死亡,造成了巨大的经济损失。研究表明,SADS-CoV能够在多种哺乳动物细胞 (包括人类细胞) 中高效复制,表明SADS-CoV不仅对猪群构成威胁,还具有潜在的跨物种传播能力,这种跨物种传播的潜力引发了对公共卫生安全的担忧。我们都知道,冠状病毒的刺突 (S) 蛋白是病毒进入宿主细胞的关键结构蛋白。S蛋白通过其S1亚基与宿主细胞受体结合,并通过S2亚基促进病毒与细胞膜的融合。因此,S蛋白是开发中和抗体的理想靶点。同时单克隆抗体 (mAbs) 是一种具有高度特异性和高亲和力的免疫球蛋白,可以用于诊断、治疗和预防病毒感染。尽管SADS-CoV的发现已有数年,但关于其S蛋白的功能、靶向抗体以及血凝特性的研究还相对较少。因此,我们以此为切入点,旨在深入揭示SADS-CoV S蛋白的功能并制备靶向S蛋白的特异性抗体,为研究SADS-CoV的生物学特性提供有力工具,并为深入了解病毒的感染机制,开发有效的疫苗和治疗药物提供理论基础和依据。
二、在经历了许多不同的研究后,您在设计研究方法上有没有什么心得分享给大家?
首先,所有试验设计的基础都是建立在大量阅读文献之后的积累上,带着问题阅读文献,有针对性地学习是设计试验的前提。在开始研究之前,必须清楚地定义研究的具体目标和需要解决的问题。这有助于集中精力,避免在研究过程中偏离方向。例如,在本研究中,我们的目标是开发针对SADS-CoV S蛋白的单克隆抗体,并研究其中和活性和血凝抑制能力。明确的目标使我们能够系统地设计试验,逐步实现研究目的。
其次,根据研究目标选择最合适的技术和方法,例如,为了验证单克隆抗体的特异性结合能力,我们采用了免疫荧光 (IFA) 和酶联免疫吸附实验 (ELISA)。这些方法能够准确地检测抗体与目标蛋白的结合,并帮助我们确定抗体的表位。在实验过程中,逐步验证和优化实验条件。
同时,为了确保研究结果的可靠性和重复性,需要从多个角度验证实验结果。例如,我们不仅通过ELISA验证了抗体的结合能力,还通过生物膜干涉 (BLI) 技术进一步评估了抗体与目标蛋白的结合亲和力。在研究过程中,我们与多个实验室和研究团队合作,结合了分子生物学、细胞生物学、免疫学等多学科的知识和技术。这种跨学科的合作不仅丰富了研究方法,还提高了研究的深度和广度。
三、文中提到mAbs 3#、24#和25#特异性结合到S1A结构域,mAbs 1#、20#和32#结合到S1B结构域,这种特异性结合是如何通过实验精确验证的?对于SADS-CoV诱导人和大鼠红细胞凝集现象,有没有进一步研究其背后的分子机制?
我们分别通过以下三个试验进行了精确验证:
1、免疫荧光试验 (IFA):
将SADS-CoV的S1A和S1B结构域分别克隆在真核表达质粒上,转染至HeLa-R19细胞使其表达在细胞表面,利用mAbs 3#、24# 和25#作为一抗进行特异性染色,通过荧光显微镜观察发现mAbs 3#、24#和25#仅在表达S1A结构域的细胞中观察到特异性荧光,而mAbs 1#、20#和32#仅在表达S1B结构域的细胞中观察到特异性荧光,表明这些抗体具有高度的特异性 (见图1a)。
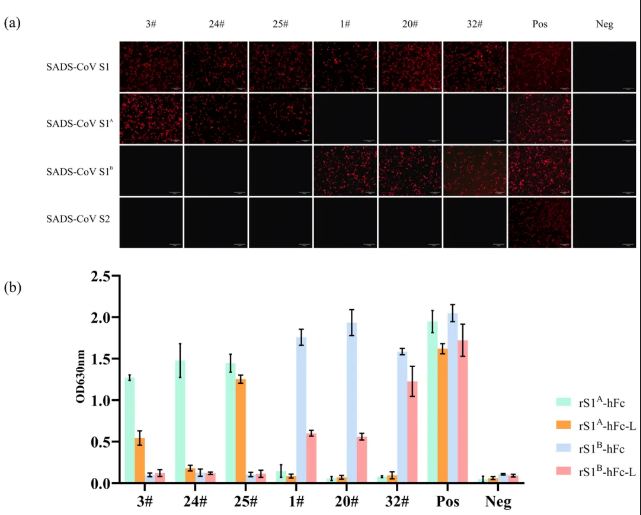
图1
2、酶联免疫吸附实验 (ELISA):
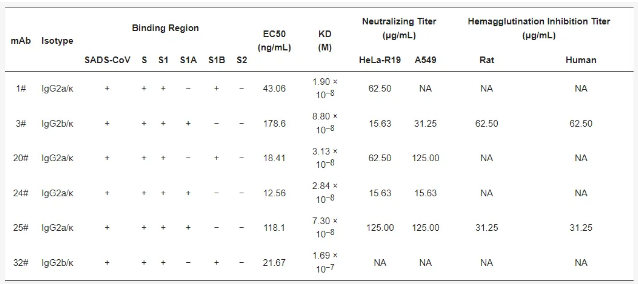
将经真核表达系统表达纯化的重组蛋白rS1A-hFc和rS1B-hFc分别包被在ELISA板,利用mAbs 3#、24# 和 25#作为一抗,通过测量吸光度值,确定每种抗体对S1A和S1B的结合能力,并测定了mAbs 3#、24#和25#对S1A的EC50值分别为178.6、12.56和118.10 ng/mL,而mAbs 1#、20#和32#对S1B的EC50值分别为43.06、18.41和21.67 ng/mL (见图2a和表1)。
3、生物膜干涉 (BLI):
进一步使用BLI技术评估了抗体与S1A和S1B的结合亲和力。结果显示,所有抗体均表现出高亲和力结合,平衡解离常数 (KD) 在2.84×10⁻⁸到1.67×10⁻⁷之间 (见图2b和表1)。
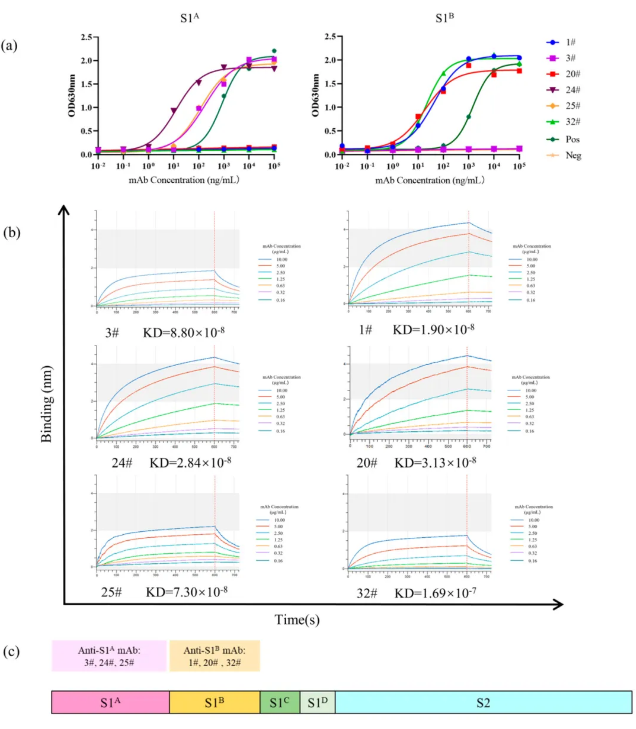
图2
表1
我们发现SADS-CoV能够使人类和大鼠的红细胞凝集,而这种凝集作用依赖于红细胞表面的唾液酸 (Sia) 受体。当红细胞用神经氨酸酶 (NA) 预处理去除Sia后,凝集现象消失 (见图3)。
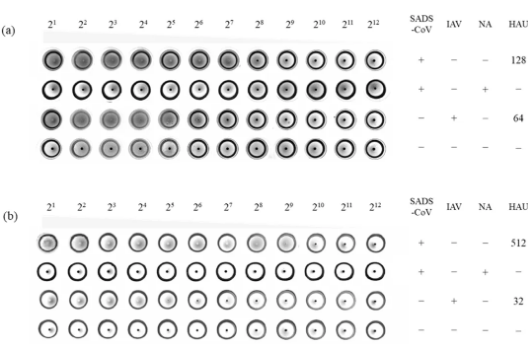
图3
我们进一步测试了单克隆抗体对血凝现象的抑制能力。结果表明,特异性结合S1A的mAbs 3#和25#能够有效抑制SADS-CoV诱导的红细胞凝集,而结合S1B的抗体则没有这种抑制能力 (见图4)。这些结果表明,S1A结构域可能包含与Sia受体结合的关键位点,从而介导血凝现象。未来的研究将进一步探索S1A与Sia受体之间的相互作用机制。
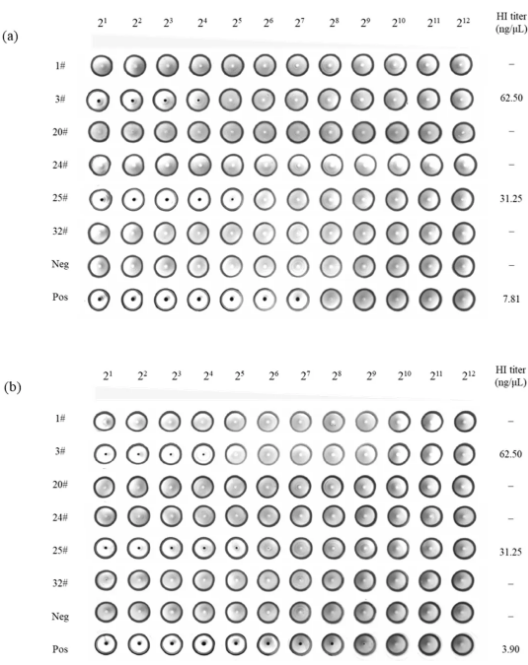
图4
四、这些针对SADS-CoV S蛋白的单克隆抗体,在实际应用于治疗猪急性腹泻综合征时,可能会面临哪些挑战,比如如何克服动物体内的免疫排斥反应等?研究确定了S1A和S1B是中和抗体的主要靶点,这对于开发其他针对冠状病毒的治疗方法有哪些借鉴意义?
虽然通过小鼠制备的单克隆抗体,可能会在猪体内引发免疫反应,但是这一问题是可以克服的。我们可以考虑使用猪源化抗体,或者通过基因工程的手段,将抗体的可变区与猪源抗体IgG的恒定区融合,利用哺乳动物表达系统生产嵌合抗体,降低免疫排斥反应。另外,如果以治疗为目的,如何将抗体有效递送到靶器官,并在体内保持足够的浓度也是一个问题。在这方面,我们可以将抗体和靶器官相应的能够支持精准递送的宿主分子相结合,实现药物的靶向递送,同时通过修饰等方法优化抗体的药代动力学和药效学特性,从而实现抗体达到靶器官时仍能达到有效的浓度。最后,病毒是在不断进化的,它们的快速变异可能导致抗体的中和活性下降。因此,持续监测病毒的变异情况也是非常重要的。
本研究确定了SADS-CoV的S蛋白的S1A和S1B结构域是中和抗体的主要靶点,为开发针对其他冠状病毒的治疗方法提供了重要参考。同时,研究揭示了S1A和S1B在病毒入侵中的关键作用,助于理解冠状病毒的感染机制,并为开发广谱中和抗体提供理论基础。冠状病毒的血凝对其病毒的传播及释放以及在体内的致病性都有影响,本研究揭示了SADS-CoV引起血凝的主要结构域时S1A,为开发抗病毒药物提供新的思路。
五、请问您目前正在关注或计划探索的未来研究方向是什么?
我们的研究已经证明,SADS-CoV的S1A结构域能够与唾液酸结合,是与宿主细胞表面的糖结合的主要区域,但是S1A结构域主要和哪种糖分子结合?S蛋白上与糖分子结合的关键位点是什么?这些结合位点在病毒增殖及在仔猪中的致病性发挥怎么样的作用?这些科学问题还未解答。未来我们将从这些方面入手,通过糖芯片技术鉴定与SADS-CoV S蛋白结合的具体糖分子,进一步通过结构生物学方法解析S1A与糖受体分子的结合细节。利用分子生物学、细胞生物学等技术筛选鉴定S1A结构域中与糖分子结合的关键氨基酸位点,进一步通过反向遗传系统拯救这些关键位点突变的重组病毒,在体内和体外分别比较重组病毒与亲本病毒的差异,揭示SADS-CoV的S1A结构域在病毒增殖和致病性中的分子细节。另外,针对我们制备的靶向SADS-CoV S蛋白的特异性单克隆抗体,我们将研究SADS-CoV如何逃避宿主免疫系统的攻击,特别是针对中和抗体的逃逸机制,以开发更有效的疫苗和治疗方法,鉴于冠状病毒的多样性和变异能力,我们将分析不同冠状病毒中保守的结构域例如融合肽区域、S2结构域等,探索开发针对多种冠状病毒的广谱中和抗体,以应对潜在的跨物种传播风险。这些研究方向将有助于我们更深入地理解SADS-CoV的生物学特性,并为开发有效的预防和治疗策略提供支持。
原文出自 IJMS 期刊:https://www.mdpi.com/2587062
期刊主页:https://www.mdpi.com/journal/ijms
IJMS 期刊介绍
主编:Maurizio Battino, Marche Polytechnic University, Italy
期刊发表生物化学与分子生物学、生物材料、生物医学、植物学、生物物理和纳米科学等分子相关领域的研究,目前已被 Scopus、SCIE (Web of Science)、PubMed 等数据库收录。
2024 Impact Factor:4.9
2024 CiteScore:9.0
Time to First Decision:16.8 Days
Acceptance to Publication:2.6 Days


转载本文请联系原作者获取授权,同时请注明本文来自MDPI开放科学科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3516770-1493657.html?mobile=1
收藏

