博文
Biomolecules:揭开渐进性纤维性骨化症的免疫“面纱”
||
文章导读
异位骨化 (HO) 是一种在正常情况下不会矿化的部位出现异常骨骼生长,炎症是它的主要驱动因素。渐进性纤维性骨化症 (FOP) 是一种侵袭性和进行性HO形成的遗传病。多种证据表明,免疫系统在驱动FOP发病机制中起着关键作用。一篇发表在 Biomolecules 题为“Immunologic Aspects in Fibrodysplasia Ossificans Progressiva”的综述探讨了炎症和免疫系统在FOP中的作用以及炎症如何成为治疗骨质疏松症的重要靶点。
骨骼中的炎症反应
炎性细胞因子和炎性细胞被认为是损伤后或在易发生HO的病理情况下形成HO的主要驱动因素。研究发现,白细胞介素家族成员IL-3等促炎细胞因子在战斗创伤患者体内升高;在人类间充质干细胞中,炎性体刺激会导致脂肪生成增强而骨生成减少;IL-6可激活骨降解,表明它可能参与骨质疏松症;骨质疏松症妇女体内促炎细胞因子IL-18的天然拮抗剂IL-18BP含量较低;抗炎细胞因子IL-10的缺失会加重1型糖尿病患者的骨质流失。另一种骨保护细胞因子是IL-33,它可能对骨吸收具有治疗潜力。
炎症驱动FOP
FOP是一种罕见的遗传性疾病,它的一个显著临床特征是患者会出现大量炎性病变,在骨骼肌、肌腱和结缔组织等正常情况下不会矿化的组织中出现大量异常骨形成。随着时间的推移,新形成的HO会导致神经受压和拉伸而无法活动并产生剧烈疼痛。这些炎性病变通常被称为“发作”,伴有典型的炎症症状,如压痕、红斑和疼痛。组织损伤会加剧FOP的发展。组织学检查显示,在这些发展中的FOP病变中存在多种细胞类型,包括巨噬细胞、肥大细胞、间充质干细胞、骨细胞、软骨细胞和成纤维细胞。据报道,结缔组织、血管和骨骼肌中的细胞因子也会升高。FOP的主要病因是ACVR1存在激活突变,而ACVR1是骨形态发生蛋白 (BMP) 通路的一部分。已发现的FOP基因突变主要位于ACVR1的甘氨酸-丝氨酸 (GS) 区域使GS区的稳定性降低,导致ACVR1持续激活并对Activin A产生新配体活性,从而导致HO并最终导致FOP患者的关节融合 (图1)。据报道,在FOP患者中,ACVR1的GS或蛋白激酶 (PK) 结构域也存在其他罕见的错义突变。FOP中的所有这些基因突变都会破坏正常的稳态和细胞分化过程,引发软骨内骨化异常。由于炎症是导致FOP和其他类型HO的主要因素,因此治疗HO的一个主要途径是破坏导致骨形成异常的炎症驱动因素 (图2)。
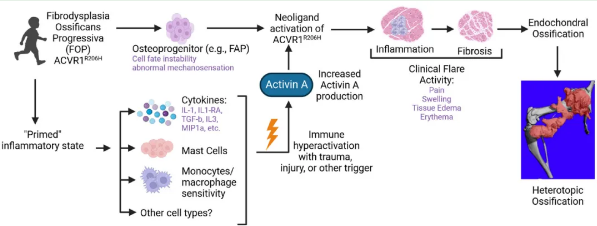
图1. 导致FOP发病的潜在炎症因素。
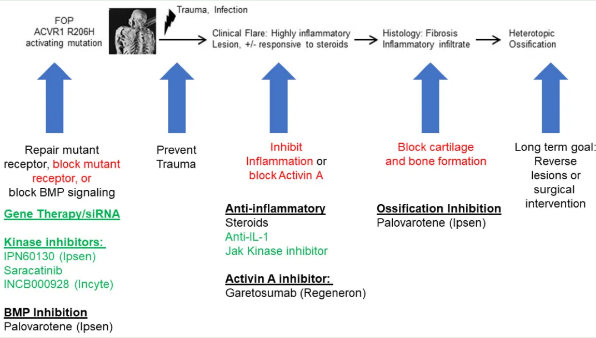
图2. 治疗FOP的潜在疗法和在研化合物及其与炎症的关系。
结语
炎症和创伤是影响HO发生的关键因素,但连接这些过程的确切机制以及其中的潜在治疗靶点在很大程度上仍然是个谜。FOP和其他类型HO的炎症具有一些共同的特征,包括缺氧信号通路的参与、间充质干细胞分化的启动、炎症通路的靶向性以及血管信号通路的激活,这些特征既有助于理解炎症的驱动因素,也有助于找到对这两种类型HO都有效的疗法。进一步的研究应系统地了解疾病的免疫过程,结合多种途径中的靶点以制定有效的治疗策略。持续的研究极有可能带来新的知识,为未来预防和逆转HO的治疗提供指导。
原文出自 Biomolecules 期刊:https://www.mdpi.com/2218-273X/14/3/357
期刊主页:https://www.mdpi.com/journal/biomolecules
Biomolecules 期刊介绍
主编:
Lukasz Kurgan, Virginia Commonwealth University, USA;
Peter E. Nielsen, University of Copenhagen, Denmark
期刊旨在发表包括生物活性和生物源性物质的结构和功能,具有生物学和医学意义的分子机制以及生物材料及其应用等在内的高水平文章。
2023 Impact Factor:4.8
2023 CiteScore:9.4
Time to First Decision:18.4 Days
Acceptance to Publication:2.7 Days


https://wap.sciencenet.cn/blog-3516770-1482145.html
上一篇:Electronics 论文选题灵感:“自然语言处理研究方向”
下一篇:2025 MDPI中国区主编年会圆满落幕