博文
Mitochondrial Communications文章推荐┃线粒体DNA突变:癌症的隐形推手?  精选
精选
|
癌症的发生与线粒体功能异常之间的关联一直是科学家们关注的焦点。近日,我们团队一项发表在Mitochondrial Communications上的研究通过线粒体基因编辑技术,在非癌细胞中诱导了线粒体DNA(mtDNA)的致病突变,并系统揭示了这些突变如何通过破坏细胞代谢、增加基因组不稳定性以及改变表观遗传景观,最终促进癌症的发生和发展。这项研究不仅为癌症的起源提供了新视角,也为早期干预和靶向治疗带来了希望。
一、研究背景:线粒体与癌症的百年之谜
1924年,诺贝尔奖得主Otto Warburg提出“瓦氏效应”(Warburg effect),认为癌细胞即便在氧气充足的情况下,也会优先选择糖酵解而非高效的氧化磷酸化来获取能量。他推测,这种代谢转变可能源于线粒体功能的不可逆损伤。尽管这一假说后来被修正(现代观点认为癌细胞同时保留线粒体呼吸功能),但线粒体在癌症中的作用始终是未解之谜。
近年来,科学家发现核基因编码的线粒体蛋白(如IDH2、SDHA、FH等)突变会直接导致癌症,这些突变通过产生“致癌代谢物”(如2-羟基戊二酸、琥珀酸等)扰乱细胞功能。然而,线粒体自身基因组(mtDNA)的突变是否直接驱动癌症,一直缺乏因果性证据。线粒体DNA突变率比核DNA高10-100倍,且广泛存在于健康人群中,但它们在癌症中的“驱动者”角色尚未明确。
二、研究突破:基因编辑技术揭示mtDNA突变的致癌性
为了验证mtDNA突变的直接作用,我们团队选择了DdCBE线粒体基因编辑工具,在人类胚胎肾细胞(HEK293)中诱导了MT-ND5基因的截短突变(MT-ND5 truncating mutations)。MT-ND5是mtDNA编码的最长基因,也是呼吸链复合物I的核心亚基,在肾癌、结直肠癌和甲状腺癌中常见其有害突变。
关键发现1:低至中度mtDNA突变即可引发线粒体功能障碍 (原文图2)
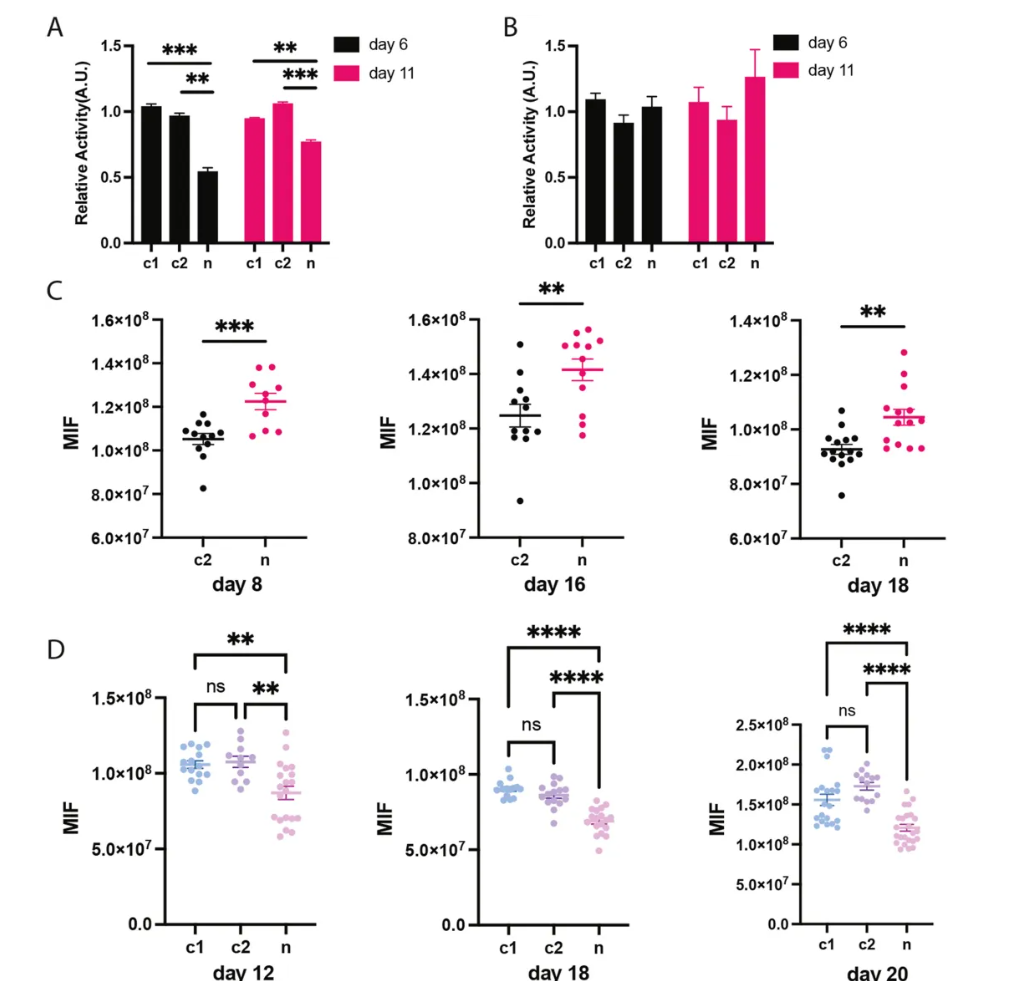
• 复合物I活性显著降低:在34%的异质性(突变mtDNA占比)水平下,呼吸链复合物I活性降至对照组的54%,导致NAD+/NADH比值下降,氧化磷酸化效率受损。
• 活性氧(ROS)水平升高:线粒体膜电位降低,同时ROS积累,表明细胞处于氧化应激状态。
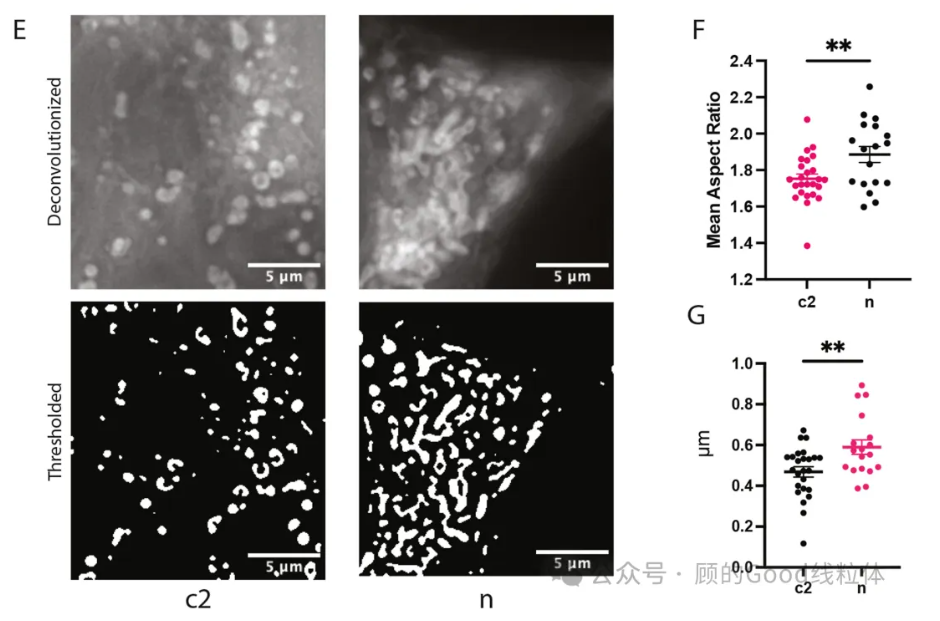
• 线粒体形态改变:突变细胞中线粒体融合增加,分支长度延长,可能是细胞试图通过融合稀释突变mtDNA的适应性反应。
关键发现2:突变细胞表现出多重致癌特征 (原文图3以及图4)
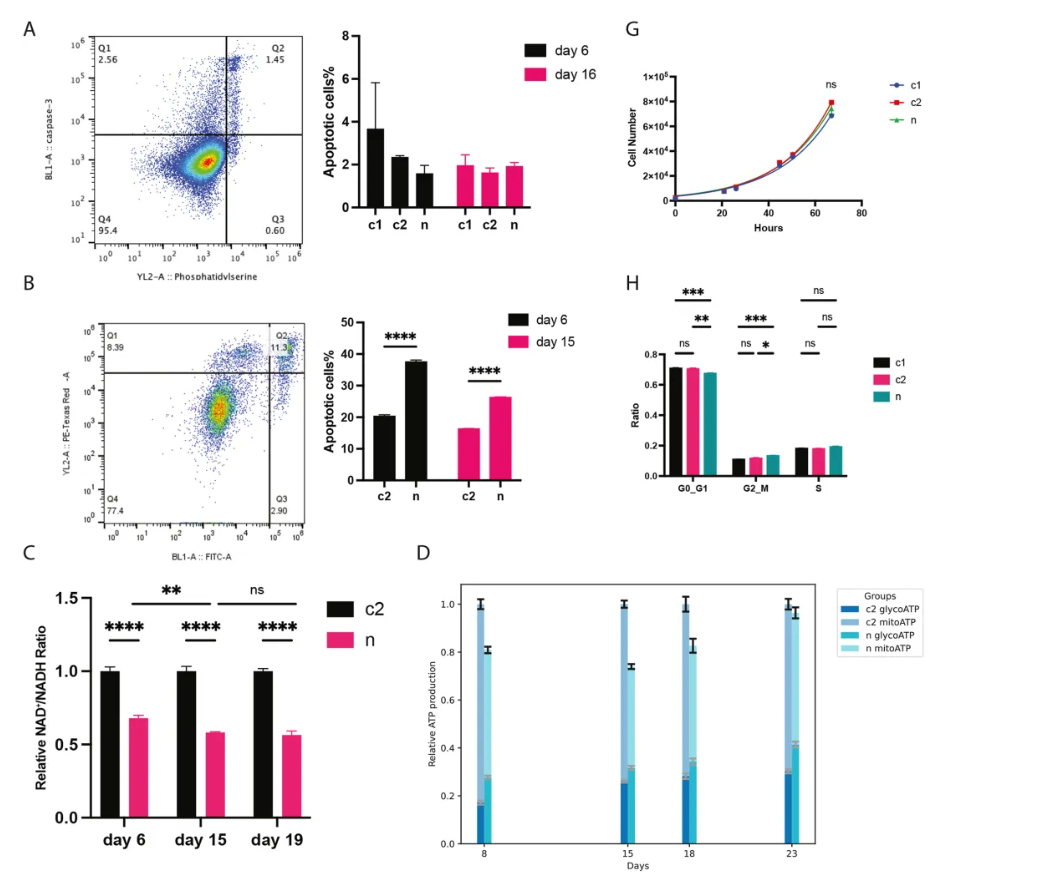
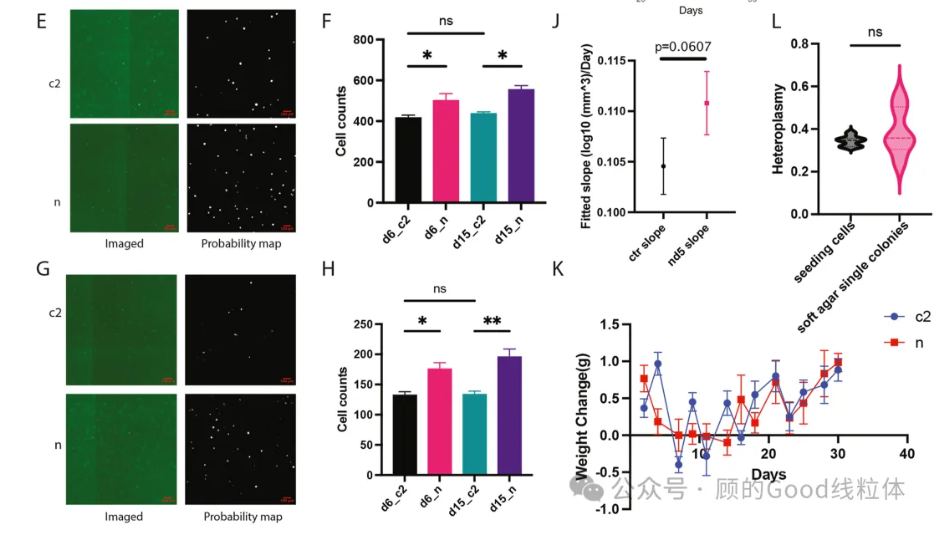
• 基因组不稳定性:转录组分析显示,DNA修复通路(如碱基切除修复、核苷酸切除修复)被抑制,细胞周期停滞在G2/M期——这是癌症基因组不稳定的典型标志。
• 代谢重编程:虽然总ATP水平随异质性降低逐渐恢复,但NAD+/NADH比值持续低下,迫使细胞增强糖酵解能力(瓦氏效应),以满足NAD+需求而非能量需求。
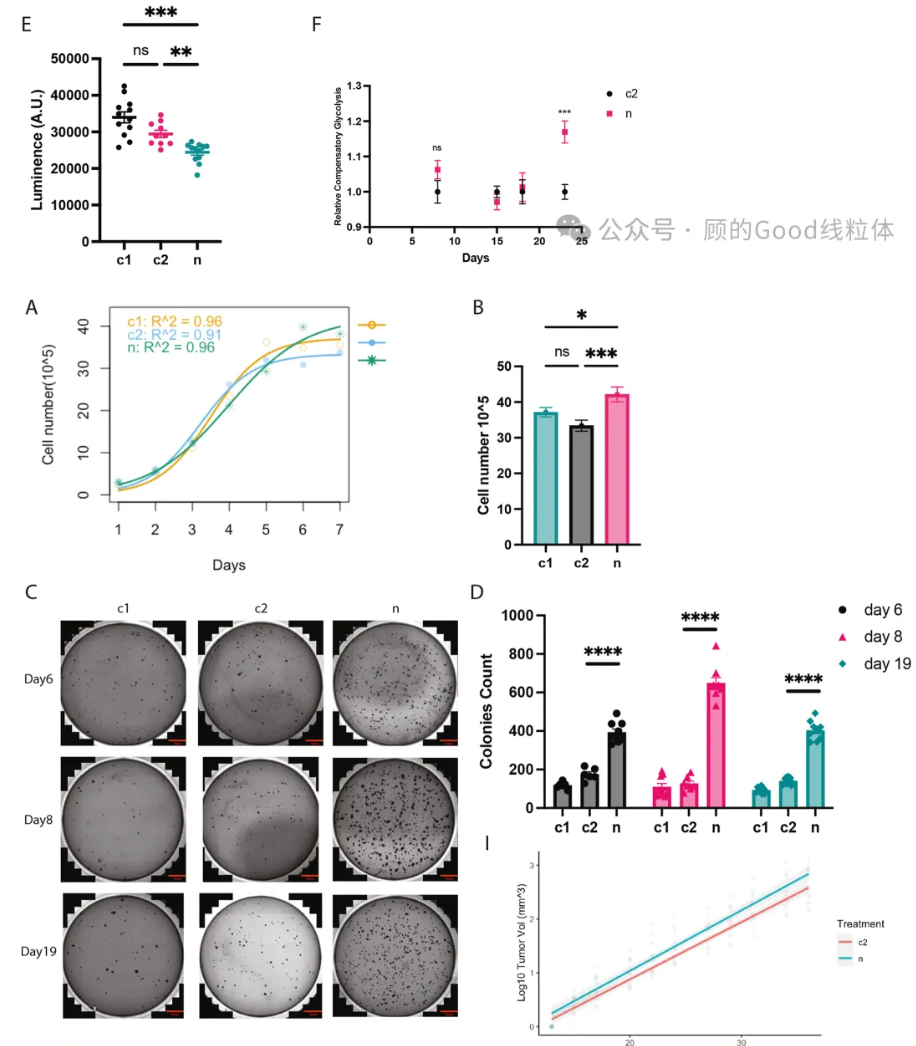
• 转移能力增强:迁移和侵袭实验表明,突变细胞的运动性和侵袭性显著提升;软琼脂实验则显示其锚定非依赖性生长能力(癌症标志之一)增强。在小鼠体内,MT-ND5异质性突变的细胞可能生长得更快(p=0.0607)。
关键发现3:表观遗传重塑是致癌的关键桥梁 (原文图5)
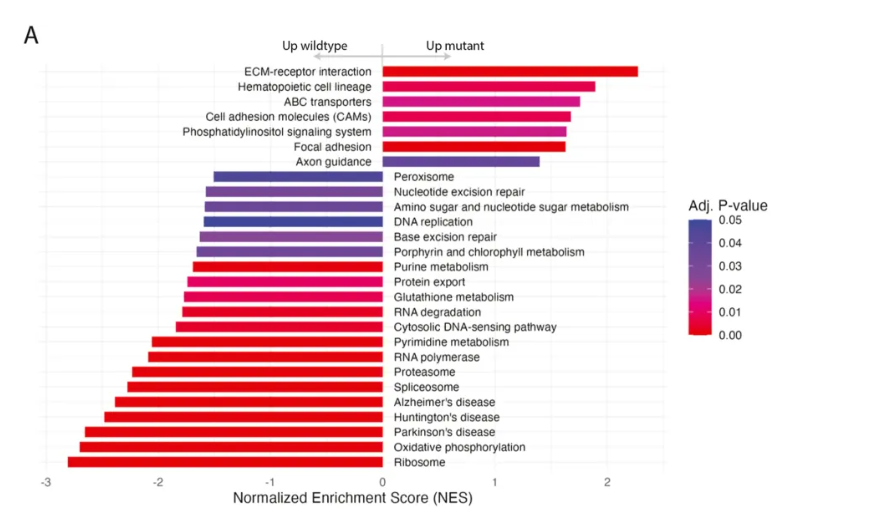
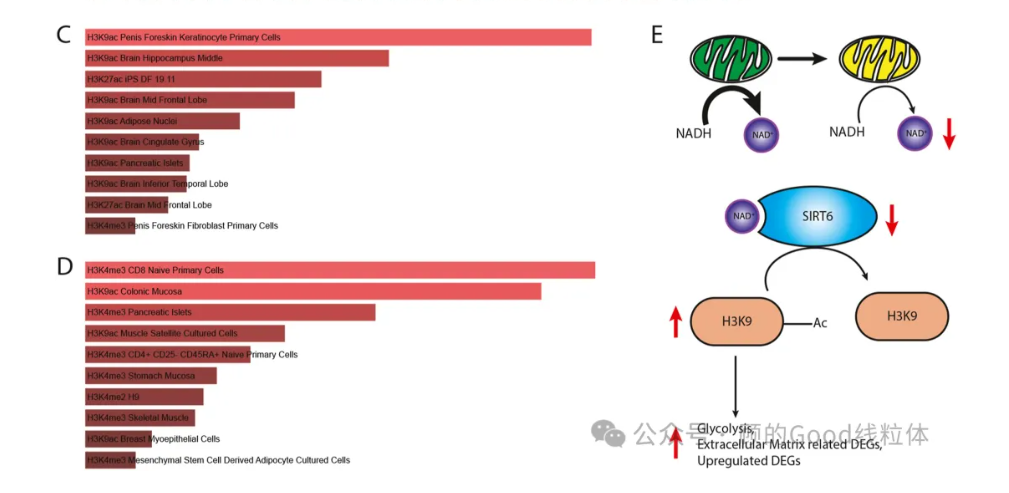
转录组通路富集显示组蛋白H3K9乙酰化(H3K9ac)水平升高,我们推测NAD+的耗竭抑制了依赖NAD+的去乙酰化酶SIRT6的活性,进而激活促癌基因表达。这一机制在基底型乳腺癌(basal subtype breast cancer)中同样被观察到,提示线粒体功能障碍可能通过表观遗传调控普遍促进癌症进展。
三、颠覆性观点:mtDNA突变的“双面角色”
传统认为,癌细胞会选择性清除有害的mtDNA突变以维持高代谢效率。但本研究提出“阶段性选择”模型:
1. 癌症初期:mtDNA突变通过ROS、基因组不稳定和表观遗传改变驱动细胞恶性转化;
2. 癌症进展期:已建立的癌细胞可能通过上调NAMPT(NAD+补救合成通路)或劫取健康线粒体(如从免疫细胞)来补偿突变缺陷,或者mtDNA异质性突变的随机分布,形成代谢弹性。
这一理论解释了为何肿瘤组织中仍能检测到有害mtDNA突变——它们可能是癌症起源的“化石痕迹”。同理,由于引起瓦氏效应的线粒体功能障碍可能在癌症进展期消失,这个阶段性选择模型也解释了“瓦氏效应”(Warburg effect)在部分癌症细胞中的缺失—为何某些转移性癌细胞表现出更高的线粒体活性。
四、临床启示与未来方向
1. 早期干预靶点:靶向mtDNA突变可能预防部分癌变。
2. 癌症分型标志:mtDNA异质性水平或可作为癌症风险预测的生物标志物。
3. 技术局限性:当前研究仅在免疫缺陷小鼠中验证了致癌性,未来需在免疫健全模型和更长期实验中进一步验证。
五、总结
这项研究首次通过基因编辑技术,在严格控制的核基因遗传背景下证明了mtDNA突变可直接促进癌症发生。它揭示了线粒体功能障碍通过代谢紊乱、氧化应激和表观遗传重塑共同推动肿瘤发展的多维机制,为理解癌症起源提供了全新视角。我们团队曾经发表过一篇综述(详见本公众号推文:衰老过程中线粒体DNA突变积累可以促进肿瘤发生吗?),系统揭示了衰老导致的mtDNA突变的积累如何驱动多重效应引起肿瘤,并提供了可能的生活干预方式。除了本文实验中检测到的ROS的积累,线粒体功能的变化,代谢重组以及基因组不稳定外,我们还在综述中提到mtDNA突变可能会引起免疫反应和炎症,并总结了以上变化的可能通路。
以上两篇文章有助于我们理解衰老,mtDNA突变的积累,和肿瘤发生之间的关系,在传统的核基因突变导致肿瘤发生之外,我们提出了mtDNA在肿瘤发生中的重要角色。线粒体DNA突变像一颗“定时炸弹”,在衰老过程中悄然累积,最终通过多重机制推动癌症发生。未来,针对线粒体的干预策略或将成为抗癌新方向!
参考文献:
[1]Wu Y, et al. (2025). Mitochondrial Communications 3:26–43. DOI:10.1016/j.mitoco.2025.03.001
[2]Minghua Kong, Lishu Guo, Weilin Xu, Chengpeng He, Xiaoyan Jia, Zhiyao Zhao, Zhenglong Gu, Aging-associated accumulation of mitochondrial DNA mutations in tumor origin, Life Medicine, Volume 1, Issue 2, October 2022, Pages 149–167, https://doi.org/10.1093/lifemedi/lnac014

期刊简介

Mitochondrial Communications是一本开放获取的同行评审英文期刊,期刊涵盖了线粒体在基础理论和临床疾病方面的科学和重要问题。期刊主编由南开大学生命科学学院院长陈佺教授担任,期刊荣誉主编由美国费城儿童医院Douglas Wallace教授担任。

线粒体是细胞内的能量工厂,也是解开生命过程和疾病研究的关键因素,Mitochondrial Communications作为一个集结线粒体生物学中前沿性观点的平台,致力于促进以线粒体健康为导向的跨学科研究,旨在快速发表高质量、经过严格同行评审的研究文章、综述及评论。
Mitochondrial Communications不仅关注围绕线粒体功能、结构、动力学、信号传导、基因组、突变、遗传等方面的前沿科学问题,且广泛欢迎涉及线粒体与代谢、衰老、神经退行性疾病、癌症、心血管疾病、免疫系统等领域的科研成果、前沿技术和理论探讨。
Mitochondrial Communications期待您的来稿!所有文章将经过严格的同行评审,文章一经收录,全文将以开放获取的形式发表在月活用户超过1700万的ScienceDirect平台,供读者免费下载阅读和引用。
https://wap.sciencenet.cn/blog-3496796-1485346.html
上一篇:Risk Sciences | 风险、韧性与可持续发展:应对城市内涝挑战
下一篇:GreenChE┃通过纯绿色环保体系实现可持续抗生素生产