代谢学人
Cell Metabolism :菌吃糖,人享瘦
撰文 | 程诗淼 高铭远 石丽 生茂正 郭盈盈 于剑编辑 | 孟美瑶
校对 | 生茂正

背景介绍
全球有超过6亿人受到肥胖的影响,肥胖已成为全球性健康危机。与2型糖尿病、心血管疾病和癌症等多种严重并发症密切相关。通过改变生活方式进行减肥的方法由于难以长期坚持,往往无法产生持久效果。虽然减肥手术以及胰高血糖素样肽-1(GLP-1)激动剂等肠促胰岛素类药物被认为是治疗肥胖的有效方法,但这些疗法的高昂费用使得许多患者难以承受。因此,迫切需要开发有效且经济可行的治疗策略。当前这些方法所依据的一个共同原理是限制营养物质的过量供应,这会直接影响人类的代谢状态和肥胖程度。此外,过量摄入可消化的淀粉和单糖也会导致肥胖和脂肪堆积,这表明限制碳水化合物的供应可能是减肥的有效途径。
目前,许多研究都强调了肠道菌群在代谢主要营养物质方面的重要作用,以及其对人类疾病的深远影响。人体内的肠道菌群贡献了总能量供应的2.5%至5%,而在小鼠体内这一比例能够达到总能量消耗的8%(小编注:人类缺乏分解某些复杂碳水化合物如纤维素、抗性淀粉、果胶等的酶,而肠道菌群能分泌糖苷水解酶,从而将这些物质发酵为SCFAs。SCFAs是一类关键的能量物质,其中丁酸是结肠上皮细胞的首选能量来源,通过β-氧化直接生成ATP,同时乙酸和丙酸进入血液循环,被肝、肌肉、心脏等组织利用后进入TCA循环或糖异生供能)。这些结果表明肠道细菌的生物量、组成和代谢活动会显著影响宿主的代谢功能。人类宏基因组研究表明,肠道细菌对多糖的降解增加了营养物质的利用率进而加速肥胖。此外,有研究报道宿主可获得的糖类物质与肠道细菌的碳水化合物代谢有关,并与胰岛素抵抗有关。这些研究提示了一个猜想,即可以通过调控肠道菌群及其功能进而对宿主的碳水化合物供应和代谢状况进行调节。
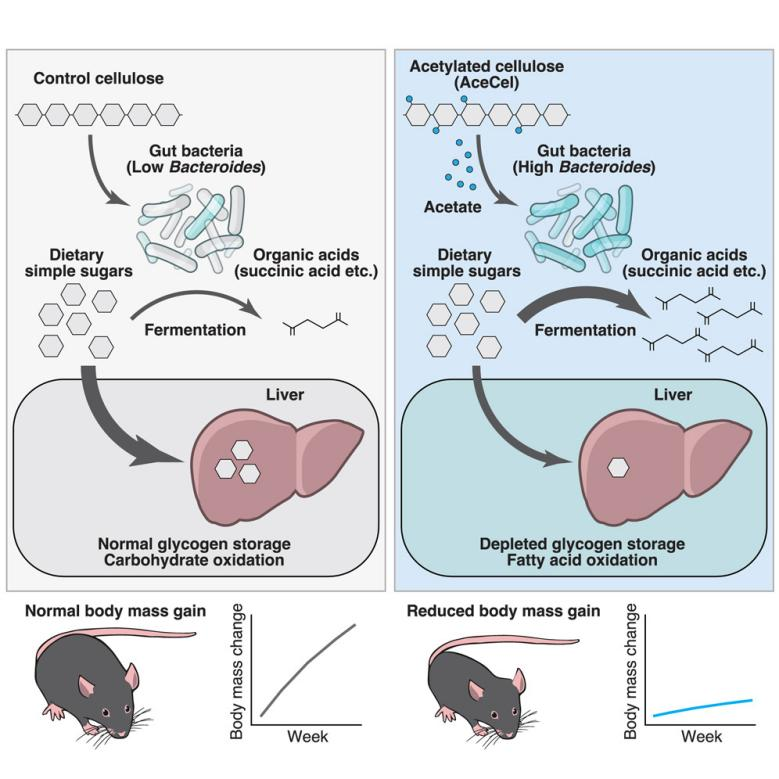
益生元是一种被宿主微生物选择性利用并赋予健康益处的物质,其易于获得并渗透日常生活(小编注:益生元通常是植物或食物中天然存在的非消化性碳水化合物,如菊粉、低聚果糖、云芝多糖、乳铁蛋白等,益生元通过饮食被生物体摄入,进而通过选择性刺激有益菌的生长或活性,从而改善宿主健康。肠道菌群代谢产生的短链脂肪酸等物质被称为后生元)。例如,可发酵的膳食纤维会被特定的肠道细菌所分解,增加短链脂肪酸的含量,为宿主代谢提供多种益处。膳食纤维对短链脂肪酸生成及代谢健康的影响,在很大程度上取决于体内原有的肠道菌群,个体间的差异限制了益生元的功效。在这方面,短链脂肪酸的使用能提供一种直接且有效的方法,以调节肠道菌群和宿主的代谢过程。虽然在一些动物研究中,短链脂肪酸水平升高与肥胖互相关联,但也有许多其他研究表明,口服短链脂肪酸能够改善代谢功能障碍。然而,这些研究主要关注的是短链脂肪酸的全身吸收及其对宿主器官和组织的直接影响,而非其对肠道菌群的影响。而乙酸作为一种主要的短链脂肪酸,已被证明在其被递送到结肠远端时能够改善人体的多项代谢指标。乙酸盐不仅是细菌的代谢产物,同时也是某些细菌的底物。例如大肠杆菌会同时消耗乙酸和葡萄糖。因此,研究远端肠道中的乙酸盐如何影响细菌和宿主代谢具有重要意义。先前研究发现乙酰化纤维素(Acetylated cellulose,AceCel)能有效地将乙酸盐递送到远端肠道(小编注:AceCel分子链上的乙酰基团(-COCH₃)取代原有的羟基(-OH),从而使AceCel具有更高的疏水性和抗消化性,能够抵抗胃酸和近端肠道的消化酶作用,在到达远端结肠后才被肠道微生物分解,确保乙酸盐不会被过早释放或吸收),揭示了乙酸盐在调节免疫球蛋白A和细菌之间的相互作用(小编注:此处为该团队21年发表的Nature文章,该文章发现乙酸盐激活肠道上皮细胞,诱导微生物刺激的CD4+T细胞以促进T细胞依赖性IgA的产生,从而增加IgA分泌,IgA会与潜在有害菌结合,阻止其侵入肠道黏液层,从而维持肠道屏障功能)。然而,AceCel对宿主和细菌代谢的影响尚不清楚。基于此,日本理化学研究所(RIKEN)综合医学科学中心肠道生态系统实验室的Hiroshi Ohno团队进行相关研究,其成果“Acetylated cellulose suppresses body mass gain through gut commensals consuming host-accessible carbohydrates”近期发表在Cell Metabolism上,该研究发现AceCel通过靶向肠道菌群,促进拟杆菌属对碳水化合物的发酵,减少宿主可利用的糖,从而促进肝脏脂肪酸氧化、抑制体重增加。这一机制不依赖短链脂肪酸受体信号,为肥胖治疗提供了以肠道菌群为靶点的新益生元策略。

敲黑板啦!
1、AceCel减少野生型和肥胖小鼠的体重增加
2、AceCel限制宿主碳水化合物氧化并促进脂肪酸利用
3、AceCel以微生物群依赖的方式减少肠道单糖和体重增加
4、乙酸盐促进肠道拟杆菌属的碳水化合物发酵
研究结果
1、AceCel抑制体重增加并改善肥胖相关症状
研究人员首先探究了AceCel饮食和在饮用水中加入乙酸钠(AceNa)对C57BL/6小鼠的影响(图1A)。先前研究已经证明,AceCel不被近端肠道吸收,但能够有效增加远端肠道的乙酸盐水平。而AceNa易于在近端肠道吸收,并且血浆中的AceNa浓度在口服灌胃后30分钟内迅速增加(小编注:近端肠道主要吸收单糖、氨基酸、脂类、水溶性维生素、离子等小分子物质,远端肠道可以吸收近端未完全吸收的物质(如纤维)以及胆汁酸、电解质、SCFAs等,并依靠肠道菌群对这些物质进行代谢,AceNa是小分子,在胃和小肠近端容易被吸收,吸收的乙酸盐直接汇入门静脉被肝脏摄取后转化为乙酰辅酶A,进入三羧酸循环或脂质合成;AceCel是大分子聚合物,具有较高的抗消化性,需依赖远端肠道菌群代谢释放乙酸盐)。研究人员发现在自由进食和饮水条件下,AceCel和AceNa都没有增加门静脉中的乙酸盐水平(小编注:在自由进食状态,乙酸盐摄取量显著少于灌胃给药,此时血中乙酸盐水平没有增加,说明这些AceNa停留在肠道而没有被吸收进入血液)(图S1A)。上述结果表明,AceCel主要增加肠道内的乙酸盐水平。与AceNa组相比,AceCel组的丙酸盐水平较高(图S1B),而丁酸盐水平保持不变(图S1C)(小编注:可能是由于AceCel选择性调节了肠道菌群的代谢功能,即AceCel在远端肠道的释放为产丙酸菌提供了生长环境)。研究人员发现,AceCel能够显著抑制体重增加,降低肝脏重量以及脂肪组织重量(图1B-F),而比目鱼肌重量不受影响(图S1D)。同时丙酰化纤维素或丁酰化纤维素喂养小鼠的体重、脂肪和肝脏重量均未发生变化(图S1E-J)。尽管这两种纤维素也增加了各自的短链脂肪酸水平,但上述代谢效应为AceCel所特有(小编注:肠道菌群代谢短链脂肪酸修饰的纤维素(如乙酰化、丙酰化、丁酰化纤维素)时一般倾向于通过水解酯键直接释放游离SCFAs和纤维素,而无法将丙酰基/丁酰基转化为乙酰基)。
接下来,研究人员探究了AceCel和AceNa对ob/ob小鼠的影响,结果发现AceCel而非AceNa能够抑制体重增加并降低肝脏重量(图1H、I)。虽然脂肪组织重量与体重的比例不受影响(图S1K-N),但AceCel在降低绝对脂肪组织重量同时降低体重增量(图S1O-R)。AceCel和AceNa组的血清总胆固醇和非酯化脂肪酸均降低,而甘油三酯保持不变(图1J-L)。在胰岛素耐受性试验中,与对照组相比,AceCel和AceNa也较小程度降低了葡萄糖水平(图1O-P)。肝脏重量减少与代谢功能障碍相关的脂肪性肝病(MASLD)的改善相关。在AceCel喂养的ob/ob小鼠中,肝脏脂肪变性得到改善(图1Q、R)。上述研究结果表明,AceCel能够抑制小鼠的体重增加并改善代谢表型。
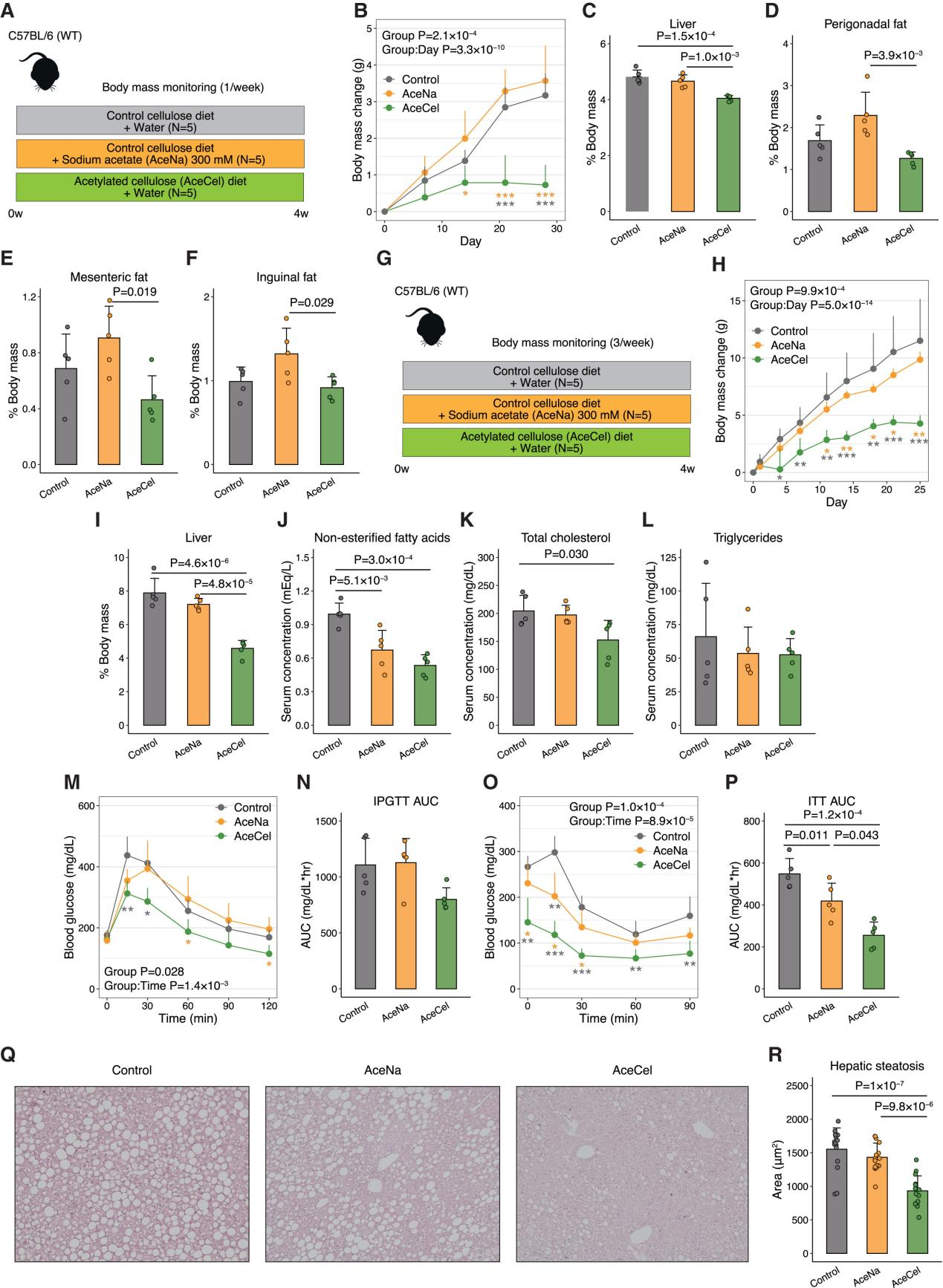
图1.AceCel抑制体重增加和相关症状
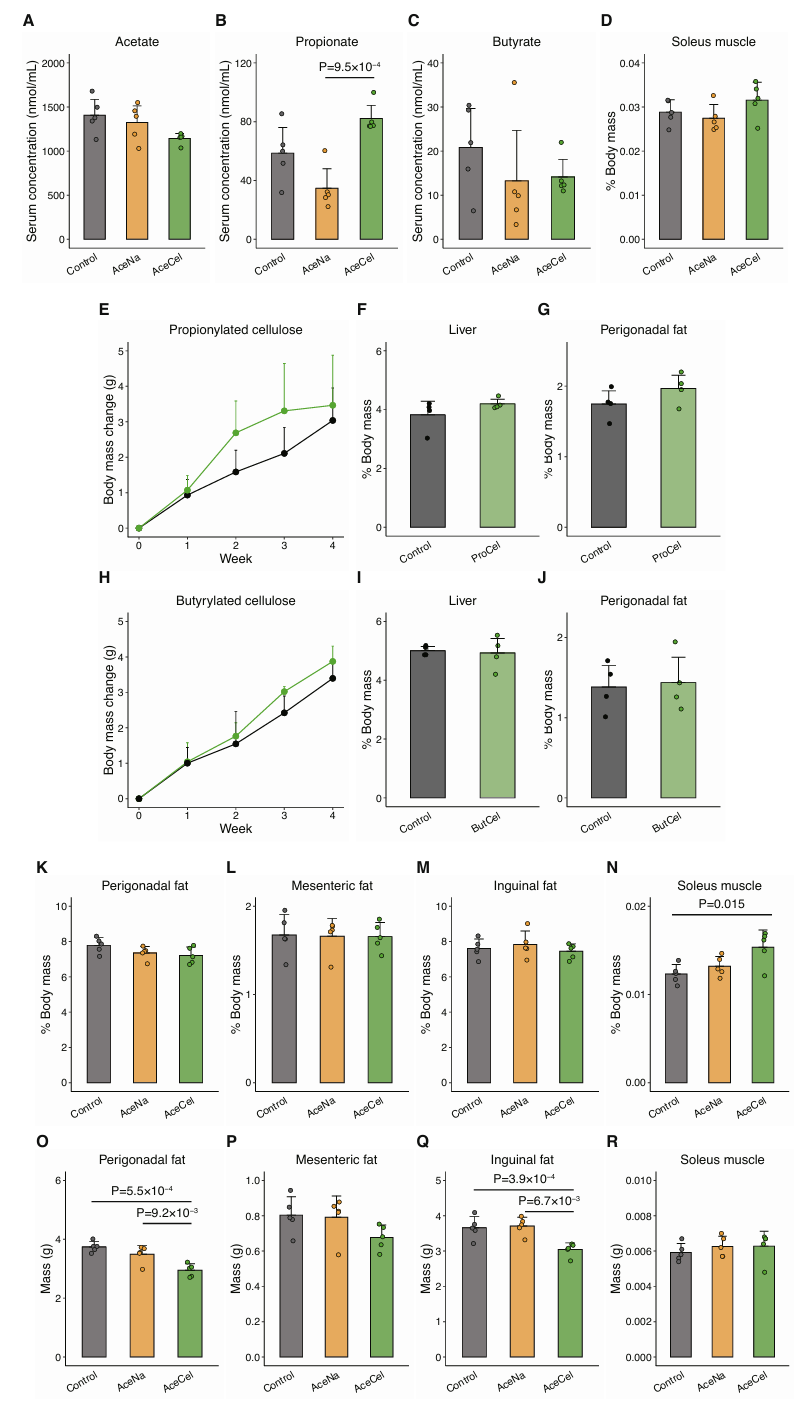 图S1.AceCel而非其他与SCFA结合的纤维素能够抑制体重增加和相关症状的发生
图S1.AceCel而非其他与SCFA结合的纤维素能够抑制体重增加和相关症状的发生
2、AceCel促进肝脏脂肪氧化
基于前文中的研究,研究人员想要进一步探明AceCel如何在饮食干预的初始阶段调节小鼠代谢(图2A)。研究人员重点关注第5天后收集的数据,此时由于新环境应激引起的代谢紊乱已经减弱(小编注:小鼠因转移到新饲养环境如代谢笼中会发生一定的环境应激,可能短期内干扰小鼠的代谢状态,导致小鼠因应激反应出现非特异性代谢变化,干扰对试验结果的判断,随着时间推移(第5天后)小鼠逐渐适应了实验环境,应激反应减轻,此时观察到的代谢变化(如RQ降低)更能反映AceCel的真实作用,而非环境干扰的混杂效应。此处作者引用的文献为一篇方法学文章,该文章评估了不同品系小鼠饲养在代谢笼后每日体重、食物与饮水摄入量、尿量等动态指标,发现小鼠转移到代谢笼后需要3-4天适应期才能达到平衡状态)。结果发现,AceCel组的呼吸商(RQ)在光照周期内显著降低,但在黑暗周期内保持不变(图2B、C)。这表明在光照周期期间,AceCel组小鼠的脂肪氧化得到增强,而碳水化合物氧化受到抑制(图2C)。鉴于小鼠在黑暗周期积极进食,但在光照周期不太活跃,这些数据提示脂肪在休息期间逐渐成为主要的氧化的底物。两组之间的能量消耗、VO2和VCO2无显著差异,但AceCel组的值均相对较低(图S2A)。尽管对照小鼠的活动量在整个实验期间保持稳定,但AceCel喂养小鼠的活动量逐渐下降,并且在黑暗和光照周期中均显著降低(小编注:文章中并未详细阐明其原因,作者在这里认为活动量减少是脂肪氧化增强和糖代谢抑制等代谢表型改变带来的结果)(图2D-F)。食物摄入量在初期因为适应问题而不太稳定,但在后期趋于稳定且组间没有显著差异(图2E、F)。这些发现表明,食欲下降并非早期阶段AceCel组小鼠代谢变化的主因,而身体活动减少可能导致代谢改变。4周的长期干预结果显示,AceCel组的累积食物摄入量因体重抑制而降低,但在进行体重标准化后保持稳定(图S2B),进一步证明食物摄入非主要驱动因素。
接下来,研究人员探究了AceCel对代谢相关基因表达的影响。在WT小鼠中,AceCel上调大部分参与肝脏脂肪酸氧化的基因(图2G),包括脂肪酸氧化的主要调节因子过氧化物酶体增殖物激活受体-α(Peroxisome Proliferator-Activated Receptor Alpha, Ppara)。研究人员还发现肉毒碱棕榈酰基转移酶(Carnitine Palmitoyltransferase 1A, Cpt1a)、3-羟基-3-甲基戊二酰辅酶A合酶2(3-hydroxy-3-methylglutaryl-CoA synthase 2, Hmgcs2)和长链酰基辅酶A合成酶(acyl-CoA synthetase long chain family member 1, Acsl)基因表达水平均有所上升,其产物直接参与脂肪酸氧化以及随后的酮体生成过程。在ob/ob小鼠的肝脏中也观察到类似的基因表达模式(图2H)。除此之外,在WT和ob/ob小鼠中,与对照组相比,AceCel处理小鼠的细胞衰老相关蛋白1(Sirtuin 1, Sirt1)和成纤维细胞生长因子21(Fibroblast Growth Factor 21, Fgf21),而编码脂肪酸合酶的Fasn显著下调(图2G、H)(小编注:AceCel处理促进肝脏脂肪酸氧化同时抑制脂肪合成模拟饥饿状态,从而激活了Sirt1,同时Ppara可以直接激活Fgf21表达,协同增强代谢适应,推动肝脏从脂质合成转向氧化供能)。与肝脏基因表达谱一致,AceCel上调WT和ob/ob小鼠eWAT脂肪中参与脂解的激素敏感性脂肪酶(Hormone-Sensitive Lipase, Hsl)和脂肪甘油三酯脂肪酶(Adipose Triacylglyceride Lipase, Atgl),以及编码抗炎因子脂联素的Adipoq(图S2C、D)。
此外,研究人员给予AceCel喂养24小时,并分析Ppara及其下游靶点表达情况(图2I),发现摄食量和体重增加保持稳定,并且这两个参数的相关性在两组中相似(图2J-L)。AceCel能够显著降低肝脏重量,而性腺周围脂肪重量保持不变(图2M、图S2E)。AceCel喂养24小时能够上调肝脏中与脂肪酸氧化相关的Ppara、Cpt1a、Hmgcs2、Ppargc1a、Sirt1和Fgf21等基因表达(图2N)。上述数据表明AceCel促进肝脏脂肪酸氧化,并且发生在主要表型变化之前。
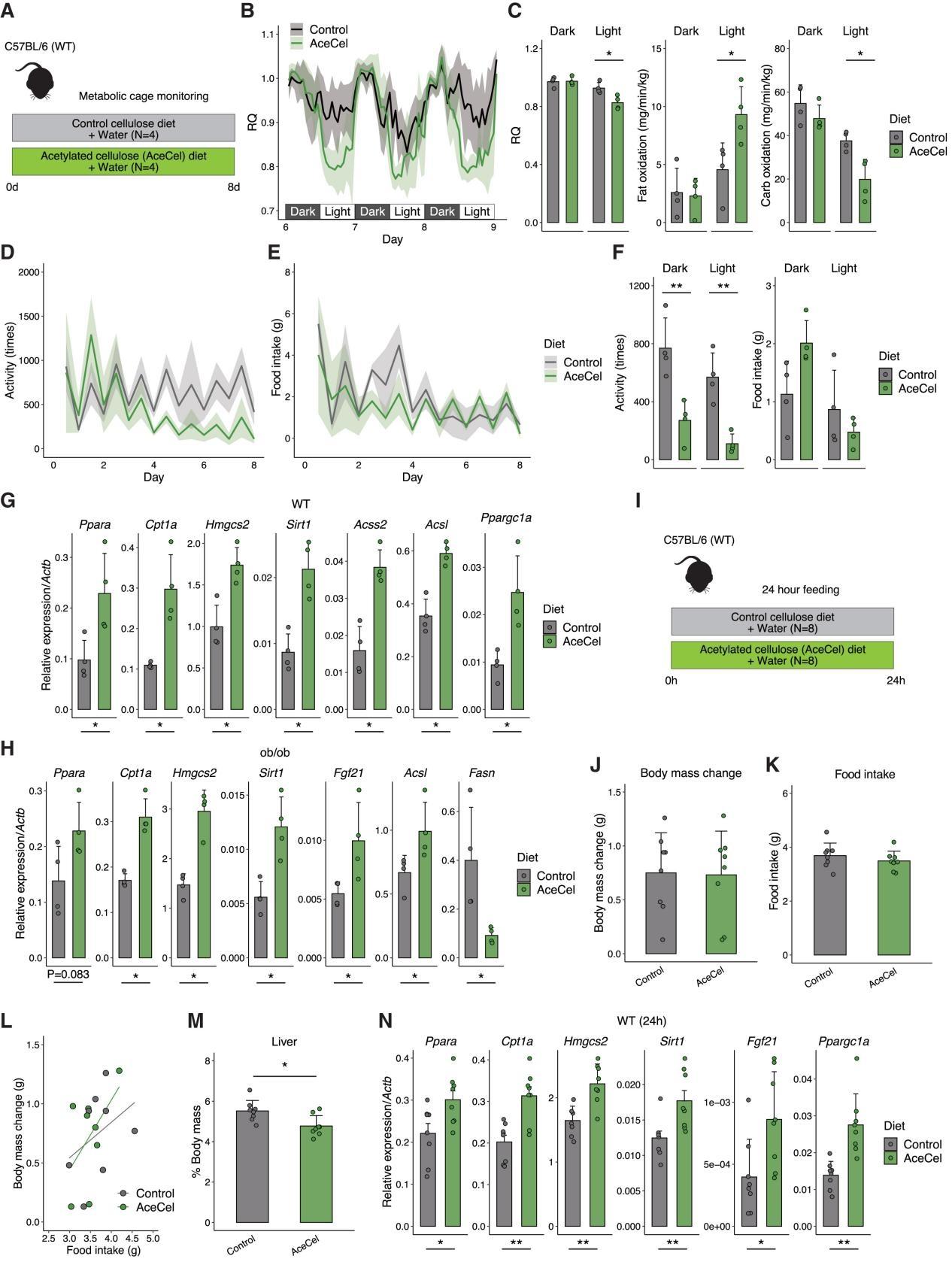
图2.AceCel促进肝脏中的脂肪酸氧化
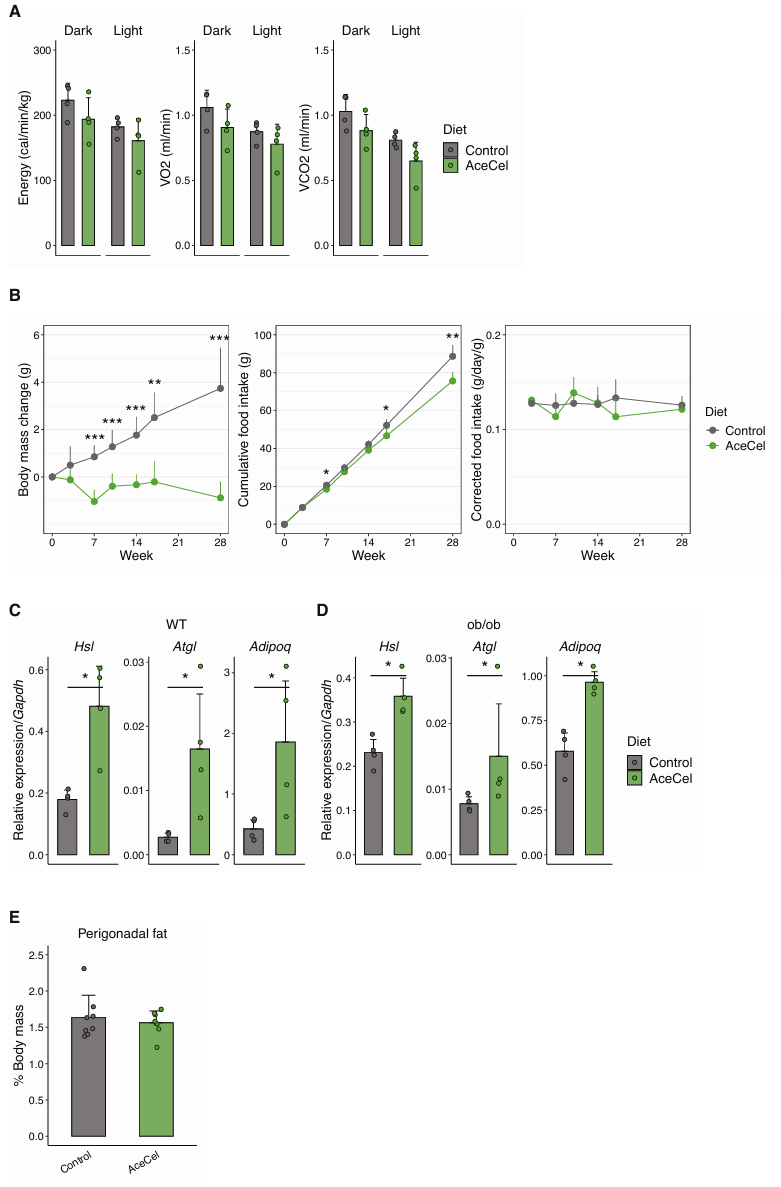
图S2.AceCel影响全身代谢
3、AceCel消耗糖原储存并抑制肝脏葡萄糖代谢
鉴于AceCel喂养小鼠光照周期的碳水化合物氧化受到抑制(图2C),研究人员推测AceCel促进脂肪氧化作为对碳水化合物氧化受限的补偿反应。实验验证结果显示,AceCel上调ob/ob小鼠磷酸烯醇式丙酮酸碳羧化酶1(Phosphoenolpyruvate Carboxykinase, Pck1)的表达,而Pck1是糖异生过程中的限速酶(图3A)。同时糖原磷酸化酶(Glycogen phosphorylase, Pygl)和糖原合成酶2(Glycogen synthase 2, Gys2)等糖原相关基因表达也上调,表明AceCel增强了糖原周转(图3A)。值得注意的是,Gys2表达也受PPARα调节。
由于糖原储存对进食状态敏感,因此研究人员对自由进食和禁食5小时后的小鼠进行为期2周的AceCel喂养(图3B)。尽管各组之间的体重减轻程度相当,但喂食AceCel小鼠的肝脏重量显著降低,在禁食AceCel组中降低程度最为明显(图3C、D)。无论自由进食还是禁食条件下,AceCel组均没有降低全身血糖水平,但显著降低门静脉葡萄糖水平(图3E、F),这意味着肠道葡萄糖流入更容易受到AceCel喂养的影响。与此一致,在AceCel组中,特别是在禁食期间肝糖原储备显著减少(图3G、H)。禁食期间,脂肪酸氧化(即Ppara、Cpt1a、Hmgcs2和Sirt1)和葡萄糖代谢(即Pck1和Gys2)相关的肝脏基因表达普遍上调,而AceCel进一步增强这一趋势(图3I),这表明AceCel加速了碳水化合物的消耗,类似于禁食期间观察到的代谢状态。上述研究表明AceCel通过限制葡萄糖内流来抑制肝糖原储存(小编注:图3A检测肝脏中糖原合成相关基因是升高的,推测是限制葡萄糖内流后代偿性增高糖原合成转录水平),从而促进代偿性脂肪氧化。
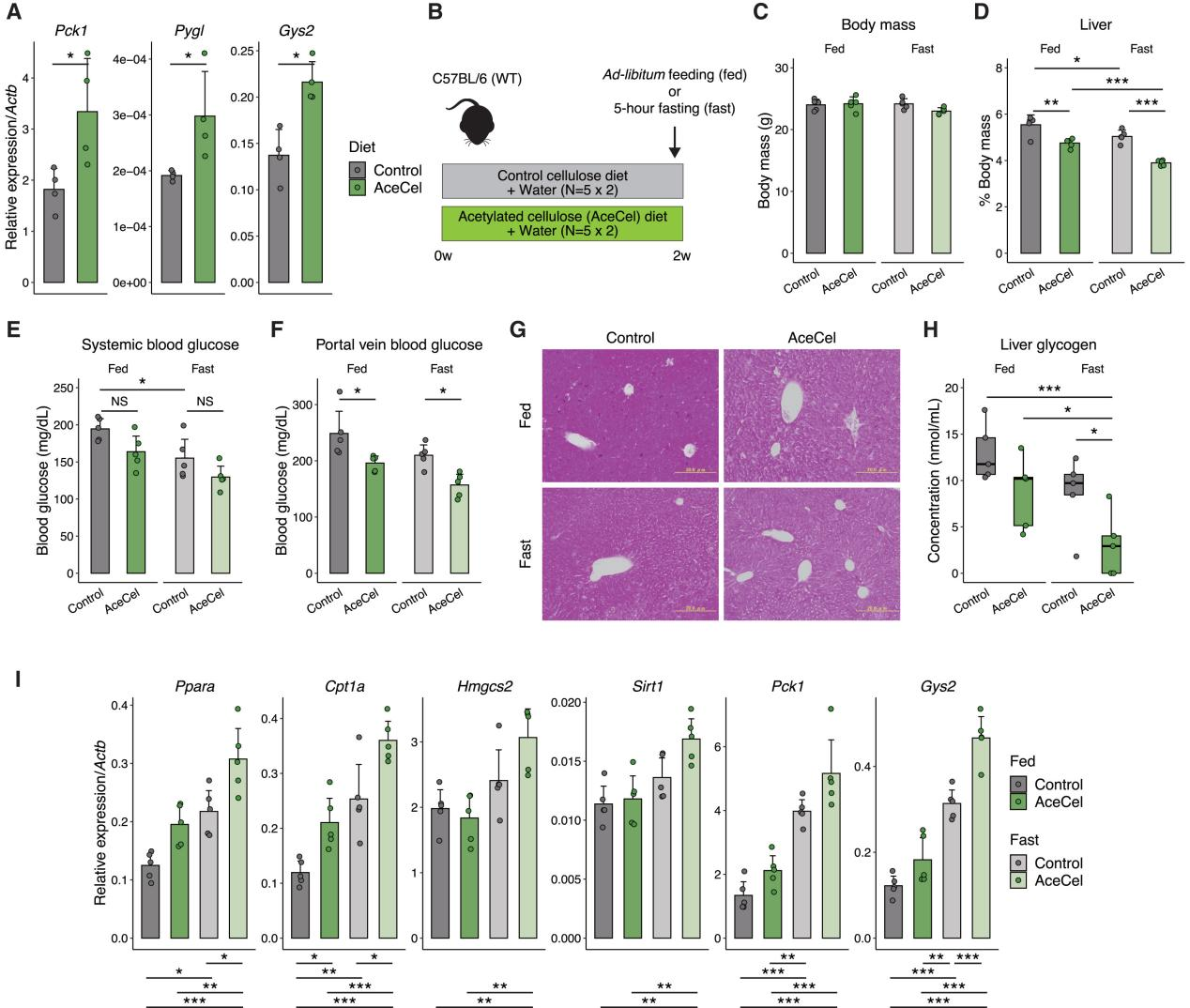
图3.AceCel抑制碳水化合物从肠道流入
4、AceCel的代谢作用由肠道菌群介导
接下来,研究人员进一步探究了AceCel改变宿主代谢的机制。尽管GPR43和GPR41等SCFA受体参与全身代谢,但在GPR43和GPR41敲除小鼠中,AceCel仍能抑制体重增长并降低肝脏和脂肪重量(图S3A-G)。此外,AceCel没有改变血清中受SCFA和GRP43调节的总GLP-1或PYY水平(图S3H、I)。上述研究结果表明AceCel的作用不依赖于SCFA受体信号传导。AceCel诱导的代谢改变类似于在长期禁食或生酮饮食期间观察到的代谢改变,其中葡萄糖利用受到抑制,而脂肪氧化得到增强。尽管AceCel和对照饮食都含有相同量的碳水化合物,但这些变化的发生与摄入量无关(图2C、K)。结合AceCel喂养的小鼠中门静脉葡萄糖水平显著降低的现象(图3F),研究人员推测AceCel可能会改变肠道环境,从而抑制糖分吸收,模拟低碳水化合物代谢状态。
拓展阅读
SCFA受体信号通路与GLP-1\PYY调控
短链脂肪酸(Short-chain fatty acids, SCFAs)主要由肠道微生物发酵膳食纤维产生,包括乙酸、丙酸和丁酸。它们通过激活肠内分泌细胞(EECs)中特定的G蛋白偶联受体(GPCRs)调控胰高血糖素样肽-1(GLP-1)和肽YY(PYY)的分泌,从而影响能量稳态、食欲及代谢功能。
在体内,SCFAs受到多种受体信号调控。其中,GPR41(FFAR3)高表达于分泌GLP-1/PYY的肠内分泌L细胞及神经细胞,通过Gᵢ/o蛋白激活MAPK/ERK信号级联,增强激素合成与释放;GPR43(FFAR2)主要分布于肠道L细胞、脂肪组织和免疫细胞,经Gq蛋白激活磷脂酶C(PLC),水解PIP₂生成IP₃触发胞内Ca2⁺释放,直接介导GLP-1/PYY囊泡胞吐;GPR109A(HCAR2)富集于结肠上皮和免疫细胞,通过Gᵢ蛋白抑制NF-κB炎症通路,间接优化激素分泌微环境;而嗅觉受体Olfr78分布于肾血管平滑肌和肠嗜铬细胞,响应丙酸激活Gₛ蛋白-cAMP-PKA通路,在拮抗GPR41功能调节血压的同时协同调控GLP-1/PYY释放。这些受体共同构成SCFAs信号网络,通过直接刺激(如GPR43介导的Ca2⁺振荡)与间接调控(如GPR109A维持的肠黏膜屏障完整性)双重机制,实现GLP-1/PYY分泌的精密调节,最终影响糖脂代谢平衡与能量摄入抑制。
参考文献:[1]Tolhurst, et.al.Diabetes, 61 (2012), pp. 364-371.
为了验证这一猜想,研究人员首先在四个独立实验中分析了盲肠微生物群组成(其中三个使用野生型小鼠,一个使用ob/ob小鼠),以确定由AceCel诱导的常见微生物特征。主坐标分析显示微生物群组成发生显著变化(图4A)。在AT19和ob4两项实验中,AceCel组明显沿着坐标轴2聚集,表明AceCel可能改变盲肠微生物群的整体结构。通过使用多变量线性混合模型进行分析,研究人员发现与对照组或AceNa组相比,AceCel组在门水平上有5个分类群(图4B)、在属水平上有17个分类群以及在扩增子序列变异(Amplicon Sequence Variant, ASV)水平上有175个分类群表现出丰度差异。其中,拟杆菌属是AceCel喂养小鼠肠道内主要菌群之一(图4B),这与先前膳食纤维能够促进拟杆菌属生长的研究结果一致。与AceNa组相比,AceCel增加了拟杆菌属的丰度和对应粪拟杆菌(BC)的ASV丰度(图S3J)。此外,AceCel还增加了疣微菌目的嗜黏蛋白阿克曼氏菌属的ASV丰度(图S3K),该菌属已被证实能够改善肥胖。相比之下,AceCel喂养小鼠毛螺菌和双歧杆菌以及假长双歧杆菌的丰度最低(图4B、图S3L)。上述结果表明AceCel对盲肠内的微生物群影响显著。
由于不同实验中ASV组成差异较大,有些ASV只在其中一项实验中出现(图4A),因此研究人员把比较范围扩大到了目水平进行进一步分析。在五个有差异的目中,只有拟杆菌目与体重变化显著相关(图4C)。于是研究人员集中于B. thetaiotaomicron (BT),B. ovatus (BO)和BC三种代表性人类共生拟杆菌单菌定植小鼠进行研究,发现BC的含量在使用AceCel处理后显著增加(图S3J),而BT仅在两个实验中的五份样本中被检测到,而BO在任何样本中均未被检测到,这使得物种水平的比较变得困难。但AceCel始终抑制BT、BC和BO单菌定殖小鼠的体重增加(图4D、图S3M)。这些发现表明AceCel的代谢作用主要由拟杆菌属介导。这与AceCel和对照组在无菌(GF)小鼠中的体重增加没有明显差异的结果相一致(图4D)。为了探究通常在GF小鼠中观察到的碳水化合物分解受损导致的盲肠肿大是否会影响体重,研究人员测量排除盲肠后的体重,发现BT单菌定植能够使对照饮食喂养小鼠的体重、肝脏重量和脂肪量增加,而这些影响在AceCel喂养小鼠中被消除(图4E-G)。进一步研究表明,与脂肪酸氧化相关的肝脏基因表达在GF小鼠中保持不变,但在BT单菌定殖组中上调,而脂肪酸合酶Fasn仅在BT单菌定殖组中下调(图4H、I)。尽管AceCel喂养的BT单菌定植小鼠的盲肠乙酸盐水平略高于其无菌对照组(图S3N),但AceCel显著提高了BT单菌定植小鼠和无菌小鼠的乙酸盐水平,这表明肠道乙酸盐水平不是这些代谢表型变化的主要因素。上述研究结果表明,AceCel会改变肠道菌群的组成,并且肠道菌群是其发挥代谢作用所必需的因素。
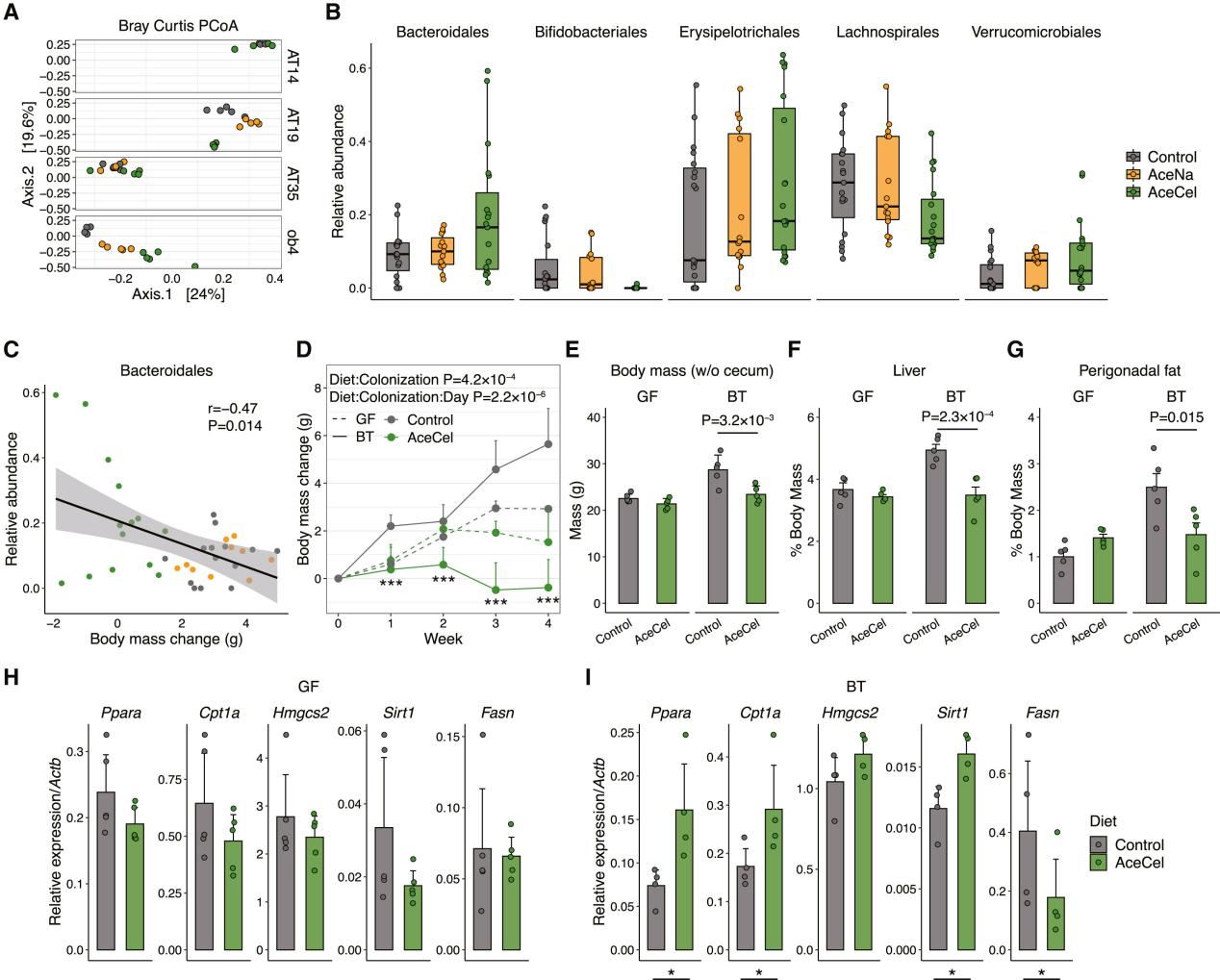
图4.AceCel以微生物群依赖性方式影响宿主代谢
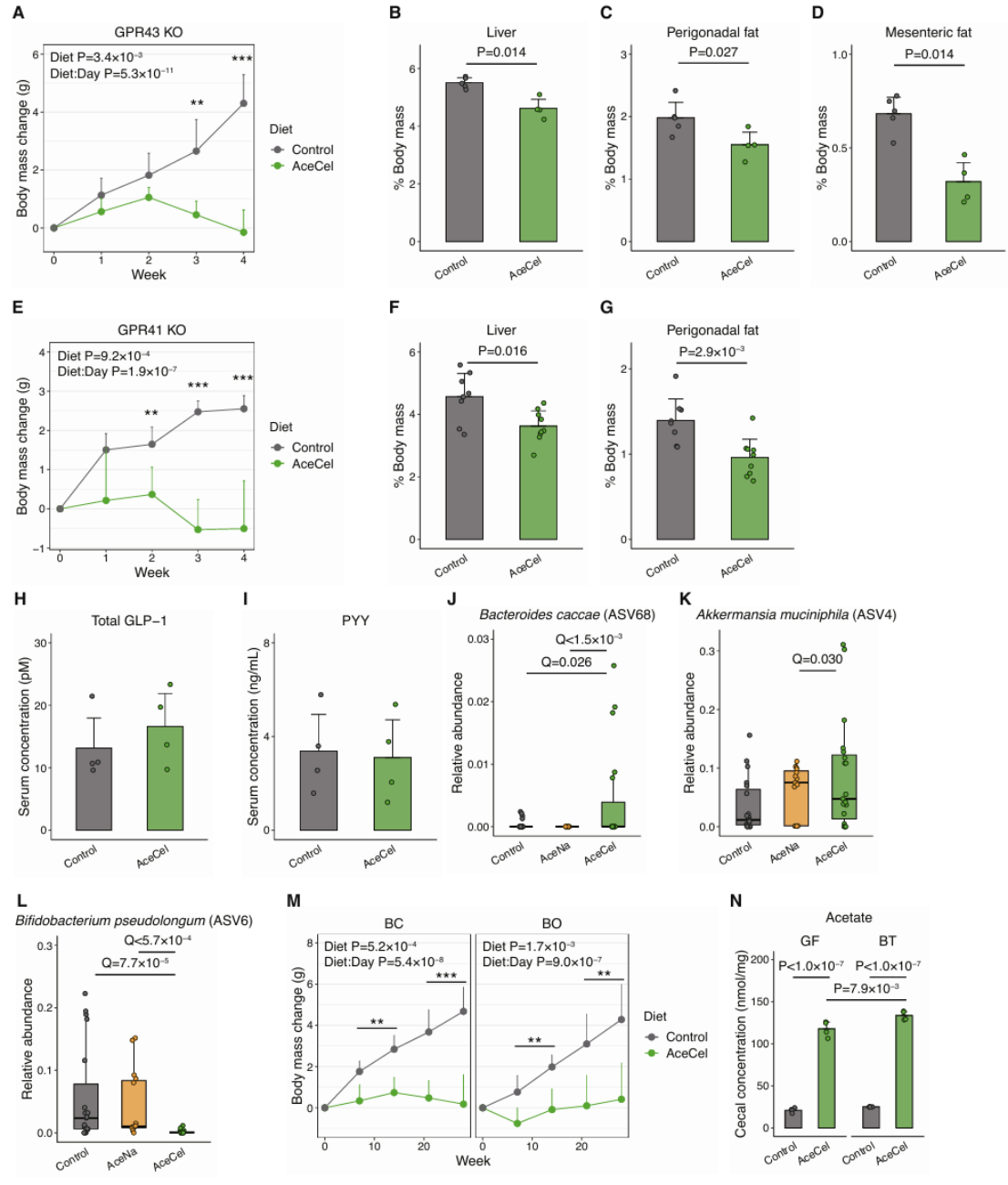
图S3.AceCel以依赖微生物群的方式减少体重增加
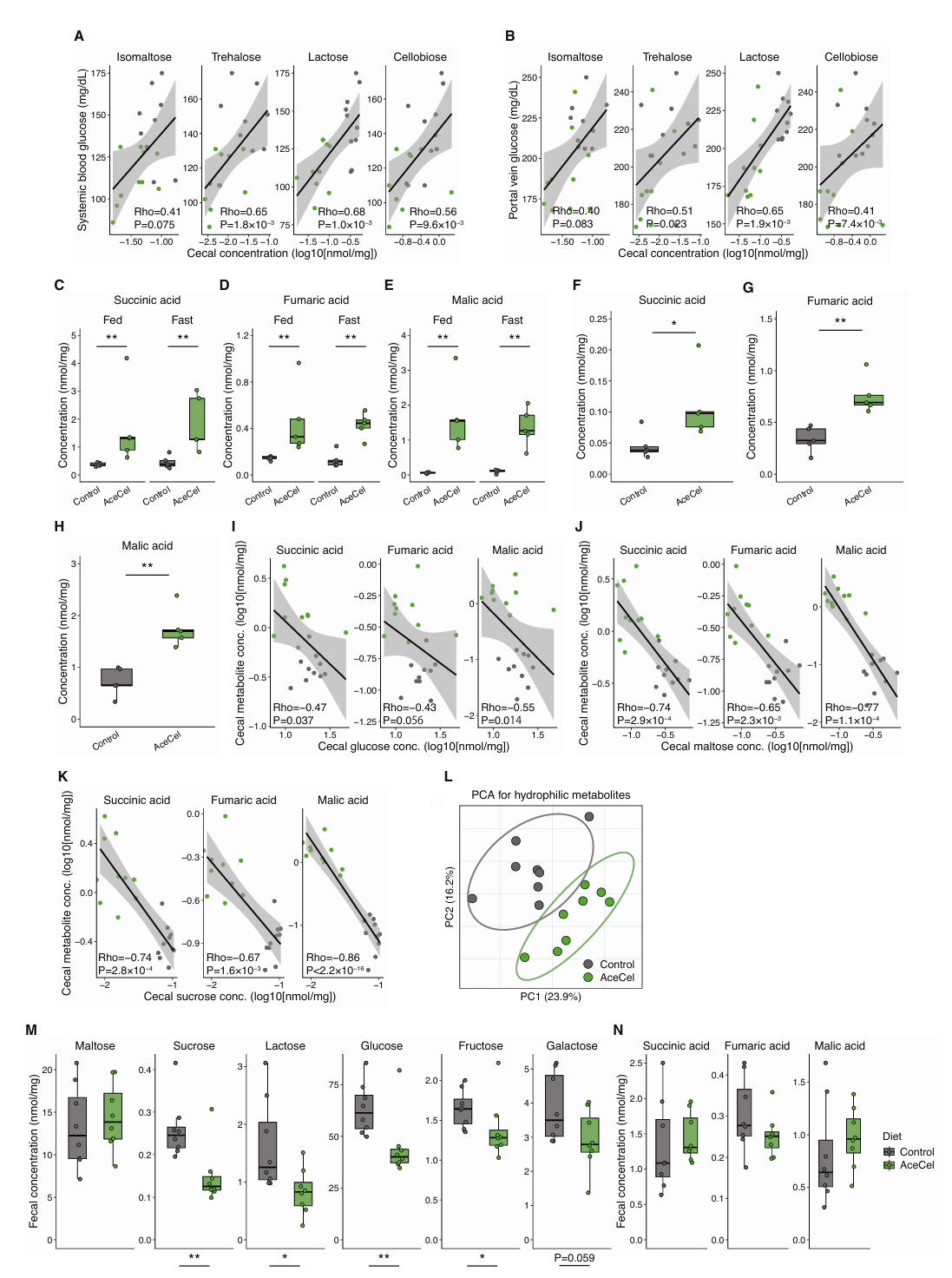
图S4.AceCel能降低SPF小鼠体内的双糖和单糖含量
5、AceCel减少碳水化合物并增加肠道中的发酵产物
肠道微生物在塑造肠道代谢环境和调节人体代谢方面发挥重要作用,于是研究人员进一步探究了AceCel对盲肠代谢产物的影响。主成分分析(PCA)显示,AceCel显著改变了无特定病原体(SPF)小鼠的整体代谢物谱,且在第一主成分上效果尤为明显(图5A、B)。此外,研究人员检测到84种盲肠代谢物在四组之间存在差异,这些显著变化大多发生在AceCel组中,并与喂养状况无关(图5C)。AceCel组中减少的代谢物主要与淀粉和糖代谢或谷胱甘肽代谢相关,而增加的代谢物主要与缬氨酸、亮氨酸和异亮氨酸生物合成相关(图5D)。主成分分析的结果也表明AceCel组在喂养和禁食两个状态下存在差异,这可能与嘌呤和嘧啶代谢物水平的升高相关(图5A、C)。
与途径分析结果一致,AceCel显著降低了大多数二糖水平,包括淀粉降解产生的麦芽糖和异麦芽糖,以及与代谢疾病相关的蔗糖(图5E)。在单糖中,盲肠葡萄糖水平与生理性SCFA水平(10-50 nmol/mg)均没有显著差异,其中后者可作为额外的营养来源。但在禁食期间,AceCel会降低葡萄糖水平(图5E)。除此之外,盲肠中的二糖和葡萄糖与全身葡萄糖水平(图5F、图S4A)以及门静脉葡萄糖水平(图5G、图S4B)呈现出较弱的正相关,这表明肠道中的单糖与宿主的葡萄糖代谢有关(小编注:本文提及宿主高达8% 的能量消耗可归因于肠道微生物群及其新陈代谢。此外也有研究表明SCFA 在 FFAR 2/3 介导的葡萄糖稳态中,平均 85 kg 的人类每日丙酸盐产生量估计为 29.5 mg/kg/天,对内源性葡萄糖产生的贡献可能相对较小(2.2 mg/kg/min),其中约 50% 可能归因于糖异生。然而,SCFA 作为调节肝葡萄糖稳态的信号分子的潜在作用尚未在人类中完全阐明)。
不仅如此,由拟杆菌属通过碳水化合物发酵产生的琥珀酸、富马酸和苹果酸等有机酸在AceCel喂养小鼠中显著增加,并与进食状态无关(图S4C-E)。这些代谢物在肝脏中也显著增加(图S4F-H),而在盲肠中的水平与单糖呈负相关(图S4I-K)。这些发现表明AceCel能够改变肠道微生物的组成及其代谢物,从而将碳水化合物转化为发酵产物。
拓展阅读
肠道微生物组与代谢
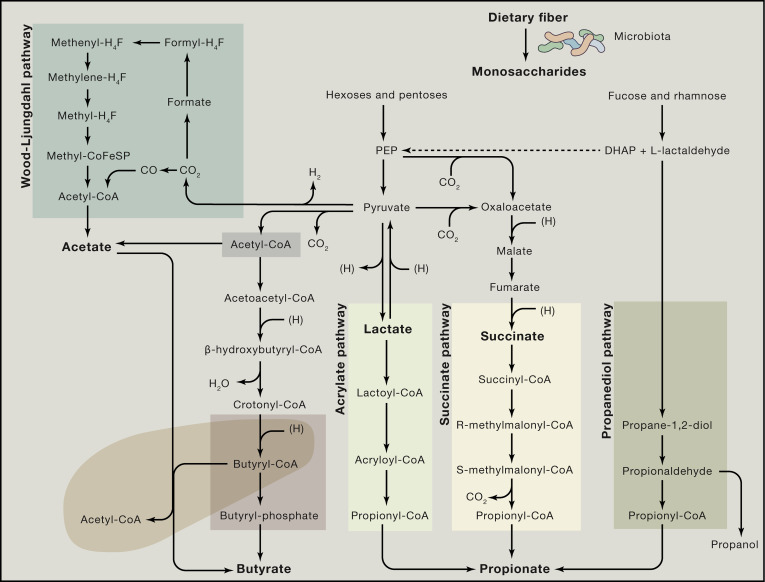
肠道微生物组是消化功能的关键组成部分,负责分解到达下消化道的复杂碳水化合物、蛋白质和少量脂肪。其主要代谢底物为食物中未被小肠吸收的残余物质,包括碳水化合物和肽类。膳食纤维(如纤维素和果胶)首先被微生物酶(例如糖苷水解酶)水解为寡糖和单糖(如葡萄糖),随后通过细菌发酵过程被利用。此发酵产生多种微生物代谢物,包括乙醇、乳酸和琥珀酸等有机酸,并最终形成乙酸、丙酸和丁酸等短链脂肪酸(Short-chain fatty acids, SCFAs)。
肠道中膳食纤维转化为单糖的过程由微生物群的特定酶谱介导,而SCFAs是发酵的主要终产物。其中,乙酸盐(乙酸)可由多种肠道细菌合成:一种途径涉及丙酮酸经丙酮酸脱羧酶作用生成乙酰辅酶A,再转化为乙酸;另一种途径为Wood-Ljungdahl途径(还原乙酰辅酶A途径),该过程包括两个分支:(1)甲基分支(东部分支),将CO2还原为甲酸,进而形成甲基四氢叶酸;(2)羰基分支(西部分支),将CO2还原为CO,随后甲基与CO结合形成乙酰辅酶A,最终水解为乙酸。除乙酸外,另一种主要的SCFA丙酸主要通过琥珀酸经脱羧酶作用直接还原获得。此外,丙酸盐也可以以乳酸或脱氧核糖为前体,分别通过丙烯酸酯途径和丙二醇途径转化形成。第三种主要的SCFAs丁酸是由两个乙酰辅酶A分子缩合并随后还原为丁酰辅酶A形成的,丁酰辅酶A可通过磷酸转丁酰酶和丁酸激酶通过所谓的经典途径转化为丁酸。此外,某些肠道微生物(如普拉梭菌Faecalibacterium prausnitzii)能共代谢乳酸和乙酸合成丁酸,从而防止乳酸积累并维持肠道环境稳定。宏基因组学证据还表明,丁酸亦可经由赖氨酸途径从蛋白质衍生氨基酸合成,这反映了微生物的营养适应性,确保SCFAs等关键代谢物的持续产生,对宿主能量供应和肠道屏障功能至关重要。
参考文献:
[1]Koh A .et.al.Cell. 2016 Jun 2;165(6):1332-1345.
研究人员还探究了喂食AceCel 24小时小鼠粪便的碳水化合物,发现脂肪酸氧化相关基因表达上调(图2N),PCA图显示AceCel在24小时内改变了代谢物谱(图S4L),同样研究人员发现单糖和二糖(除了麦芽糖)显著减少,而发酵产物在该时间点尚未积累(图S4N)。这些研究结果表明,肠道内碳水化合物的改变先于宿主代谢的改变,并可能有助于宿主代谢的变化。
接下来,研究人员分析了BT单菌定植小鼠和GF无菌小鼠的盲肠代谢物。主成分分析显示,AceCel对在PC2维度上对BT单菌定殖小鼠的盲肠代谢物具有显著影响,同时其还轻微影响GF小鼠中的代谢物组成(图S5A)。与在SPF小鼠实验中的结果一致,AceCel能够降低AceCel喂养小鼠盲肠中的麦芽糖和海藻糖含量。值得注意的是,GF小鼠中的麦芽糖保持低水平且不受AceCel影响,而海藻糖虽然也保持低水平,但在AceCel组中略有降低(图5H、I)。另一方面,蔗糖的含量在GF小鼠体内更高,而AceCel仅在GF小鼠体内降低了其含量(图S5B)。在BT单菌定植小鼠中,BT优先消耗的葡萄糖、阿拉伯糖和果糖减少,而AceCel进一步促进这一过程(图5J、图S5C、D)。相比之下,AceCel将半乳糖减少至与GF小鼠相似的程度(图S5E)。AceCel增加了BT单菌定植小鼠盲肠中的琥珀酸和富马酸水平,而其在GF小鼠中保持低水平且不受影响(图S5F、G),这表明琥珀酸和富马酸来源于细菌代谢过程。然而与SPF小鼠不同的是,AceCel并未增加BT单菌定植小鼠的苹果酸含量(图S5H),说明单独使用BT存在代谢限制。由于口服琥珀酸不会抑制体重增长(图S5I),因此AceCel的代谢效果不是由琥珀酸所介导。受限于富马酸的低水溶性,研究人员无法获得与琥珀酸浓度近似的口服溶液,因此无法进行口服测试。上述研究表明,AceCel通过促进细菌碳水化合物的消耗和微生物群依赖性机制降低肠道单糖水平。
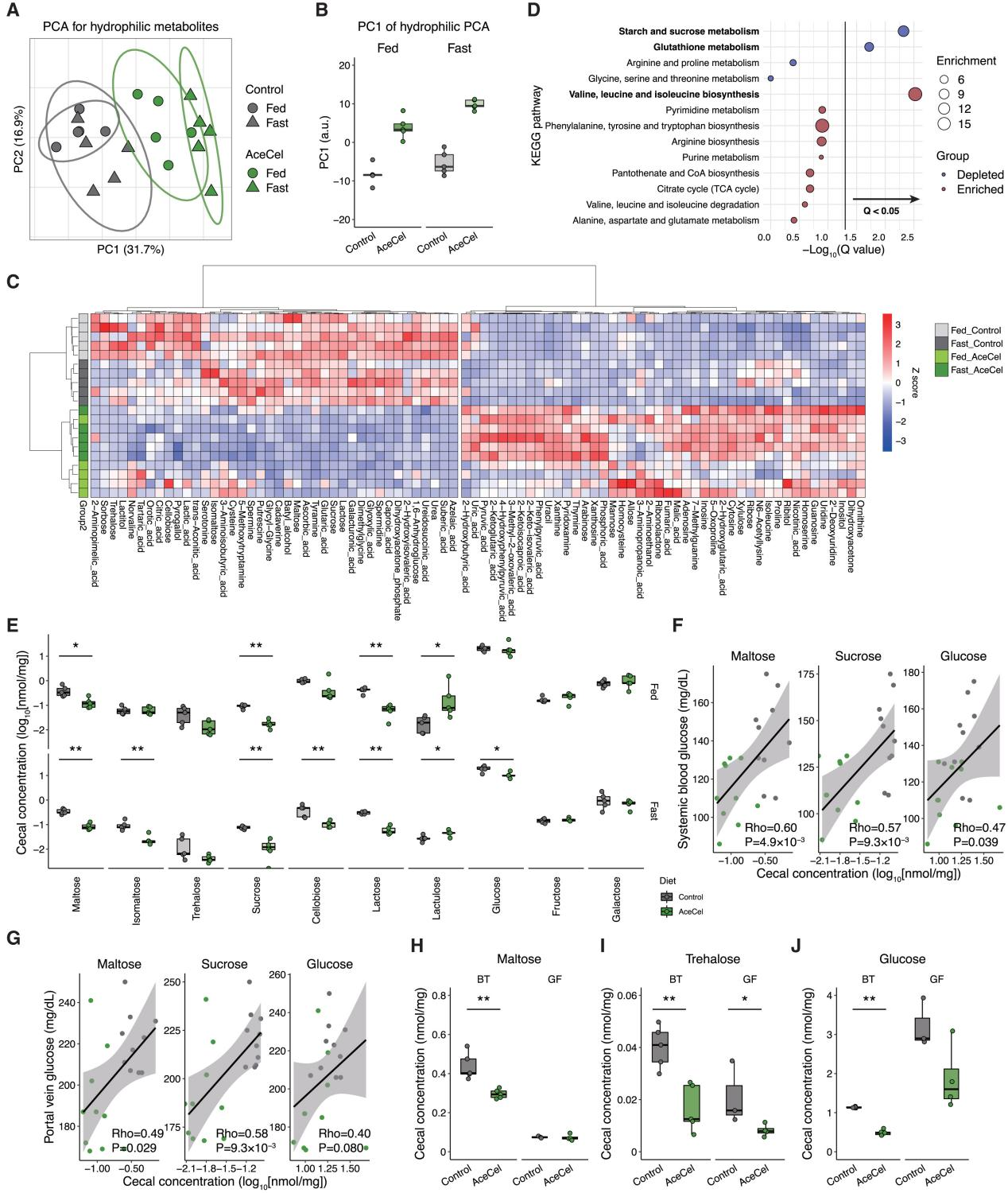 图5.AceCel以微生物群依赖性方式减少肠道碳水化合物
图5.AceCel以微生物群依赖性方式减少肠道碳水化合物
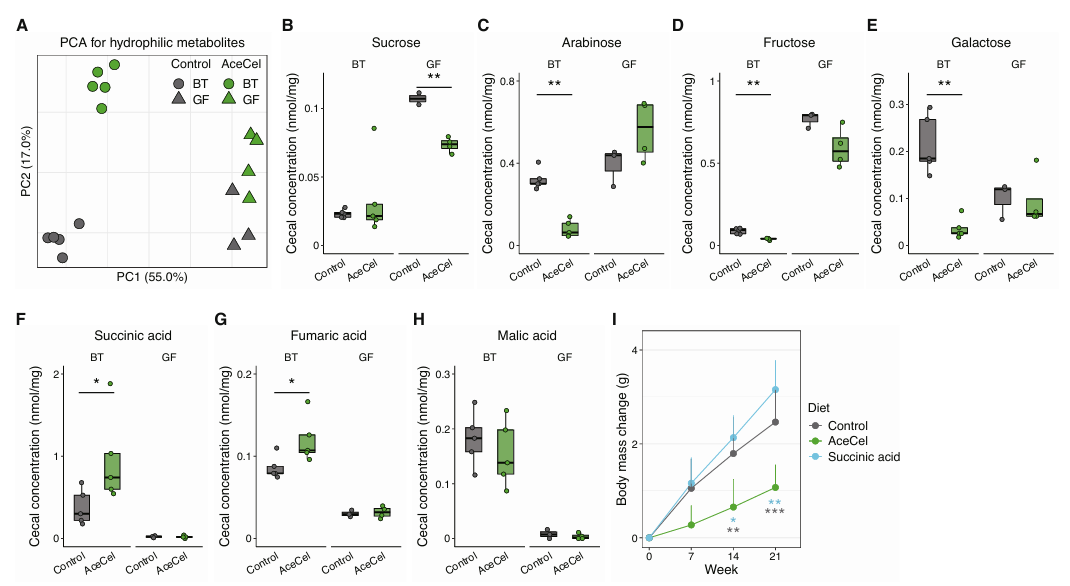
图S5.AceCel能够降低BT单菌种植小鼠体内的双糖和单糖含量
6、乙酸盐增强拟杆菌属的丰度和碳水化合物代谢功能
为了进一步探究AceCel的作用机制,研究人员检测了乙酸盐对拟杆菌属的生物量和功能的影响,并特别关注BT以评估其在碳水化合物消耗过程中的作用。首先,研究人员在含有葡萄糖,同时含或不含AceNa的培养基中培养BT,发现当培养基充分补充葡萄糖时,AceNa能够显著降低培养上清液中的葡萄糖水平(图6A),并减少包括葡萄糖和果糖在内的单糖含量(图S6A、B)。AceNa还以剂量依赖性方式增加琥珀酸和富马酸等发酵产物的含量,但不会增加苹果酸的含量,这一结果与BT单菌定植小鼠的研究结果相一致(图S5F-H)。同时AceNa会以剂量依赖性方式显著增加细菌浓度(图6B)。在BT单菌定植小鼠中,AceCel增加了BT单菌定植小鼠的盲肠丰度(图6BC)。基因表达分析显示,乙酸盐调控BT的碳水化合物代谢基因表达,其中AceNa上调BT培养物及单菌定植小鼠中与碳水化合物转运和分解相关的基因(如susG、susB、glkA)(图6D - F)。上述发现共同表明,乙酸盐能促进BT的生长并增强碳水化合物代谢,在一定程度上解释了AceCel喂食小鼠肠道碳水化合物消耗增加的现象。
有研究表明,肥胖患者肠道菌群常通过减少粪便能量排泄提高能量获取(小编注:前人研究显示,肥胖个体肠道菌群中 厚壁菌门(Firmicutes)(如 Clostridium、Ruminococcus)比例升高,这些菌擅长分解复杂碳水化合物(如纤维素、抗性淀粉),生成更多可吸收的 短链脂肪酸(SCFAs)(乙酸、丙酸、丁酸)。且某些菌群(如 Bacteroides)增加胆汁酸代谢,提高膳食脂肪乳化效率,促进脂肪吸收。此外肥胖 vs. 瘦者粪便测热显示,肥胖者粪便能量密度降低 5-10%,即更多能量被吸收)。研究人员在第2周时并未观察到对照组和AceCel喂养小鼠在粪便能量输出方面存在差异,而在第4周时,AceCel喂养小鼠的粪便能量输出仅轻微下降,这可能是由于后期较低的绝对食物摄入量所致(图S2B)。鉴于盲肠内容物和肝脏中琥珀酸和富马酸均升高(图S4C-H),同时宿主可利用的碳水化合物含量减少(图5E),这些发现表明AceCel 的代谢作用主要是由细菌将碳水化合物转化为难以被宿主代谢的发酵产物所驱动(小编注:发酵产物主要是指:乙酸;丙酸及丁酸),而非通过粪便中的能量损失实现。最后,研究人员没有发现AceCel直接调节负责将膳食糖降解成单糖的刷状缘酶的证据,因为来自喂食AceCel 24小时或四周的小鼠的小肠上皮匀浆没有显著改变葡萄糖释放(图S6F、G)。
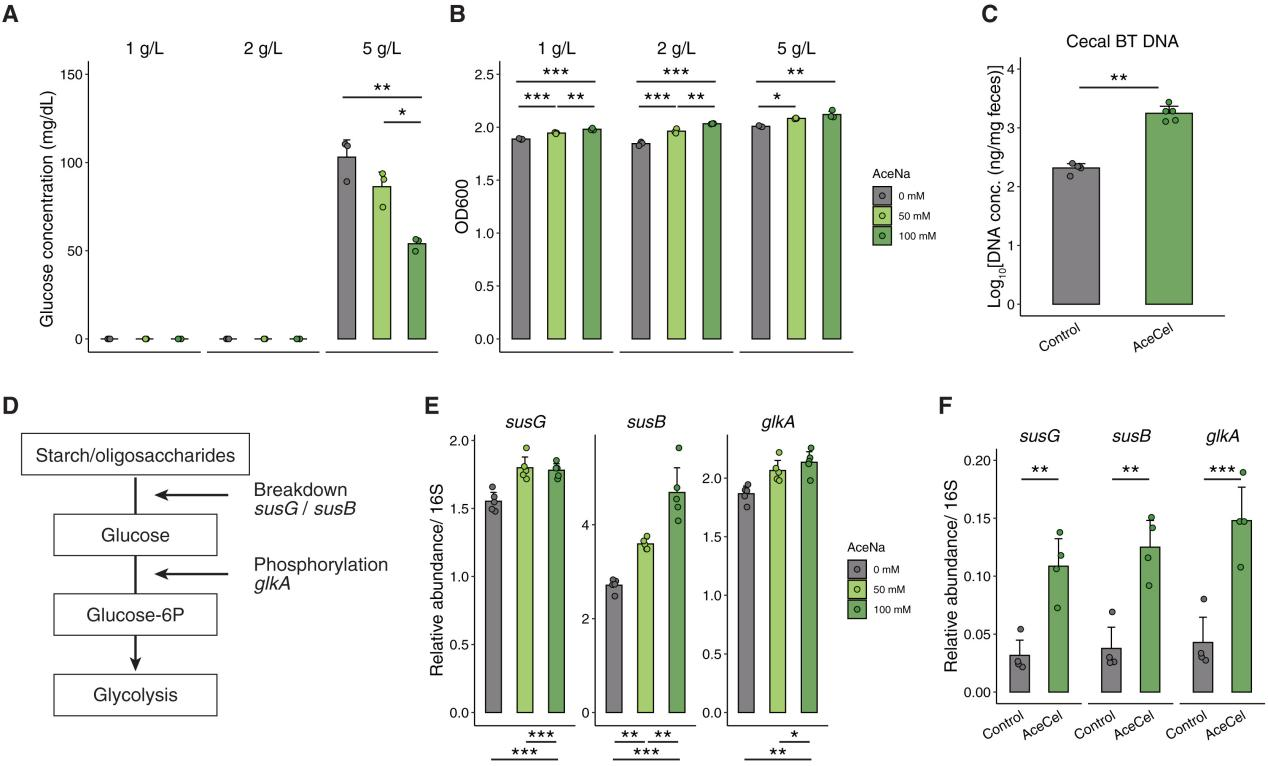
图6.AceCel增强BT的丰度和碳水化合物代谢
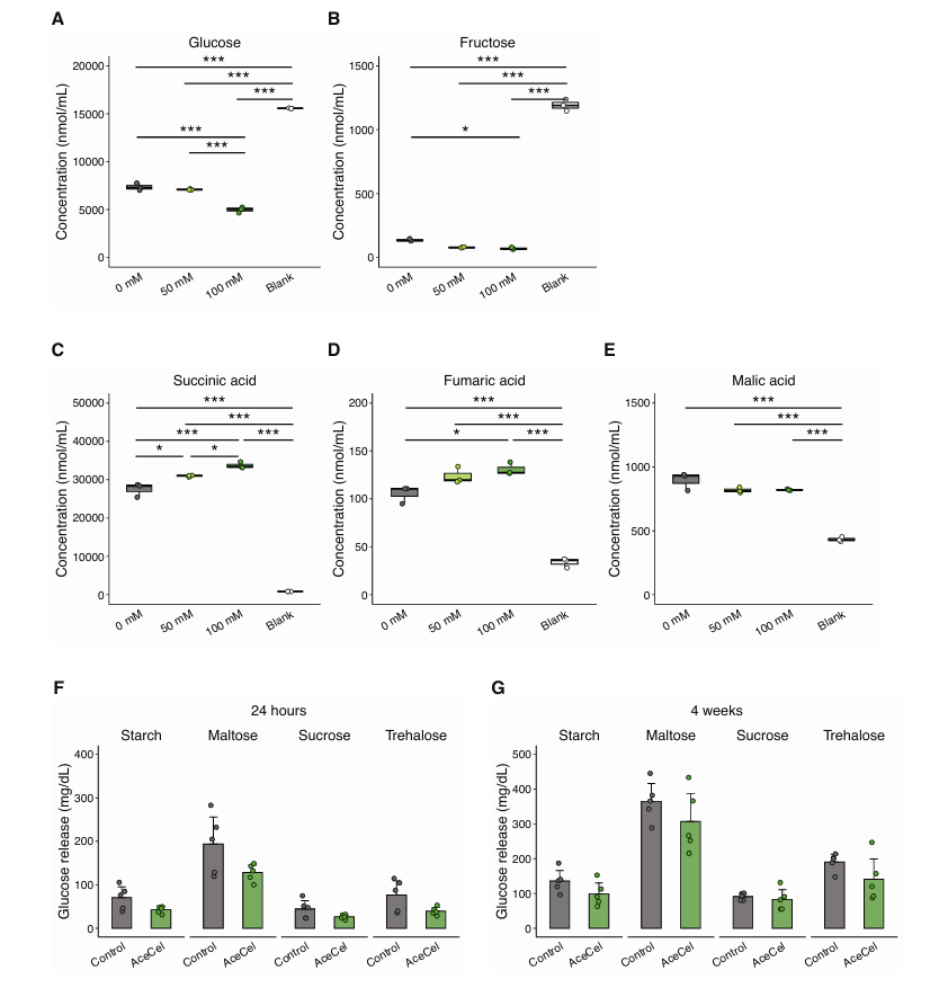
图S6.乙酸盐直接调节了拟杆菌属的碳水化合物代谢过程
总结
在本研究中,研究人员发现AceCel显著改变了肠道细菌的组成和功能,显著抑制野生型和肥胖小鼠的体重增加。AceCel限制宿主肝脏中碳水化合物的氧化(小编注:作者引用了相关文献,其报道了AceCel发酵产生的SCFA(乙酸和丙酸)通过肠道L细胞GLP-1分泌,增强外周胰岛素敏感性,从而抑制了肝脏中碳水化合物的氧化),并以微生物群依赖的方式促进肝脏脂肪酸的氧化。并通过进一步研究表明,乙酸盐增强了肠道拟杆菌属的碳水化合物发酵能力,驱动肠道单糖消耗,介导"菌群-宿主"代谢轴协同调控,降低宿主能量获取。这些发现强调了AceCel作为益生元的潜力,它可以调节细菌和宿主的碳水化合物代谢,为肥胖干预提供了基于微生物组调控的新策略。
原文链接:https://www.cell.com/cell-metabolism/fulltext/S1550-4131(25)00223-2
转载本文请联系原作者获取授权,同时请注明本文来自徐凌燕科学网博客。
链接地址:https://blog.sciencenet.cn/blog-3483272-1481619.html
转载本文请联系原作者获取授权,同时请注明本文来自徐凌燕科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3483272-1503797.html?mobile=1
收藏

