博文
肿瘤机制与治疗策略
|
作者:黄必录
摘要:宿主产生肿瘤的主要原因包括免疫系统的遗传缺陷和免疫系统的衰老,从而导致免疫系统无法有效地清除掉肿瘤细胞。因此,根治肿瘤最理想的策略是修正免疫系统的遗传缺陷和逆转衰老的免疫系统。
关键词:肿瘤细胞;癌症;免疫系统;永生化;端粒;rDNA;P53
预印本:https://papers.ssrn.com/sol3/papers.cfm?abstract_id=5286041
1 介绍
肿瘤分良性和恶性两种类型,而癌症是恶性肿瘤的统称。并不是所有的肿瘤都是癌症,但所有的癌症都是肿瘤。肿瘤是导致人类死亡的第二大因素,至今没有找到根治方法。
肿瘤细胞是由正常细胞因为基因突变等原因而不再受Hayflick极限的限制,获得返老还童和无限复制能力的细胞,目前治疗肿瘤的策略主要是如何杀死肿瘤细胞:包括手术,伽马刀、超声刀、放疗、化疗、靶向疗法和CAR-T疗法等,但这些方法无法把所有的肿瘤细胞消灭掉,再加上正常细胞也会因为基因突变不断产生新的肿瘤细胞,因此很容易导致肿瘤复发。
下面我们先探讨一下肿瘤生物学的几个关键问题,以便接下来了解肿瘤为什么很难治愈,以及如何才能根治肿瘤。
2 肿瘤细胞不是去分化(dedifferentiation)的细胞
以肝细胞为例,胎肝细胞会大量表达甲胎蛋白,成人肝细胞不会表达甲胎蛋白,当成人肝细胞变成肝癌细胞后又会再次表达甲胎蛋白,但肝癌细胞还保留着肝细胞的身份,只是基因表达谱重新回到了胚胎期[1-2]。其它各种组织的成年细胞变成肿瘤细胞后,基因表达谱也与胚胎期相似[3-4]。提示,肿瘤细胞不是去分化的细胞,而是生理年龄逆转到胚胎期的细胞。
3 肿瘤细胞的永生化机制
“Telomere DNA and ribosomal DNA co-regulation model for cell senescence”认为,端粒DNA和核糖体DNA(rDNA)的阵列缩短是导致细胞衰老和Hayflick极限的根本原因,并已通过敲除45S rDNA等实验证明是正确的[5-6]。
然而,大部分肿瘤细胞高表达端粒酶,并且端粒和45S rDNA阵列的长度比正常细胞还短,例如,正常卵巢细胞中的端粒长度为8~13kb,而在恶性卵巢肿瘤中小于8kb[7];正常肝细胞端粒长度为7.8±0.2kb,肝癌细胞端粒长度为5.2±0.2kb[8];表达人类乳头瘤病毒E6和E7致癌基因的IMR90人永生化肺成纤维细胞,用高精度端粒测量方法--Telo-seq,检测了这些细胞在分裂66次、68次、71次、85次、96次和106次时的端粒长度。结果显示,平均端粒长度从66次分裂时的4294bp,到106次分裂时的2746bp[9];很多种的肿瘤细胞45S rDNA 拷贝数显著减少[10]。提示,肿瘤细胞虽然高表达端粒酶,但并不能增加端粒长度。肿瘤细胞的永生化机制也与端粒和45S rDNA无关。因此无需担心端粒酶疗法会致癌。
P53/P21/P16信号通路在调节衰老方面发挥着重要作用[11]。 约有一半的肿瘤细胞p53基因突变,另一半因为各种问题导致P53蛋白快速降解或失去作用。P53基因缺失可以使细胞无限增殖[12-13],这表明P53是细胞衰老的主控因子。
但是,为什么在肿瘤细胞里表达正常的P53蛋白甚至过表达该蛋白,很多时候是没有效果的?原来,P53蛋白要发挥作用需要先形成四聚体。若失去功能的P53蛋白和功能正常的P53蛋白组成四聚体,也会丧失正常功能[14]。
综上所述,肿瘤细胞返老还童和永生化机制与端粒和rDNA阵列的物理长度无关,而与p53基因突变或P53蛋白快速降解有关。
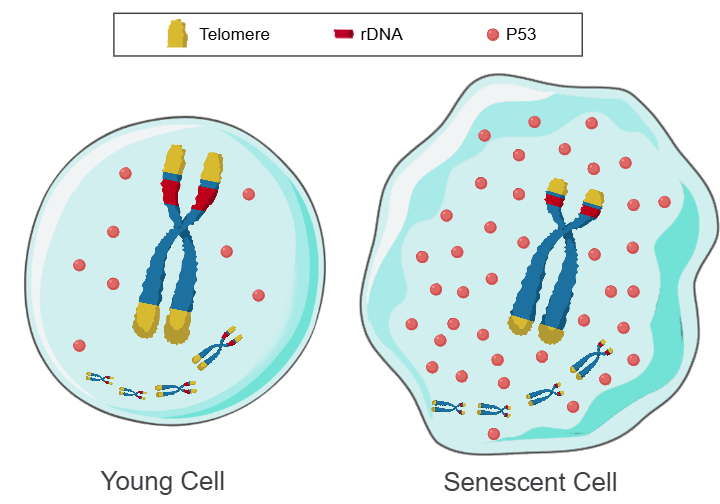
图1:Telomere DNA and ribosomal DNA co-regulation model for cell senescence
a.染色体上长阵列的端粒和rDNA,P53迅速降解,P53水平低,细胞年轻。b.染色体上短阵列的端粒和rDNA,P53缓慢降解,P53水平高,细胞衰老。
4 DNA突变负荷与免疫监视灵敏度负相关。
通常认为,细胞分裂越频繁,DNA突变负荷越高,然而,Abascal等人发现[15],不分裂和频繁分裂的细胞,DNA突变负荷是相同的;无论动物寿命长短,体型大小,在老年期,DNA突变负荷相差不大[16];每年吸烟23包和116包,支气管基底细胞的DNA突变负荷是一样的[17]。提示,体细胞的DNA突变负荷与免疫监视灵敏度相关,当突变负荷大到一定阈值时就会被免疫系统清除掉[18]。DNA突变积累不是导致细胞和个体衰老的原因,而仅仅是免疫系统衰老的结果。
由于寿命长的物种免疫系统衰老的更慢,能更长时间保持免疫监视的灵敏度,因此,无论寿命长短和体型大小,在老年期,DNA突变负荷相差不大。也就是说,导致突变细胞积累的根本原因,归结于有遗传缺陷的免疫系统或衰老的免疫系统。
5 肿瘤是如何杀死宿主的
肿瘤除了通过机械压迫重要部位导致宿主死亡外,恶性肿瘤还会使宿主极度疲劳、厌食、消瘦和多器官衰竭,最终导致宿主死亡,这些症状称为“恶病质”。
肿瘤导致宿主消瘦的原因并不是因为肿瘤与宿主争夺营养,因为有的良性肿瘤重达几十千克也没让宿主死亡,而是肿瘤细胞会释放生长分化因子15(GDF15)和炎症因子IL-6到血液中。GDF15和IL-6会穿过血脑屏障,激活大脑特定区域,导致宿主厌食、抑郁、加速肌肉和脂肪的分解,以及抑制抗肿瘤免疫反应[19-21]。
大面积微血管堵塞会导致组织缺氧和多器官衰竭。有66.7%的肿瘤患者死于肺栓塞[22]。这是由于肿瘤释放的趋化因子CXCL13,促进了血小板的聚集产生血栓[23]。值得注意的是,最近发现一种新的凝血机制也许与肿瘤诱发的多器官衰竭有关。当内皮细胞损伤时,红细胞会破裂流出黏性内容物并堵塞住微血管,这种红细胞微血管病变与缺血-再灌注损伤相关,在心肌梗死、肠道缺血、中风、脓毒性休克和心源性休克患者的微血管中尤为突出[24]。
细胞的生理状态分“功能态”和“增殖态”,例如,心肌细胞的搏动,肝细胞分解各种有毒物质和合成白蛋白就属于功能态。而肿瘤细胞会释放一些信号分子,改变正常细胞基因表达,使组织细胞无法完成正常的生理需求,导致患者出现虚弱和器官衰竭等症状。
由造血干细胞分化的红细胞、血小板和白细胞,数量不足就会导致宿主缺氧和窒息、凝血障碍和感染。而肿瘤细胞会通过释放细胞分化抑制剂,抑制正常细胞分化和成熟。例如,骨髓组织中的脂肪细胞对于骨髓中的血细胞的分化成熟至关重要,正常人体红骨髓中存在着大量的脂肪细胞,而急性髓性白血病(AML)患者红骨髓中几乎没有脂肪细胞,原因是AML患者骨髓中的肿瘤细胞会释放一些抑制间充质干细胞向脂肪细胞的分化的分子[25]。
6 导致肿瘤发生率随着年龄增长而上升的原因并不是基因突变,关键在于衰老的免疫系统
通过基因测序发现,原发肿瘤与复发的肿瘤可能是来自不同的克隆[26];寿命不足6个月的绿松石鳉鱼(Nothobranchius furzeri),会在不足6个月里重演了人类衰老历程中的各种表征:出现了基因组不稳定性、有害突变广泛积累、脂褐素积累、胸腺迅速变小、端粒缩短、并患上肿瘤[27],提示,肿瘤的产生无需经过漫长的DNA突变积累,而是可以随时快速出现。
端粒缩短是导致衰老的主要原因,因此,端粒更短者免疫系统也更衰老,肿瘤的发生率也更高。而超长端粒的小鼠肿瘤发生率更低,寿命更长[28];癌症幸存者可能比未患癌症的人具有更高的生物学年龄[29];研究发现[30],肿瘤患者的端粒长度缩短更快,看起来比同龄人大15岁,这些人体内细胞的端粒比应有长度更短,而且持续变短,直至肿瘤形成前4年左右突然停止缩短;较短的端粒会导致T细胞免疫缺陷[31];在德系犹太百岁老人中,hTERT和hTERC突变拥有更长的端粒,更长的寿命和预防年龄相关疾病[32];端粒最短组肿瘤发生率是端粒最长组的3倍,端粒最短组的肿瘤患者死亡率是端粒最长组的11倍[33]。
由于端粒长度与DUX4基因表达呈负相关[34]。DUX4与MHC-I基因表达也呈负相关,因此,随着端粒的不断缩短,DUX4表达会逐渐上调,MHC-I表达会逐渐下调,从而影响抗原呈递[35],这也是衰老组织容易积累衰老细胞和中老年人肿瘤发生率比年轻人高的重要原因之一。
个体每天都有很多细胞发生基因突变,少数突变的细胞会产生肿瘤细胞,但健康的免疫系统能及时清除掉这些异常的细胞。而有遗传缺陷的免疫系统或衰老的免疫系统,将无法有效地清除掉这些突变的细胞,从而导致肿瘤的发生。因此,免疫系统的遗传缺陷[36]或免疫系统的衰老才是导致个体产生肿瘤的主要原因[37-38]。
综上所述,导致年轻宿主产生肿瘤的根本原因是因为免疫系统的遗传缺陷,导致年老宿主产生肿瘤的根本原因是因为免疫系统衰老到一定阈值。
7 肿瘤为什么很难治愈
首先,肿瘤细胞与正常细胞的基因差异非常小,因此,免疫系统很难把肿瘤细胞与正常细胞区分开来,其实,一个人体内的肿瘤细胞与正常细胞的基因差异性,比人与人之间的基因差异性还要小,因此,癌症通常是不会传染的。此外,在正常细胞中拥有的蛋白质,同样也存在于肿瘤细胞中,因此,杀死肿瘤细胞的药物往往也会杀死正常细胞。
对于母体来说,胎盘和胎儿属于异物,因此,为了防止免疫系统的攻击,胎盘和胎儿的细胞必然具备能够阻止免疫系统攻击的对策,由于肿瘤细胞的基因表达谱回到了胚胎期,因此,肿瘤细胞也继承了胎盘和胎儿的各种免疫豁免策略。例如,肿瘤细胞表达一种名叫PAK4的丝氨酸/苏氨酸激酶,能阻止T细胞进入肿瘤组织。只要清除肿瘤的PAK4,T细胞就可以大举进入肿瘤,之前那些PD-1抑制剂久攻不下的肿瘤,也能被消灭掉[39];肿瘤细胞还会释放IL-1α和G-CSF,经外周血循环,抑制了全身免疫反应[40]。此外,肿瘤细胞还有很多免疫豁免策略,这里就不一一介绍了。
8 肿瘤的治疗
如上所述,由于肿瘤会向血液释放GDF15、IL-6、CXCL13、IL-1α和G-CSF等有害的信号分子,因此,治疗肿瘤的方法是先通过手术切除肿瘤,或原位杀死肿瘤,然后再想办法增强免疫功能,利用免疫系统清除掉遗漏的肿瘤细胞。
但是,很多杀死肿瘤的方法往往会杀敌一千,自损八百,这会极大的消弱了免疫系统,为肿瘤的复发创造了条件。例如,一些放化疗药物也会杀死免疫细胞和加快DNA突变频率,最高能达到自然突变频率的100倍[41];由于手术切除造成出血过多往往需要输血,而输血后宿主的淋巴细胞数量会下降,巨噬细胞和NK细胞的活性也会降低,这样就会增加肿瘤复发率[42-43];尽管CAR-T疗法能有效杀死血液肿瘤,但CAR-T疗法类似于化疗,在杀死癌变的B细胞时,也会把正常的B细胞一起杀死,这样也会极大的消弱免疫系统[44-45]。
为了减少肿瘤治疗的副作用,除了精准靶向药,如果情况允许,可以尽量选择伽马刀、超声刀,或直接向肿瘤内注射药物,或直接加热或冷冻肿瘤,以此来杀死肿瘤。
肿瘤治疗后往往会复发,因此,在清除肿瘤后需要通过增强免疫系统的功能来预防复发。虽然NK细胞等免疫细胞寿命较短,但可以由骨髓中的造血干细胞源源不断的分化补充,因此,对于有遗传缺陷的免疫细胞,可以通过修正造血干细胞中突变的基因来永久治愈;对于衰老的免疫系统,可以通过增加造血干细胞和胸腺的上皮干细胞(epithelial stem cells)[46]中的端粒和45S rDNA阵列的长度,从而让免疫系统返老还童。
结论
综上所述,导致宿主产生肿瘤的主要原因包括免疫系统的遗传缺陷和免疫系统的衰老,使免疫系统无法有效地清除掉肿瘤细胞。未来将通过修正造血干细胞的遗传缺陷或让衰老的免疫系统返老还童,使肿瘤得到根治。
参考文献
[1] Engelhardt NV, Goussev AI, Shipova LJ, et aI. Immunofluorescent study of alpha-foetoprotein (alpha-fp) in liver and liver liver tumours. I. Technique of alpha-fp localization in tissue sections. Int J Cancer. 1971 Mar 15;7(2):198-206. doi: 10.1002/ijc.2910070203.
[2] Camper SA, Tilghman SM. Postnatal repression of the alpha-fetoprotein gene is enhancer independent. Genes Dev. 1989 Apr;3(4):537-46. doi: 10.1101/gad.3.4.537.
[3] Balachandran S, Narendran A. The Developmental Origins of Cancer: A Review of the Genes Expressed in Embryonic Cells with Implications for Tumorigenesis. Genes (Basel). 2023 Feb 28;14(3):604. doi: 10.3390/genes14030604.
[4] Rácz GA, Nagy N, Tóvári J, Apáti et al. Identification of new reference genes with stable expression patterns for gene expression studies using human cancer and normal cell lines. Sci Rep. 2021 Sep 30;11(1):19459. doi: 10.1038/s41598-021-98869-x.
[5] Bilu Huang.Telomere DNA and ribosomal DNA co-regulation model for cell senescence.Negative,2021,12(3):9-15.doi:10.13276/j.issn.1674-8913.2021.03.003(2021).
[6] Bilu Huang , Xiaowen Hu. Causality of Aging Hallmarks. Aging and disease. 2025 https://doi.org/10.14336/AD.2025.0541
[7] Murakami J, Nagai N, Ohama K, et al. Telomerase activity in ovarian tumors. Cancer. 1997 Sep 15;80(6):1085-92.
[8] Urabe Y, Nouso K, Higashi T, et al. Telomere length in human liver diseases. Liver. 1996 Oct;16(5):293-7. doi: 10.1111/j.1600-0676.1996.tb00748.x.
[9] Schmidt TT, Tyer C, Rughani P, et al. High resolution long-read telomere sequencing reveals dynamic mechanisms in aging and cancer. Nat Commun. 2024 Jun 18;15(1):5149. doi: 10.1038/s41467-024-48917-7.
[10] Wang M, Lemos B. Ribosomal DNA copy number amplification and loss in human cancers is linked to tumor genetic context, nucleolus activity, and proliferation. PLoS Genet. 2017 Sep 7;13(9):e1006994. doi: 10.1371/journal.pgen.1006994.
[11] Yang F, Yi M, Liu Y, et al. Glutaredoxin-1 Silencing Induces Cell Senescence via p53/p21/p16 Signaling Axis. J Proteome Res. 2018 Mar 2;17(3):1091-1100. doi: 10.1021/acs.jproteome.7b00761.
[12] Shay JW, Pereira-Smith OM, Wright WE. A role for both RB and p53 in the regulation of human cellular senescence. Exp Cell Res. 1991 Sep;196(1):33-9. doi: 10.1016/0014-4827(91)90453-2.
[13] Navalkar A, Paul A, Sakunthala A, et al. Oncogenic gain of function due to p53 amyloids occurs through aberrant alteration of cell cycle and proliferation. J Cell Sci. 2022 Aug 1;135(15):jcs259500. doi: 10.1242/jcs.259500.
[14] Boettcher S, Miller PG, Sharma R, et al. A dominant-negative effect drives selection of TP53 missense mutations in myeloid malignancies. Science. 2019 Aug 9;365(6453):599-604. doi: 10.1126/science.aax3649.
[15] Abascal F, Harvey LMR, Mitchell E, et al. Somatic mutation landscapes at single-molecule resolution. Nature. 2021 May;593(7859):405-410. doi: 10.1038/s41586-021-03477-4.
[16] Cagan A, Baez-Ortega A, Brzozowska N, et al. Somatic mutation rates scale with lifespan across mammals. Nature. 2022 Apr;604(7906):517-524. doi: 10.1038/s41586-022-04618-z.
[17] Huang Z, Sun S, Lee M, et al. Single-cell analysis of somatic mutations in human bronchial epithelial cells in relation to aging and smoking. Nat Genet. 2022 Apr;54(4):492-498. doi: 10.1038/s41588-022-01035-w.
[18] Litchfield K, Reading JL, Puttick C, et al. Meta-analysis of tumor- and T cell-intrinsic mechanisms of sensitization to checkpoint inhibition. Cell. 2021 Feb 4;184(3):596-614.e14. doi: 10.1016/j.cell.2021.01.002.
[19] Tsai VW, Macia L, Johnen H, et al. TGF-b superfamily cytokine MIC-1/GDF15 is a physiological appetite and body weight regulator. PLoS One. 2013;8(2):e55174. doi: 10.1371/journal.pone.0055174.
[20] Molfino A, Amabile MI, Imbimbo G, et al. Association between Growth Differentiation Factor-15 (GDF-15) Serum Levels, Anorexia and Low Muscle Mass among Cancer Patients. Cancers (Basel). 2020 Dec 31;13(1):99. doi: 10.3390/cancers13010099.
[21] Zhu XA, Starosta S, Ferrer M, et al. A neuroimmune circuit mediates cancer cachexia-associated apathy. Science. 2025 Apr 11;388(6743):eadm8857. doi: 10.1126/science.adm8857.
[22] [Gimbel IA, Mulder FI, Bosch FTM, et al. Pulmonary embolism at autopsy in cancer patients. J Thromb Haemost. 2021 May;19(5):1228-1235. doi: 10.1111/jth.15250.
[23] Lucotti S, Ogitani Y, Kenific CM, et al. Extracellular vesicles from the lung pro-thrombotic niche drive cancer-associated thrombosis and metastasis via integrin beta 2. Cell. 2025 Mar 20;188(6):1642-1661.e24. doi: 10.1016/j.cell.2025.01.025.
[24] Wu MCL, Italiano E, Jarvis-Child R, et al. Ischaemic endothelial necroptosis induces haemolysis and COVID-19 angiopathy. Nature. 2025 Jun 4. doi: 10.1038/s41586-025-09076-x.
[25] Boyd AL, Reid JC, Salci KR, et al. Acute myeloid leukaemia disrupts endogenous myelo-erythropoiesis by compromising the adipocyte bone marrow niche. Nat Cell Biol. 2017 Nov;19(11):1336-1347. doi: 10.1038/ncb3625.
[26] Morrissy AS, Garzia L, Shih DJ, et al. Divergent clonal selection dominates medulloblastoma at recurrence. Nature. 2016 Jan 21;529(7586):351-7. doi: 10.1038/nature16478.
[27] de Bakker DEM, Valenzano DR. Turquoise killifish: A natural model of age-dependent brain degeneration. Ageing Res Rev. 2023 Sep;90:102019. doi: 10.1016/j.arr.2023.102019.
[28] Muñoz-Lorente MA, Cano-Martin AC, Blasco MA. Mice with hyper-long telomeres show less metabolic aging and longer lifespans. Nat Commun. 2019 Oct 17;10(1):4723. doi: 10.1038/s41467-019-12664-x.
[29] Wang S, Prizment A, Moshele P, et al. Aging measures and cancer in the Health and Retirement Study (HRS). Nat Commun. 2025 Jul 1;16(1):5916. doi: 10.1038/s41467-025-60913-z.
[30] Hou L, Joyce BT, Gao T, et al. Blood Telomere Length Attrition and Cancer Development in the Normative Aging Study Cohort. EBioMedicine. 2015 Apr 13;2(6):591-6. doi: 10.1016/j.ebiom.2015.04.008.
[31] Schratz KE, Flasch DA, Atik CC, et al. T cell immune deficiency rather than chromosome instability predisposes patients with short telomere syndromes to squamous cancers. Cancer Cell. 2023 Apr 10;41(4):807-817.e6. doi: 10.1016/j.ccell.2023.03.005.]
[32]Atzmon G, Cho M, Cawthon RM, et al. Evolution in health and medicine Sackler colloquium: Genetic variation in human telomerase is associated with telomere length in Ashkenazi centenarians. Proc Natl Acad Sci U S A. 2010 Jan 26;107 Suppl 1(Suppl 1):1710-7. doi: 10.1073/pnas.0906191106.
[33] Willeit P, Willeit J, Mayr A, et al. Telomere length and risk of incident cancer and cancer mortality. JAMA. 2010 Jul 7;304(1):69-75. doi: 10.1001/jama.2010.897.
[34] Stadler G, Rahimov F, King OD,et al. Telomere position effect regulates DUX4 in human facioscapulohumeral muscular dystrophy. Nat Struct Mol Biol. 2013 Jun;20(6):671-8. doi: 10.1038/nsmb.2571.
[35] Chew GL, Campbell AE, De Neef E, et al. DUX4 Suppresses MHC Class I to Promote Cancer Immune Evasion and Resistance to Checkpoint Blockade. Dev Cell. 2019 Sep 9;50(5):658-671.e7. doi: 10.1016/j.devcel.2019.06.011.
[36] Xu X, Li J, Zou J, et al. Association of Germline Variants in Natural Killer Cells With Tumor Immune Microenvironment Subtypes, Tumor-Infiltrating Lymphocytes, Immunotherapy Response, Clinical Outcomes, and Cancer Risk. JAMA Netw Open. 2019 Sep 4;2(9):e199292. doi: 10.1001/jamanetworkopen.2019.9292. Erratum in: JAMA Netw Open. 2020 Apr 1;3(4):e206708. doi: 10.1001/jamanetworkopen.2020.6708.
[37] Palmer S, Albergante L, Blackburn CC, et al. Thymic involution and rising disease incidence with age. Proc Natl Acad Sci U S A. 2018 Feb 20;115(8):1883-1888. doi: 10.1073/pnas.1714478115.
[38] Gounder SS, Abdullah BJJ, Radzuanb NEIBM, et al. Effect of Aging on NK Cell Population and Their Proliferation at Ex Vivo Culture Condition. Anal Cell Pathol (Amst). 2018 Aug 2;2018:7871814. doi: 10.1155/2018/7871814.
[39] Abril-Rodriguez G, Torrejon DY, Liu W, et al. PAK4 inhibition improves PD-1 blockade immunotherapy. Nat Cancer. 2020;1(1):46-58. doi: 10.1038/s43018-019-0003-0. Epub 2019 Dec 9. Erratum in: Nat Cancer. 2020 Feb;1(2):264. doi: 10.1038/s43018-020-0025-7.
[40] Allen BM, Hiam KJ, Burnett CE, et al. Systemic dysfunction and plasticity of the immune macroenvironment in cancer models. Nat Med. 2020 Jul;26(7):1125-1134. doi: 10.1038/s41591-020-0892-6. Epub 2020 May 25. Erratum in: Nat Med. 2024 May;30(5):1502. doi: 10.1038/s41591-024-02947-2.
[41] Pich O, Muiños F, Lolkema MP, et al. The mutational footprints of cancer therapies. Nat Genet. 2019 Dec;51(12):1732-1740. doi: 10.1038/s41588-019-0525-5.
[42] Kirkley SA. Proposed mechanisms of transfusion-induced immunomodulation. Clin Diagn Lab Immunol. 1999 Sep;6(5):652-7. doi: 10.1128/CDLI.6.5.652-657.1999.
[43] Blumberg N, Heal J, Chuang C, et al. Further evidence supporting a cause and effect relationship between blood transfusion and earlier cancer recurrence. Ann Surg. 1988 Apr;207(4):410-5. doi: 10.1097/00000658-198804000-00007.
[44] Han D, Xu Z, Zhuang Y, et al. Current Progress in CAR-T Cell Therapy for Hematological Malignancies. J Cancer. 2021 Jan 1;12(2):326-334. doi: 10.7150/jca.48976.
[45] Chohan KL, Siegler EL, Kenderian SS. CAR-T Cell Therapy: the Efficacy and Toxicity Balance. Curr Hematol Malig Rep. 2023 Apr;18(2):9-18. doi: 10.1007/s11899-023-00687-7.
[46] Ragazzini R, Boeing S, Zanieri L, et al. Defining the identity and the niches of epithelial stem cells with highly pleiotropic multilineage potency in the human thymus. Dev Cell. 2023 Nov 20;58(22):2428-2446.e9. doi: 10.1016/j.devcel.2023.08.017.
https://wap.sciencenet.cn/blog-3440171-1494259.html
上一篇:细胞衰老的端粒DNA和核糖体DNA共调控模型的简介
下一篇:神经退行性疾病的根本原因