博文
[转载]谷胱甘肽的合成和在植物非生物胁迫中的作用
||
一、简介1888 年,de Rey-Pailhade 发现酵母细胞中含有一种他命名为“philothion”的物质。 1921 年,霍普金斯从肌肉组织中提取了这种化合物,命名为谷胱甘肽,他报告说它是可自氧化的。两年后,一种制备结晶形式化合物的新方法的开发证实了谷胱甘肽确实是谷氨酸、半胱氨酸和甘氨酸的三肽。同年,霍普金斯因在维生素和相关营养因子方面的这项工作和其他工作而获得诺贝尔奖。 植物经常受到各种各样的生物和非生物胁迫,如高盐度、干旱、极端温度和重金属。为了对抗这些胁迫,植物已经具备了通过酶和非酶抗氧化系统对升高的ROS进行解毒的机制。大量研究证实,谷胱甘肽作为一种非酶氧化还原因子,在抗氧化防御系统中占据中心位置,因此在植物抵御非生物胁迫方面起着关键作用。谷胱甘肽的活性、稳定性和高水溶性使其成为保护植物免受非生物胁迫的理想生物分子。它在细胞中具有几种不同的功能,如异源素毒性的解除,重金属的固存和对ROS的防御。此外,它涉及植物生命的许多方面,GSH是不同酶的底物,这些酶也参与ROS的解毒作用,GSH也是有机硫的长距离运输的主要形式之一。
添加图片注释,不超过 140 字(可选)
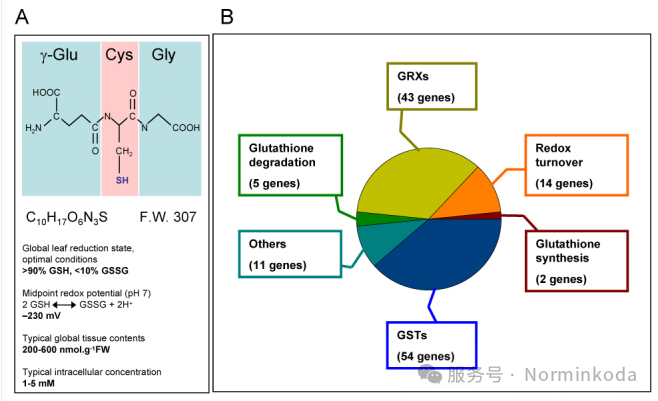
图1、A:胱甘肽身份证。B: 谷胱甘肽相关基因关键组的简单概述二、谷胱甘肽合成代谢过程谷胱甘肽是一种低分子量的硫醇,存在于几乎所有生物体中。谷胱甘肽有还原型(GSH)和氧化型(GSSG)两种形式,在生理条件下以还原型谷胱甘肽占绝大多数。谷胱甘肽还原酶可以催化两型间的互变,该酶的辅酶还可以为磷酸戊糖旁路代谢提供的NADPH。它由三个氨基酸组成:谷氨酸、半胱氨酸和甘氨酸。
添加图片注释,不超过 140 字(可选)
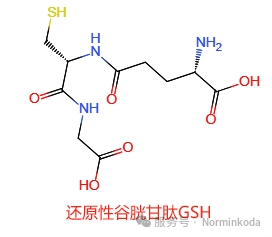
图2、还原性谷胱甘肽 谷胱甘肽的生物合成由两种ATP依赖酶分两步催化。在植物中,谷胱甘肽生物合成的第一步发生在质体中,第二步发生在细胞质中。相反,在哺乳动物、酵母和细菌中,这两个步骤都发生在细胞质中。在第一反应中,L-半胱氨酸和L-谷氨酸通过谷氨酸-半胱氨酸合成酶(GSH1,EC6.3.2.2)的作用结合,生成中间产物r-谷氨酰半胱氨酸(y-EC)。在第二个反应中,甘氨酸连接到y-EC的C端,该反应由谷胱甘肽合成酶(GSH2,EC 6.3.2.3)催化,形成三肽还原型谷胱甘肽(GSH)。

添加图片注释,不超过 140 字(可选)
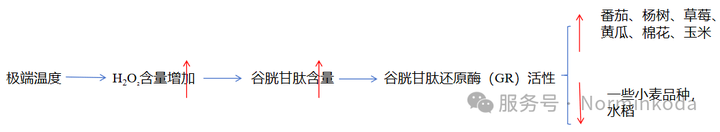
图3、谷胱甘肽的生物合成 GSH1(谷氨酸-半胱氨酸合成酶)是GSH生物合成的主要调节酶,仅位于质体中。这是谷胱甘肽生物合成的限速步骤;谷胱甘肽对GSH1的反馈抑制也是植物和动物体内谷胱甘肽稳态的一个重要调节点。第二步的 GSH2酶(谷胱甘肽合成酶)主要定位在细胞质中,但也定位在质体中。因此,谷胱甘肽生物合成发生在质体和细胞质中,它需要γ-EC(r-谷氨酰半胱氨酸)从质体输出到细胞质。GSH细胞质产生的意义在于可以通过用专门针对细胞质的野生型GSH2(谷胱甘肽合成酶)补充缺乏GSH2(谷胱甘肽合成酶)的突变体植物。补充作用恢复了GSH生物合成,因此挽救了表型。三、谷胱甘肽与植物抗低温性极端温度导致细胞内ROS的积累,是影响植物生长发育或分布受限的主要原因之一。低温胁迫时H2O₂含量增加,导致谷胱甘肽氧化,这种氧化还原变化是一种刺激防御机制的信号,如谷胱甘肽的生物合成和酶的激活。因此,在一些植物物种中,低温胁迫下较高谷胱甘肽含量可以诱导的谷胱甘肽还原酶(GR)活性增加,包括番茄、杨树、草莓、黄瓜、棉花、小麦和玉米。然而,这并不是一个普遍的规则,总是有例外的。GR活性在一些小麦品种中没有变化;在水稻中,低温处理后,它甚至下降。四、谷胱甘肽与植物抗高温性与其他环境胁迫一样,高温会导致活性氧的产生和氧化胁迫,其中,抗氧化系统的成分对保护细胞至关重要。非酶的GSH库和谷胱甘肽的氧化还原状态在胁迫反应和极端温度耐受性中起着关键作用。在抗高温小麦变种中测定到谷胱甘肽含量升高,结果表明,谷胱甘肽水平与高温胁迫耐受性呈正相关。在不同植物物种中,高温处理后也诱导谷胱甘肽生物合成,如小麦、玉米、水稻、番茄、芥末、苹果或欧洲山毛榉。通过刺激乙二醛酶和其他抗氧化系统,GSH的外源预处理似乎也是绿豆的有效耐高温诱导剂。如前所述,不仅谷胱甘肽的含量,其氧化还原状态也影响当前的胁迫反应。因此,在短期高温胁迫暴露的植物中通常观察到GR(谷胱甘肽还原酶)活性被诱导。然而,长期处理往往导致GR活性的衰退,甚至谷胱甘肽水平降低。 玉米、水稻、番茄、芥末、苹果或欧洲山毛榉等。通过刺激乙二醛酶和其他抗氧化系统,GSH的外源预处理似乎也是绿豆的有效耐高温诱导剂。如前所述,不仅谷胱甘肽的含量,其氧化还原状态也影响当前的胁迫反应。因此,在短期高温胁迫暴露的植物中通常观察到GR(谷胱甘肽还原酶)活性被诱导。然而,长期处理往往导致GR活性的衰退,甚至谷胱甘肽水平降低。
添加图片注释,不超过 140 字(可选)
图4、GSH响应温度胁迫五、谷胱甘肽与植物抗盐性盐胁迫是指土壤中可溶性盐浓度高(约40mmol/L),不利于植物生长的情况。它是最有害的非生物胁迫之一,严重损害农作物,导致全球农作物产量大幅下降。植物可以通过将K+/Na+比率维持在生理范围内来耐受盐胁迫。Na+在植物组织中的过度积累导致离子毒害,从而降低细胞内K+含量,因为Na+与 K+竞争细胞内运输。细胞K+含量的降低对不同的代谢途径均有不利影响。此外,有研究表明,在盐胁迫下,ROS激活保卫细胞外向整流K+(GORK)通道,从而降低细胞中K+的含量。源于GORK 通道激活的离子泄漏将导致程序性细胞死亡。 (1),耐盐甘蓝型油菜通过降低根系 K+渗透通道对活性氧的敏感性,具有更高的保留K+的能力。盐分胁迫导致渗透胁迫、离子胁迫和氧化胁迫,这些效应共同抑制了植物的生长、发育和存活率。在这些影响中,氧化胁迫被认为是最有害的。氧化胁迫在细胞内和细胞外水平诱导产生不同类型的活性氧。活性氧的毒性作用可通过多种不同的酶和非酶抗氧化剂抵消。谷胱甘肽是一种非酶抗氧化剂,在盐胁迫下有助于提高植物的生长性能。 (2)GSH网络参与了抵御盐胁迫的反应。GSH水平的提高与耐盐性的增强相关。在盐胁迫下,谷胱甘肽在植物中有助于维持细胞氧化还原平衡并发挥信号功能。作为一种抗氧化剂,谷胱甘肽有助于减少氧化胁迫,防止脂质过氧化并保护质膜,从而稳定质膜,减少被Na+损伤,从而提高植物的耐盐性。 (3)硫的添加通过增加GSH水平和提高盐胁迫耐受性来降低芥菜的盐依赖性氧化胁迫。 与缺乏谷胱甘肽和半胱氨酸合成基因的突变植株相比,盐胁迫下野生型油菜幼苗的谷胱甘肽和半胱氨酸合成增加了三倍。野生型也比突变型植物表现出更强的耐盐性,表明GSH对盐胁迫具有保护作用。 (4)在含盐培养基中生长的幼苗受谷胱甘肽或谷胱甘肽依赖和调节酶的活性调节。在盐胁迫下,过度表达GST(谷胱甘肽S-转移酶和GPX(谷胱甘肽过氧化物酶)生物合成基因的转基因烟草植株显示出对幼苗生长的刺激作用。这种效应可能是由于谷胱甘肽库的调节。外源施用摩)脯氨酸和甘氨酸甜菜碱可通过减少蛋白质羰基化、改善抗氧化防御和甲基乙二醛解毒系统,对NaCl诱导的氧化损伤提供保护功能。此外,谷胱甘肽的含量和GPX、GST和GlyI(乙二醛酶1)活性的增加与烟草的耐盐性有关。 (5)通过在紫花苜蓿(Medicago sativa)植株中过度表达GS-TU13基因,碱性胁迫下GSTU13转基因系表现出更好的生长和生理指标。(6)盐生植物(盐芥Eutrema salsugineum)中,300 mmol/LNaCl导致亲水性抗氧化剂(抗坏血酸、总谷胱甘肽)的含量显著增加。六、谷胱甘肽与植物抗旱性干旱诱导的气孔关闭受多种植物激素调节,如茉莉酸、油菜素类固醇、细胞分裂素和乙烯,但主要受脱落酸(ABA)调节。当植物经历干旱胁迫时,它们在木质部汁液中积累ABA,并移动到保卫细胞,使其信号网络被激活,这导致保卫细胞收缩,气孔关闭。此外,干旱诱导的气孔导度、膜电子传递速率、CO₂扩散、羧化效率和光合作用的损伤会导致质外体ROS 的产生,从而导致氧化损伤。最终,干旱导致生长和发育过程受到抑制和作物产量下降。 (1)活性氧主要是通过激活质膜NADPH氧化酶和质外体SOD产生的。然后,它导致H2O2在质外体和细胞中的作用。干旱胁迫下,玉米和甘蓝型油菜植株中GST水平增加。与野生型相比,GST17受损的拟南芥突变体(atgst17)显示出更高的GSH含量,因此,它增加了对干旱的耐受性。GSH水平的增加激活了ABA合成,进而增强ABA对干旱的保较高的谷胱甘肽含量提高了拟南芥的耐旱性,并且在拟南芥中显示了整体翻译水平的变化。 (2)此外,转录组学研究揭示了GSH处理期间脱落酸、生长素、茉莉酸生物合成和信号基因的激活。 (3)有研究发现了一氧化氮(NO),它参与ABA诱导的促进气孔关闭的信号通路。谷甘肽可能在此过程中发挥作用,因为S-亚硝基谷胱甘肽(GSNO)代表细胞中储存NO的化合物,其可以充当反式亚硝基化剂。GSNO是一种NO衍生分子,由NO与内积累。由NADPH氟化酶产生的质外体ROS对ABA诱导的气孔关闭至关。 (4)在硫酸盐诱导的气孔关闭过程中,由RBD和RBOHF(质定位NADPH氧化酶)产生的ROS有非常重要的作许多研究已经通过ABA诱导的气孔关闭证实了GSH在干旱胁迫中的作已经证明,谷胱甘肽参与了拟南芥cad2-1突变体(谷胱甘肽生物合成受粗)的气孔关闭.保卫细胞中GSH的减少导致气孔关闭,是因为它调节了ABA信号。七、总结干旱、盐碱、重金属胁迫、外源物质、极端温度和强光等非生物胁迫影响全球作物生产力。所有这些胁迫因素最终导致细胞内ROS的积累。谷胱甘肽具有多种不同的功能,它参与ROS 信号和解毒、重金属固存、异源解毒、MG信号和解毒、胁迫耐受相关基因表达的调节、细胞结构和生殖发育的保护。 (1)谷胱甘肽通过与许多抗氧化酶和植物激素的协同作用发挥这些功能,因此,未来的研究需要回答在植物细胞和亚细胞(细胞质、质体、线粒体和过氧化物酶体)水平上与谷胱甘肽运输相关的关键问题。 (2)还需要探索非生物胁迫下的亚细胞内谷胱甘肽的稳态。 一些研究也强调了谷胱甘肽在特定细胞间稳态的重要性。细胞内谷胱甘肽分布的变异性可调节特定区域间的氧化还原状态,这可能是参与防御反应的信号通路的一部分。 (3)关于整体胁迫反应的结果仍然非常多变,因此需要进一步探讨。还需要解决GSH与其他植物激素(如茉莉酸、水杨酸和乙烯)以及信号化合物(如NO、HzO和Ca+)的相互作用。 (4)由于大量外源施加谷胱甘肽会抑制植物生长,因此还需要研究其毒性。 (5),GSH的作用在几种翻译后修饰中还没有清楚地解释,如涉及胁迫下信号传导的亚硝基化、羟基化和谷胱甘肽化。 还需要更多的研究来转变应用方面的现有知识,以改良农作物去应对气候变化和非生物胁迫。
相关产品: 还原型谷胱甘肽(GSH)含量检测试剂盒(NM-W-0407) 总谷胱甘肽(T-GSH)/氧化型谷胱甘肽 (GSSG)检测试剂盒(NMK0425) 谷胱甘肽过氧化物酶(GPX)活性检测试剂盒(NM-W-0405) 抗坏血酸过氧化物酶(APX)活性检测试剂盒(NM-W-0404) 抗坏血酸氧化酶(AAO)活性检测试剂盒(NM-W-0406) 谷胱甘肽S-转移酶(GST)活性检测试剂盒(NM-W-0409) 谷胱甘肽还原酶(GR)活性检测试剂盒(NM-W-0410) 一氧化氮(NO)含量检测试剂盒(NM-W-0132) ATP含量检测试剂盒(NMK0979) 参考文献 [1]侯少范,薛泰麟,谭见安.高等植物中的谷胱甘肽过氧化物酶及其功能[J].科学通报, 1994.DOI:CNKI:SUN:KXTB.0.1994-06-021.[2]Noctor G, Queval G, Mhamdi A, et al. Glutathione[J]. The Arabidopsis Book/American Society of Plant Biologists, 2011, 9: e0142.[3]植物适应非生物胁迫的代谢组学研究。[4]Jefferies H, Coster J, Khalil A, et al. Glutathione[J]. ANZ journal of surgery, 2003, 73(7): 517-522. 通路图 · 目录
https://wap.sciencenet.cn/blog-3289971-1490537.html
上一篇:[转载]Plants||MC调控大豆蛋白响应干旱胁迫的机制
下一篇:[转载]植物反肉桂酸4-单加氧酶(C4H)酶联免疫分析
全部作者的其他最新博文
- • [转载]International Journal of Food Properties||理化+代谢分析陈皮不同年份的成分变化
- • [转载]Journal of Genetics and Genomics(1区7.1分)||ZmPRX38提高玉米茎秆强度和产量
- • [转载]Agronomy||外源施用纳米硅和褪黑素改善薏苡幼苗盐害
- • [转载]BMC_Plant_Biology||理化+转录组学+代谢组学揭示藜麦花穗磷胁迫反应的关键基因和核心代谢途径
- • [转载]Plants||OsLEA1b调控水稻高温淀粉生物合成
- • [转载]Plant Biotechnol. J.||WAK106-E2Fa-DPb1-UGT74E2模块等位基因变异调节杨树纤维