资料来源:梅斯医学,2025年09月08日 20:03 上海
脓毒症是一种由感染引起的全身炎症反应失调综合征,其特征为过度的炎症反应、凝血功能紊乱以及多器官功能障碍。全球每年约有3150万例脓毒症患者,重症脓毒症的病死率高达30%~50%,而脓毒性休克患者死亡率甚至可达60%~80%。尽管长期以来认为过度炎症是脓毒症的核心机制,但单纯的抗炎治疗并未显著提高患者生存率,提示其病理机制远比想象复杂。近年来,中性粒细胞胞外诱捕网(NETs)作为炎症与凝血交互作用的关键介质,成为研究焦点。NETs由中性粒细胞释放,由DNA、颗粒蛋白及抗菌酶组成,可捕获病原体,但过度形成会加剧组织损伤与血栓形成。B细胞淋巴瘤蛋白10(BCL-10)作为CBM(CARD9/BCL-10/MALT1)信号复合体的核心成分,调控NF-κB通路,进而促进炎症及NETs形成。
大黄素(Emodin)是传统中药大黄的主要活性成分,具有抗炎、抗氧化及器官保护作用,但其在脓毒症中的作用机制尚不明确。
近日,首都医科大学附属北京中医医院刘清泉团队在《Advanced Science》杂志发表题为《Emodin Alleviates Sepsis-Induced Multiorgan Damage by Inhibiting NETosis through Targeting Neutrophils BCL-10》的基础研究文章,本研究系统阐述了大黄素通过靶向作用于BCL-10,调控BCL-10/MALT1复合物,抑制NF-κB活化,显著缓解脓毒症诱导的细胞因子风暴和凝血异常,并在抑制NETs形成方面展现出显著功效。大黄素在脓毒症中赋予显著的多器官保护效应,本研究的开展为大黄素及其靶点BCL-10在脓毒症中的转化研究提供了新的线索。

图1 论文首图
1. 大黄素改善脓毒症小鼠的死亡率及多器官病理损伤:为评估大黄素的保护作用,研究者建立了CLP脓毒症模型,将小鼠分为假手术组、模型组、大黄素干预组(20 mg/kg腹腔注射)及地塞米松(DXMS)对照组。结果显示,模型组7天生存率显著低于假手术组,而大黄素组生存率显著提高(P = 0.035)。病理学分析表明,模型组肺组织出现肺泡结构破坏、微血栓形成及炎性浸润;肝组织表现为肝细胞脂肪变性、红细胞外渗及微血栓;脾组织红白髓界限模糊,白髓增生;肾组织可见肾小管上皮水肿及间质炎症。DXMS仅部分减轻炎症,而大黄素显著改善上述病变,提示其器官保护效果优于传统抗炎药物。

图2 大黄素改善脓毒症小鼠的死亡率及多器官病理损伤
2. 大黄素缓解脓毒症诱导的全身炎症失调与病理性凝血激活:通过多重因子芯片检测发现,模型组小鼠24小时内血浆促炎因子(如TNF-α、IL-1β、IL-6、IFN-γ)显著升高,48小时后凝血因子(如组织因子TF、糖蛋白VI、Sonic Hedgehog)达到峰值。大黄素干预显著抑制24小时炎症因子表达,并降低48小时凝血因子水平。Western blot进一步证实,模型组肝组织TF、GPVI及Shh蛋白表达上调,大黄素可逆转这种变化。这表明脓毒症存在“炎症-凝血”级联反应,而大黄素通过双重调控恢复内环境稳态。
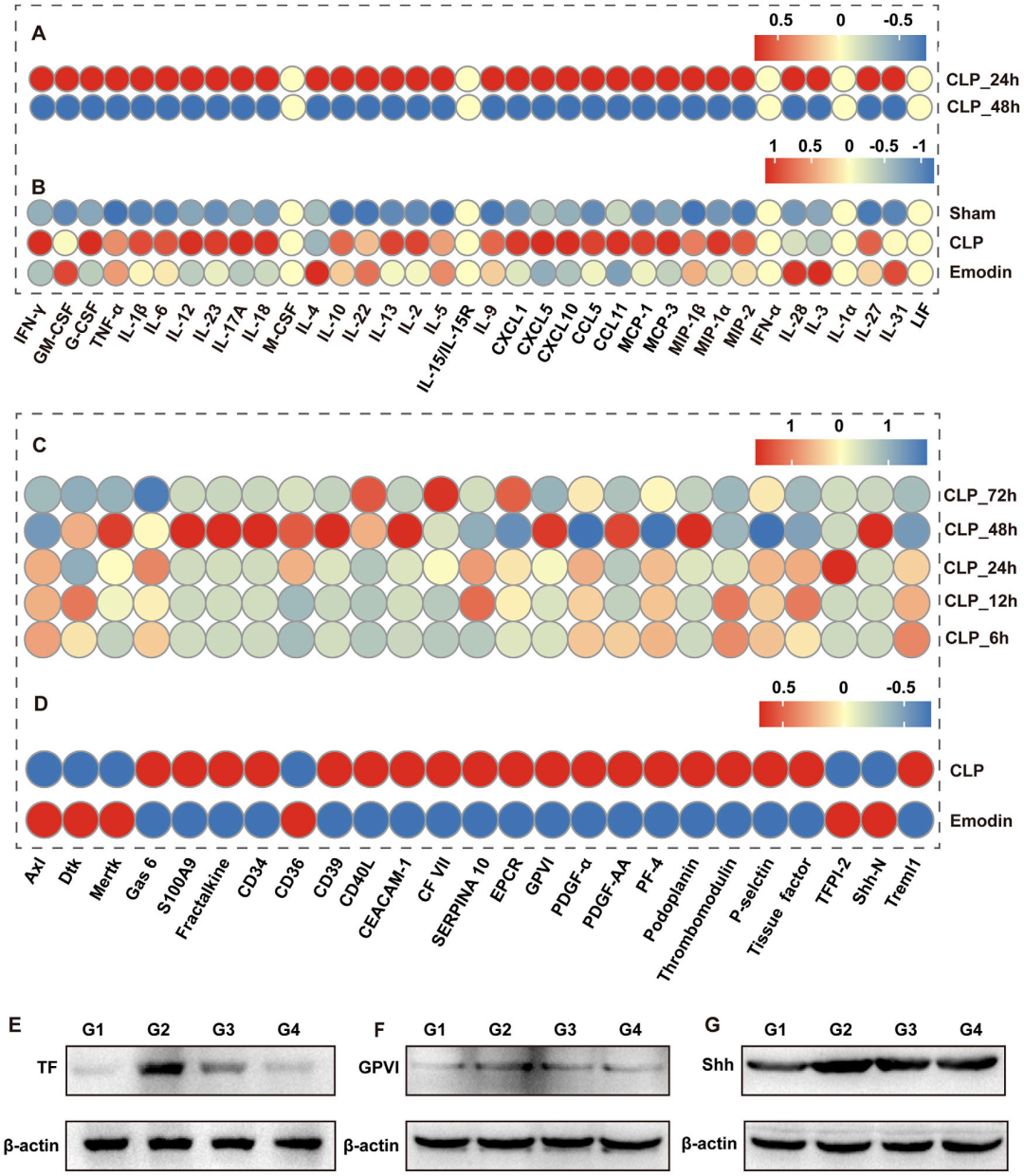
图3 大黄素缓解脓毒症诱导的全身炎症失调与病理性凝血激活
3. 大黄素抑制脓毒症小鼠中NETs的形成:NETs的过度形成是脓毒症器官损伤的重要推手。研究发现,模型组血浆游离DNA(cfDNA)水平在24小时显著升高,大黄素组则明显降低。肝组织Western blot显示,中性粒细胞弹性蛋白酶(NE)、髓过氧化物酶(MPO)及瓜氨酸化组蛋白H3(CitH3)表达在模型组持续升高,而大黄素显著抑制其表达。免疫荧光进一步证实,大黄素减少肝组织中MPO与CitH3共定位的NETs结构,表明其可通过阻断NETs形成减轻组织损伤。
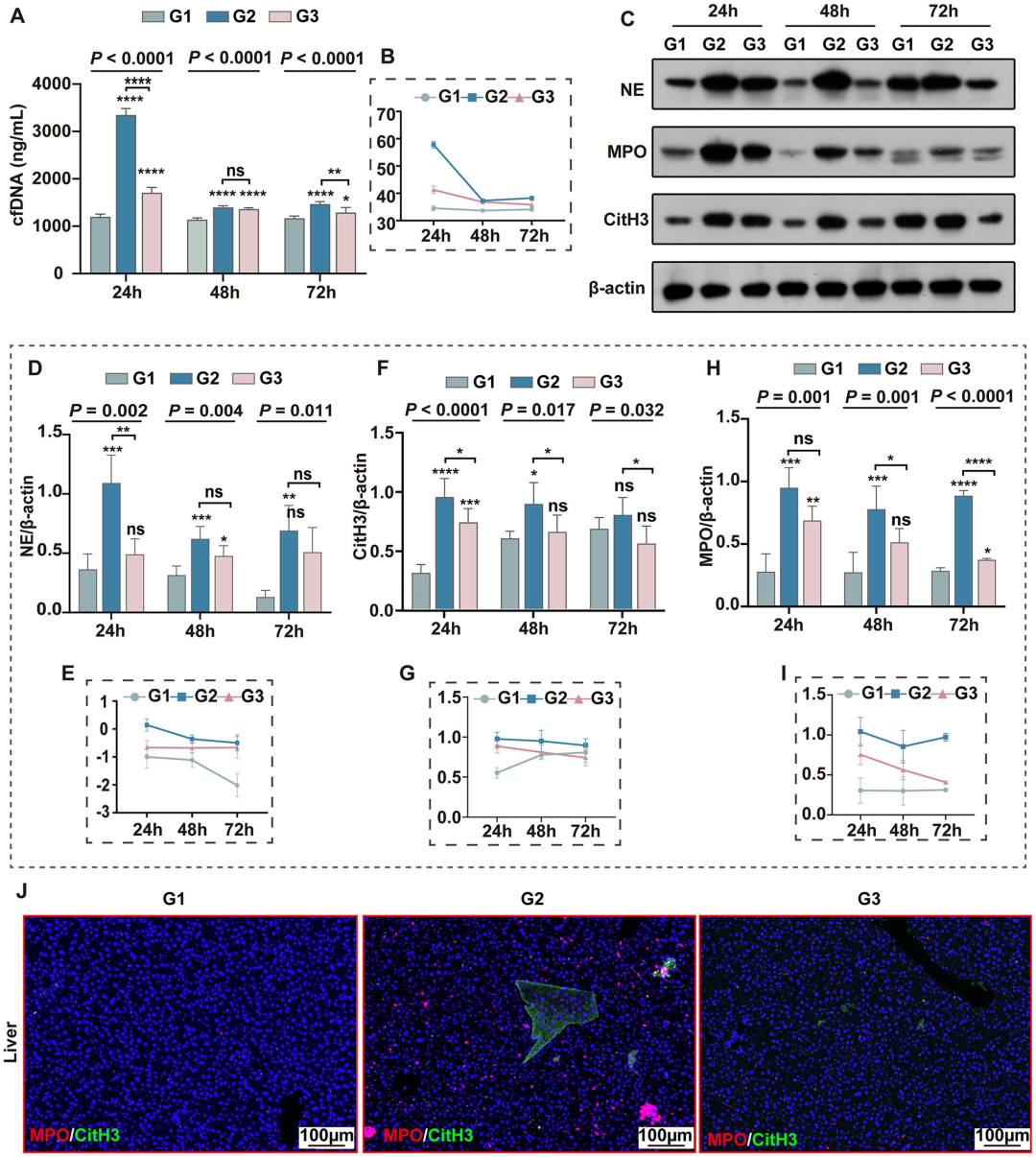
图4 大黄素抑制脓毒症小鼠中NETs的形成
4. 大黄素抑制中性粒细胞NETs的形成:体外实验中,研究者采用PMA诱导HL-60细胞分化的中性粒细胞样细胞(dHL-60)形成NETs。CCK-8实验显示,大黄素(10μM)对细胞无毒性,但显著抑制PMA诱导的活性氧(ROS)生成及NETs结构形成。cfDNA、NE及MPO水平在PMA组显著升高,大黄素干预后明显下降。Sytox Green染色显示,PMA诱导细胞核呈网状结构,大黄素则维持细胞圆形形态。这些结果从细胞水平证实了大黄素直接抑制NETs生成的作用。
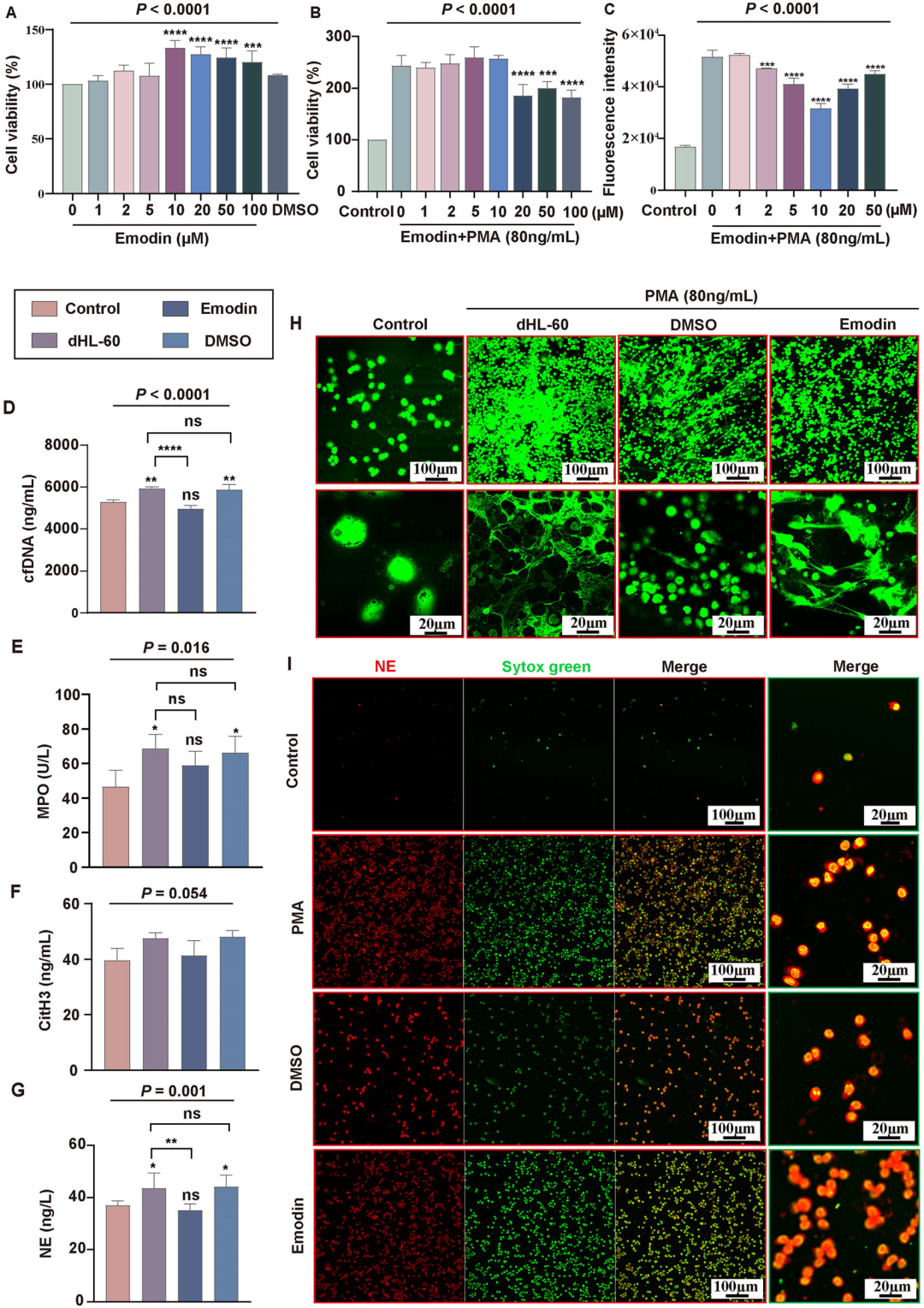
图5 大黄素抑制中性粒细胞NETs的形成
5. BCL-10在大黄素介导的NETs形成抑制中起关键作用:通过HuProt人类蛋白芯片筛选发现,BCL-10是大黄素的潜在结合靶点(信号噪声比25.168)。表面等离子共振(SPR)显示,大黄素与重组BCL-10蛋白的亲和力KD值为1.94×10⁻⁶ M。下拉实验及分子对接证实,大黄素通过疏水作用及氢键与BCL-10的CARD结构域结合。竞争性抑制实验表明,游离大黄素可阻断BCL-10与固定化大黄素的结合,热位移实验进一步证明大黄素增强BCL-10的热稳定性。这些发现首次揭示BCL-10是大黄素发挥作用的直接分子靶点。
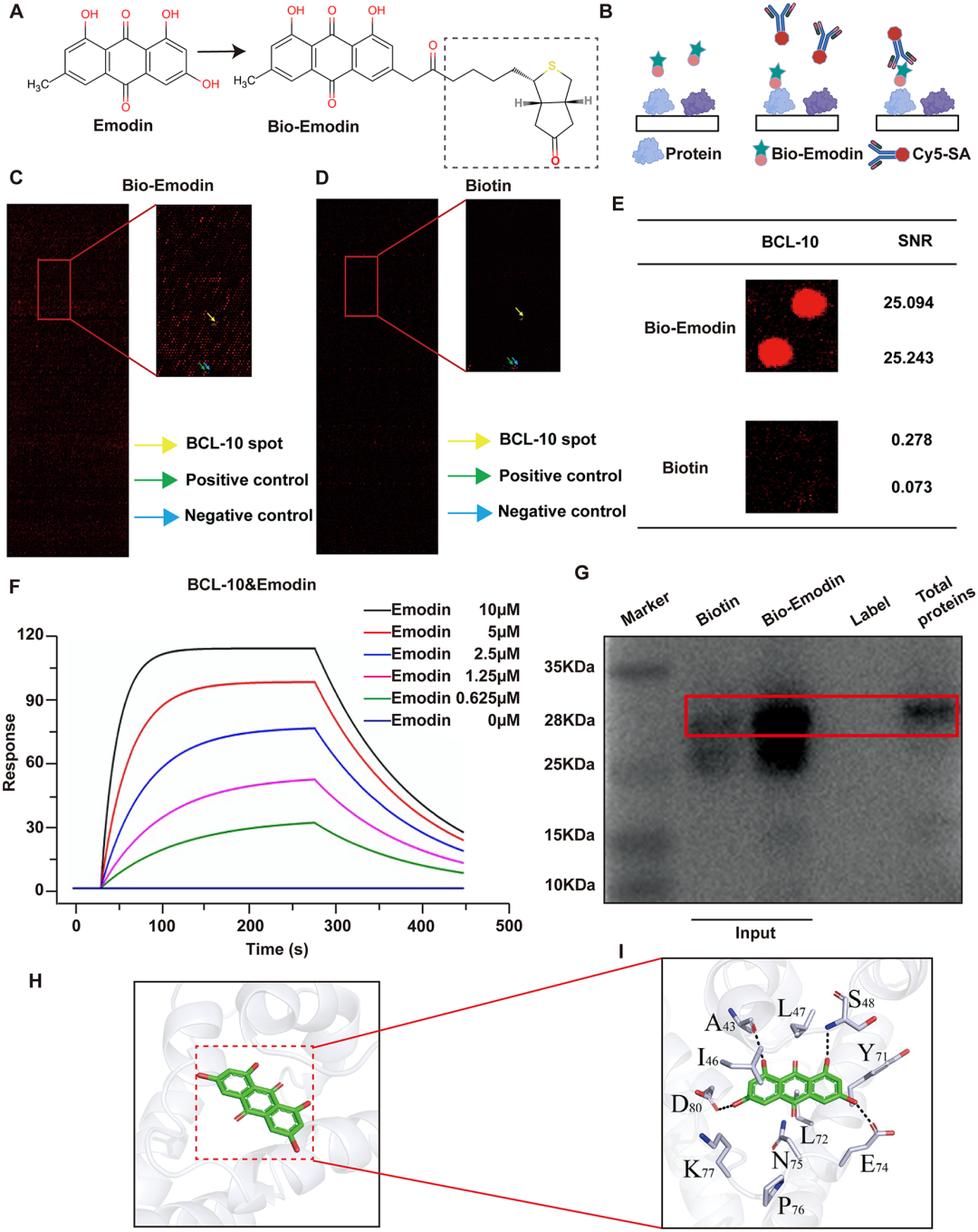
图6 BCL-10在大黄素介导的NETs形成抑制中起关键作用
6. 大黄素通过靶向中性粒细胞BCL-10抑制脓毒症中NETs的形成:单细胞测序分析显示,模型组外周血中性粒细胞比例显著增加,且BCL-10表达与NETs标志基因(CAMP、HMGB1、PAD4)呈正相关。大黄素干预后,中性粒细胞浸润减少,BCL-10及NETs相关基因表达下调。KEGG分析表明,大黄素抑制中性粒细胞的NF-κB信号、白细胞跨内皮迁移及NETs形成通路。这提示大黄素通过下调BCL-10表达,阻断NETs过度生成,从而缓解脓毒症病理进程。
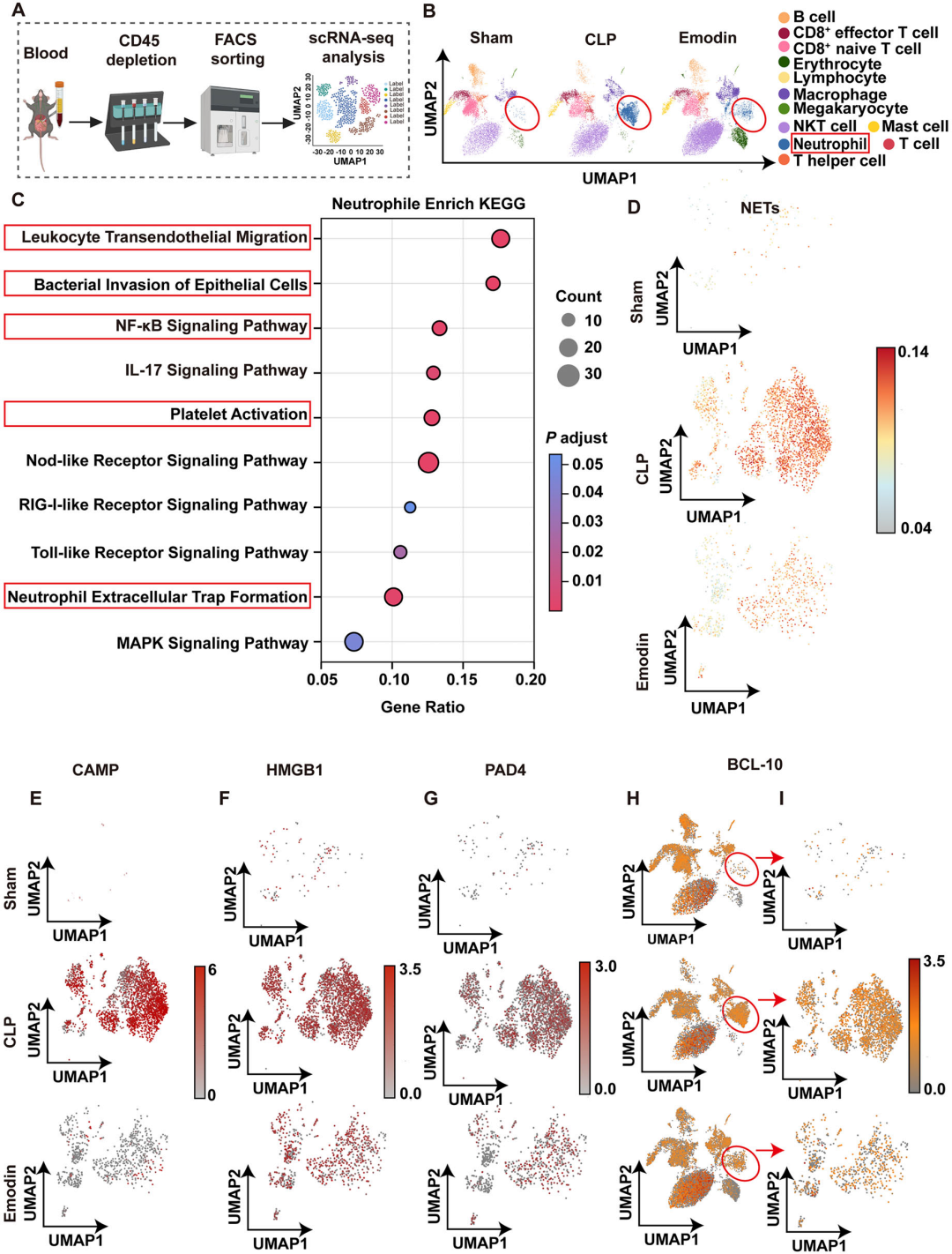
图7 大黄素通过靶向中性粒细胞BCL-10抑制脓毒症中NETs的形成
7. BCL-10缺失改善小鼠的脓毒症表型及NETs形成:为验证BCL-10的功能,研究者构建了中性粒细胞特异性BCL-10敲除小鼠(BCL-10⁻/⁻)。CLP建模后,BCL-10⁻/⁻小鼠7天生存率显著高于BCL-10f/f小鼠(P=0.015)。病理学显示,敲除组肝、肺、肾等器官炎性浸润减轻,脾红白髓界限清晰,脂肪变性及微血栓减少。血浆炎症因子(TNF-α、IL-1β、CXCL1/5)水平显著降低,肝肺组织CitH3阳性NETs结构减少。这直接证明BCL-10缺失可通过抑制NETs形成改善脓毒症预后。

图8 BCL-10缺失改善小鼠的脓毒症表型及NETs形成
8. 单细胞RNA测序揭示BCL-10缺失减少中性粒细胞浸润及NETs形成:对BCL-10⁻/⁻与BCL-10f/f小鼠的脓毒症外周血进行单细胞测序,发现敲除组中性粒细胞比例显著降低。KEGG分析显示,BCL-10缺失抑制NF-κB、RIG-I样受体及NETs形成通路,CAMP、HMGB1、PAD4等NETs相关基因表达下调。这表明BCL-10不仅调控NETs生成,还通过影响中性粒细胞募集参与脓毒症免疫失衡,其缺失可重塑免疫细胞谱系,减轻病理损伤。
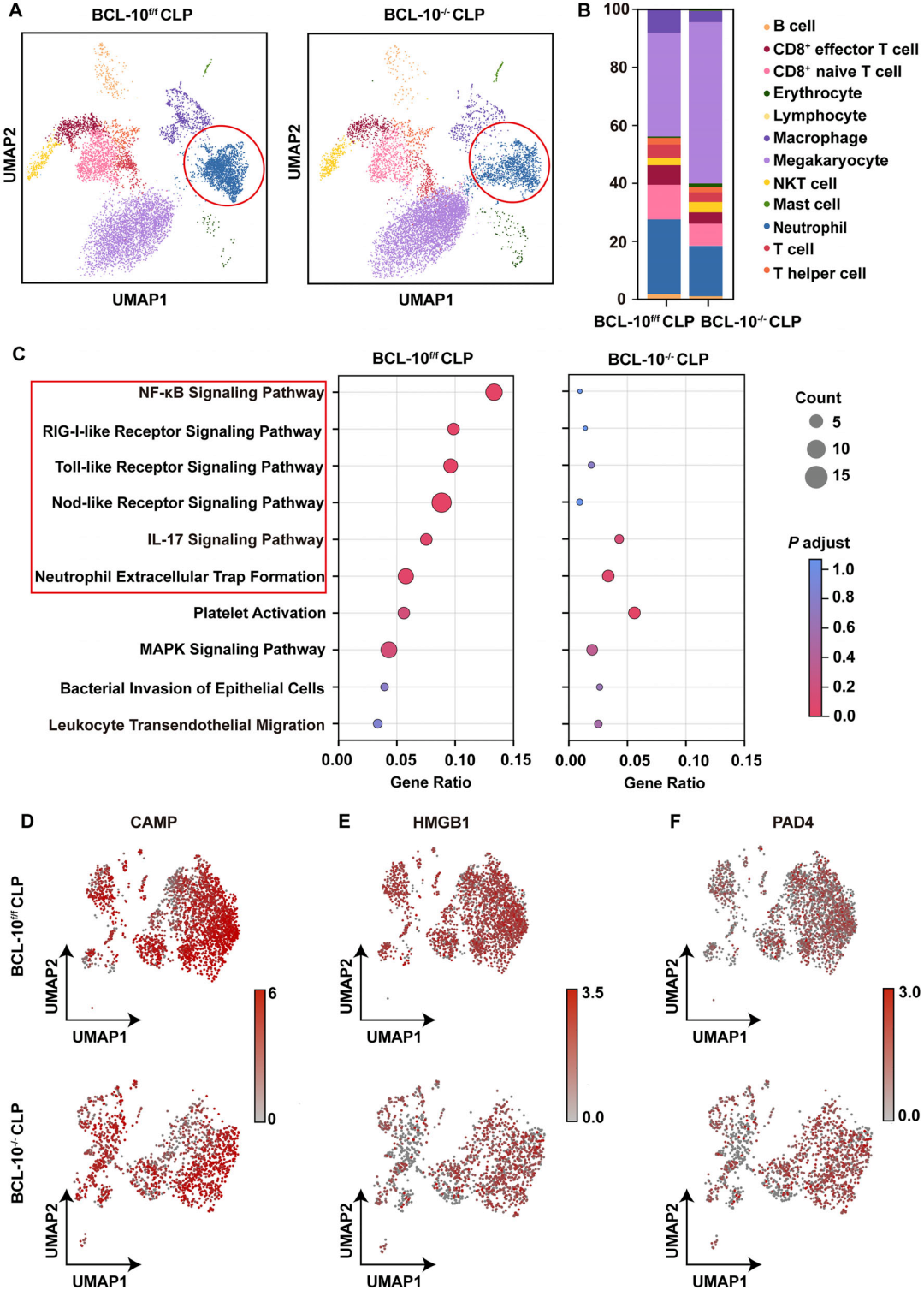
图9 单细胞RNA测序揭示BCL-10缺失减少中性粒细胞浸润及NETs形成
9. 大黄素通过调控BCL-10-MALT1功能抑制NF-κB激活从而减少NETs形成:大黄素干预组显著降低脓毒症小鼠肝组织BCL-10、MALT1蛋白表达及NF-κB p65磷酸化水平。免疫荧光显示,BCL-10与MALT1共定位于肝细胞,大黄素破坏其复合体形成。BCL-10敲除小鼠中,NF-κB p65磷酸化及NETs标志蛋白(MPO、NE)表达显著降低,且大黄素未进一步下调这些指标,提示其作用依赖BCL-10。综上,大黄素通过结合BCL-10,阻断其与MALT1的相互作用,抑制NF-κB通路激活,最终减少NETs形成,恢复炎症-凝血平衡,发挥多器官保护作用。
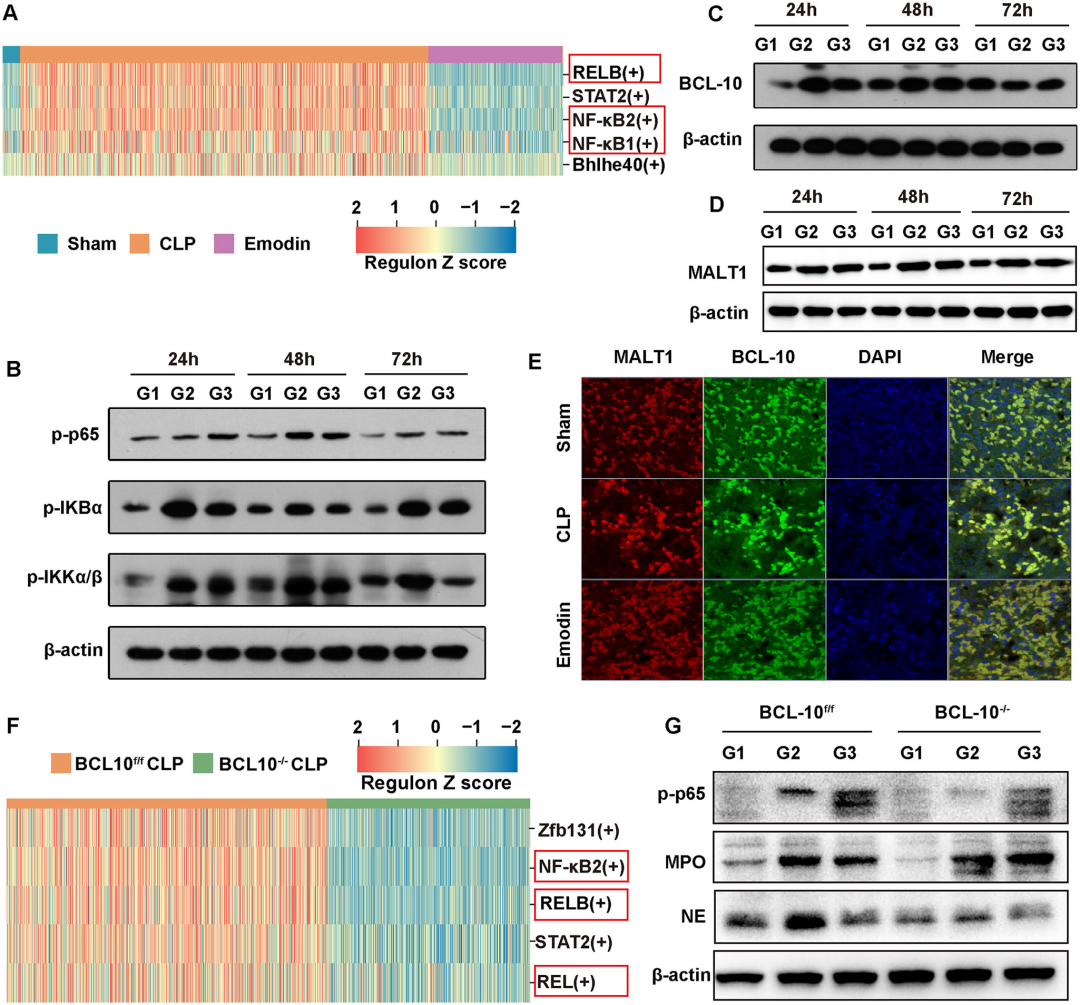
图10 大黄素通过调控BCL-10-MALT1功能抑制NF-κB激活从而减少NETs形成
小 结
本研究首次阐明大黄素通过“靶向BCL-10-MALT1-NF-κB-NETs”轴干预脓毒症的分子机制,为中药现代化及脓毒症治疗提供了创新性策略。未来需进一步优化大黄素的药代动力学特性,探索其在临床中的应用潜力。
参考文献
Xu X,Yan Y,Zheng M,Zhang M,Chen T,Qu Z,Bai Y,Zhang S,Zhao C,Shi Y,Lin Y,Wang N,Bai Y,Zhai Y,Bai Z,Guo W,Liu Q. Emodin Alleviates Sepsis-Induced Multiorgan Damage by Inhibiting NETosis through Targeting Neutrophils BCL-10. Adv Sci(Weinh). 2025 Aug 8:e17129. doi:10.1002/advs.202417129. Epub ahead of print. PMID:40779122.
转载本文请联系原作者获取授权,同时请注明本文来自聂广科学网博客。
链接地址:https://wap.sciencenet.cn/blog-279293-1501522.html?mobile=1
收藏

