AHM:生物活性支架治疗萎缩性骨不连
研究背景:骨折后出现的萎缩性不愈合是一种棘手的并发症,其特征是骨折部位血管供应不足、成骨能力低下,无法形成骨痂。全球骨不愈合的发病率为1.9%-4.9%,给患者带来慢性疼痛、残疾和肢体功能障碍,治疗费用高昂且效果不佳。传统的治疗方法包括自体骨移植和异体骨移植,但都存在局限性,如自体骨来源稀缺,异体骨存在疾病传播风险。因此,开发新型生物相容性骨植入材料成为当务之急。
为解决这些难题,来自新乡医学院任文杰教授团队及合作者开发了出一种快速清除萎缩性骨不连病理微环境和加速骨再生的生物活性支架。该支架由载有环状骨形态发生蛋白2(circBMP2)的MnO2-Cu2+(MC)纳米颗粒和多巴胺修饰的脱矿骨基质组成。该生物活性支架亮点包括:1. MC纳米颗粒不仅能通过促进血管生成和高效清除活性氧来阻断萎缩性不愈合的病理过程,还能作为有效的基因传递载体,增强细胞内非病毒基因的表达,从而增强对缺陷部位驻留细胞的基因修饰能力。2. circBMP2作为重组BMP2的替代品,通过在细胞内提供持续稳定的BMP2表达,促进内源细胞的成骨分化,有助于快速启动骨再生。3. 多巴胺修饰增强了脱钙骨基质支架对MC-circBMP2(MCB)纳米颗粒运载能力。
兔子桡骨萎缩性不愈合模型证实该生物活性支架持续释放的MCB纳米颗粒通过改善血管生成、清除活性氧(ROS)和加速内源细胞的成骨分化,阻断了局部病理性微环境及快速启动新骨形成,显著促进了骨缺损的愈合。本研究证实,结合血管生成、活性氧清除与成骨分化于一体的多靶向策略,能够有效治愈萎缩性不愈合的大段骨缺损。相关工作以“The Treatment of Large Bone Defects with Atrophic Nonunion by Bioactive Scaffolds Remodeling the Regeneration Microenvironment”为题发表《Advanced Healthcare Materials》期刊上。梁卓博士为论文第一作者,新乡医学院任文杰教授、浙江大学贺永教授和上海交通大学医学院附属第九人民医院周广东教授为论文的通讯作者。
研究内容:
1.载有MCB纳米颗粒生物活性支架制备及治疗萎缩性骨不连的作用机制示意图: 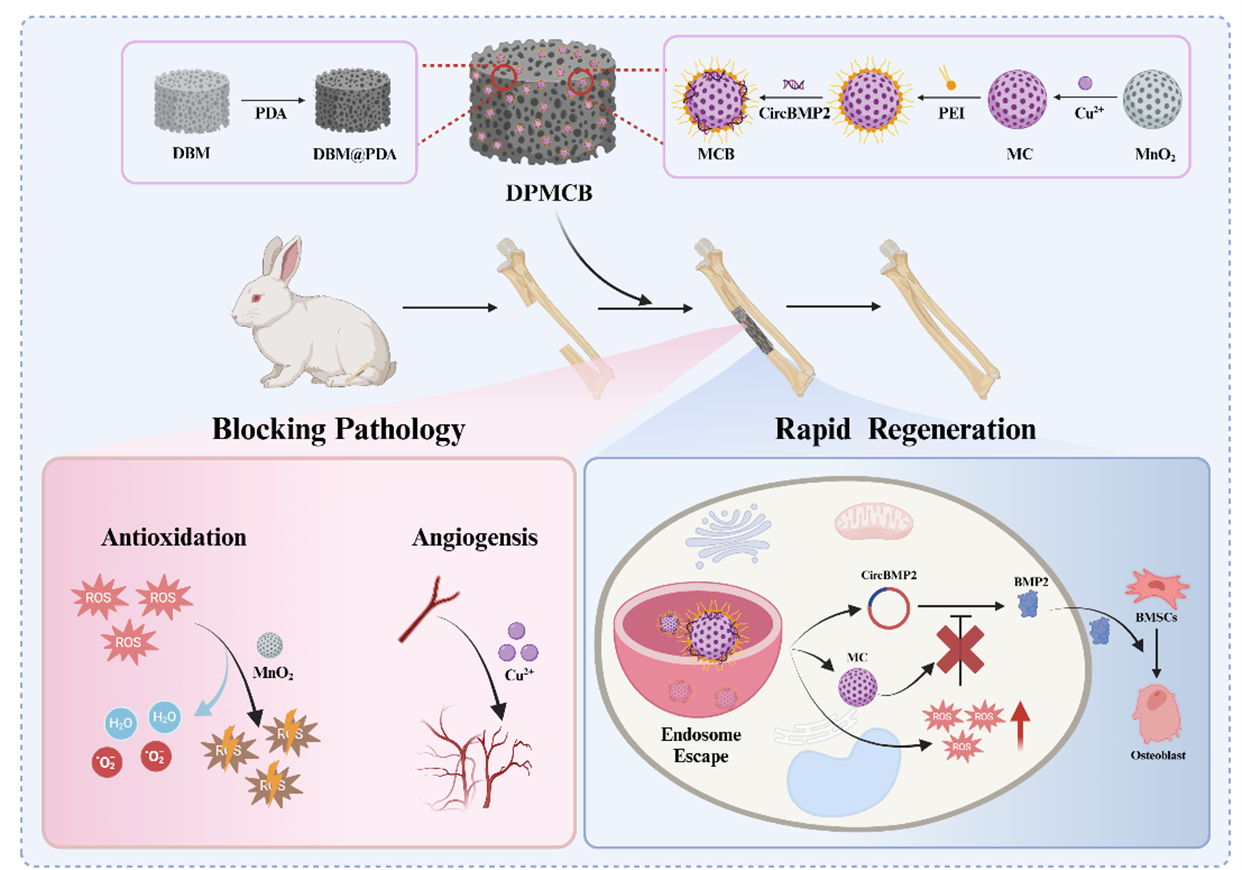
图1 载有MCB纳米颗粒生物活性支架治疗萎缩性骨不连的作用机制示意图
2. MC纳米颗粒表征及功能分析:以SiO2纳米颗粒作为牺牲模版合成MnO2纳米颗粒,并将其浸泡于CuCl2溶液中获得MC纳米颗粒。细胞实验证实MC纳米颗粒通过有效清除胞外和胞内过度积累ROS,保护骨髓间充质干细胞(BMSC)免受氧化损伤并促进巨噬细胞向M2型极化发挥作用。

图2 MC纳米颗粒制备及功能评估
2.MC基因传递系统的制备与表征:由于MC纳米颗粒的表面带负电荷,将带负电的核酸嫁接到MC表面需要阳离子聚合物如聚乙烯亚胺(PEI)作为桥梁。粒径分析显示,随着PEI和核酸的组装,纳米颗粒的尺寸逐渐增大,且纳米颗粒的表面电位在PEI组装后出现电位反转。这些结果表明,在PEI的桥接作用下,核酸已成功负载于MC表面。通过细胞活力、基因转染效率和成骨分化能力实验评估MC基因传递系统生物功能,结果显示PEI/MC质量比为5:2时具有最佳转染效率。
3.MCB基因传递系统的制备与功能分析:ELISA检测评估circBMP2体内基因表达能力,结果显示circBMP2能够持续稳定表达BMP2。为了进一步评估MCB NPs在骨修复中的效率,通过碱性磷酸酶(ALP)和茜素红染色评估了转染MCB后BMSCs的成骨分化。未转染的细胞用作对照组。MCB组的ALP生成量高于对照组和PEI-circBMP2(PB)组。BMSCs的钙沉积呈现相似趋势。根据这些结果,可以确定MCB显著提升了BMSCs的成骨分化能力。

图3 MCB纳米颗粒的表征、细胞毒性及转染效率评估
4.生物活性支架的构建与生物相容性:在早期研究中,通过静电吸附将基因载体附着在脱矿骨基质(DBM)支架表面,但这种方法导致药物负载效率降低。研究中使用PDA对DBM表面进行了修饰。扫描电子显微镜结果显示,PDA修饰后DBM支架表面变得粗糙,但其孔隙率并无显著差异。此外,与DBM相比,PDA修饰的DBM(DP)支架能够携带更多的MCB纳米颗粒,这表明PDA修饰增强了DBM的药物负载效率。为了评估支架的细胞相容性和抗氧化应激能力,研究收集了经H₂O₂处理的支架的洗脱液进行细胞相容性评估。细胞活性实验表明,复合支架洗脱液保持了良好的细胞相容性。值得注意的是,在模拟氧化应激条件下,只有DPMCB支架洗脱液表现出完全的细胞保护作用。这些发现证实了DPMCB支架具有清除ROS的能力,并能有效阻断氧化损伤信号通路。为了全面评估生物活性支架的促血管生成和成骨特性,本研究系统地研究了支架提取物对人脐静脉内皮细胞(HUVECs)迁移和管状结构形成的影响,通过划痕实验和体外管状结构形成实验进行评估,同时通过ALP活性分析评估BMSCs的成骨分化潜力。划痕闭合分析显示,DPMCB支架在氧化应激条件下显著增强了HUVECs的迁移。体外管状结构形成实验表明,所有实验组均表现出一致的促血管生成表型。此外,DPMCB支架在氧化应激诱导的微环境中显著上调了BMSCs中的ALP酶活性,显示出强大的成骨诱导能力。这些发现共同表明,DPMCB支架在病理高氧化应激条件下协同维持了促血管生成和成骨功能。

图4 基因激活支架的功能评估
5.骨再生:生物活性支架对难治性骨缺损修复的治疗效果通过兔桡骨不连接模型进行了研究。结果显示随着移植时间的延长,纤维囊逐渐减少,新骨形成量增加。其中,DPMCB组在12周时新骨分布显著增强,新生骨与宿主骨之间没有明显间隙。这些结果表明,DPMCB支架将支持萎缩性骨不连更好的愈合。

图5 植入后4周、8周和12周兔桡骨萎缩性不连模型的X线检查及骨组织学修复观察
总结与展望
本研究成功开发了一种更稳定且翻译效率更高的BMP2基因表达载体。基于circBMP2载体制造的MCB被涂覆在PDA修饰的DBM支架上,构建出具有基因活性的DPMCB支架。DPMCB具有良好的生物相容性,既能清除细胞内外异常堆积的ROS,又能促进血管生成和成骨分化。此外,通过整合ROS清除、炎症调节、血管生成与成骨分化的功能,该支架重塑了萎缩性骨不连的病理骨缺损微环境,并实现了骨不连终末愈合的功能。本研究为设计针对萎缩性骨不连的病理微环境重塑材料提供了新思路。
全文链接:
https://doi/10.1002/adhm.202500120
转载本文请联系原作者获取授权,同时请注明本文来自贺永科学网博客。
链接地址:https://wap.sciencenet.cn/blog-2159320-1484693.html?mobile=1
收藏

