精选
精选
免疫细胞的突破:科学家发现了对抗癌症的隐藏盟友
诸平
据奥地利维也纳生物中心分子病理学研究所(Research Institute of Molecular Pathology简称IMP)2024年12月1日提供的消息,免疫细胞的突破:科学家发现了对抗癌症的隐藏盟友(Immune Cell Breakthrough: Scientists Discover a Hidden Ally in the Fight Against Cancer)。
免疫疗法或免疫治疗(immunotherapy)研究的最新进展揭示了新的免疫细胞在对抗癌症中的关键作用,从而导致提高治疗效果和克服耐药性的潜在策略。免疫疗法改变了癌症治疗方式,通过利用免疫系统对抗疾病,为曾经被认为无法治愈的癌症带来了新的希望。然而,许多癌症可以逃避免疫攻击,导致对这些治疗的抵抗。由IMP的安娜·奥贝罗(Anna Obenauf)领导的研究人员已经确定了炎症单核细胞(一种免疫细胞类型)在重新激活T细胞以攻击肿瘤内的癌细胞方面的关键作用。相关研究结果于2024年11月27日已经在《自然》(Nature)杂志网站——Anais Elewaut, Guillem Estivill, Felix Bayerl, Leticia Castillon, Maria Novatchkova, Elisabeth Pottendorfer, Lisa Hoffmann-Haas, Martin Schönlein, Trung Viet Nguyen, Martin Lauss, Francesco Andreatta, Milica Vulin, Izabela Krecioch, Jonas Bayerl, Anna-Marie Pedde, Naomi Fabre, Felix Holstein, Shona M. Cronin, Sarah Rieser, Denarda Dangaj Laniti, David Barras, George Coukos, Camelia Quek, Xinyu Bai, Miquel Muñoz i Ordoño, Thomas Wiesner, Johannes Zuber, Göran Jönsson, Jan P. Böttcher, Sakari Vanharanta, Anna C. Obenauf. Cancer cells impair monocyte-mediated T cell stimulation to evade immunity. Nature, Published: 27 November 2024. DOI: 10.1038/s41586-024-08257-4. https://www.nature.com/articles/s41586-024-08257-4
参与此项研究的有来自奥地利维也纳维也纳生物中心分子病理学研究所{Research Institute of Molecular Pathology (IMP), Vienna BioCenter (VBC), Vienna, Austria}、奥地利维也纳大学博士学院和维也纳医科大学的维也纳生物中心(Vienna BioCenter, Doctoral School of the University of Vienna and Medical University of Vienna, Vienna, Austria)、德国慕尼黑工业大学(TUM)医学与卫生学院分子免疫学研究所{Institute of Molecular Immunology, School of Medicine and Health, Technical University of Munich (TUM), Munich, Germany}、芬兰赫尔辛基大学医学院(Faculty of Medicine, University of Helsinki, Helsinki, Finland)、瑞典隆德大学肿瘤中心(Lund University Cancer Center, Division of Oncology, Lund University, Lund, Sweden)、瑞士洛桑大学{University of Lausanne (UNIL), Lausanne, Switzerland}、瑞士洛桑大学(UNIL)和洛桑洛桑大学医院(CHUV)肿瘤科{Department of Oncology, University Hospital of Lausanne (CHUV) and University of Lausanne (UNIL), Lausanne, Switzerland}、瑞士洛桑阿戈拉研究中心(Agora Research Center, Lausanne, Switzerland)、澳大利亚悉尼大学(The University of Sydney, Sydney, New South Wales, Australia)以及奥地利维也纳医科大学(Medical University of Vienna, Vienna, Austria)的研究人员。
发表在《自然》(Nature)杂志上的这些发现将单核细胞定位为增强免疫治疗的一个有希望的靶点,有可能使黑色素瘤、肺癌、胰腺癌和结直肠癌等癌症的患者受益。
免疫疗法的发展(The Evolution of Immunotherapy)
在过去的几十年里,免疫疗法已经彻底改变了癌症治疗,为曾经被认为无法治愈的疾病(包括黑色素瘤、肺癌和膀胱癌)提供了有效的选择。最初在实验室进行的实验研究现在已经转变为改变生活的临床应用,为患有难以治疗的癌症患者带来了新的希望。
免疫疗法如何起作用(How Immunotherapy Works)
免疫疗法是利用人体的免疫系统来瞄准并消灭癌细胞。这可以通过广泛增强免疫活性或专注于帮助免疫系统识别、攻击和消除癌细胞的特定途径来实现。
尽管免疫疗法取得了重大进展,但仍面临重大挑战。一个关键的障碍是癌症通过改变其细胞以逃避检测,并在肿瘤内创造免疫抑制环境来逃避免疫系统的能力。因此,许多患者对目前的治疗没有反应,例如,超过50%的被诊断患有黑色素瘤(最具侵袭性的皮肤癌类型)的患者看到有限的治疗效果或根本没有任何效果。
癌症免疫疗法的先进研究(Advanced Research in Cancer Immunotherapy)
癌症如何逃避免疫反应的许多问题仍然未知,主要是由于癌症和免疫细胞之间相互作用的分子事件的复杂级联。了解这些过程的细微差别将是开发更有效治疗方法的关键。
在IMP高级组长安娜·奥贝罗领导的一项研究中,一个国际研究小组整合了包括黑色素瘤小鼠模型(melanoma mouse models)、单细胞RNA测序(single-cell RNA sequencing)、先进的功能遗传学(advanced functional genetics)和成像技术(imaging technologies)在内的尖端工具,以推动我们对免疫系统在对抗癌症中的作用的理解。
这项发表在《自然》(Nature)杂志上的研究,揭示了一种额外类型的免疫细胞参与刺激针对癌症的免疫反应,为促进免疫治疗的新策略开辟了可能性,并有可能将其益处扩大到更多的患者。
重新思考癌症免疫周期(Rethinking the Cancer Immunity Cycle)
研究人体抗肿瘤防御的研究人员通常指的是“癌症免疫循环”(‘cancer immunity cycle’),即免疫细胞识别和消灭癌细胞的一系列步骤。这个循环的核心是T细胞,它是免疫系统的主要抗癌细胞。但是T细胞并不是单独工作的;它们依赖于其他免疫细胞的激活,特别是抗原呈递细胞(antigen-presenting cells简称APCs),如树突状细胞(dendritic cells),是主要的T细胞激活剂(T cell activators)。
当癌细胞释放被APCs捕获的蛋白质片段或抗原时,这一过程就开始了。这些细胞将抗原呈递给T细胞,有效地引导T细胞识别癌细胞作为目标。一旦在淋巴结(lymph nodes)中被激活,T细胞就会前往肿瘤部位摧毁它,释放新的抗原,重新启动免疫激活的循环。
这项研究的第一作者之一、维也纳生物中心博士项目(Vienna BioCenter PhD Program)的学生阿内斯·埃莱沃特(Anais Elewaut)说:“正如我们今天所理解的那样,癌症免疫周期实际上是不完整的,我们错过了肿瘤微环境中T细胞再激活的关键步骤。我们发现,当T细胞到达肿瘤时,它们仍然需要其他免疫细胞的额外激活才能完全有效。”
新发现和未来发展方向(Novel Findings and Future Directions)
为了确定这一过程中缺失的成分,科学家们使用强大的细胞模型来研究使癌症对最常见的免疫疗法敏感的因素。
安娜·奥贝罗实验室产生了两种来自小鼠的黑色素瘤细胞系模型,它们对常用疗法的反应不同:一种对免疫疗法和靶向疗法都有良好的反应,后者使用针对特定癌细胞的物质;另一种对这两种治疗都有抗药性(resistant to both these treatment types)。“有了这个系统,我们可以密切地比较反应性肿瘤(responsive tumors)和耐药肿瘤(resistant tumors),帮助我们找出决定治疗成功或失败的关键因素。”
单核细胞:癌症免疫的新参与者(Monocytes: A New Player in Cancer Immunity)
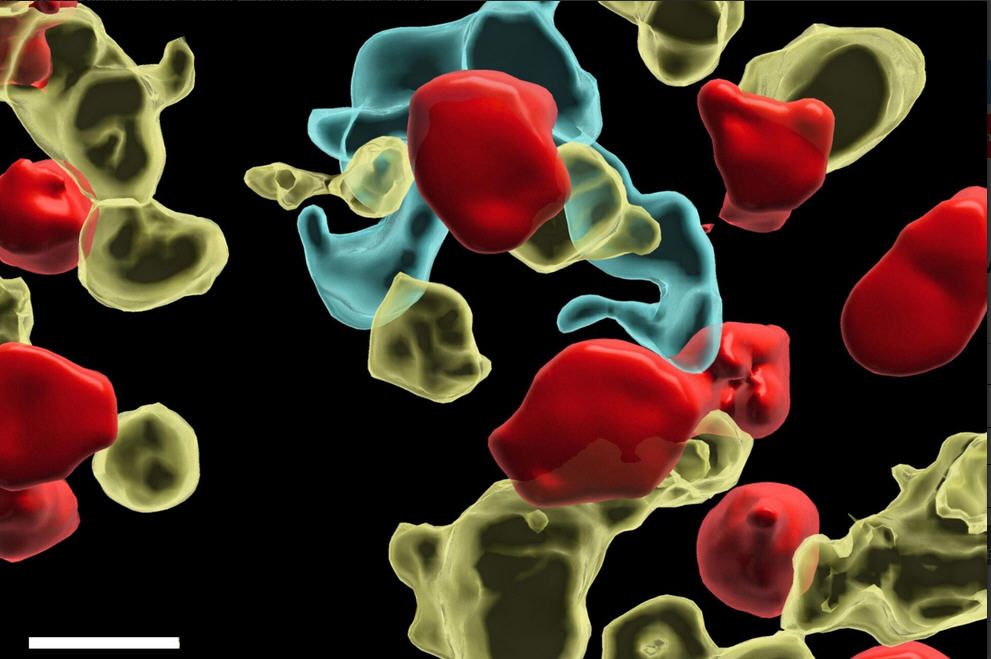
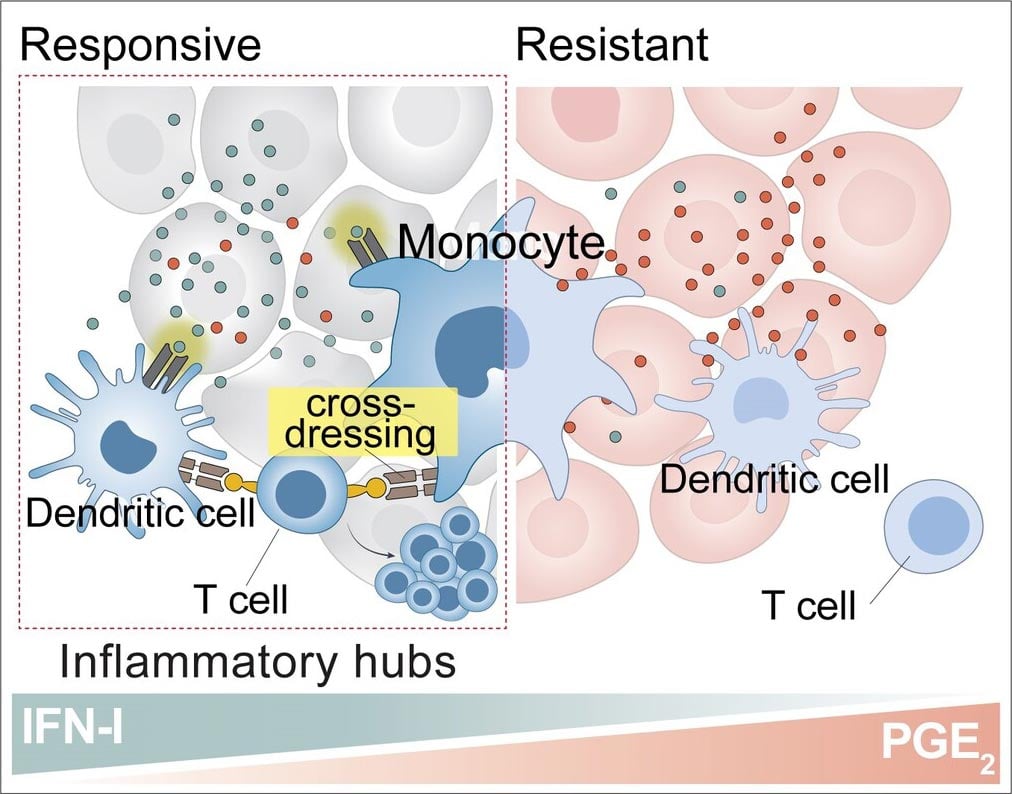
该团队首先通过分析单细胞水平的基因表达来分析两种模型中的肿瘤环境,然后根据其表面的特定标记对免疫细胞类型进行分类和量化。“当我们注意到反应性肿瘤中的单核细胞比抵抗性肿瘤中的单核细胞多时,我们非常感兴趣。”阿内斯·埃莱沃特解释说:“单核细胞是一种从未报道过在T细胞刺激中起作用的免疫细胞。长期以来,研究人员一直将树突状细胞视为T细胞的主要激活剂,而忽略了其他免疫细胞的作用。相比之下,耐药模型只有很少的单核细胞,但充满了抑制性巨噬细胞(suppressive macrophages),这是已知的抑制免疫反应的细胞。”
该研究的共同第一作者之一、维也纳生物中心博士项目的学生Guillem Estivill解释说:“单核细胞被认为在癌症免疫中发挥有限的作用。现在我们展示这些特定免疫细胞的存在或缺失如何导致非常不同的治疗结果。尽管树突状细胞对于启动淋巴结中的癌症免疫周期至关重要,但要充分激活肿瘤中的T细胞,树突状细胞和单核细胞都是必需的。”
科学家们发现,单核细胞可以直接借用癌细胞的一部分,包括抗原,并将它们呈递给T细胞。这个过程被称为“变装”(‘cross-dressing’),它允许单核细胞重新激活T细胞,从而增强T细胞识别和攻击癌细胞的功能。
恢复免疫平衡对抗癌症(Restoring Immune Balance Against Cancer)
该研究还显示了癌细胞是如何通过使T细胞难以保持激活状态并有效发挥作用来逃避免疫的。癌细胞会增加前列腺素E2(prostaglandin E2)分子的产生,这种分子会阻止单核细胞和树突状细胞的活动。同时,癌细胞会减少刺激免疫活动的干扰素(interferons)分子的产生,从而进一步削弱免疫系统对抗肿瘤的能力。Guillem Estivill解释说:“我们已经看到,通过激活单核细胞,恢复这些分子的水平可以使T细胞恢复其杀死癌症的作用。”
基于这一发现,一种有希望的策略是使用COX抑制剂(COX inhibitors),如阿司匹林药物(aspirin—drugs),阻断环氧化酶(cyclooxygenase简称COX)的酶,这种酶负责产生引起炎症的分子,如前列腺素E2(prostaglandin E2)。此外,刺激干扰素的产生可以增强免疫系统对抗癌症的能力。这些方法可以与现有的免疫疗法相结合,为目前对治疗有抗药性的癌症提供新的工具。
这些发现使得单核细胞有望成为促进免疫治疗的靶点,并有可能使受与黑色素瘤分子途径相似的癌症影响的广泛患者受益。这些癌症包括肺癌、胰腺癌和结直肠癌。
免疫治疗的未来方向(Future Directions in Immunotherapy)
未来的研究将集中在探索如何用单核细胞和其他免疫细胞刺激T细胞,在不同形式的免疫治疗中发挥作用。这一发现可能会揭示克服免疫疗法耐药性的新方法。安娜·奥贝罗说:“结合COX抑制剂和免疫疗法的临床试验即将开始。我们已经确定了提高其有效性的策略,我们的目标是加深对抗肿瘤免疫机制的理解。我希望这将帮助我们克服更多患者的耐药性,使癌症免疫疗法成为更广泛患者的可行选择。”
Guillem Estivill是IMP 安娜·奥贝罗实验室(Anna Obenauf’s lab at the IMP)的博士生,也是EVOMET网络(EVOMET network)的成员,EVOMET网络是一个著名的欧洲联盟,致力于研究癌症转移的演变。EVOMET由欧洲委员会在玛丽-居里行动下的创新培训网络计划(European Commission’s Innovative Training Networks program under the Marie Skłodowska-Curie Actions)支持,由巴塞罗那生物医学研究所{Institute for Research in Biomedicine (IRB) Barcelona}协调,包括13个领先的学术、临床和工业机构。这一合作倡议培训转移生物学和治疗发展方面的早期职业研究人员。通过促进跨学科和跨部门的合作,EVOMET旨在加快靶向治疗的发展,改善转移性癌症的治疗。
本研究得到了德国勃林格殷格翰公司(Boehringer Ingelheim)、奥地利研究促进局{Austrian Research Promotion Agency (headquarter grant FFG-852936)}、欧洲研究理事会{European Research Council (‘CombaTCancer’, grant number 759590 and ‘UnlockIT’ grant number 101125797)}、维也纳科学技术基金{Vienna Science and Technology Fund (LS-16-063)}、SNF博士后流动基金{SNF postdoctoral mobility grant (grant number 214359)}、玛丽-居里博士后奖学金计划{Marie Skłodowska–Curie postdoctoral fellowship programme (grant number 101108907)}以及西格丽德·尤萨柳斯基金会(Sigrid Jusélius Foundation)的资助或支持。另外也得到了VIP2博士后计划(VIP2 postdoctoral programme),该计划已获得欧盟研究与创新框架计划地平线2020 (2014 - 2020){ European Union’s Framework Programme for Research and Innovation Horizon 2020 (2014‐2020) (Marie Skłodowska–Curie grant agreement number 847548 and 955951)}的资助。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
The tumour microenvironment is programmed by cancer cells and substantially influences anti-tumour immune responses1,2. Within the tumour microenvironment, CD8+ T cells undergo full effector differentiation and acquire cytotoxic anti-tumour functions in specialized niches3,4,5,6,7. Although interactions with type 1 conventional dendritic cells have been implicated in this process3,4,5,8,9,10, the underlying cellular players and molecular mechanisms remain incompletely understood. Here we show that inflammatory monocytes can adopt a pivotal role in intratumoral T cell stimulation. These cells express Cxcl9, Cxcl10 and Il15, but in contrast to type 1 conventional dendritic cells, which cross-present antigens, inflammatory monocytes obtain and present peptide–major histocompatibility complex class I complexes from tumour cells through ‘cross-dressing’. Hyperactivation of MAPK signalling in cancer cells hampers this process by coordinately blunting the production of type I interferon (IFN-I) cytokines and inducing the secretion of prostaglandin E2 (PGE2), which impairs the inflammatory monocyte state and intratumoral T cell stimulation. Enhancing IFN-I cytokine production and blocking PGE2 secretion restores this process and re-sensitizes tumours to T cell-mediated immunity. Together, our work uncovers a central role of inflammatory monocytes in intratumoral T cell stimulation, elucidates how oncogenic signalling disrupts T cell responses through counter-regulation of PGE2 and IFN-I, and proposes rational combination therapies to enhance immunotherapies.
转载本文请联系原作者获取授权,同时请注明本文来自诸平科学网博客。
链接地址:https://wap.sciencenet.cn/blog-212210-1462665.html?mobile=1
收藏