博文
[转载]三名接受狂犬病供体实体器官患者的狂犬病暴露后预防的临床管理和体液免疫反应
|||
三名接受狂犬病供体实体器官患者的狂犬病暴露后预防的临床管理和体液免疫反应
摘要
背景
狂犬病病毒会导致致命的脑炎,并可通过器官移植传播。2013年,一名男子在接受了一名患有狂犬病的捐赠者的肾脏后18个月患上了狂犬病,当时并不知道这名捐赠者在获取器官时已被感染。另外三名接受同一供体器官(肝脏、肾脏、心脏)的患者在移植前均未接种狂犬病疫苗,他们在供体确诊为狂犬病后(移植手术后18个月)立即接受了狂犬病暴露后预防(PEP)和5剂狂犬病疫苗。我们描述了他们的临床管理。
方法
由于3名受试者都在接受免疫抑制药物治疗,因此使用快速荧光灶抑制试验进行了疫苗接种后血清学检测,以测量狂犬病毒中和抗体(RVNAs)。对接种狂犬病疫苗可接受的抗体反应定义为在第五剂疫苗接种后≥7天采集的血清标本中检测到浓度≥0.1 IU/mL的RVNAs。
结果
尽管处于免疫抑制状态,但所有3名受体均表现出可接受的抗体应答。移植手术已经过去了36个多月,3名受者都没有狂犬病的证据。
结论
3例先前未接种疫苗的来自狂犬病供体的实体器官受体的存活是出乎意料的。虽然导致他们存活的确切因素尚不清楚,但我们的数据表明PEP可能提高供体被回顾性诊断为狂犬病的移植安全性。
关键词:狂犬病,实体器官移植,暴露后预防
狂犬病是由狂犬病病毒引起的致命性脑炎。估计每年有55,000人死于狂犬病,并且大多数病例与患狂犬病的犬的咬伤有关。通过使用暴露后预防法(PEP ),可以在常规暴露(如动物咬伤)后预防狂犬病,对于以前未接种疫苗的免疫活性人员,该预防法包括狂犬病免疫球蛋白(RIG)和4剂狂犬病疫苗。
施用狂犬病疫苗后刺激的体液反应涉及狂犬病毒中和抗体(RVNAs)的产生,其可以用快速荧光灶抑制试验(RFFIT)来测量;当宿主产生体液反应时,施用RIG可立即提供RVNAs。根据免疫实践咨询委员会(ACIP)的规定,如果宿主的血清在1:5的血清稀释度下完全中和攻击狂犬病病毒,则可以记录对施用狂犬病疫苗的可接受抗体反应;这对应于大约0.1 IU/mL的RVNA浓度。RVNA滴度与预防狂犬病无关,并且免疫功能正常的人不常规进行疫苗接种后血清学检测,因为大多数人会有可接受的抗体反应。相比之下,免疫抑制患者对狂犬病疫苗的抗体反应通常减弱,尽管与这种次优反应相关的确切因素尚未明确。因此,ACIP建议以前未接种疫苗的免疫抑制患者使用RIG和接种5剂疫苗,并在接种后进行血清学检测,以确认出现了可接受的抗体反应。
虽然大多数狂犬病病例与直接接触患有狂犬病的动物的历史有关,但狂犬病病毒也可通过移植从受感染的人类供体获得的组织或器官而传播。例如,在2004年和2005年,在接受从在移植时不知道患有狂犬病的捐赠者处获得的实体器官的人当中,发生了两次单独的狂犬病爆发。在这两起事件中,所有移植前未接种狂犬病疫苗的受体在移植后6周内出现狂犬病症状,随后死亡;这包括在对供体进行狂犬病回顾性诊断后接受PEP治疗的受者。对这些疫情的观察表明,从患有狂犬病的供体获得的器官的接受者中有很高的传染率,并对PEP在这种情况下的有效性提出了疑问。
2013年,我们报告了第三起通过实体器官移植传播狂犬病病毒的事件。与之前的2起实体器官相关疾病暴发相反,在总共4例之前未接种疫苗的实体器官受体中,只有1例(左肾受体)在17个月的异常长潜伏期后出现狂犬病。其余3名受者(肝脏、右肾、心脏)在供者确诊狂犬病后立即接受PEP(在PEP第0、3、7、14和28天注射RIG和5剂疫苗)。尽管在移植手术后18个月开始PEP,但这3名受者至今没有发生狂犬病。本文描述了这3例器官捐献者被回顾性诊断为狂犬病后的临床处理,重点是免疫抑制患者处理PEP的挑战。
方法
公众健康调查的细节已经公布。由于3名存活的受者都在接受免疫抑制药物治疗,因此使用RFFIT对系列血清标本进行了疫苗接种后血清学检测。RFFIT检测RVNAs的下限为0.04 IU/mL。如果在接种第五剂疫苗后至少7天,从血清中检测到浓度≥0.1 IU/mL的RVNAs,则认为受试者对接种狂犬病疫苗产生了可接受的抗体反应。我们还评估了PEP给药前收集的基线血清标本,以验证是否有任何狂犬病病毒抗原暴露史。对基线血清标本进行了RVNAs检测(使用RFFIT)和狂犬病病毒特异性结合抗体检测(使用间接荧光抗体检测) 。
结果
肝脏受体
肝脏接受者是一名42岁的男子,他因布-加综合征晚期肝病接受肝移植;在移植之前,他没有接种过狂犬病疫苗。就在接受器官之前,患者病情危重,终末期肝病模型评分为40。病人的移植手术很顺利,移植后的过程也很顺利,除了肾衰竭;他在移植后第11天出院回家。
该患者的诱导免疫抑制方案包括甲泼尼龙(1次静脉[IV]剂量为1 g)和阿仑珠单抗(1次静脉剂量为30 mg)。他的初始维持免疫抑制方案包括在术后前3个月逐渐减量的甲基强的松龙和他克莫司,初始血清谷值目标为4-8 ng/mL。在移植后第8个月,患者出现下肢带状疱疹,用阿昔洛韦成功治疗;他的免疫抑制方案没有调整。其他移植后并发症包括慢性肾功能不全、口服降糖药控制的糖尿病和高血压。他的移植肝脏没有排异反应。
PEP由RIG和5剂纯化的鸡胚细胞狂犬病疫苗。在第五次疫苗给药后14天(PEP第42天)收集的血清显示了对狂犬病疫苗的可接受的抗体反应;截至移植后第28个月/第280天,仍可检测到浓度≥0.1 IU/mL的轮状病毒(表1, 图1)。该患者仍在使用他克莫司维持免疫抑制治疗,并且没有狂犬病的临床证据。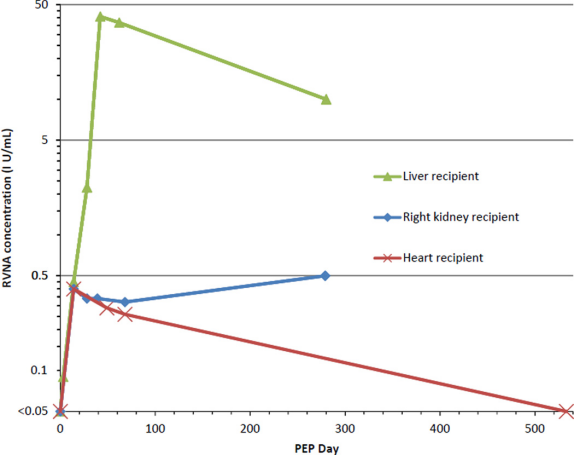
图1 3例接受从狂犬病供体获得的实体器官的患者对狂犬病暴露后预防(PEP)的抗体反应。该图显示了狂犬病毒中和抗体(RVNAs)的浓度(Y-轴,对数标度)在狂犬病PEP开始后的不同时间点(X-轴)针对3名实体器官接受者,他们接受了从患有狂犬病的捐赠者处获得的器官。我们使用的实验室检测法对RVNAs的检测下限为0.04 IU/mL,但为简单起见,该图中显示了0.05 IU/mL。由免疫实践咨询委员会定义的对施用狂犬病疫苗的可接受抗体反应的临界值对应于约0.1 IU/mL的RVNA浓度;相比之下,世界卫生组织的临界值是0.5 IU/mL。
表1 3例接受狂犬病供体实体器官的患者对狂犬病暴露后预防(PEP)和免疫抑制药物的抗体反应
器官 | 月份 | PEP天 | RVNA | 抑制免疫反应的药物(血清槽级别目标) |
肝脏 | 18 | 0 | <0.04 | 总胆固醇(4-8纳克/mL) |
18 | 3 | 0.1 | 总胆固醇(4-8纳克/mL) | |
19 | 14 | 0.5 | 总胆固醇(4-8纳克/mL) | |
19 | 28 | 2.2 | 总胆固醇(4-8纳克/mL) | |
20 | 42 | 40.8 | 总胆固醇(4-8纳克/mL) | |
20 | 62 | 36.8 | 总胆固醇(4-8纳克/mL) | |
28 | 280 | 10.0 | 总胆固醇(4-8纳克/mL) | |
右肾 | 18 | 0 | <0.04 | TAC(6-8纳克/mL)MPA(1.5-2.5克/mL) |
19 | 14 | 0.4 | TAC(6-8纳克/mL)MPA(1.5-2.5克/mL) | |
19 | 28 | 0.3 | TAC(6-8纳克/mL)MPA(1.5-2.5克/mL) | |
20 | 39 | 0.3 | TAC(6-8纳克/mL)MPA(1.5-2.5克/mL) | |
21 | 68 | 0.3 | TAC(6-8纳克/mL)MPA(1.5-2.5克/mL) | |
28 | 279 | 0.5 | TAC(6-8纳克/mL)MPA(1.5-2.5克/mL) | |
心 | 18 | 0 | <0.04 | TAC(10–12纳克/mL)泼尼松2.5毫克/天 |
19 | 14 | 0.4 | TAC(10–12纳克/mL)泼尼松2.5毫克/天 | |
20 | 49 | 0.3 | TAC(10–12纳克/mL)泼尼松2.5毫克/天 | |
21 | 68 | 0.3 | TAC(10–12纳克/mL)泼尼松2.5毫克/天 | |
36 | 533 | <0.04 | TAC(6–8纳克/mL)西罗莫司(4–8纳克/mL) |
RVNA,狂犬病毒中和抗体;TAC他克莫司(一种免疫抑制剂);MPA霉酚酸。
右肾受体
右肾受体是一名41岁的男性,因高血压肾病接受肾移植时有甲状旁腺功能亢进和巴雷特食管病史;在移植之前,他没有接种过狂犬病疫苗。病人的移植手术很顺利,除了高血压之外,他的移植后疗程也很顺利;他在移植后第三天出院回家。
该患者的诱导免疫抑制方案包括甲基强的松龙(从静脉注射剂量500 mg开始,在3天内快速减量)和阿仑珠单抗(静脉注射剂量30 mg,共1次)。他的初始维持免疫抑制方案包括他克莫司和霉酚酸,血清谷浓度目标分别为8-12 ng/mL和2-3 μg/mL。在移植后第3个月,他出现了BK病毒相关性肾病和BK病毒血症,促使他克莫司和麦考酚酸剂量减少,以维持血清谷浓度目标分别为6-8 ng/mL和1.5-2.5 μg/mL。移植后12个月期间获得的肾活检显示BK病毒相关肾病消退。他移植的肾脏没有任何排异反应。
PEP包括RIG和用于第一疫苗剂量的人二倍体细胞狂犬病疫苗,以及用于随后4个疫苗剂量的纯化的鸡胚细胞狂犬病疫苗。在第五次疫苗给药后11天(PEP第39天)收集的血清显示了对狂犬病疫苗的可接受的抗体反应;截至移植后第28个月/第279天,仍可检测到浓度≥0.1 IU/mL的RVNAs。
在PEP治疗期间和之后进行了几项检测免疫功能的试验。在基线(移植后第18个月/PEP第0天)通过流式细胞仪进行的t细胞分析显示,CD3细胞的绝对计数为189/mm3(正常范围629–2465/mm3),CD8细胞绝对计数为46个/mm3(正常范围93–1025/mm3),以及133/mm的绝对CD4细胞计数3(正常范围:340–1568/mm3).同时(移植后第18个月/PEP第0天)测定的定量免疫球蛋白(Igs)如下:IgG 748 mg/dL(正常范围700–1600mg/dL),IgA 105 mg/dL(正常范围70–400mg/dL),IgM 52 mg/dL(正常范围40–230mg/dL)。移植后第21个月/第68天的流式细胞仪分析显示CD3细胞的绝对计数为205/mm3,绝对CD8细胞计数为68个/mm3,绝对CD4细胞计数为125/mm3。在移植后第28个月/第279天,免疫球蛋白定量测定显示:IgG 587 mg/dL,IgA 90 mg/dL,IgM 36 mg/dL。该患者仍在接受他克莫司和霉酚酸的维持性免疫抑制治疗,并且没有狂犬病的临床证据。
心脏接受者
心脏接受者是一名54岁的男性,在因特发性扩张型心肌病接受心脏移植时有II型糖尿病和高血压病史;在移植之前,他没有接种过狂犬病疫苗。在接受该器官之前,该患者患有甲氧西林敏感的重症疾病金黄色葡萄球菌脓毒症并发急性肾衰竭和复发性室性心动过速。病人的移植手术很顺利,除了肾衰竭之外,他的移植后疗程也很顺利;他在移植后第11天出院回家。
该患者的诱导免疫抑制方案包括甲基强的松龙(500毫克的1次静脉注射剂量)和巴利昔单抗(20毫克的1次静脉注射剂量)。在术后的头两天,他额外接受了1 g的甲泼尼龙。他的初始维持免疫抑制方案包括他克莫司,初始血清谷值目标为10-14 ng/mL,强的松(每日50 mg)在术后第一个45天逐渐减少至每日15 mg,以及霉酚酸酯(每日两次,每次1 g)。在移植后第2个月,他接受了心脏活检,显示1A排异反应等级;他的免疫抑制方案没有调整。移植后3个月的心脏活检显示1B排异反应等级;他的免疫抑制方案没有调整。移植后第4个月的心脏活检显示排斥反应消退,他的他克莫司剂量滴定至目标血清谷浓度10–12 ng/mL,随后他的泼尼松剂量减少至每日12.5 mg。在移植后第12个月和第15个月,患者继续出现1A级排斥反应,但未对其免疫抑制方案进行调整。
PEP包括RIG和用于前4个疫苗剂量的纯化的鸡胚细胞狂犬病疫苗,以及用于第五个疫苗剂量的人二倍体细胞狂犬病疫苗。在第五次疫苗给药后21天(PEP第49天)收集的血清显示了对狂犬病疫苗的可接受的抗体反应;截至移植后第36个月/第533天,未检测到RVNAs。该患者仍在接受他克莫司和西罗莫司的维持性免疫抑制治疗,并且没有狂犬病的临床证据。
讨论
全球已经报告了三组与实体器官移植相关的人类狂犬病,所有这些都发生在人类狂犬病负担非常低的国家。在世界其他地区,包括犬类狂犬病流行和人类狂犬病更常见的地区,器官移植是越来越多地使用的医疗干预。这些情况强调了通过一级预防策略(如提高潜在供体对狂犬病的认识)和二级预防策略(如PEP)来研究预防移植相关狂犬病的方法的必要性。
此处描述的3名受体的存活率是前所未有的,他们在移植手术时都没有接种狂犬病疫苗。不幸的是,导致它们存活的确切因素仍不清楚。18个月过去了,人们发现这3名接受者接受了一名患有狂犬病的捐赠者的器官,而这3人当时都没有症状。对此的一种解释是,鉴于狂犬病病毒的典型潜伏期小于1年,这3名受体接受的器官没有任何狂犬病病毒负担,因此没有狂犬病风险。然而,1名患狂犬病的受体经历了17个月的长潜伏期,这是反对这一假设的证据。另一种可能性是,这3名受试者暴露于亚感染剂量的狂犬病毒,该病毒在PEP给药前已被清除。据报道,在被患有狂犬病的动物咬伤的人中也发生了类似的事件,但这些人虽然没有接受PEP治疗,但并没有患上狂犬病。第三种可能性,也是最令人担忧的,是这3名受者处于狂犬病病毒的潜伏期,如果他们没有接受PEP,就会出现临床疾病;因此,我们按照ACIP推荐的时间表进行PEP治疗。值得注意的是,供体感染了浣熊狂犬病病毒变体,另一个尚未解决的问题是,与2004年和2005年两次移植相关狂犬病暴发中未接种疫苗的受体相比,这是否可以解释这3个受体的不同结果。浣熊是美国最常报道的狂犬病动物,然而只有3例人类感染浣熊狂犬病病毒变体的报道。虽然我们知道人类感染浣熊狂犬病病毒变异体是致命的,但与其他狂犬病病毒变异体(如来自蝙蝠的变异体)相比,这种狂犬病病毒变异体在人类宿主中可能具有不同的自然史(如较长的潜伏期)。
根据ACIP的建议,考虑到3名受试者的免疫抑制状态,我们对他们进行了疫苗接种后血清学检测。ACIP没有具体说明是否应该评估单个血清样本或系列样本,尽管一些作者认为,如果目标抗体水平得到证明,单个样本就足够了。这种管理免疫抑制患者PEP的方法通常适用于常规狂犬病病毒暴露,如动物咬伤,其中存在离散的有限暴露。然而,我们认为这3名受者有持续暴露于狂犬病毒的潜在风险,因为他们的移植器官可能仍然携带狂犬病毒。此外,它们暴露的部位(它们的移植器官)不能被清洗,正如通常对咬伤所做的那样(即使在没有PEP的情况下也能降低狂犬病的风险),并且因为它们的移植器官不能被RIG直接渗透。因此,我们收集了所有3名受试者的系列血清样本,作为其疫苗接种后血清学检测的一部分。
我们用于确定是否出现可接受的抗体反应的标准与ACIP推荐的标准一致:使用RFFIT以1:5的血清稀释度完全中和攻击狂犬病病毒,这大致相当于0.1 IU/mL的RVNA浓度。相反,世界卫生组织(WHO)建议使用0.5 IU/mL的浓度作为临界值。最终,这些是任意的标准,并且具有高于这些水平的RVNA浓度并不赋予对狂犬病的“保护作用。据估计,在美国每年有多达36,000人接受PEP,尽管PEP并不总是被适当地施用,并且尽管对于可接受的抗体反应使用了比世卫组织更低的RVNA截止值,但是在美国还没有PEP与目前许可的细胞培养狂犬病疫苗。然而,考虑ACIP和世卫组织标准之间的差异很重要,因为心脏受者从未出现RVNAs浓度≥0.5 IU/mL,右肾受者直到PEP第279天最后一次抽取血清时才出现RVNAs浓度≥0.5 IU/mL。当这些RVNA临界值均未达到时,很少有数据可用于指导免疫抑制患者的PEP管理,并且已经提出了非常不同的策略,包括重复施用整个PEP系列和加倍疫苗剂量。在有更多的数据帮助免疫抑制患者的PEP管理标准化之前,每个病例都必须单独处理,通常要咨询适当的公共卫生官员。接种狂犬病疫苗可能会发生不良事件,因此应仔细考虑施用超过ACIP建议的5剂疫苗剂量的额外疫苗剂量的益处和风险。
在免疫抑制人群中管理PEP的一个持续挑战仍然是我们无法预测这些人中哪些人可能具有差的抗体应答。虽然看到肝脏受体在3名受体中具有最强的抗体反应并不令人惊讶,但鉴于他服用的免疫抑制药物比其他2名受体少,他的反应的压倒性优势似乎与免疫抑制药物的差异不成比例。事实上,肝脏受体产生的抗体反应超过了在完成疫苗接种后类似时间点对其他肝脏移植受体报告的抗体反应(17岁肝脏移植受体为36.8 IU/mL对11.69 IU/mL)。这些观察表明,其他内在宿主因素也可能在一个人对PEP的反应中发挥作用。
对免疫抑制患者进行PEP管理的另一个不确定性是他们应该表现出目标RVNA水平的持续时间。例如,肝脏和心脏受体的抗体滴度在评估的最终血清样本中均下降;相比之下,右肾受体的抗体滴度增加,尽管最近没有接受狂犬病疫苗或其免疫抑制药物治疗方案有任何变化。这种情况,特别是对于肝脏和心脏受体,是否需要持续的血清学评估尚不清楚。
虽然已有一些关于人类免疫缺陷病毒患者PEP的数据,但迫切需要对其他类别的免疫抑制患者如移植受体。从实验室的角度来看,接种狂犬病疫苗后,评估T细胞和B细胞反应以及其他免疫功能标记物应是进一步研究的优先领域。系统报告免疫抑制个体PEP治疗经验的国际注册可以帮助临床医生和公共卫生官员提出循证治疗建议。最后,应进行前瞻性研究,旨在招募移植受者并测量对PEP的免疫反应;这种方法的优点是它允许招募更同质的研究人群,集中于移植环境。
3例先前未接种疫苗的来自狂犬病供体的实体器官受体的存活是一个意想不到的和前所未有的情况。虽然我们不知道导致他们存活的确切情况,但我们的数据首次表明,在供体被回顾性诊断患有狂犬病的情况下,PEP可能提高移植的安全性。
Vora NM, Orciari LA, Niezgoda M, Selvaggi G, Stosor V, Lyon GM 3rd, Wallace RM, Gabel J, Stanek DR, Jenkins P, Shiferaw M, Yager P, Jackson F, Hanlon CA, Damon I, Blanton JD, Recuenco S, Franka R. Clinical management and humoral immune responses to rabies post-exposure prophylaxis among three patients who received solid organs from a donor with rabies. Transpl Infect Dis. 2015 Jun;17(3):389-95. doi: 10.1111/tid.12393. Epub 2015 May 19. PMID: 25851103; PMCID: PMC4642444.
https://wap.sciencenet.cn/blog-55647-1394171.html
上一篇:[转载]356.在斯里兰卡上市的兽用狂犬病疫苗的效力
下一篇:[转载]非特异性效应对疫苗测试、批准和监管的影响