博文
肠道细菌产生氢气对肝脏炎症的作用研究【2009年哈佛BBRC】
 精选
精选
||
这是氢气生物学领域的经典文献,回答了一个关键问题,就是来自肠道细菌代谢产生的氢气是否能产生生物学效应。本研究结果表明,细菌来源的氢气能产生作用。当然从应用角度,是否可以采用这种方式,并不一定。因此这一研究的价值是生理现象和概念验证。说明氢气在生物体中的重要性。2004年哈佛大学另外一个小组研究发现,肠道细菌代谢产生的氢气是孕妇肠道皮质激素转化为孕激素的重要因素,也算是对这个概念的进一步延申。那就是氢气在肠道细菌代谢中的重要生物学价值。至少在孕期肠道内分泌调节方面具有核心地位。

引言
氢气(H2)溶解在水中的抗氧化效果已在缺血再灌注引起的小鼠脑损伤模型中得到证实。继这项研究之后,其他几篇报告也表明,H2可以抑制由氧化应激引起的器官组织损伤,如肝脏、肠道和心脏等。由于炎症与氧化应激之间的密切联系被广泛认可,它们互相激活,因此有效的抗氧化剂也应该能抑制在组织破坏性疾病中引发的炎症。然而,关于H2抗炎症方面的报告却很少见。
重要的是,在过去的动物模型研究中,H2以外源性形式通过气体或溶于水中的方式提供给动物。然而,同样真实的是,一些肠道细菌,如大肠杆菌(E. coli),因其拥有氢气酶而能产生H2。如果肠道细菌确实释放H2,那么这种内源性产生的H2应该会影响宿主对氧化和炎症应激的抵抗力。然而,到目前为止还没有研究探讨由肠道细菌产生的H2对宿主抵抗炎症刺激的影响。
刀豆蛋白A(ConA)是一种血凝素,能凝集血液红细胞,并作为一种主要刺激T细胞的有丝分裂原。因此,它通过激活淋巴细胞的浸润引起急性炎症,导致伴有肝窦内血栓形成的大量肝细胞坏死性组织损伤。因此,ConA诱导的肝炎已被用作实验鼠模型,反映了人类自身免疫性肝炎的大部分病理特性。无胸腺裸鼠和SCID鼠对ConA诱导的肝炎的抵抗力清楚地证明了T细胞在ConA诱导的肝损伤中的允许作用。尽管ConA引起的组织损伤仅限于肝脏,但解释这种器官特异性的潜在机制仍然不清楚。尽管如此,ConA介导的T细胞激活也会增加血液中促炎细胞因子的水平,包括肿瘤坏死因子α(TNF-α)和干扰素γ(IFN-γ),这些细胞因子由激活的T细胞释放,并被认为在ConA诱导的肝炎症发展中起关键作用。
本研究使用Concanavalin A诱导的急性肝炎小鼠模型,检查了(1)肠道定殖细菌释放的H2量以及(2)肠道细菌释放的H2对肝脏炎症的影响。
材料和方法
动物
8至10周龄的雄性C57BL/6j小鼠被饲养在常规房间内,保持12小时光照-黑暗周期和恒定温度。本研究采用的实验程序已获得Forsyth IACUC的批准。
构建表达GFP的E. coli
本研究使用了大肠杆菌W3110株(ATCC 27325)及其不产H2的hypF缺失突变株PMD23(补充材料1;可在线获取)。HypF对于活性氢化酶的合成至关重要,因为其缺失会导致氢化酶活性下降>95%。通过电穿孔技术,两种E. coli菌株都被转染了含有氨苄西林抗性基因(Ampr)启动子的pGFPuv-载体(Clontech, Mountain View, CA)。得到的两个菌株,E. coli W3110gfp+(Ampr+/GFP+/HypF+)和E. coli PMD23gfp+(Ampr+/GFP+/HypF−),在含有氨苄西林(100 μg/ml)的Luria–Bertani(LB)肉汤中培养。
氢气测量
在小鼠器官中产生的氢气(H2)使用针型氢气传感器(Unisense A/S, Aarhus, Denmark)按照Hayashida等人发表的方法进行测量。在二氧化碳吸入后立即处死小鼠,将针型氢气传感器置于用25G针头在器官中准备的导向路径上。否则,将氢气传感器直接放入通过心脏穿刺采集的血液样本中。标准阳性浓度的H2是通过在大气压下使H2气体在水中饱和(25°C时781μM或37°C时721μM)来制备的,而未处理的对照水用于0μM H2量的测定。始终考虑并调整H2的扩散因子(例如,从塑料管中的采样血液中为0.7μM/min)。
制备溶解H2的水
高纯度H2气体(Airgas, Salem, NH)被喷射到水或培养基中,直到H2浓度达到饱和(780μM,25°C)。然后,通过稀释制备适当浓度的H2。水中饱和的H2显示pH值为7.6和非常高的氧化还原电位(ORP水平-511mV)。
刀豆蛋白A诱导的急性肝炎模型
实验方案-A。(1)动物自由摄取含有抗生素混合物(磺胺甲恶唑,8mg/ml,和甲氧苄啶,1.6mg/ml)或对照无抗生素水3天。(2)两组动物在接下来的两天内休息,自由摄取无抗生素水。(3)向两组小鼠静脉注射ConA(Sigma, St. Louis, MO, 15mg/kg;盐水溶液),并在0、2和10小时后监测血清中的ALT和AST。
实验方案-B。(1)动物自由摄取含有抗生素混合物(磺胺甲恶唑,4mg/ml;甲氧苄啶,0.8mg/ml;和氨苄西林,0.1mg/ml)的水3天。(2)接下来的三天,动物保持自由摄取含有氨苄西林(0.1mg/ml)的饮用水。(3)向两组小鼠注射ConA(15mg/kg,盐水溶液):(a)接受富含H2的水(780μM,pH 7.6,1ml/小鼠[口服],每组n=5)或(b)接受对照水(1ml/小鼠[口服],每组n=5)的小鼠,在ConA注射前12小时以及ConA注射后0和3小时给予。ConA注射后,两组仍供应含有氨苄西林的饮用水。实验方案-B的图示见图2A。
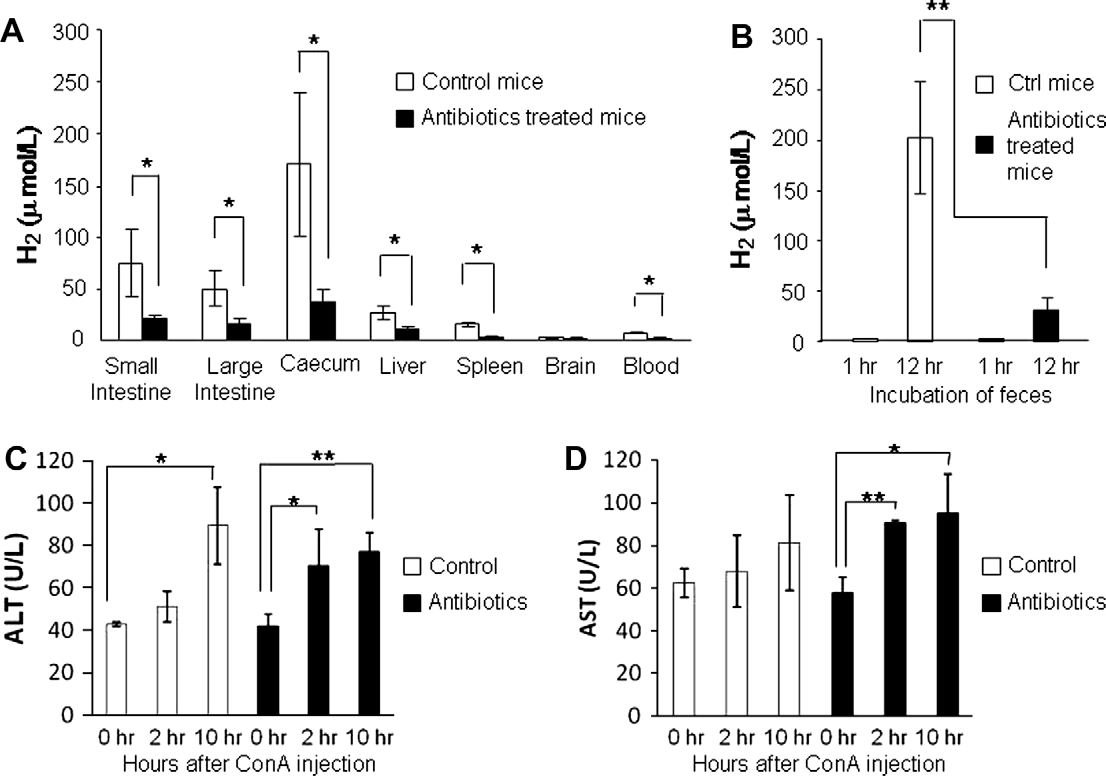
图1. 全身抗生素处理对肠道导管和肝脏中H2水平及小鼠对ConA诱导肝炎易感性的影响。(A)使用针型氢气传感器测量不同器官中的H2浓度(每组n=3)如直方图所示。(B)从用抗生素处理3天接着休息2天的小鼠收集的新鲜粪便样本(粪便,20mg/10ml的LB肉汤,每组n=3)在37°C下孵育1小时或12小时,随后测量细菌培养中的H2。(C和D)向预先用抗生素(磺胺甲恶唑,8mg/ml,和甲氧苄啶,1.6mg/ml)处理3天,随后用无抗生素水休息2天的小鼠静脉注射ConA(15mg/kg)。测量血清中的ALT(C)和AST(D)水平。数据以每组五只小鼠的平均值±标准差表示。∗p<0.05, ∗∗p<0.01:值有显著差异(t检验)。
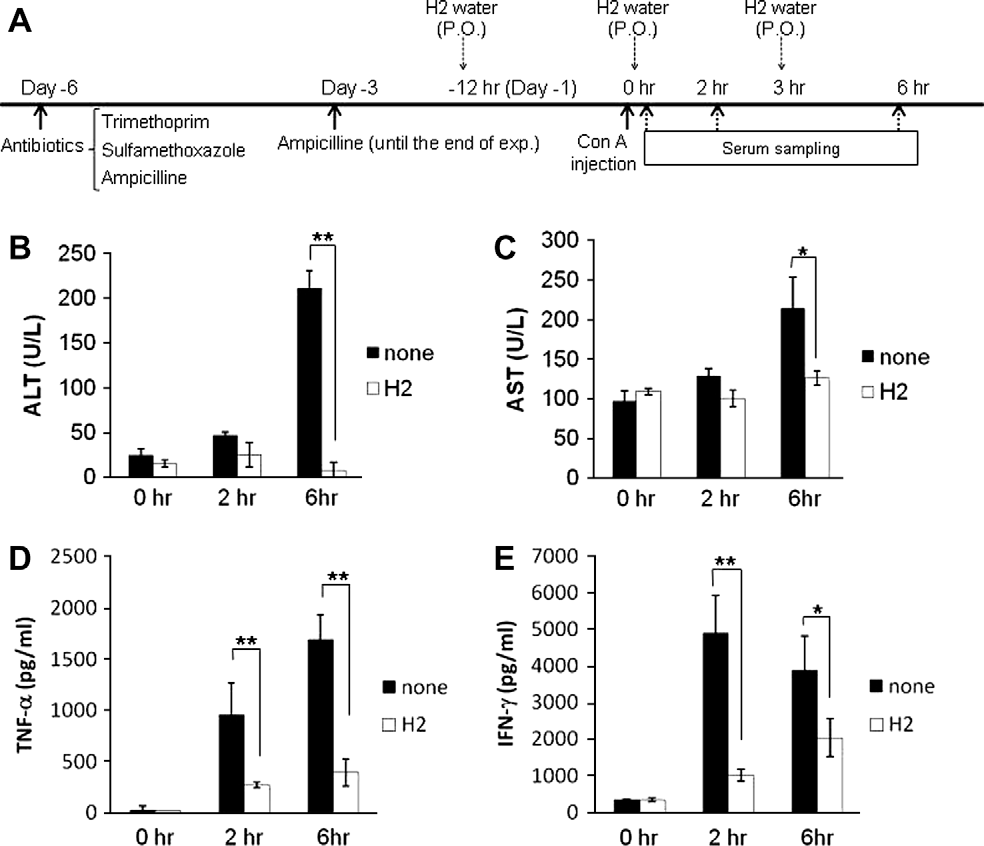
图2. 外源性应用H2对经抗生素预处理的C57BL/6j小鼠ConA诱导肝损伤的影响。(A)实验方案-B的图解:细节在材料和方法中描述。在ConA注射后0、2和6小时收集的小鼠的ALT(C)、AST(D)、TNF-α(E)和IFN-γ(F)水平被测量并以直方图形式呈现。每个直方图(C、D、E和F)中的柱和条表示相应值的平均值±标准差(每组n=5)。∗p<0.05, ∗∗p<0.01:值有显著差异(t检验)。
实验方案-C。(1)动物自由摄取含有与方案-B中相同的三种抗生素混合物的水3天。(2)接下来的三天,动物保持自由摄取含有氨苄西林(1mg/ml)的水。(3)向两组小鼠注射ConA(15mg/kg,盐水溶液):(a)用E. coli W3110gfp+重建的小鼠(每组n=5)或(b)定殖PMD23gfp+的小鼠(每组n=5)。两种E. coli菌株在对数生长期收获并应用(109个细菌/100μl盐水含5%羧甲基纤维素/小鼠[口服]),使用Popper喂食针在ConA注射前2天进行。即使在ConA注射后,两组也被供应含有氨苄西林的饮用水。实验方案-C的图解见图3A。
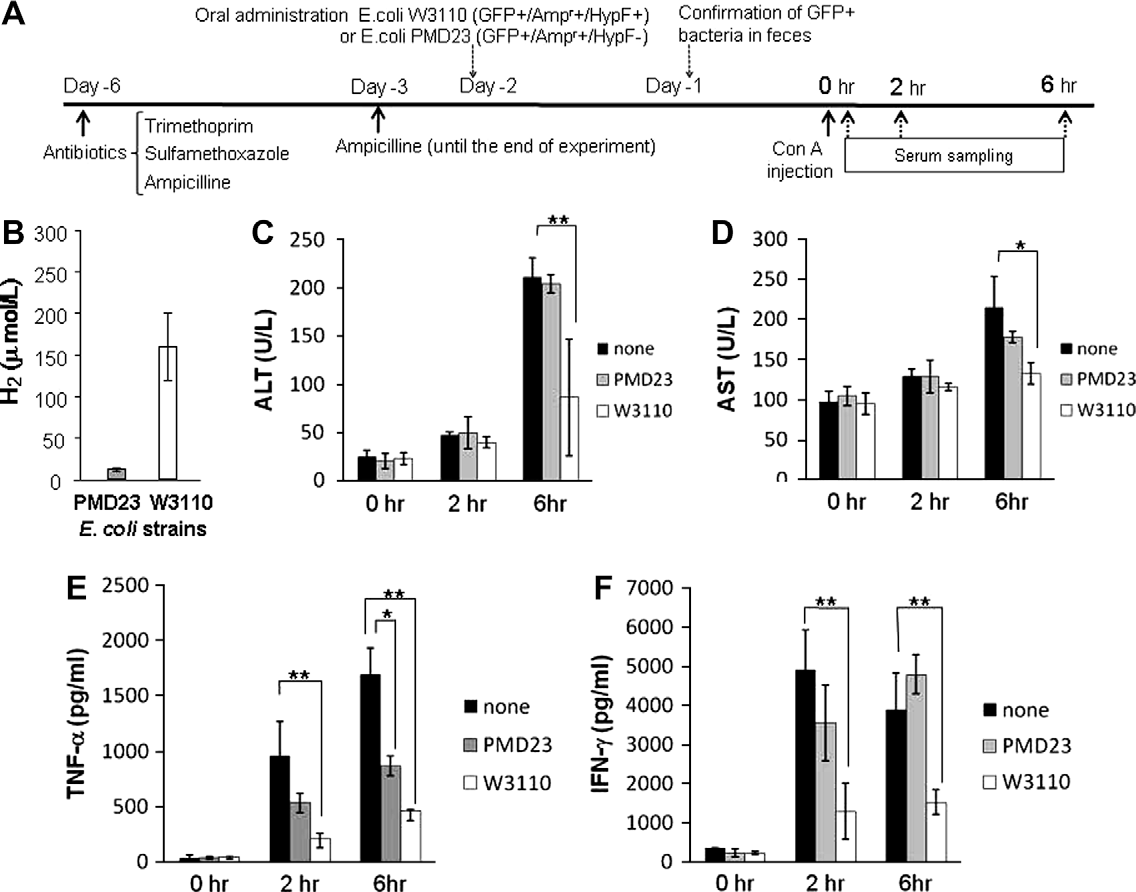
图3. 用产生H2的大肠杆菌重建肠道导管,而不是缺乏H2的大肠杆菌,可以下调经抗生素预处理的C57BL/6小鼠中ConA诱导的肝损伤。(A)实验方案-C:细节在材料和方法中描述。(B)在补充有氨苄西林(100μg/ml)的LB肉汤中培养12小时的大肠杆菌菌株PMD23(Ampr+/GFP+/HypF−)或W3110(Ampr+/GFP+/HypF+)产生的H2水平。在ConA注射后0、2和6小时收集的小鼠血清中的ALT(B)、AST(C)、TNF-α(D)和IFN-γ(E)水平被测量,并以直方图形式显示为各值的平均值±标准差(每组n=5)。∗p<0.05, ∗∗p<0.01:通过t检验显著不同。
肝脏炎症生物标志物和促炎细胞因子的测量
通过使用检测试剂盒并遵循制造商的说明(Biotron Diagnostics, Hemet, CA)来分析血清中的丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)水平,从而分析肝脏损伤的程度。使用酶联免疫吸附测定(ELISA)试剂盒(PeproTech, Rocky Hill, NJ)对促炎细胞因子TNF-α和IFN-γ进行定量。
肝脏组织病理学分析
从注射ConA后10小时牺牲的小鼠中取样的肝脏左叶进行组织学分析,采用苏木精和伊红(H&E)染色处理。
脾淋巴细胞的体外增殖及其促炎细胞因子产生的分析
通过密度梯度离心法使用Histopaque(Sigma)从C57BL/6j小鼠的脾脏中分离单核淋巴细胞。在96孔板中,将淋巴细胞(2×105/孔)用溶解在补充有10% FBS、l-谷氨酰胺和抗生素的RPMI培养基中的H2预处理(H2浓度为175、350和700μM)。然后在96孔板中的细胞与ConA(1μg/ml)反应或不反应24小时,并通过ELISA检测培养上清液中的TNF-α和IFN-γ。96孔板中的脾淋巴细胞进一步与[3H]胸腺嘧啶(0.5μCi)孵育最后16小时,总共48小时的培养,通过放射闪烁计数器监测处于增殖状态的细胞中结合的放射性(cpm)。
结果
H2是动物肠道中碳水化合物发酵的副产品。还证明,活体小鼠胃或肝脏中的H2浓度(约20-80μM)比氢的全细胞Km值高出20倍以上。基于这些证据,我们假设腹部器官中这种升高的H2水平来源于肠道细菌。为了验证这一假设,小鼠接受抗生素(磺胺甲恶唑和甲氧苄啶)治疗3天,然后休息2天,饮用水中不含抗生素。此后,通过在血琼脂平板上培养新鲜粪便确认了抗生素抑制肠道菌群的效果(对照未处理小鼠,1.6±0.5×Log109 CFU/g;抗生素处理小鼠,7.0±6.1×Log107 CFU/g)。图1A显示了不同器官中的H2量。盲肠中检测到的H2量最高,其次是小肠、大肠、肝脏、脾脏和血液。大脑中检测到了微量的H2。系统性给小鼠使用抗生素(磺胺甲恶唑和甲氧苄啶)显著降低了所有测试器官中检测到的H2量。从抗生素处理的小鼠采样的新鲜粪便的体外培养也显示出比对照未处理样本显著更低的H2产量(图1B)。这些数据证明了抗生素依赖性的H2变化,如通过小鼠器官的原位测量和粪便的体外培养所测,表明肠道导管以及肝脏和脾脏中的H2直接来源于常驻细菌。
为了探索产生H2的共生细菌在肠道导管中的存在是否影响小鼠对ConA诱导的肝损伤的敏感性,对预先用或不用抗生素处理的小鼠静脉注射ConA(15 mg/kg)(实验方案-A)。基线水平的ALT和AST在预先用或不用抗生素处理的小鼠组之间没有差异(图1C和D),表明抗生素未造成肝脏损伤。在2小时测量的血清中ALT和AST水平在接受抗生素的小鼠中显著升高,但与0小时测量的控制基线水平无差异(图1C和D)。肝脏的组织形态学分析也显示,与未经处理的对照组小鼠相比,经抗生素处理的小鼠组织损伤程度更严重(见补充数据1),这表明抗生素治疗增加了小鼠对ConA诱导的肝炎的易感性。换句话说,没有抗生素的情况下,肠道菌群的存在似乎足以防止ConA诱导的肝炎的发展。
如果由肠道细菌产生的H2负责保护肝脏免受ConA诱导的炎症,那么对经抗生素处理的小鼠外源性补充H2应该能下调对ConA挑战的炎症反应水平。为验证这一假设,经抗生素处理的小鼠接受了溶解有H2的水(口服)(实验方案-B)。如预期的那样,通过口服途径外源性应用的H2显著抑制了从ConA注射后6小时测量的经抗生素处理小鼠中的炎症性ALT和AST生物标志物(图2B和C)。重要的是,血清中的促炎细胞因子TNF-α和IFN-γ,这些是由激活的T细胞产生的,也通过在经抗生素处理的小鼠中应用H2而显著下调(图2D和E)。
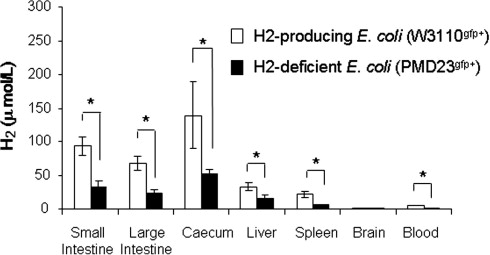
为了检查来自肠道细菌的H2对ConA诱导的肝损伤的影响,用两种不同的大肠杆菌株重建了预先用抗生素处理的小鼠,即(1)产生H2的大肠杆菌株W3110gfp+或(2)缺乏H2的大肠杆菌株PMD23gfp+;然后,静脉注射ConA(图3A,实验方案-C;图3B,W3110gfp+和PMD23gfp+产生的H2)。通过在含有氨苄西林的琼脂平板上培养从接受含氨苄西林饮用水的小鼠粪便中回收的GFP+细菌,确认了这两种大肠杆菌株在小鼠中的定殖。在被W3110gfp+定殖的小鼠的小肠和大肠、盲肠以及肝脏中检测到了较高量的H2,而被PMD23gfp+定殖的小鼠在这些器官中保留了低水平的H2(见补充数据2;可在线获取)。与携带PMD23gfp+的或对照小鼠相比,ConA注射后6小时收集的血清中ALT和AST水平在W3110株小鼠中显著降低(图3C和D)。血清中TNF-α和IFN-γ的水平也在携带W3110gfp+的小鼠中相比携带PMD23gfp+的或对照小鼠显著受到抑制(图3E和F)。因此,根据实验方案-A、-B和-C的结果,来自肠道细菌释放的H2似乎在抑制ConA注射引起的肝脏炎症中发挥了作用。
人们认为,从激活的T细胞释放的TNF-α和IFN-γ会引起ConA诱导的肝炎模型中的肝组织损伤。因此,为了探讨H2是否可以影响ConA刺激的T细胞中TNF-α和IFN-γ的产生,将脾脏单核淋巴细胞(MNL)在体外用ConA刺激,存在或不存在H2。如图4所示,培养基中存在H2显著抑制了MNL的增殖(图4A),以及与没有H2时用ConA刺激MNL相比,TNF-α和IFN-γ的产生(分别为图4B和C)。值得注意的是,单独的H2既不影响未经刺激的MNL的增殖,也不影响IFN-γ的产生。因此,这项体外研究强烈支持了H2可以抑制ConA介导的T细胞激活,从而导致组织破坏性的TNF-α和IFN-γ的产生这一假设。
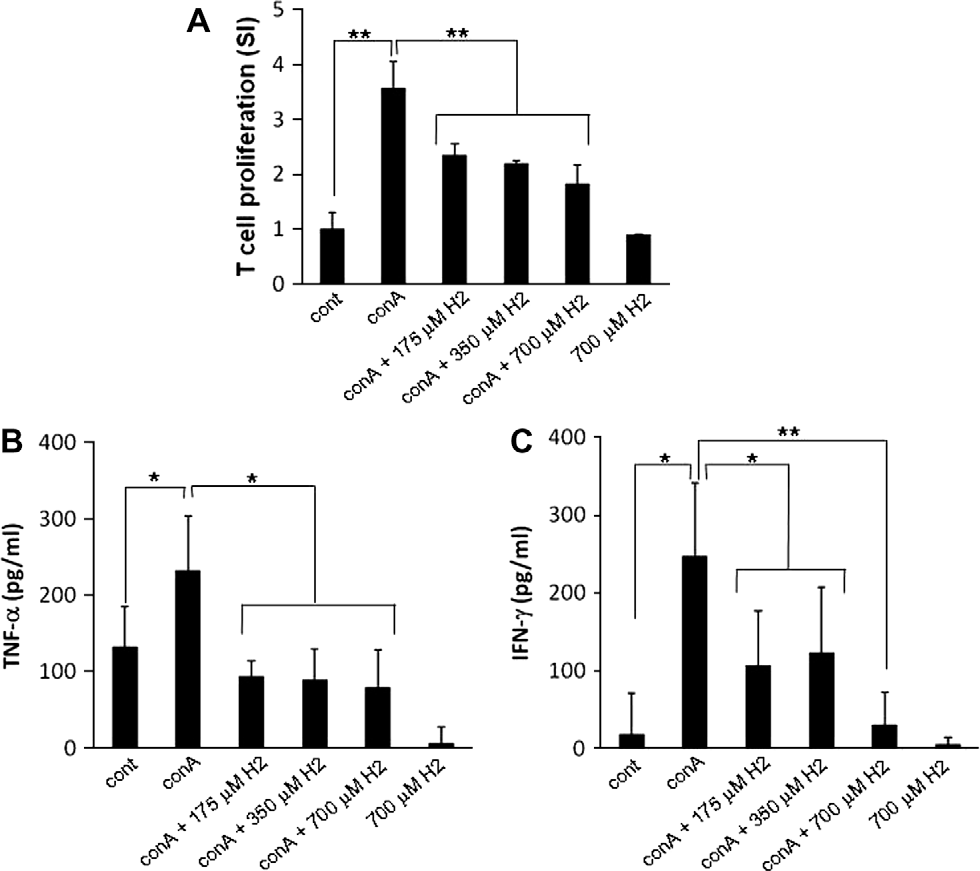
图4. H2对ConA刺激的淋巴细胞炎症反应的体外影响。从C57BL/6小鼠脾脏中分离的单核淋巴细胞,用溶解有H2的介质预处理,浓度分别为175、350和700μM,在96孔板中处理1小时。然后,细胞与ConA(1μg/ml)反应或不反应24小时,以使用ELISA测量促炎细胞因子的表达,或48小时以通过[3H]胸腺嘧啶掺入实验评估增殖。淋巴细胞的增殖(A)和培养上清液中TNF-α和IFN-γ的产生(B和C)以直方图显示。SI(刺激指数):受刺激细胞的cpm与未受刺激细胞的cpm之比。柱状图和条形图表示三个不同培养物的相应值的平均值±标准差。∗p<0.05, ∗∗p<0.01:值差异显著(t检验)。
讨论
累积的证据表明,肠道常驻细菌在其与宿主的共生关系背景下具有宿主保护功能。然而,支持这种细菌介导的宿主保护功能的机制尚不清楚。一些研究表明,无菌小鼠的肠道血液系统与常规小鼠相比血管化程度较差,这表明肠道共生细菌可以影响宿主稳态血管生成的发展。然而,由于来自肠道常驻细菌产生的H2对小鼠Concanavalin A诱导的肝炎显示出抗炎作用,本研究展示了一种由肠道定殖细菌介导的新型抗炎机制。如果H2从肠道细菌释放确实在抑制ConA注射引起的肝脏炎症中发挥作用,正如我们的协议A、B和C所展示的,那么由共生细菌促进的微毛细血管网络可能促进了H2通过血流的运输是合理的。
值得注意的是,口服给药的H2的抗炎效果高于从肠道细菌释放的H2。通常情况下相反,因为细菌在肠道消化物中不断释放H2(约1g/小鼠),而总水量消耗约为2ml/天/小鼠,所有来自饮用水的H2立即从胃中扩散。因此,我们研究中从肠道细菌释放的H2的相对低的抗炎效力最有可能归因于其他存在于肠道粘膜深处或胃中的细菌,如报道消耗大量H2的肝螺杆菌,清除了H2。为了证明这一假设,需要对口腔胃肠道粘膜中产生或消耗H2的细菌进行详细分析。
尽管大多数先前研究H2的生物学效应集中在由器官如肝脏和大脑的缺血再灌注引起的氧化组织损伤上,但H2是否也能影响淋巴细胞激活引起的炎症尚不清楚。因此,这项研究的新颖之处在于发现来自共生细菌产生的氢气(H2)似乎抑制了ConA刺激的淋巴细胞产生的促炎细胞因子TNF-α和IFN-γ的组织破坏性产生。此外,ROS可以通过上调NF-kB信号通路来激活TNF-α表达,同时,它还可以激活NADPH-氧化酶(NOX)表达,该酶从NADPH产生ROS。因此,炎症和氧化过程是相互关联的。ROS和炎症之间的这种多重交叉反应表明,H2介导的对ConA刺激的淋巴细胞中TNF-α和IFN-γ的抑制也可能涉及H2的抗氧化作用。
总之,本研究表明,来自肠道定殖细菌释放的H2可以抑制Concanavalin A诱导的肝脏炎症,全身抗生素治疗可能会改变肠道中保护性共生菌群的数量,最终导致肝脏中存在的H2浓度降低。由于大多数哺乳动物缺乏产生H2的分解酶,肠道细菌是肝脏中保护性H2的唯一可能来源。实际上,共生细菌在宿主防御中的作用之一可能由常驻菌群产生抗炎H2的能力定义。因此,外源性因素,如引入抗生素,可能会影响H2的功能量,从而影响生物体对疾病的易感性。
附属材料
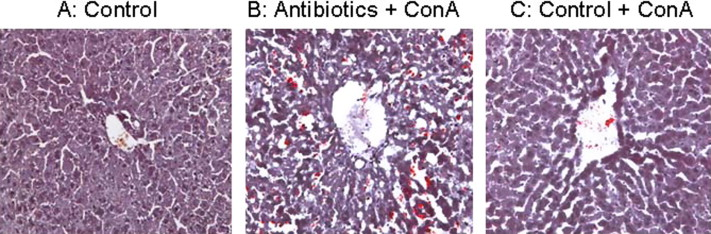
补充数据。小鼠肝脏的组织学评估。从以下来源取样的肝脏:(A) 未接受抗生素的正常小鼠,(B) 在Con A注射后10小时接受抗生素治疗的小鼠,以及(E) 在Con A注射后10小时的对照组未处理小鼠,切片并用苏木精-伊红(HE)染色(原始放大倍数200×)。
补充数据。重建的大肠杆菌菌株对不同器官中H2浓度的影响。用抗生素预处理的小鼠通过两种不同的大肠杆菌菌株进行重建,即(1) 产生H2的大肠杆菌菌株W3110gfp+或(2) 缺乏H2的大肠杆菌菌株PMD23gfp+(实验方案-C)。使用针式氢传感器在第1天测量不同器官中的H2浓度(每组n=3)。∗p<0.05:括号指示的列之间的值差异显著(t检验)。
https://wap.sciencenet.cn/blog-41174-1442472.html
上一篇:氢气抗氧化人体试验证据
下一篇:极限户外技能增强科学考察工作