博文
衰老神经元驱动的大脑衰老
||
衰老是一种程序化的细胞响应,可以在受到压力后被激活,并以细胞状态的显著变化达到高潮。面对不可修复的损伤,特别是在疾病或与慢性衰老相关的伤害期间,许多细胞要么经历程序化细胞死亡(凋亡),要么转变为抗凋亡的非增殖性衰老状态。了解细胞衰老的条件已经从对增殖耗竭的狭窄反应转变为一种多样化、普遍的策略,以管理分子损伤;调动对策;并保持组织结构、功能和生物体健康。然而,在老年个体中,衰老细胞积累到如此程度以至于它们导致组织功能障碍。特别是,最近的研究表明,尽管神经元是后有丝分裂的且不能经历典型的增殖停滞,但它们仍会经历衰老。神经元衰老主要在疾病和神经退行性疾病的情况下观察到,可能会将衰老的神经元置于人脑健康衰老和疾病之间的阈值上。
神经元衰老是由各种与衰老相关的压力形式诱导的状态转变——包括DNA损伤、活性氧物种(ROS)或肿瘤信号传导——这导致一个代谢活跃但信息处理能力不足的神经元。神经元衰老的初始压力响应阶段最终进展到成熟的衰老状态,伴随着表观遗传和形态重构、代谢重编程以及发展出一种称为衰老相关分泌表型(SASP)的炎症性细胞因子和趋化因子混合物,它可以激活周围的细胞,包括星形胶质细胞和小胶质细胞。在神经元这种自出生以来就是后有丝分裂的细胞类型中发现了衰老现象,这是令人惊讶的,因为长期以来增殖停滞被认为是衰老状态的核心。
人类大脑中的神经元种群多样且复杂,目前正在努力开发一个完整的大脑细胞图谱。鉴于这种多样性,是否有特定的神经元亚型容易衰老?最常报道的亚型是来自皮层区域的兴奋性神经元,特别是前额叶皮层。通常在神经退行性疾病中观察到衰老神经元,主要是阿尔茨海默病(1-4),但也在其他条件中观察到,包括进行性核上性麻痹(4)和高胰岛素血症(5)。在一个使用老化的人皮层神经元的体外模型中,表达谷氨酸的兴奋性细胞比表达γ-氨基丁酸(GABA)的抑制性细胞更频繁地衰老(3),并且对人类大脑的单细胞分析确定皮层兴奋性神经元是最常见的衰老神经元亚型(2)。皮层神经元在正常衰老过程中也容易衰老,没有疾病成分,正如在大鼠皮层神经元(6)、老年小鼠锥体神经元(7)和老年小鼠钙结合蛋白表达神经元(8)中所观察到的。
影响更特定神经元亚群的疾病可以表现出衰老表型,如帕金森病中人类诱导多能干细胞(iPSC)衍生的多巴胺能中脑神经元(9, 10)或人类和小鼠急性物理损伤部位周围的神经元(11, 12)。小脑中的衰老不太清楚,小鼠在衰老或DNA损伤时观察到衰老(8, 12),但这些细胞在很大程度上缺席于人类大脑范围内识别衰老神经元的努力(13)。衰老神经元与受疾病影响区域的共定位表明,病理机制起始于和/或促进神经元衰老。鉴于研究神经元衰老的研究相对较少,其他与衰老相关的压力因素可能会触发非兴奋性或皮层亚型的衰老。
一个主要挑战是建立衰老的特定、通用标记。由于衰老表型的固有复杂性和可以衰老的各种细胞类型,目前接受的策略是多标记方法。这种方法导致了许多不同的表型被归类为神经元衰老的标记,其中一些在衰老之外的状态下也被观察到。
神经元衰老最常见的标志之一是表达细胞周期依赖性激酶抑制剂,包括p21、p16和p19。p21在帕金森病患者、脊髓损伤和高胰岛素血症患者的体外诱导多能干细胞(iPSC)衍生的衰老神经元中表达,以及在体内含有DNA双链断裂(DSBs)的小鼠神经元中和经过长时间体外培养的啮齿动物和人类神经元中表达(1, 5, 6, 9-11)。最初,人类衰老神经元中的p21表达较高,但在晚期衰老时随着形态变化和其他特征如SASP的发展而降低,这突出了表型的暂时异质性(3)。p16的表达在小鼠和人类iPSC衍生神经元的神经元衰老中经常被观察到(3-5, 7, 12, 13),但不必然如此(1, 9, 10)。p19已在阿尔茨海默病患者的人类神经元衰老中报道(13)。
DNA损伤的标志物也在神经元衰老中显著,如DNA双链断裂标记物磷酸化组蛋白H2AX(γ-H2AX)的存在(1, 4, 6, 8)、核大小(3, 9, 13)或结构(6, 9, 13)的变化,以及表观遗传重构和形成与衰老相关的异染色质焦点(6, 8)。溶酶体酸化和溶酶体衰老相关β-半乳糖苷酶已在许多神经元衰老研究中报道(3, 5, 6, 8-11),尽管由于神经元与增殖细胞之间在溶酶体生物学上的本质差异,这些作为神经元衰老标志物的最终可靠性尚不清楚。
神经元是非常长寿的细胞,具有高代谢需求,伴随着活性氧物种(ROS)的产生。这些代谢需求需要依赖于自噬来回收氧化的大分子结构和细胞器。因此,自噬受损可以导致ROS诱导的损伤积累和随后的大鼠神经元体外衰老响应(6)。相反,缺乏自噬诱导的GATA结合蛋白4(GATA4)表达的抑制,一种参与先天免疫信号传导的转录因子,可以促进神经元SASP(7)。神经元的代谢需求也使它们通过线粒体机制容易衰老(3-5, 9, 10)。最近对老年人类细胞培养模型的研究表明,与衰老人类神经元中的衰老相关的氧化磷酸化受损(3, 14),并且葡萄糖代谢受损最终导致细胞周期机器的重新激活,随后是小鼠中的神经元衰老(5)。一致地,氧化磷酸化与电子传递解耦和ROS增加已被提议为神经元衰老的标志物(8),线粒体功能障碍是帕金森病神经元衰老的核心组成部分(9, 10)。
衰老相关压力触发衰老
神经元在生命早期从神经干细胞经历终端分化,随后永久停止细胞周期。结果,神经元经历了一生的与年龄相关的压力,最终在生命的晚期以一个衰老表型的亚群达到顶峰。尽管是非增殖性的,衰老神经元表现出与其他衰老相关的常见表型。
因为神经元衰老在神经退行性疾病的背景下比健康衰老更常见,代谢改变可能是神经退行性发病机理中的早期表型变化,所以衰老似乎是承受次优或高ROS产生的代谢环境的补偿机制。在这种脆弱状态下,增加生物合成的糖酵解中间产物或氧化损伤可能会诱导具有特别高能量需求的细胞类型——神经元进入衰老状态。长期的衰老随后可能导致由于SASP释放和不可逆转的神经炎症对周围细胞累积效应而导致的神经退行性疾病(见图)。
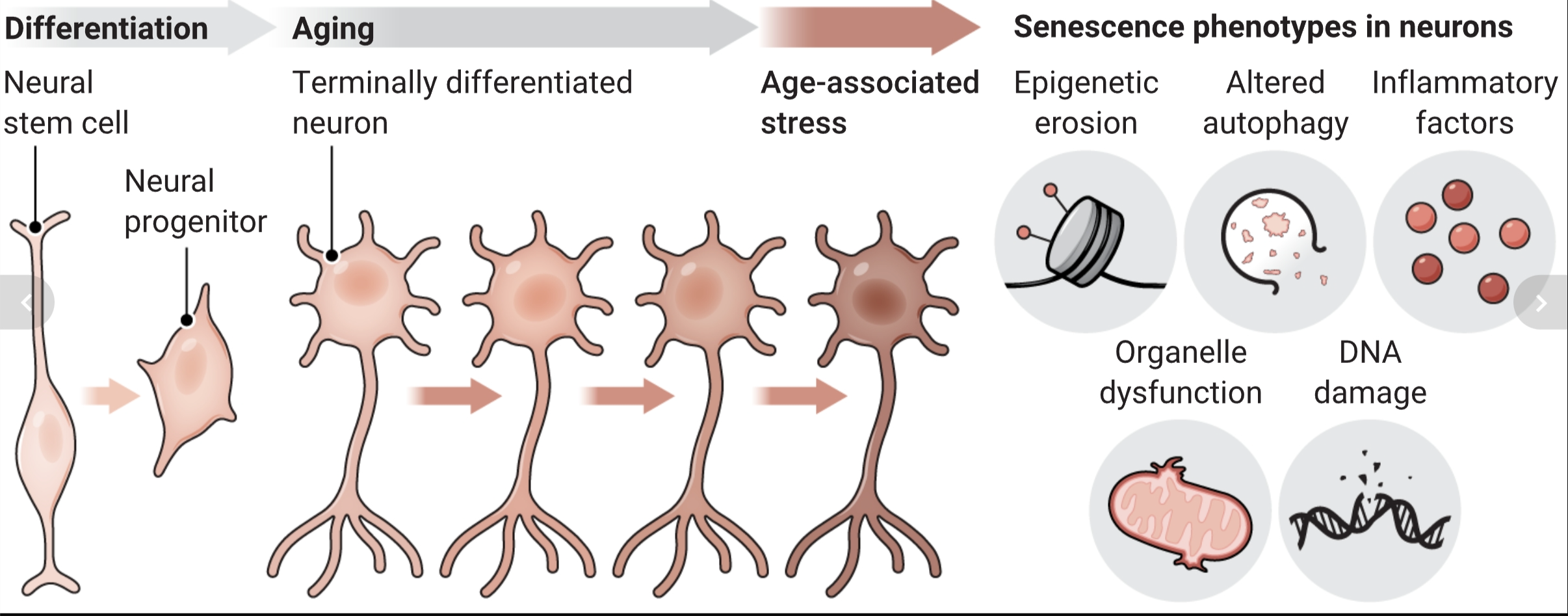
有什么证据表明影响邻近细胞的神经元SASP参与脑疾病发病机理?在老年死后人脑中,表达p16的神经元和胶质细胞最显著地围绕着p16阳性的成熟神经元聚集(3)。许多SASP因子吸引免疫细胞,并且已报告微胶质在体外由人类iPSC衍生的帕金森病神经元或含有DSB的小鼠神经元中被衰老神经元激活(1, 10)。在阿尔茨海默病小鼠模型中,通过选择性化学清除衰老细胞(senolysis)后,微胶质的激活也有所减少(4)。此外,来自衰老神经元培养基的处理在星形胶质细胞中触发了反应性表型(3),并在体外诱导了原发性大鼠神经元的过早衰老(6)。在大脑衰老和疾病期间也观察到衰老胶质细胞数量增加,神经元SASP可能是这些细胞中触发衰老的压力源。
在神经元中报道的SASP因子是多样化的,并且很可能根据衰老的时间阶段、细胞类型、模型系统以及衰老启动因子的性质而有所不同。白细胞介素-6是一种广泛观察到的神经元SASP因子,包括在人类阿尔茨海默病脑脊液和体外神经元中,老年大鼠神经元体内外,人体和小鼠中风后的神经元,以及带有DSBs的小鼠神经元(3, 6-8, 12)。然而,它在帕金森病患者的人类iPSC衍生神经元、高血糖小鼠和小鼠脊髓损伤模型的神经元衰老中却未被观察到(5, 9, 11)。各种趋化因子也涉及神经元SASP。C-C基序趋化因子配体2(CCL2)是DSB和自噬诱导的神经元衰老中的主要SASP因子(1, 6),其表达在senolysis后减少(11)。自噬诱导的神经元衰老中一个关键的累积转录因子GATA4,在另一项DNA损伤诱导的神经元衰老研究中被提及(7),这表明CCL2(一个GATA4目标)也可能在小鼠DNA损伤后在体内释放。细胞内在的免疫反应似乎是神经元SASP维持的一个可能机制,无论是通过DNA损伤响应信号(1)、GATA4活性(7)还是核因子κB(NF-κB)信号传导(4)。然而,许多其他SASP因子可能还有待发现,识别那些介导免疫或胶质细胞激活的关键特征非常重要,这些特征可能在病理发生中发挥作用。
衰老细胞是缓解与年龄相关衰退的主要目标。那么,是否可以用治疗药物针对衰老神经元来治疗脑部疾病呢?衰老神经元对senolytics敏感,这是一类选择性诱导衰老细胞凋亡的多样化药物。例如,达沙替尼和槲皮素的组合杀死了包括人类阿尔茨海默病和帕金森病神经元在内的衰老细胞,以及老年转基因小鼠中的含有神经纤维缠结tau蛋白的神经元(3, 4, 9)。然而,这种组合的最近临床试验显示槲皮素的脑穿透性低,这限制了其有效性(15)。许多senolytics的穿透性尚未经过测试,但大于500 Da的那些不太可能穿过血脑屏障(BBB)。其他药物已显示出作为衰老神经元的senolytics的前景。在高血糖小鼠模型中,调节胰岛素释放的2型糖尿病药物利拉鲁肽减少了衰老神经元的数量(5);促进凋亡的B细胞淋巴瘤2(BCL-2)抑制剂ABT-263清除了小鼠脊髓损伤后的衰老神经元(11);促进自噬的阿奇霉素或抗氧化剂黄酮素菲赛汀消除了体外的衰老多巴胺能人类iPSC衍生神经元(9)。老年阿尔茨海默病患者来源的神经元比认知正常个体的神经元更容易被BCL-2抑制剂ABT-737在体外清除(14),但健康的iPSC衍生多巴胺能神经元也在体外受到ABT-737的影响(9)。这强调了未来工作需要完全定义衰老神经元依赖的生存途径,以便可以特异性针对它们。
在小鼠中,通过饮食限制(8)或给予促进自噬的二糖海藻糖(6)间接减少了神经元衰老,这两者都可以被视为逆转衰老表型的senomorphic(能够逆转衰老表型的药物),这是消除不可替代的衰老神经元的一种替代策略。对于senolytics和senomorphics的体内研究,一个重要的考虑是这些药物对这些结果的直接或间接影响的贡献,因为清除非神经元性衰老细胞可能解释了一些益处。定义的体外模型可能是测试抗衰老药物直接效果的一个有用方法(3)。在这一领域已经取得了进展,包括维持年龄的转分化策略、引入促进衰老的遗传变异,以及通过药物治疗或早老蛋白突变加速老化。
迄今为止收集的关于神经元衰老的证据指向持久的衰老神经元在触发老年大脑病理发生中的因果关系。因此,准确识别并针对衰老神经元代表了干预与年龄相关疾病的一个机会,这是一个将受益于继续调查神经元衰老遗传标记物的领域。此外,神经元衰老的确切特征是否具有致病性仍然没有完全解决,未来的工作应该解决哪些变化是最重要的,或者是否有任何变化提供生理益处。除了体内发展之外,产生老年人类有丝分裂后细胞的新体外技术构成了研究衰老和测试针对衰老的干预措施的令人兴奋的新模型。对未来神经元衰老的研究和理解将有助于开发更先进和精确的抗衰老疗法,考虑到许多社会迅速老龄化以及对与年龄相关疾病的治疗干预的巨大需求,这是一个及时的事件。
https://wap.sciencenet.cn/blog-41174-1440168.html
上一篇:最完美的杀虫剂RNAi
下一篇:动物体内氢气释放规律研究方法