博文
氢水处理对紫外线辐射大豆异黄酮富集的影响和机制研究
||
氢水处理对UV-B辐射发芽大豆异黄酮富集和机制研究
本研究表明:
H2缓解了UV-B对发芽大豆生长压力。
在UV-B压力下,H2处理参与调节发芽大豆代谢物。
H2在UV-B压力下参与调节发芽大豆抗氧化系统。
在UV-B压力下,H2处理促进了发芽大豆异黄酮的富集。
在UV-B压力下,H2处理促进了苷元向苷元的转化。
论文摘要
本研究调查了氢气(H2)处理在紫外线B(UV-B)辐射下对发芽大豆的生长状况、抗氧化系统、代谢物变化以及异黄酮含量和组成的影响。结果显示,与单独UV-B相比,H2通过调节代谢物(核苷酸、脂肪、氨基酸、激素和神经递质)的含量及相关代谢途径,促进了发芽大豆的生长。H2通过直接与活性氧物质结合或介导抗氧化系统来抵抗UV-B压力。苯丙氨酸解氨酶、肉桂酸-4-羟化酶和4-香豆酸辅酶A连接酶活性和基因表达的增加,促进了异黄酮的富集,并通过降低异黄酮7-O-葡萄糖基转移酶和异黄酮7-O-葡萄糖苷-6″-O-丙二酰基转移酶的活性和基因表达,促进了苷元向苷元的转化。这些结果在一定程度上解释了H2处理缓解UV-B压力、促进发芽大豆生长和富集异黄酮(尤其是苷元)的可能原因。
Xu, W., Li, M., Li, W., Liu, H., Xu, X., yang, T., Ma, M., Effect of H2 treatment
under UV-B irradiation on the enrichment of germinated soybean isoflavones and mechanisms based on
growth state, antioxidant system, and metabolomics, LWT - Food Science and Technology (2024),
1引言
大豆作为全球重要的粮食作物具有显著的地位。它不仅富含蛋白质和脂质,还含有多种生物活性化合物,如异黄酮、生育酚和大豆皂苷,因此引起了人们的关注。作为大豆中的主要酚类化合物,异黄酮被认为是对外源性刺激作出反应的产物。异黄酮不仅可以预防乳腺癌、心血管疾病、骨质疏松症或更年期症状,还可以作为人体的抗氧化剂,从而防止组织氧化损伤。异黄酮是通过苯丙烷途径的一个分支合成的,其中苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)和4-香豆酸辅酶A连接酶(4CL)是异黄酮合成的关键酶。大豆异黄酮主要包括九种单体,根据其结构可分为三类:苷元、糖苷和丙二酰基糖苷(丙二酰基大豆苷、丙二酰基染料木苷和丙二酰基甘油苷)。这三种类型的异黄酮具有不同的抗氧化能力,其中苷元具有最高的抗氧化能力。异黄酮苷元和糖苷之间会发生相互转化。β-葡萄糖苷酶(β-GC)、异黄酮7-O-葡萄糖基转移酶(IF7GT)和异黄酮7-O-葡萄糖苷-6″-O-丙二酰基转移酶(IF7MaT)在异黄酮苷元和糖苷之间的转化中起着重要作用。其中,β-GC断裂β-糖苷键,使糖苷转化为具有更高生物活性的苷元。IF7GT和IF7MaT是异黄酮苷元向糖苷转化的关键酶。
大豆发芽过程可以富集异黄酮。然而,仅仅发芽过程并不能显著增加异黄酮的含量。因此,如何在大豆发芽过程中进一步富集异黄酮已成为热门研究话题。
紫外线B(UV-B)辐射作为一种物理诱导技术,由于其绿色、清洁和非污染特性,在植物次生代谢产物的合成中被广泛应用,例如酚类化合物、生物碱和硫苷。UV-B辐射已被证明可以在大豆发芽期间促进异黄酮的富集。然而,UV-B诱发的反应性氧物种(ROS)可能对植物的生长状态和细胞膜的稳定性造成不同程度的损害。
近年来,氢气(H2)作为选择性抗氧化剂和信号分子受到了广泛关注。H2是植物中的活性物质,不仅对种子萌发、幼苗生长和根伸长有积极影响,还通过增强抗氧化酶的活性来提高植物对压力的抵抗力,如超氧化物歧化酶(SOD)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)和过氧化氢酶(CAT)。H2在植物抵抗多种压力中发挥着重要作用。向处于盐胁迫、干旱胁迫和镉胁迫下的植物引入外源性H2,已显示出可以改善植物在压力下的生长和发育。同时,H2可以改变植物的化学分布,从而促进营养素(例如,游离香草酸和γ-氨基丁酸)的富集。
然而,H2处理在UV-B辐射下对发芽大豆异黄酮含量和组成的影响仍不清楚,且H2处理在异黄酮含量和组成方面的调节机制尚未研究。
2材料与方法
2.1. 植物材料和实验设计
大豆种子为东农690品种,并存储在−80 °C环境中。在发芽前,称重26g种子并用蒸馏水冲洗3次,然后在蒸馏水中浸泡7小时,最后放置在发芽器(DYJ-A03, Gamoy, 中国)中进行发芽。
(1) 对照组:大豆在黑暗中以30 °C的温度生长,并喷洒蒸馏水,每24小时更换一次。
(2) UV-B组:发芽期间,将8瓦的UV-B灯置于距离发芽机50厘米的上方。喷洒蒸馏水的方法与(1)一致。
(3) H2组:发芽的大豆用0.5 mg/L的H2溶液处理。喷洒方法与(1)一致。
UV-B + H2组:发芽期间,将8瓦的UV-B灯置于距离发芽机50厘米的上方,并且发芽的大豆用0.5 mg/L的H2溶液处理。处理方法与(2)和(3)一致。
样品在大豆发芽的第2天(2 d)和第4天(4 d)收集。第一组样品立即用于确定生理指标。第二组样品放入冻干机(alpha 1–2, Christ, Germany)中进行冻干,然后取出研磨并存放在−20 °C的冰箱中,以备后续指标的测定。第三组样品用液氮快速冷冻,然后存放在−80 °C的超低温冰箱中,以备后续指数测量。
2.2. 异黄酮含量的测定
使用高效液相色谱仪(HPLC, UItiMate 3000, Thermo Fisher Scientific, Shanghai, China)和C柱(UItiMate5 μmAQ-C18®120 Å, 250 × 4.6 mm, Welch, China)来检测异黄酮。首先,将冻干的发芽大豆用高通量组织研磨器(JXFSTPRP-CL, Shanghai Jingxin Industrial Development Co., Ltd.)研磨成粉末状,然后取0.2 g大豆粉加入6 mL的800 mL/L甲醇溶液中,于40 °C下超声溶解60分钟。混合溶液在4 °C下以11,000 g离心40分钟。提取上清液并通过0.45 μm微孔过滤器过滤,将过滤后的溶液(20 μL)加载到HPLC分析仪上。使用1 mL/L乙酸溶液作为A相和1 mL/L乙酸乙腈溶液作为B相。B相的洗脱梯度为0-50分钟时13-35%,50-51分钟时35-13%。流速为1 mL/min,UV检测器的波长为260 nm。
2.3. PAL、C4H和4CL活性的测定
将0.2 g发芽大豆样品加入到2 mL提取缓冲液中,并在4 °C下研磨成匀浆(pH 8.8, 50 mM钠硼酸缓冲液,40 g/L PVP,2 mM EDTA,和5 mM β-巯基乙醇)。将匀浆在4 °C下以12,000 g离心20分钟,上清液用于酶活测定。PAL活性采用Han等人(2017年)描述的方法进行分析。C4H(BC4080, Solarbio, Beijing, China)和4CL(BC4220, Solarbio, Beijing, China)活性均使用活性测定试剂盒进行测量。
2.4. β-GC、IF7GT和IF7MaT活性的测定
β-GC活性使用400 nm活性测定试剂盒(BC2560, Solarbio, Beijing, China)进行测量。IF7GT和IF7MaT的活性使用酶联免疫吸附测定(ELISA)(Ric biology, Hebei, China)在450 nm处进行测量。
2.5. 生理参数的测定
在不同的实验组中分别测量了培养两天和四天的发芽大豆的长度(cm)、鲜重(g)和干重(g)。鲜重使用分析天平(AX2202ENH, Ohaus Instruments, China)进行测量。将发芽大豆使用真空冻干机(Pilot 3-6E, Beijing Boyikang Experimental Instrument Co., Ltd.)冻干以确定其干重。
2.6. 测定活性氧(ROS)含量
取0.1克发芽大豆,加入1毫升丙酮进行冰浴匀浆,然后在4°C下以10,000 g离心30分钟。根据过氧化氢试剂盒(北京Solarbio科技有限责任公司)的指导,在415 nm处检测过氧化氢的含量。将0.1克发芽大豆与1毫升50 mM磷酸钾缓冲液(pH 7.8)在冰上匀浆,然后在4°C下以10,000 g离心30分钟。根据超氧阴离子试剂盒(北京Solarbio科技有限责任公司)的指导,在530 nm处检测超氧阴离子的含量。根据·OH试剂盒(上海同蔚实业有限公司)的指导检测·OH。
2.7. 测定丙二醛(MDA)和电解质泄漏率(EL)
根据M. Yao等人(2021年)的方法分析MDA。将新鲜发芽大豆样品(0.2克)在2毫升100 g/L三氯乙酸溶液中适当研磨,并在4°C下以10,000 g离心20分钟。取1毫升上清液与1毫升0.05 M NaOH溶液(含6.7 g/L硫代巴比妥酸)反应。混合物然后在水浴中加热至100°C持续20分钟,以10,000g离心20分钟,并立即冷却。使用酶标仪读取上清液在450、532和600 nm处的吸光度。
EL的测定方法如文中所述。取2个新鲜发芽的大豆芽,切成5 mm长,放入试管中并加入40毫升蒸馏水。将试管放在水浴中(32°C,2小时)。使用电导率仪测定电导率(EC1)。然后将试管放入沸水浴中(100°C,20分钟)。冷却后,使用电导率仪测定最终电导率(EC2)。EL通过以下公式计算:
2.8. ROS分布分析
根据Ma等人(2022年)的描述,使用共聚焦激光扫描显微镜(TCSsp5Ⅱ, Agilent Technologies Inc., USA)检测发芽大豆中的过氧化氢分布。将大豆发芽成100 μm切片,并在黑暗中用25 μM 2′,7′-二氯二氢荧光素二乙酸酯溶液孵育1小时。洗涤后,使用磷酸盐缓冲液(4°C)观察样品。激发波长为488 nm,发射波长为515 nm。
2.9. 抗氧化酶活性的测定
取0.1克发芽大豆样品,加入1毫升提取缓冲液(1 mM EDTA、0.05 g/mL聚乙烯吡咯烷酮和50 mM磷酸盐缓冲液)进行冰浴匀浆,然后在4°C下以12,000 g离心10分钟。使用SOD、POD、APX和CAT活性试剂盒分别检测SOD、POD、APX和CAT的活性。
2.10. 基因表达(实时定量PCR,qRT-PCR)
使用SteadyPure植物RNA提取试剂盒从发芽大豆中提取总RNA。使用TranScript® Green One-Step qRT-PCR SuperMix进行cDNA合成和RT-qPCR以验证基因表达(表S1)。PCR参数设置在CFX96 Touch实时PCR检测系统上。对于每个样本,进行三次PCR重复实验以进行实时定量分析。使用CFX Manager™软件进行相对定量分析。
2.11. 基于液相色谱-串联质谱(LC-MS)的非靶向代谢组学分析
2.11.1. 样品制备和提取
称取100毫克样品放入2毫升离心管中,加入600 μL甲醇(含有2-氨基-3-(2-氯苯基)丙酸)(4 mg/L)。混合物涡旋30秒,然后在55 Hz下研磨60秒。进行超声处理15分钟,并在4°C下以11,000转速离心10分钟。最后,将上清液用0.22 μm滤膜过滤,用于LC-MS检测。每组样品重复四次。QC样品制备:从待测样品中取部分混合成QC样品。QC样品重复10次。
2.11.2. 液相色谱条件
使用Vanquish UHPLC系统和ACQUITY UPLC® HSS T3(2.1 × 100 mm, 1.8 μm)进行LC分析。流速为0.3 mL/min,注射体积为2 μL。在LC-ESI(+)-MS分析中,流动相为(B2)乙腈中的1 mL/L甲酸和(A2)水中的1 mL/L甲酸。分离梯度为0–1分钟,8 % B2;1–8分钟,8 %–98 % B2;8–10分钟,98 % B2;10–10.1分钟,98 %–8 % B2;以及10.1–12分钟,8 % B2。代谢物的质谱检测是在配备ESI离子源的Q Exactive上进行的。
2.11.3. 质谱条件
采用MS1和MS/MS采集。参数如下:外壳气压力,40 arb;辅助气流量,10 arb;喷雾电压,ESI(+)和ESI(−)分别为3.50 kV和−2.50 kV;毛细管温度,325 °C;MS1范围,m/z 100–1000;MS1分辨率,70000 FWHM;每个周期的数据依赖性扫描次数,10;MS/MS分辨率,17500 FWHM;归一化碰撞能量,30 eV;动态排除时间,自动(Want等人,2013)。
2.11.4. 数据处理和多变量分析
原始数据首先通过ProteoWizard软件包中的MSConvert转换为mzXML格式(v3.0.8789),并使用XCMS进行特征检测、保留时间校正和对齐。应用稳健的LOESS信号校正(QC-RLSC)进行数据归一化,以纠正任何系统性偏差。归一化后,只有QC中相对标准偏差(RSD)小于30%的离子峰被保留,以确保正确的代谢物鉴定。
使用Ropls软件进行所有多变量数据分析和建模。数据经过均值中心化和缩放处理。模型基于主成分分析(PCA)、正交偏最小二乘判别分析(PLS-DA)和偏最小二乘判别分析(OPLS-DA)构建。差异代谢物通过MetaboAnalyst进行途径分析。
2.12. 统计分析
使用SPSS 22.0进行统计分析,采用单因素方差分析(ANOVA)、Duncan检验和双因素方差分析(two-way ANOVA)确定显著差异(P < 0.05)。所有实验均重复三次进行。
3. 结果
3.1. 长度、鲜重和干重
发芽第4天的大豆长度和鲜重高于第2天(图1A–B)。与对照相比,长度在第4天减少了34.7%(UV–B)和25.6%(UV–B + H2),但增加了13.1%(H2)(图1A)。鲜重减少了44.4%(UV–B)和29.6%(UV–B + H2),增加了13%(H2)(图1B)。发芽大豆的干重没有显示出显著差异(P < 0.05)(图1C)。处理(UV–B、H2和UV-B + H2)与发芽时间(第2天和第4天)的交互作用对发芽大豆的长度和鲜重有显著影响(P < 0.05),而对干重没有显著影响(P > 0.05)。进一步分析显示,UV-B、H2和UV-B + H2处理在第4天对长度和鲜重的影响大于第2天。
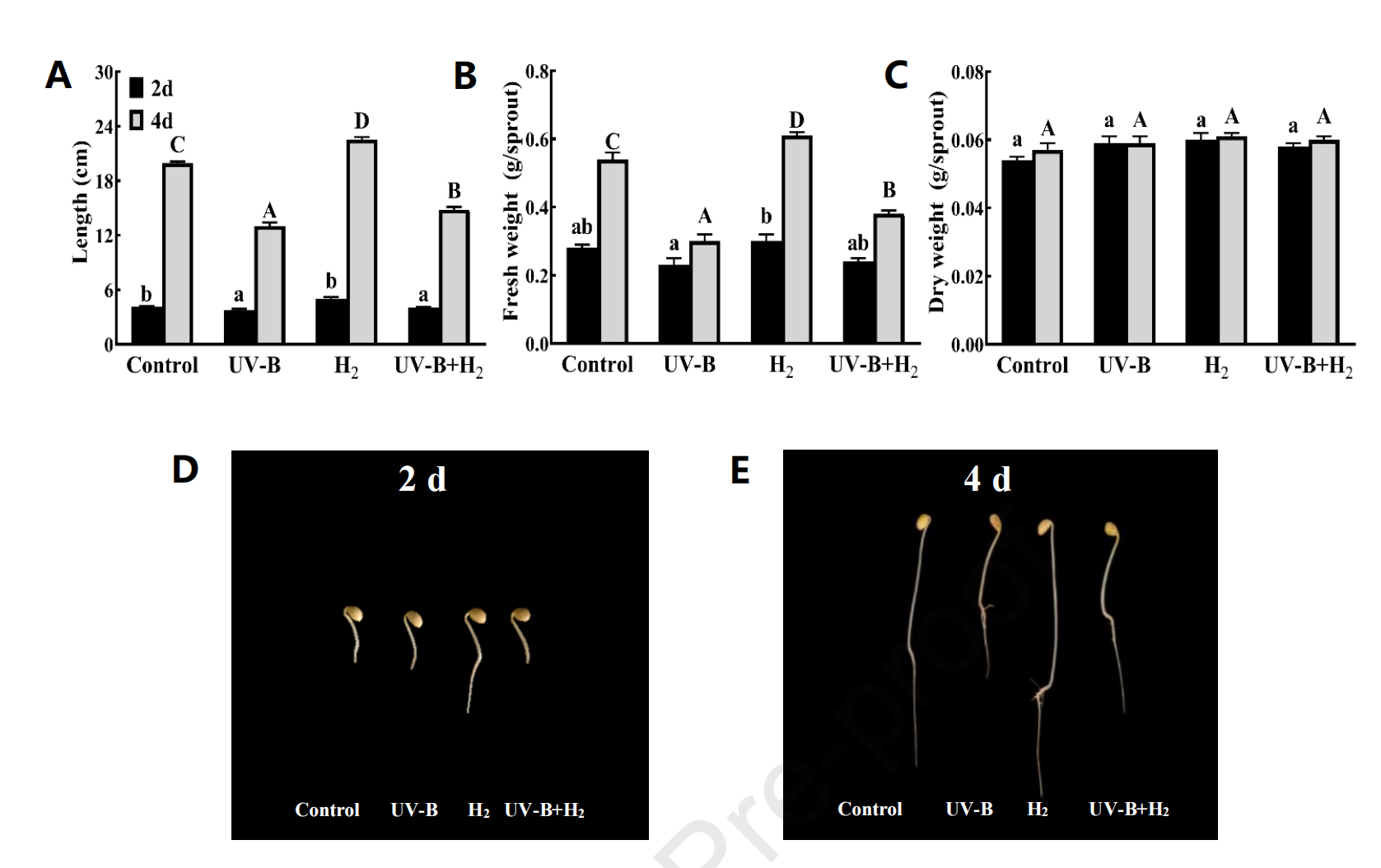
图1. H2能够缓解UV-B应激对发芽大豆生长的影响。发芽大豆的长度(A),鲜重(B),干重(C),以及第2天(D)和第4天(E)的发芽大豆图像。注:不同的小写字母代表不同样本在发芽2天后的显著差异。不同的大写字母代表不同样本在发芽4天后的显著差异(p < 0.05)。
3.2. 过氧化氢、超氧阴离子、·OH和MDA含量、EL以及ROS分布
H2处理在UV-B辐射期间对发芽大豆的过氧化氢含量、超氧阴离子含量、MDA含量和EL的影响如图2所示。第4天的过氧化氢、超氧阴离子、·OH、MDA和EL含量高于第2天。与第4天的对照相比,UV-B处理导致过氧化氢含量增加了42.6%,而H2处理使其减少了31.3%(见图2A)。超氧阴离子含量在UV-B处理下增加了63.3%,在H2处理下减少了13.3%(见图2B)。·OH含量在UV-B处理下增加了34%,在H2处理下减少了17%(见图2C)。MDA含量在UV-B处理下增加了18%,在H2处理下减少了6.2%(见图2D)。EL在UV-B处理下增加了16.2%,在H2处理下减少了11.1%(见图2E)(P < 0.05)。处理交互作用(UV-B、H2和UV-B + H2)和发芽时间(第2天和第4天)对发芽大豆中的过氧化氢、超氧阴离子和·OH含量有显著影响(P < 0.05),而对MDA含量和EL没有显著影响(P > 0.05)。进一步分析表明,H2处理在第2天对过氧化氢含量的影响高于第4天,而UV-B和UV-B + H2处理在第4天对过氧化氢含量的影响高于第2天。UV-B、H2和UV-B + H2处理在第4天对超氧阴离子和·OH含量的影响高于第2天。

图2. 在UV-B辐射下H2处理对发芽大豆中ROS含量和氧化损伤的影响。过氧化氢(过氧化氢) (A),超氧阴离子(超氧阴离子) (B),羟基自由基(·OH) (C),丙二醛(MDA) (D),和电解质泄漏(EL) (E)。使用共聚焦激光扫描显微镜分析发芽大豆中ROS的含量:对照第4天(F),UV-B第4天(G),H2第4天(H),和UV-B + H2第4天(I)。过氧化氢(过氧化氢);超氧阴离子(超氧阴离子);羟基自由基(·OH);丙二醛(MDA);和电解质泄漏(EL)。注:不同的小写字母代表不同样本在发芽2天后的显著差异。不同的大写字母代表不同样本在发芽4天后的显著差异(p < 0.05)。
使用荧光探针H2DCFDA检测UV-B辐射和H2处理的发芽大豆中ROS的积累情况,如图2F-I所示。与对照相比,单独UV-B辐射使得荧光强度增加,而添加外源H2后荧光强度减少。
3.3. SOD, POD, APX, 和CAT活性
如图3所示,发芽第4天的SOD、POD和CAT活性高于第2天,而APX活性在第2天的发芽中高于第4天。与第2天对照相比,APX活性增加了45%(UV-B)、75%(H2)和35%(UV-B + H2)(见图3C-1)。与第4天对照相比,SOD活性增加了12.7%(UV-B)、76.5%(H2)和22.5%(UV-B + H2)(见图3A-1)。POD活性增加了186%(UV-B)和20.4%(UV-B + H2);在H2处理下没有显著变化(P > 0.05)(见图3B-1)。CAT活性增加了21%(H2)和11.6%(UV-B + H2);在UV-B处理下没有显著变化(P > 0.05)(见图3D-1)。处理交互作用(UV-B、H2和UV-B + H2)和发芽时间(第2天和第4天)对发芽大豆中的SOD、POD、APX和CAT活性有显著影响(P < 0.05)。

图3. 在UV-B辐射下H2处理对发芽大豆中抗氧化酶活性和基因表达的影响。SOD(A),POD(B),APX(C),和CAT(D)。SOD,超氧化物歧化酶;POD,过氧化物酶;APX抗坏血酸过氧化物酶;和CAT,过氧化氢酶。注:不同的小写字母代表不同样本在发芽2天后的显著差异。不同的大写字母代表不同样本在发芽4天后的显著差异(p < 0.05)。
3.4. SOD, POD, APX, 和CAT基因表达
在UV-B辐射下H2处理对SOD(A-2)、POD(B-2)、APX(C-2)和CAT(D-2)基因表达的影响如图3所示。发芽第4天的SOD、POD和CAT基因表达高于第2天,而APX基因表达在发芽第4天低于第2天。与第2天对照相比,APX基因表达增加了200%(UV-B)、1350%(H2)和423%(UV-B + H2)(见图3C-2)。与第4天对照相比,SOD基因表达增加了306%(H2)和1190%(UV-B + H2)(见图3A-2)。POD基因表达增加了1500%(UV-B)、214%(H2)和234%(UV-B + H2)(见图3B-2)。CAT基因表达增加了223%(UV-B)、543%(H2)和327%(UV-B + H2)(见图3D-2)(P < 0.05)。处理交互作用(UV-B、H2和UV-B + H2)和发芽时间(第2天和第4天)对发芽大豆中APX和CAT基因表达有显著影响(P < 0.05),而对SOD和POD基因表达没有显著影响(P > 0.05)。
3.5. 异黄酮含量
如图4A所示,是在UV-B和H2处理下发芽大豆异黄酮的色谱图。图4B展示了在UV-B辐射下H2处理对发芽大豆总异黄酮含量的影响。发芽第4天的异黄酮含量高于第2天。在第2天发芽时,UV-B和H2对异黄酮的积累没有显著影响,而在UV-B + H2的处理下与对照相比增加了53.5%。在第4天发芽时,与对照相比,异黄酮含量分别增加了32.2%(UV-B)、18.1%(H2)和38.5%(UV-B + H2)(P < 0.05)。处理交互作用(UV-B、H2和UV-B + H2)和发芽时间(第2天和第4天)对发芽大豆的异黄酮含量没有显著影响(P > 0.05)。
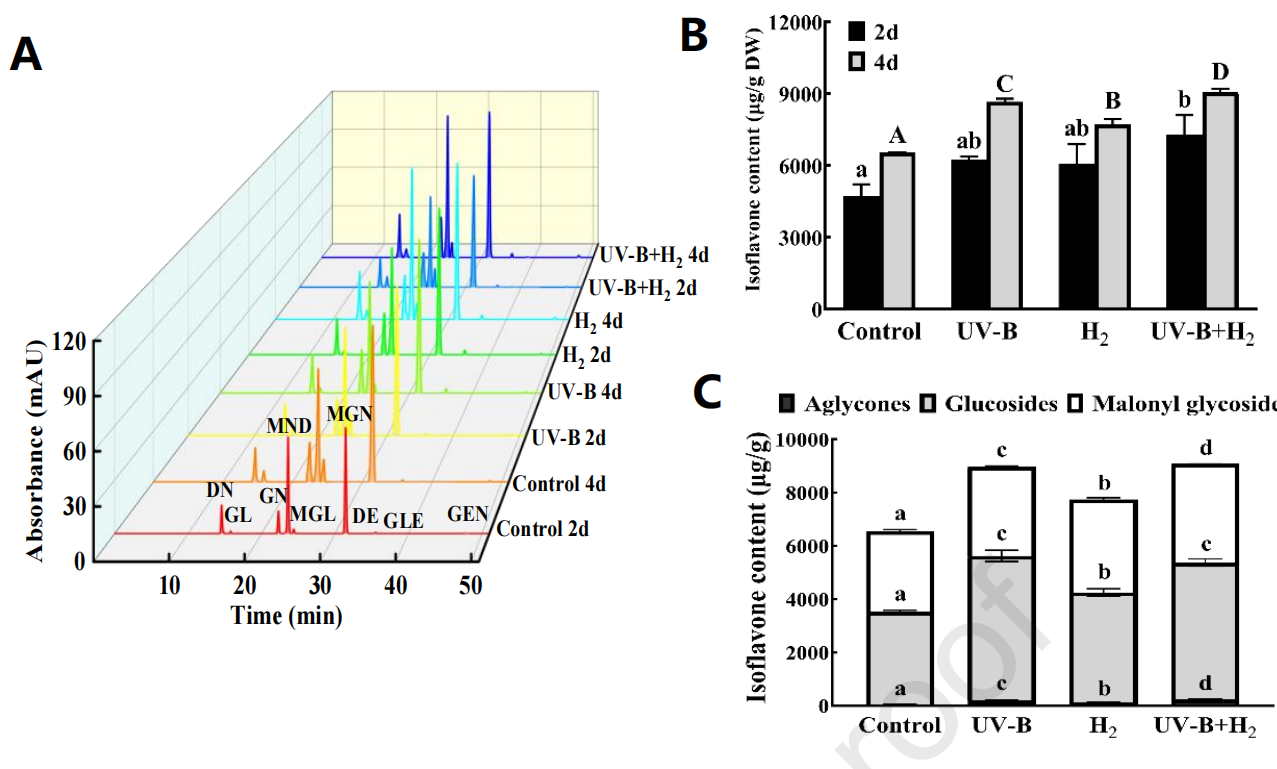
图4. 在UV-B辐射下H2处理增加了发芽大豆异黄酮的含量以及非糖苷型异黄酮占总异黄酮的比例。异黄酮的液相图像(A),发芽第2天和第4天大豆异黄酮含量(B),以及发芽第4天大豆异黄酮成分含量(C)。注:不同的小写字母代表不同样本在发芽2天后的显著差异。不同的大写字母代表不同样本在发芽4天后的显著差异(p < 0.05)。
如图4C所示,是第4天发芽时不同异黄酮类型含量的情况。在对照组中,非糖苷型异黄酮含量较低(59.74 μg/g),而糖苷型(3467.87 μg/g)和丙二酰基糖苷型含量(3028.14 μg/g)较高,占据了大部分。非糖苷型异黄酮含量分别增加了256%(UV-B)、116%(H2)和309%(UV-B + H2)。糖苷型含量分别增加了56.1%(UV-B)、19%(H2)和47.8%(UV-B + H2)。丙二酰基糖苷型含量分别增加了10.3%(UV-B)、15.2%(H2)和22.6%(UV-B + H2)(见表S2)(P < 0.05)。
3.6. PAL, 4CL, 和 C4H 活性
如图5A–C所示,是异黄酮合成途径中关键酶的活性。发芽第4天的PAL、C4H和4CL活性高于第2天。与第4天对照相比,PAL活性分别增加了80%(UV-B)、33.3%(H2)和100%(UV-B + H2)(见图5A–1)。C4H活性分别增加了16.5%(UV-B)、17%(H2)和20.9%(UV-B + H2)(见图5B–1)。4CL活性分别增加了84.7%(UV-B)、33.7%(H2)和151%(UV-B + H2)(见图5C–1)(P < 0.05)。处理(UV-B、H2和UV-B + H2)和发芽时间(第2天和第4天)的交互作用对发芽大豆的PAL和4CL活性有显著影响(P < 0.05),而对C4H活性没有显著影响(P > 0.05)。
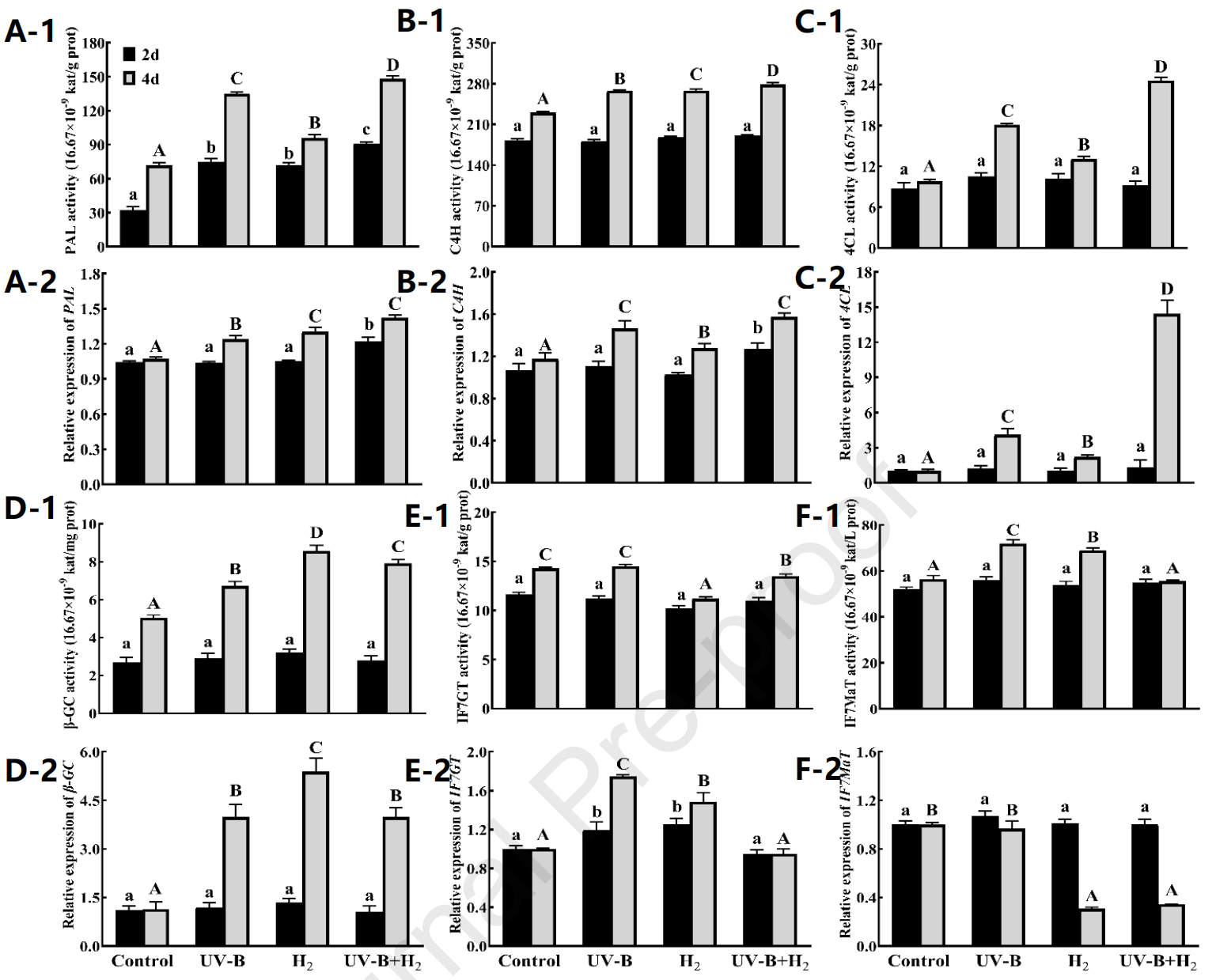
图5. 在UV-B辐射下H2处理对发芽大豆异黄酮合酶和转化酶活性及基因表达的影响。PAL (A),C4H (B),4CL (C),β-GC (D),IF7GT (E),和 IF7MaT (F)。PAL,苯丙氨酸解氨酶;C4H,肉桂酸-4-羟化酶;4CL,4-香豆酸辅酶A连接酶;β-GC,β-葡萄糖苷酶;IF7GT,异黄酮7-O-葡萄糖基转移酶;和IF7MaT,异黄酮7-O-葡萄糖苷-6″-O-丙二酰基转移酶。注:不同的小写字母代表不同样本在发芽2天后的显著差异。不同的大写字母代表不同样本在发芽4天后的显著差异(p < 0.05)。
3.7. PAL, C4H, 和 4CL 基因表达
如图5A–C所示,发芽第4天的PAL、C4H和4CL基因表达高于第2天。与第4天对照相比,PAL基因表达分别增加了16%(UV–B)、23%(H2)和35%(UV–B + H2)(见图5A–2)。C4H基因表达分别增加了22%(UV–B)、14.4%(H2)和27.1%(UV–B + H2)(见图5B–2)。4CL基因表达分别增加了300%(UV–B)、77.8%(H2)和1433%(UV–B + H2)(P < 0.05)(见图5C–2)。处理(UV–B、H2和UV-B + H2)和发芽时间(第2天和第4天)的交互作用对发芽大豆的4CL基因表达有显著影响(P < 0.05),而对PAL和C4H基因表达没有显著影响(P > 0.05)。
3.8. β-GC, IF7GT, 和 IF7MaT 活性
图5展示了在UV-B辐射下H2处理对β-GC(D-1)、IF7GT(E−1)和IF7MaT(F-1)活性的影响。发芽第4天的β-GC、IF7GT和IF7MaT活性高于第2天。与第2天对照相比,这些活性在不同处理下没有显著差异(P > 0.05)。与第4天对照相比,β-GC活性分别增加了33.3%(UV–B)、70.2%(H2)和57.1%(UV–B + H2)(见图5D–1)。IF7GT活性分别减少了21.7%(H2)和5.6%(UV–B + H2),而UV-B处理没有显著差异(P > 0.05);(见图5E–1)。IF7MaT活性分别增加了27.4%(UV–B)和22.1%(H2),而UV-B + H2处理没有显著差异(P > 0.05);(见图5F–1)。处理交互作用(UV–B、H2和UV-B + H2)和发芽时间(第2天和第4天)对发芽大豆的β-GC和IF7MaT活性有显著影响(P < 0.05),而对IF7GT活性没有显著影响(P > 0.05)。
3.9. β-GC, IF7GT, 和 IF7MaT 基因表达
图5展示了在UV-B辐射下H2处理对β-GC(D-2)、IF7GT(E−2)和IF7MaT(F-2)基因表达的影响。发芽第4天的β-GC和IF7GT基因表达高于第2天,而第4天的IF7MaT基因表达低于第2天。第2天时,β-GC基因表达没有显著差异(P > 0.05),但与第4天对照相比,分别增加了254%(UV–B)、382%(H2)和262%(UV–B + H2)(见图5D–2)。与第2天对照相比,IF7GT基因表达分别增加了19.7%(UV–B)和25.3%(H2),而UV-B + H2处理没有显著差异(P > 0.05)。与第4天对照相比,IF7GT基因表达分别增加了74.7%(UV–B)和48.4%(H2),而UV-B + H2处理没有显著差异(见图5E–2)。第2天时,IF7MaT基因表达没有显著差异(P > 0.05),但与第4天对照相比,分别减少了69.1%(H2)和66%(UV–B + H2),而UV-B处理没有显著差异(P < 0.05);(见图5F–2)。处理交互作用(UV–B、H2和UV-B + H2)和发芽时间(第2天和第4天)对发芽大豆的IF7GT和IF7MaT基因表达有显著影响(P < 0.05),而对β-GC基因表达没有显著影响(P > 0.05)。
如图6A所示,在正交偏最小二乘法判别分析(OPLS-DA)模型中,对照组、UV-B处理组和UV-B + H2处理组之间有明显的分离。为了进一步了解不同处理组之间的代谢物差异,筛选了487种代谢物以识别不同处理组下的差异常代谢物。如图6B的维恩图所示,UV-B组与对照组之间有88种差异常代谢物(44种上调和44种下调),UV-B + H2组与对照组之间有99种差异常代谢物(35种上调和64种下调),UV-B + H2组内有44种差异常代谢物(10种上调和34种下调)。这表明UV-B和UV-B + H2处理在大豆发芽过程中显著改变了代谢物的数量(P < 0.05)。
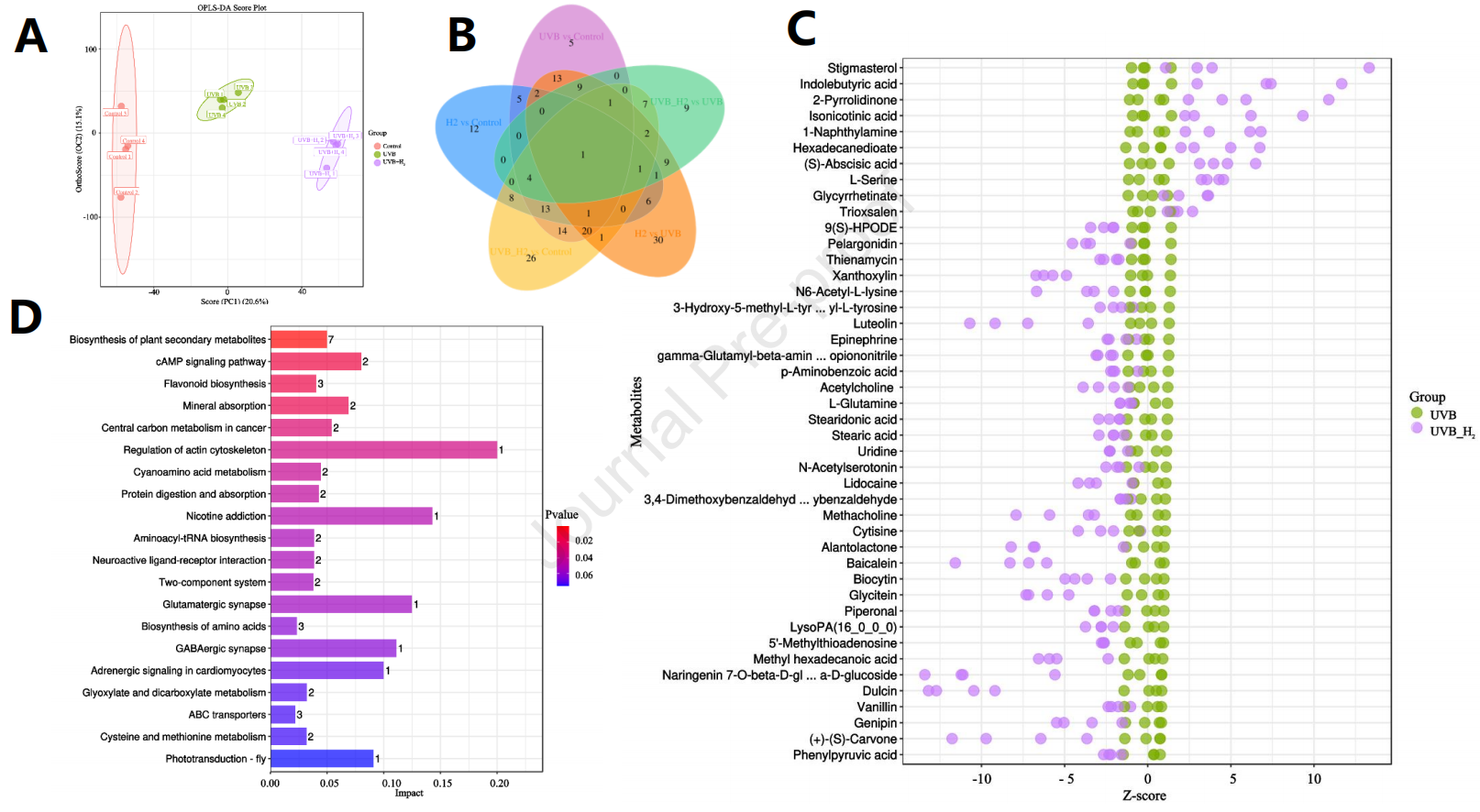
图6. 在UV-B辐射下进行H2处理导致发芽大豆的代谢变化。基于UV-B或UV-B + H2触发的发芽大豆代谢组数据的OPLS-DA得分图(A)。维恩图显示了不同处理下的重叠和差异代谢物的数量(B)。用Z分数图来衡量在UV-B和UV-B + H2处理下发芽大豆代谢物的相对含量,横坐标是通过Z分数转换的组内代谢物的相对数量,越向右表示该组中代谢物的含量越大(C)。基于KEGG分析的代谢途径影响因子的直方图。横坐标表示与不同代谢途径富集的影响值,值越高,表明在该途径中检测到的代谢物的贡献越大。颜色与P值相关;红色表示P值较小,蓝色表示P值较大。P值越小,表示检测到的差异代谢物对该途径的影响越显著(D)。OPLS-DA,正交偏最小二乘判别分析;KEGG,京都基因与基因组百科全书。
如图S1所示,对照组、UV-B组和UV-B + H2组中代谢物的分布有显著差异(P < 0.05)。与对照组相比,UV-B和UV-B + H2组增加了异黄酮的含量,并激活了与异黄酮合成相关的代谢途径(苯丙素生物合成)(图S2)。与UV-B组不同,在UV-B + H2组中有44种代谢物发生了变化。其中,核苷酸(胞嘧啶和尿苷)含量减少,氨基酸(L-丝氨酸)含量增加,脂肪物质(十六烷二酸增加,硬脂酸和甲基十六烷酸减少)含量变化,一些信号分子((S)-脱落酸、吲哚丁酸和豆甾醇水平增加)和神经递质(甲胆碱、乙酰胆碱和肾上腺素减少)也发生了变化(图6C)。所有重要的代谢物都被映射到KEGG数据库(图6D)。其中,植物次生代谢物生物合成途径富集了最多的差异代谢物,而氨基酸生物合成途径、cAMP信号传导途径、癌症中的中心碳代谢和ABC转运体途径也受到H2的显著影响(P < 0.05)。
4. 讨论
作为物理压力,UV-B可以抑制植物的生长和发育,产生氧化损伤,而H2对种子萌发有积极效果,如提高植物的抗逆性(图1A–E)。Guan等人发现H2能够提高黑大麦的萌发率。因此,我们进一步使用代谢组学探索了H2对发芽大豆生长压力的UV-B失活机制。核苷酸如胞嘧啶和尿苷是核酸的重要组成,它们水平的降低表明H2加速了发芽大豆中核酸的合成。Williams(2021)也指出了核苷酸生物合成和代谢在植物生长和发育中的重要性。萌发期间核苷酸大量利用是确保发芽大豆正常生长的关键因素。
大豆是世界上最重要的油籽作物。像脂肪的重要成分一样,脂肪酸在调节大豆生长和发育中起着重要作用。与仅使用UV-B处理相比,UV-B + H2处理后十六烷二酸和硬脂酸的含量发生了显著变化。硬脂酸是一种多不饱和脂肪酸,Meï等人(2015)指出多不饱和脂肪酸的含量与植物细胞培养物和组织的生长速率呈反比。在本研究中,硬脂酸含量的降低表明H2促进了发芽大豆细胞和组织的生长。十六烷二酸具有抗菌特性。十六烷二酸含量的增加和硬脂酸含量的降低表明H2可以通过调节脂肪酸组成来促进UV-B辐射下发芽大豆的生长。此外,H2处理后L-丝氨酸的含量增加,L-丝氨酸参与了细胞组织的分化并促进了萌发。因此,H2通过调节响应UV-B诱导压力的代谢物组成来促进大豆萌发。
在调节代谢产物之外,我们的发现表明H2还参与了UV-B辐射下发芽大豆抗氧化系统的调控(图2A–E)。UV-B辐射显著增加了发芽大豆中的ROS含量,而H2降低了ROS含量。MDA和EL含量的降低也表明H2具有出色的抗氧化特性。与UV-B处理相比,添加H2显著促进了SOD、APX和CAT的活性和基因表达(图3)。这表明H2参与了UV-B辐射下发芽大豆中ROS的调节,并通过增加抗氧化酶活性和基因表达来减轻UV-B造成的压力。Zhao等人(2017)也发现,在铝压力下添加H2能够激活抗氧化酶,增强玉米幼苗的抗氧化能力。POD活性由于H2的添加而没有增加,因此我们推测,除了参与抗氧化系统的调节外,H2还可以作为还原剂直接结合并消除ROS。因此,我们研究了发芽大豆中的·OH水平。结果表明,H2处理显著降低了发芽大豆中的·OH含量(图2C)。Wu等人(2021)也表明H2可以直接与·OH反应,缓解赤霉素诱导的小麦籽粒细胞毒性。这表明H2可以通过激活抗氧化酶或独立地调节由UV-B诱导产生的ROS水平。除了抗氧化酶活性和基因表达被H2激活外,几种与植物生长代谢和抗氧化剂相关的代谢物水平也被H2上调,包括吲哚丁酸、(S)-脱落酸和豆甾醇(图6C)。Li、Zeng、Leng、Feng和Kang(2018)报告称,吲哚丁酸可以在镉压力下增加APX、CAT和POD的活性,并有效抵抗镉压力引起的膜脂质过氧化,导致MDA含量下降。(S)-脱落酸可以增加抗氧化酶活性(SOD、POD、CAT和APX)和Asr1基因表达水平,从而减少干旱压力下玉米叶片的氧化损伤。同样,作为常见的植物固醇之一,豆甾醇调节脂质过氧化并减少氧化DNA损伤。作为动植物产生的神经调节剂,神经递质在抵抗压力、适应环境、生长发育过程中发挥重要的调节作用,并与植物激素相互作用以调节抗氧化指标。与仅使用UV-B处理相比,在UV-B辐射下进行H2处理能够增加吲哚丁酸和(S)-脱落酸的含量,同时降低乙酰甲胆碱、乙酰胆碱和肾上腺素的含量,这可能是因为H2导致了调节发芽大豆氧化防御系统的激素和神经递质之间的动态平衡。总体而言,H2通过激活抗氧化酶活性和参与代谢物调节来应对UV-B诱导的ROS增加,从而促进大豆的正常生长和发育。
与对照组相比,UV-B处理促进了发芽大豆中异黄酮的富集(图4B),这可能是由于UV-B激活了异黄酮合成途径的关键酶(PAL、4CL和C4H)(图5A–C)。在UV-B辐射下添加H2进一步增加了异黄酮含量(图4B)。同时,PAL、C4H和4CL的活性和基因表达也得到了进一步改善(图5A–C)。这一结果与Xie等人(2015)的研究一致,他们发现在UV-B辐射下进行H2处理增加了紫花苜蓿中PAL、CHS和CHI的基因表达。代谢组分析显示,与对照组相比,UV-B和UV-B + H2处理都激活了与异黄酮合成相关的途径(苯丙素生物合成途径)(图S1–2)。这表明H2可以介导UV-B诱导的异黄酮富集。值得注意的是,与UV-B处理相比,添加H2进一步提高了苷元和总异黄酮的比例(图4C)。这一结果与Yin等人(2022)的研究相似,他们证明UV-B压力增加了总异黄酮和苷元(染料木黄酮、黄豆黄素和甘油三酯)的含量。在UV-B辐射下进行H2处理降低了IF7GT和IF7MaT的活性和基因表达(图5E–F),从而抑制了苷元向苷元的转化。同时,H2处理增加了β-GC的活性和基因表达,并最终促进了苷元向苷元的转化(图5D)。
5. 结论
在UV-B辐射下进行H2处理不仅促进了大豆的生长和增加了抗氧化反应,而且显著富集了异黄酮,特别是苷元。在逆境压力下,植物在其生理、生化和功能成分上会发生变化,这些变化通常是由内部信号分子调节的。然而,本研究并未探讨在UV-B压力下进行H2处理是否会影响发芽大豆内信号分子的变化,进而影响生理生化质量和异黄酮的变化。因此,未来有必要从信号转导的角度进一步探索在UV-B辐射下进行H2处理对发芽大豆中异黄酮富集的影响机制。
https://wap.sciencenet.cn/blog-41174-1420617.html
上一篇:珊瑚编年史
下一篇:微化石猎人展示最清晰恐龙时代生态系统