博文
氧化应激和晚期糖基化终产物
|
氧化应激是由活性氧、活性氮和其他自由基物种在细胞内过度积累引起的,会导致各种疾病的发生和发展,包括糖尿病、肥胖症、糖尿病肾病、糖尿病神经病变和神经系统疾病,如阿尔茨海默病(AD)、肌萎缩侧索硬化症(ALS)和帕金森病 (PD)。氧化应激也与心血管疾病和癌症有关。
加剧的氧化应激导致晚期糖基化终产物(AGEs)的加速形成,AGEs是交联蛋白质和蛋白质修饰的复杂混合物。在糖尿病、肥胖症、AD 和其他 I 型神经系统疾病中产生相对较高水平的 AGEs。AGEs,如N类e-羧甲基赖氨酸 (CML) 可作为疾病进展的标志物。AGEs通过与晚期糖基化终产物受体(RAGE)的相互作用,引发一连串有害的信号转导事件,形成炎性细胞因子,从而在恶性循环中进一步加剧氧化应激。因此,AGE抑制剂、AGE破坏剂和RAGE抑制剂是多种疾病(包括糖尿病和AD)的潜在治疗剂。
AGEs的复杂性和缺乏成熟的AGE形成机制是缺乏针对氧化应激和AGE相关疾病的有效疗法的主要原因。本文综述了氧化应激在AGE相关慢性疾病(包括糖尿病和神经系统疾病)发病机制中的作用,以及基于抗氧化剂、AGE破坏剂和RAGE抑制剂的治疗方法开发的最新进展。此外,本综述概述了基于单原子纳米酶的治疗策略,这些策略通过隔离活性氧和活性氮来减弱氧化应激。
1. 引言
氧化应激是糖尿病、肥胖症和糖尿病诱发的微血管疾病(包括糖尿病视网膜病变终末期肾病、动脉粥样硬化和心血管疾病)发病的致病因素。氧化应激是由活性自由基(如活性氧和活性氮)等活性自由基在细胞内过度积累引起的。虽然活性氧和活性氮是正常细胞功能和宿主防御系统对抗入侵细菌的组成部分,但其过量会导致各种病症的发生和加重,包括神经系统疾病和糖尿病。
细胞抗氧化剂(如谷胱甘肽)和抗氧化酶(如超氧化物歧化酶(SOD)、过氧化氢酶(XAT)、谷胱甘肽过氧化物酶(GPx))可隔离活性氧和活性氮,以维持细胞氧化还原状态的最佳平衡。活性氧和活性氮的形成和破坏之间的不平衡导致了这些活性自由基的过度积累。虽然活性氧和活性氮在生理浓度下充当信号分子,但在氧化条件下,过量的活性氧和活性氮通过与蛋白质、脂质和DNA的有害反应而造成细胞损伤,从而导致各种氧化应激相关疾病的发病机制,包括糖尿病、肥胖症和神经系统疾病,如阿尔茨海默病(AD)和帕金森病(PD)。
氧化应激还有助于晚期糖基化终产物(AGEs)的形成,从而导致蛋白质和核酸的有害结构修饰。AGEs是通过蛋白质氨基与还原糖的羰基的非酶促反应形成的,随后是涉及糖氧化反应的进一步蛋白质修饰,因此氧化应激在AGEs的形成和AGE相关疾病的发病中起主要作用,包括AD、糖尿病、动脉粥样硬化和肌萎缩侧索硬化症(ALS),AGEs在糖尿病、肥胖、AD和其他神经系统疾病中普遍存在相对较高的水平,在AD病例中,AGEs主要定位于β淀粉样蛋白(amyloid beta, Aβ)斑块和神经原纤维缠结(NFT)。AGEs的水平与糖尿病、肥胖症和阿尔茨海默病(AD)的氧化应激程度和疾病进展相关。
糖尿病也是阿尔茨海默病(AD)发病的主要致病因素之一,它们具有共同的生物标志物,包括AGEs和其他氧化应激标志物升高,如脂质过氧化产物4-羟基-反式-2-壬烯醛(HNE)。由于AD和2型糖尿病的常见生物标志物,AD有时被称为糖尿病3型。
过量的AGEs及其与AGEs受体(RAGE)的结合会诱导信号级联反应,从而进一步加剧氧化应激,形成恶性循环。AGEs与RAGE(年龄-RAGE相互作用)的相互作用也与高血糖条件下胰腺癌的发病有关,尤其是在糖尿病和肥胖病例中。AGE-RAGE 相互作用和由此产生的氧化应激是糖尿病肾病发病的致病因素(参见下文)。
氧化应激还会产生脂质过氧化产物的复杂混合物,其中一些,如丙二醛(MDA)和4-羟基-反式-2-壬烯醛(HNE),主要负责DNA修饰和由此产生的致癌作用。人们重新对开发针对脂质过氧化产物和抗氧化剂的疗法产生兴趣,以减弱脂质过氧化。
开发RAGE抑制剂作为癌症和神经系统疾病以及其他AGE相关疾病的潜在疗法也越来越感兴趣。迄今为止,还没有FDA批准的基于RAGE抑制剂的疗法,因为RAGE是一种多配体结合受体,实现RAGE结合的选择性仍然是一个挑战。然而,目前有一些潜在有用的疗法正在临床试验中用于治疗癌症和神经系统疾病。
经过工程改造以选择性进入神经元细胞的纳米酶可有效减弱氧化应激,该领域已引起人们对开发治疗各种神经系统疾病的有效疗法的兴趣。该领域最近的一个趋势是将基于单原子的纳米酶嵌入近红外探针的表面,以便对神经炎症部位进行成像。由氧化还原活性金属(如Mn、Co、Zn和Pt)制成的纳米酶材料通过隔离活性氧或作为抗菌剂来减轻神经炎症,消灭肿瘤细胞并介导糖尿病伤口愈合。这些纳米酶也可以经过工程设计,使其能够穿透血脑屏障(BBB),并在靶向神经系统疾病(如创伤性脑损伤(TBI)时对进入神经元细胞具有高选择性。
2. 活性氧
活性氧在线粒体呼吸周期以及细胞代谢期间生理上形成,并通过过渡金属离子催化的氧化还原反应(芬顿)非酶促形成。线粒体是活性氧形成的主要来源,线粒体抗氧化酶(Mn超氧化物歧化酶 (MnSOD)、过氧化氢酶和抗坏血酸氧化酶)控制线粒体 活性氧 的水平,以维持正常生理活动所需的 活性氧 的最佳平衡。活性氧和随之而来的氧化应激与各种疾病的发病有关,包括糖尿病、心血管疾病、糖尿病神经病变和糖尿病肾病。高血糖是糖尿病的主要原因,会激活各种信号通路,导致活性氧的过度表达和氧化应激。在糖尿病患者中,氧化应激增加会导致内皮功能障碍和动脉粥样硬化。在过表达MnSOD的转基因动物模型中,研究表明,内皮细胞中线粒体活性氧的衰减可改善非再灌注线粒体梗死的冠状动脉血管生成和心脏功能。
TBI 涉及血脑屏障的广泛损伤,并伴有活性氧的过量产生,例如超氧自由基阴离子(O2·−)、羟基自由基(·OH)和过氧化氢(H2O2).活性氧诱导的神经元细胞损伤会对健康产生长期影响,并在某些情况下导致AD的发作。
氧化应激会破坏血脑屏障,从而进一步加剧AD和TBI病例的神经元损伤[43]。单原子Mn催化剂对活性氧的隔离可减轻神经炎症,促进BBB的重建,同时恢复神经功能。将这种单原子Mn催化剂包埋在近红外II(1500-1700 nm)碲化银(Ag2Te)量子点作为成像探针,用于监测活性氧诱导的神经炎症。在这种纳米酶型催化系统中,氧化还原活性的Mn将超氧自由基阴离子(O2·−) 到双氧 (O2)和羟基自由基(·OH)到羟基阴离子(−OH),随后转化为H2O通过从相邻的酸性位点(图1)。将Mn掺杂在近IR-II(1500-1700 nm)活性PbS/CdS量子点(QD)显像剂上的类似方法可抑制促炎因子的释放,并隔离TBI脑中过量的活性氧,从而提供神经保护作用。目前正在开发使用基于单原子的催化纳米酶的候选治疗药物,用于治疗神经系统疾病,包括AD和TBI。此外,纳米酶可以被设计成穿过BBB并消除错误折叠的蛋白质,因此可以作为有效的治疗方法,特别是对于神经系统疾病。
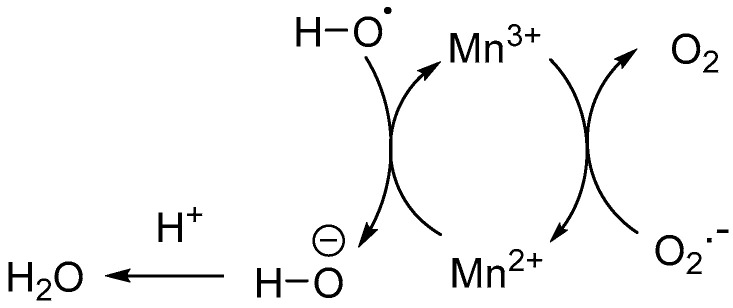
图1 单原子锰催化活性氧反应。
由Pt/CeO组成的单原子催化剂2,除了分解活性氧外,还有助于阻断线粒体中活性氧生成的来源。因此,这些单原子催化剂通过干扰α-甘油磷酸穿梭途径和苹果酸-天冬氨酸穿梭途径来实现功能失调的线粒体的自我清除,从而减弱活性氧再生。天然存在的抗氧化剂,如番茄红素,对活性氧的封存有潜在用处。然而,天然存在的抗氧化剂在帕金森病 (PD) 治疗中的使用受到阻碍,因为它们被整合到 PD 神经元细胞中涉及技术挑战。在这种情况下,基于生物相容性的番茄红素抗活性氧纳米点在被设计为靶向神经元线粒体时,会诱导致病性α-突触核蛋白的外排,并有助于PD中多巴胺能神经元的存活。
硫辛酸衍生的甲基丙烯酸酯共聚物被证明可以清除脂质过氧化产物,如丙烯醛和 H2O2.当这些化合物用作治疗候选物时,可能会在TBI 和其他神经退行性疾病中提供保护作用,因为在TBI和AD病例中会产生多种脂质过氧化产物和过量的活性氧(图2) 据推测,H2O2的毒性水平通过将聚合物中的二硫醇部分氧化为二硫化物而淬灭。这些聚合物还与基于Gd-DOTA的MRI成像剂相结合,以监测其潜在的治疗效果。
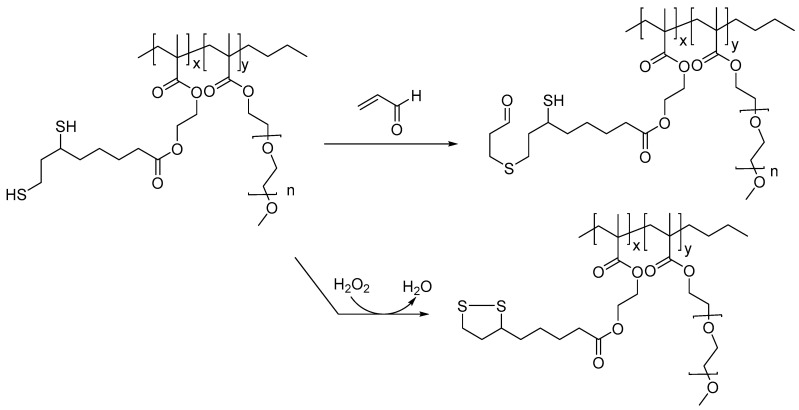
图2硫辛酸基聚合物及其在ROS和脂质过氧化产物的封存机理
超氧自由基阴离子(O2·−)由烟酰胺腺嘌呤二核苷酸(NADH或NAD-磷酸,NADPH)氧化酶、葡萄糖氧化酶或黄嘌呤氧化酶催化,或通过Fe(II)和Cu(I)等金属离子催化的非酶促Fenton反应。超氧自由基阴离子O2·−反应性相对较低,因此本身不是氧化应激启动的主要贡献者。然而,超氧径向阴离子通过SOD进一步还原为H2O2后,然后是金属离子催化的芬顿反应形成高反应性羟基自由基(HO·)。羟基自由基比超氧自由基阴离子的反应性强得多,并与蛋白质和核酸反应形成各种蛋白质和核酸聚集体,这些聚集体与多种病理有关,包括糖尿病、肥胖症和神经系统疾病。过氧化氢酶将毒性相对较大的过氧化氢转化为双氧和水一个(图3)。其他减弱活性氧的抗氧化酶包括谷胱甘肽过氧化物酶、CuZn-SOD 和 Mn-SOD。当活性氧的形成和封存不平衡时,过量的活性氧(如羟基自由基)会积累并引发氧化应激。在糖尿病病例中,胰腺的抗氧化酶水平相对较低,葡萄糖浓度较高,因此容易发生活性氧诱导的产生胰岛素的B细胞损伤。
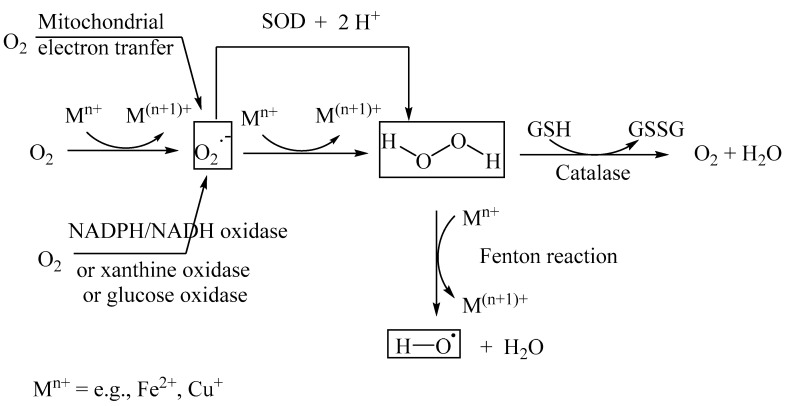
图3细胞内活性氧产生过程。
3. 脂质过氧化
羟基自由基与脂质的反应通过链传播事件形成脂质氢过氧化物。HNE由亚油酸的脂质过氧化形成,通过与核酸碱基和蛋白质结合而发挥细胞毒性。HNE的核酸加合物有助于诱变和致癌性,蛋白质修饰导致蛋白质功能丧失或酶失活。多不饱和脂肪酸的脂质过氧化生成MDA,形成核酸碱基加合物。在溶液中,MDA以烯醇互变异构形式存在。脱氧鸟苷在嘧啶环上与MDA形成加合物,得到嘧啶并[1,2a]嘌呤-10(3H)-酮为主要产物(图4).MDA还与脱氧腺苷和脱氧胞苷形成加合物,在没有细胞内DNA修复机制的情况下,这会导致致突变性和致癌性。在伴有冠状动脉疾病的2型糖尿病患者中,MDA水平升高,MDA也被用作氧化应激和脂质过氧化的标志物。

图4从脱氧鸟苷形成MDA加合物
一些脂质过氧化产物,如HNE在糖尿病和阿尔茨海默病病例中大量存在,这意味着HNE被用作疾病进展的生物标志物。HNE与蛋白质和核酸反应产生共价加合物,这些蛋白质和核酸修饰可导致各种病理的发作,包括AD和糖尿病。高血糖会升高糖尿病患者的 HNE 水平。HNE与Aβ肽聚集体的产生相关,在高血糖病例中可能引发AD的发作。HNE作为一种细胞信号分子,因此在糖尿病患者的肝细胞癌、胰腺癌和结直肠癌的发病中发挥作用。HNE还参与肺纤维化的发生和发展,肺纤维化是一种肺组织中细胞外基质过度积累的疾病。骨关节炎病例的HNE水平升高,据推测,HNE诱导软骨细胞中胶原II和基质金属蛋白酶13的转录和翻译后修饰,从而影响胶原稳态和胶原降解。
天然存在的多酚可以隔离HNE,并在一定程度上减弱HNE的毒性作用。因此,根皮素(苹果的一种多酚成分)与活化的芳香环发生傅克-工艺品型反应,产生苯甲醇和其他半缩醛化合物,如体外实验所示(图5)。在根皮素喂养的小鼠中,HNE的剂量依赖性捕获也被证实。
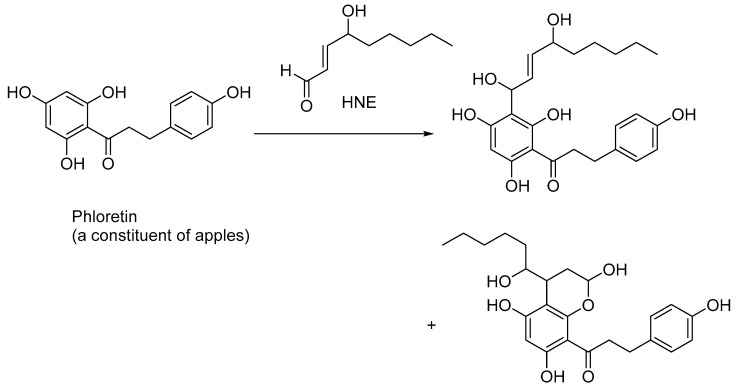
图5根皮素(一种在苹果中发现的多酚类抗氧化剂)螯合 HNE
N-乙酰半胱氨酸作为一种抗氧化剂,当用作联合药物时,也可能有助于降低HNE水平,并增强依帕司他(一种醛糖还原酶抑制剂)的抗关节炎作用。同样,谷胱甘肽也会在HNE中加入Michael,形成无毒的加合物,在体内还原为相应的醇。Michael 将 HNE 添加到 N2-脱氧鸟苷的氨基,随后形成环状半向反应,形成dG-HNE加合物(图6) [这些观察结果表明,HNE的细胞毒性是由于蛋白质和核酸的氨基的共轭加成(Michael加成)所致(即HNE的β碳处氨基的亲核加成),从而影响其正常的生理功能和核酸复制和转录。HNE还通过与组氨酸侧链反应与蛋白质形成Michael加合物,如高效液相色谱-串联质谱(LC-MS/MS)研究所示。组氨酸的Michael加成产物可逆地发生环化反应,形成相应的半缩醛(m/z 312),加合物被酶促还原为相应的醇(m/z 314)并氧化为相应的羧酸(m/z 328;图6) 。这些化合物可作为脂质过氧化衍生的羰基应激的生物标志物。
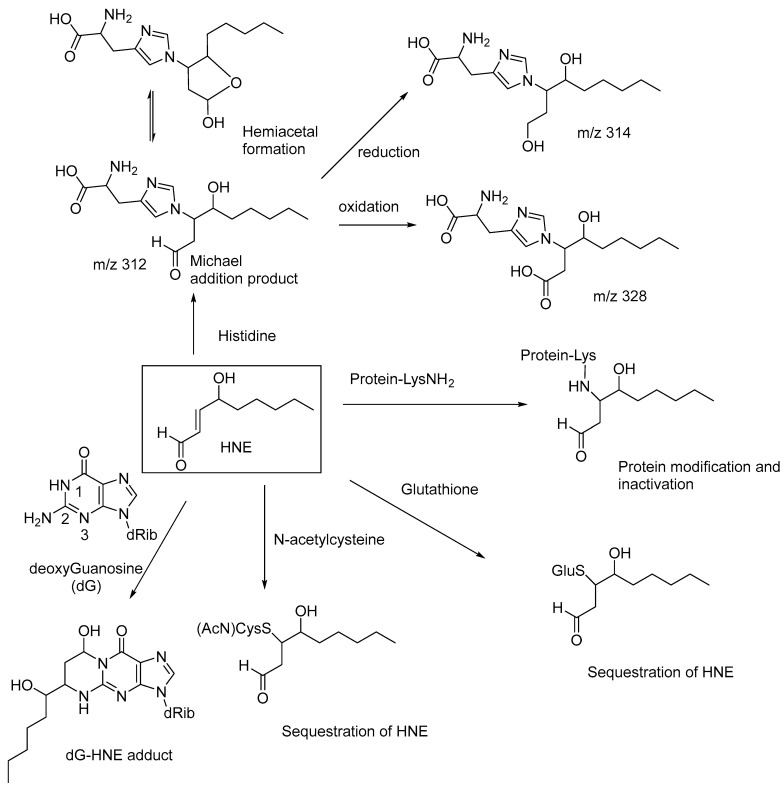
图6通过蛋白质和DNA修饰以及谷胱甘肽和N-乙酰半胱氨酸螯合HNE对HNE的细胞毒性
HNE与所有四个核酸碱基形成加合物,并改变其转录特性,导致癌变。这些核酸-HNE加合物与氧化应激介导的因子一起导致肝癌的发病。HNE的DNA碱基加合物可用作人类癌症中脂质过氧化介导的DNA损伤的生物标志物。
与蛋白质和核酸相比,抗氧化剂 N-乙酰半胱氨酸 (NAC) 和谷胱甘肽在 HNE 上与 Michael 添加的反应性相对较高,并有效地隔离了 HNE,从而减轻了 HNE 的毒性 (图6).通过吸烟产生的 活性氧 上调肺泡巨噬细胞 (AM) 中的血管紧张素转换酶 2 (ACE2),从而增加 AM 对 SARS-CoV-2 感染的易感性。NAC通过抑制细胞内活性氧来降低ACE2表达,因此NAC和其他活性氧隔离抗氧化剂可能对COVID-19的肺部并发症具有预防作用。
4. 活性氧和DNA损伤
活性氧将2′-脱氧鸟苷氧化为8-羟基-2′脱氧鸟苷(8-氧代-dG;图7),从而引起位点特异性 DNA 损伤。8-oxo-dG 用作氧化应激和 DNA 损伤的标志物。研究表明,杨梅素是茶和浆果的一种成分,可能导致 H2O2 诱导的 DNA 损伤,在Cu(I)存在下,可能是通过原位形成Cu(I)-过氧化氢。抗癌药物,如薯蓣皂苷元,促进由活性氧介导的癌细胞中的DNA损伤。使用薯蓣皂苷元和顺铂的联合治疗导致DNA损伤增加,活性氧水平升高,细胞抗氧化酶降低,从而诱导肿瘤细胞凋亡。
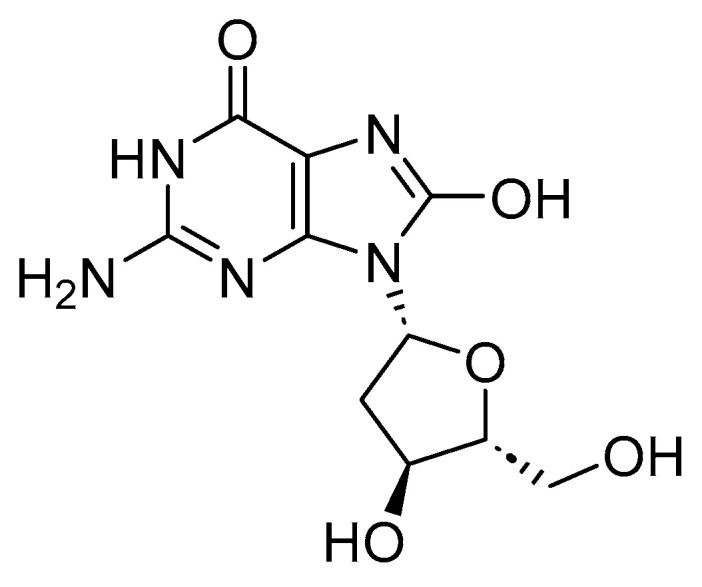
图7 8-羟基-2′脱氧鸟苷(8-oxo-dG)的结构
5. 活性氮
活性氮包括自由基一氧化氮 (NO) 和过氧亚硝酸 (ONOOH)。一氧化氮合酶 (NOS) 使用 NADPH 作为辅助因子催化 L-精氨酸氧化转化为 NO。NO在生理浓度下作为信号分子。然而,通过过度激活NOS而异常形成过量的NO会导致氧化应激。一氧化氮与超氧化物反应生成过氧亚硝酸。过氧亚硝酸参与蛋白质酪氨酸残基的硝化,从而改变蛋白质功能(硝化应激)(图8) 。
一氧化氮参与蛋白质硫醇残基的亚硝基化,从而施加亚硝化应激。在正常生理条件下,S-亚硝基化蛋白介导氧化还原信号传导并控制细胞代谢。然而,在氧化应激条件下(即NO产生过量),亚硝化应激会导致多种疾病的病理生理学,包括AD、帕金森病和亨廷顿舞蹈症。在AD和帕金森病的情况下,氧化还原酶蛋白二硫键异构酶(PDI)的S-亚硝基化与内质应激之间存在相关性。过氧亚硝酸还通过金属离子催化的芬顿反应产生高反应性的羟基自由基,进一步增加氧化应激(图8).
硝基酪氨酸见于AD、肌萎缩侧索硬化症(ALS)和多发性硬化症,并被用作这些疾病的标志物,但尚无明确证据表明这些标志物是这些疾病的病因还是副现象。亚硝化和硝化应激是多发性硬化症中观察到的神经退行性变的促成因素。靶向调节NOS的疗法尚未获批用于临床,但选择性NOS抑制剂可用于治疗多种疾病,如AD和糖尿病。

图8活性氮种类及其对蛋白质修饰的影响
6 氧化应激和晚期糖基化终产物(AGEs)
AGEs在多种疾病中大量形成,包括糖尿病和神经系统疾病,如AD和帕金森病。AGEs是通过还原糖与蛋白质伯氨基的非酶促反应形成的,然后进行一系列氧化转化。这些氧化转化称为糖氧化,在氧化应激条件下会加剧,即当活性氧(reactive oxygen species, 活性氧)和活性氮通过异常细胞代谢过量形成时。美拉德反应的中间1,2-二羰基产物,如甲基乙二醛、乙二醛和2-氨基葡萄糖,与蛋白质氨基高度反应,形成蛋白质交联,从而使酶失活。这些1,2-二羰基化合物(α-二羰基化合物)的过度积累,也称为羰基应激,有助于AGEs和蛋白质交联的形成。AGEs的积累,以及AGE-RAGE的相互作用,加剧了氧化应激、羰基应激和其他致病因素,包括肠道菌群的失衡。谷物多酚类化合物通过其抗氧化作用,为减轻氧化应激和羰基应激提供了一种非药物干预手段,因此代表了治疗糖尿病和神经系统疾病的预防方法。
AGEs可以形成为分子内或分子间蛋白质交联(例如,戊糖素、赖氨酸和精氨酸交联)或涉及赖氨酸或精氨酸侧链(例如,精氨酸嘧啶、Ne-羧甲基赖氨酸 (CML))(图9)。AGE水平与糖尿病、糖尿病性神经病变、糖尿病肾病和神经系统疾病(包括AD和PD)的严重程度增加相关。
AGEs通过激活RAGE-NF-kB信号转导加速糖尿病相关动脉粥样硬化,从而促进内皮细胞中的低密度脂蛋白(LDL)转吞作用。AGE抑制剂,如吡哆胺,可螯合中间体AGE前体甲基乙二醛和其他1,2-二羰基化合物,从而防止动脉粥样硬化的形成。体外研究表明,AGEs可增强NADPH氧化酶的活化,从而增强内皮细胞中活性氧的产生。氯沙坦、雷米普利、白藜芦醇和N-乙酰胱氨酸(NAC)可能通过其抗氧化作用和活性氧隔离作用减轻AGE诱导的内皮功能障碍。
AGEs也是在食品的高温加工过程中形成的。摄入这些膳食AGEs还可能导致非酒精性脂肪性肝病(NAFLD)、小儿肥胖、癌症、痴呆和糖尿病的发病和进展。

图9 通过非酶糖基化和糖氧化形成AGE的示意图
7 AGE抑制剂作为治疗靶点
基于噻唑鎓的化合物,如ALT-711,破坏预先形成的AGE蛋白交联。这种AGE交联断裂剂可能用作治疗AGE相关疾病(图10)。ALT-711的临床试验显示,它能有效降低收缩压,在舒张性心力衰竭病例中具有积极的结局。
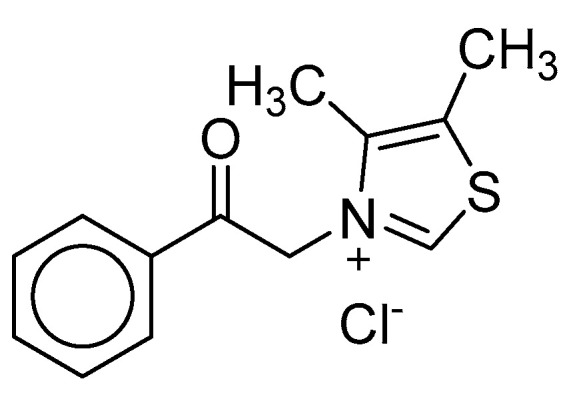
图10 一种 AGE 交联断裂器alagebrium (ALT-711) 的结构
氨基胍(pimagedine)在体外显示出抗糖化和AGE抑制作用。然而,在临床试验中,该化合物几乎没有显示出积极的结局,临床试验因风险收益比不佳而终止。
尽管AGE破坏剂和AGE 抑制剂在减轻AGEs和AGE 相关疾病方面的概念对糖尿病和其他AGE 相关疾病治疗药物的未来开发很有希望,但目前还没有 FDA 批准的基于AGE 抑制剂或破坏剂的候选药物。这可能归因于AGEs结构的复杂性以及迄今为止其形成的机制途径不完善。如下所述,靶向由AGE-RAGE相互作用引起的氧化应激可能是开发基于AGE诱导的氧化应激的治疗方法的替代方法。
8. AGE-RAGE 相互作用和氧化应激
AGEs通过与AGEs受体(RAGE)的相互作用,通过一系列信号级联反应引发进一步的氧化应激。AGE-RAGE 相互作用导致 NADPH 氧化酶的激活,从而增加 活性氧 的产生和脂质过氧化。AGE-RAGE相互作用还导致核因子κβ( NFkB)的激活,从而导致促炎细胞因子上调的基因激活,包括白细胞介素-1β(IL-1β)、白细胞介素-6( IL-6)和肿瘤坏死因子α(TNF-α)。
AGE-RAGE 相互作用导致基质金属蛋白酶的产生增加,基质金属蛋白酶参与主动脉瘤的进展。因此,AGE-RAGE相互作用导致的氧化应激增加在主动脉瘤中起作用。根据 AGE-RAGE 相互作用与主动脉瘤之间的这种相关性,在主动脉瘤病例中,AGE-RAGE 应激、细胞因子和基质金属蛋白酶升高。
氧化应激的增加导致AGE积累,而AGE又会通过与RAGE的结合而加剧氧化应激。高AGE水平与RAGE表达相关。RAGE 还通过与高迁移率组 Box-1(HMGB-1)蛋白结合而加剧氧化应激。AGE-RAGE/HMGB-1 信号通路参与 2 型糖尿病心肌病的发病。大约三分之二的 2 型糖尿病患者会发展为糖尿病心肌病。青蒿素是一种抗疟药,已被证明可以减轻AGE-RAGE/HMGB-1信号通路诱导的氧化应激,并改善糖尿病心肌病。
膳食多酚清除活性氧,从而减弱反应性α-二羰基化合物的形成,其与蛋白质氨基的高反应性导致分子内和分子间蛋白质交联和AGEs的形成。多酚类抗氧化剂还调节AGE-RAGE轴和微生物群-肠-脑轴,从而预防神经退行性疾病,包括AD、ALS和PD。
9 RAGE抑制剂作为治疗候选药物
RAGE抑制剂与RAGE结合,从而减弱RAGE与AGEs和其他配体(包括淀粉样蛋白β肽(Aβ))的结合。RAGE抑制剂可以减弱AGE-RAGE相互作用,因此由此产生的氧化应激效应将大大减少。因此,RAGE抑制剂对多种AGE相关疾病具有潜在的治疗作用,包括神经退行性疾病和糖尿病。
RAGE抑制剂FPS-ZM 1(4-氯-N-环己基-N-(苄甲基)苯甲酰胺)可减轻AGE诱导的神经炎症和氧化应激,如体外大鼠原代小胶质细胞(图11) FPS-ZM 1减弱了AGE刺激的NADPH氧化酶和活性氧表达,从而表现出神经保护作用。FPS-ZM 1 与 RAGE 的 V 结构域结合,这种 RAGE 抑制作用导致抑制循环 Aβ 的流入1-40和 Aβ1-42进入AD小鼠模型的大脑。这种对RAGE的阻断降低了Aβ1-42和 Aβ1-40水平,并改善了小鼠模型的认知能力。
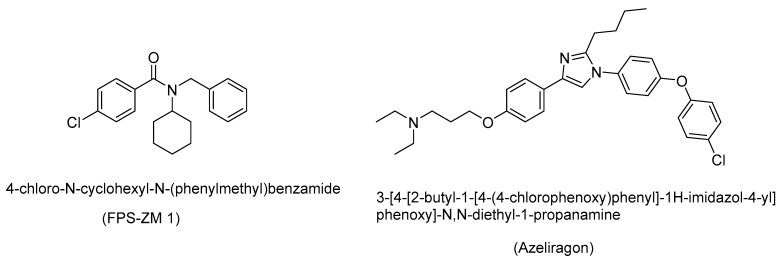
图11 RAGE抑制剂FPS-ZM 1和azeliragon的结构
RAGE抑制剂azeliragon(IUPAC名称:3-[4-[2-丁基-1-[4-(4-氯苯氧基)苯基]-1H-咪唑-4-基]苯氧基]-N,N-二乙基-1-丙胺;也称为TTP488)抑制三阴性乳腺癌的转移,并在II期临床试验中显示出良好的安全性。这种RAGE抑制剂策略可能产生基于小分子的候选治疗药物,用于治疗各种氧化应激介导的疾病,包括AD。
RAGE有几种配体,包括Aβ,它在AD中大量产生。 用RAGE抑制剂化合物抑制RAGE可阻止RAGE介导的炎症细胞因子表达信号传导,因此RAGE抑制剂可能被证明是治疗AD和其他AGE相关疾病(包括糖尿病和癌症)的临床上有用的化合物。动物模型和临床试验显示,azeliragon可减弱AD的多种病理通路。
10 结论与展望
氧化应激是多种疾病发生和发展的驱动力,包括糖尿病、肥胖症和阿尔茨海默病,活性氧和活性氮在蛋白质、核酸和脂质的结构修饰中起着重要作用。蛋白质和核酸的后一种结构修饰有助于糖尿病、癌症、AD 和心血管疾病的病理发作。氧化应激也导致AGEs的过度形成,从而导致RAGE的过度表达。矛盾的是,AGEs与RAGE的结合通过一系列信号级联进一步加剧了氧化应激,而这种AGE-RAGE相互作用以及随之而来的释放炎性细胞因子和核转录因子的信号级联反应是糖尿病和肥胖症患者胰腺癌发病的主要原因。
目前涉及AGE抑制剂和AGE破坏化合物的治疗方法,如氨基胍和alagebrium (ALT-711),在临床试验中显示出有限的成功。越来越多的人努力开发RAGE抑制剂作为AGE相关疾病(包括AD和糖尿病)的治疗方法。基于小分子的RAGE抑制剂,如FPS-ZM 1和azeliragon,目前正处于治疗AD和癌症的临床试验的各个阶段。如小鼠AD模型中的体内所示,FPS-ZM 1减弱了循环Aβ的流入1-40和 Aβ1-42进入大脑并提高认知能力。基于小分子抗氧化剂和纳米酶的疗法可以隔离活性氧和活性氮,对糖尿病和神经系统疾病的药物发现具有潜在影响。
AGE抑制剂和破坏剂以及RAGE抑制剂在治疗氧化应激介导的疾病(包括糖尿病和AD)方面具有潜在影响。最近临床试验的成功鼓励了人们对开发用于治疗癌症和神经系统疾病的小分子RAGE抑制剂重新产生兴趣。我们希望这篇综述能够激发进一步研究开发有效的治疗方法,特别是开发可以渗透血脑屏障的选择性RAGE抑制剂和抗氧化纳米酶,以治疗AD等毁灭性疾病。
Reddy VP. Oxidative Stress in Health and Disease. Biomedicines. 2023 Oct 29;11(11):2925.
https://wap.sciencenet.cn/blog-41174-1419457.html
上一篇:基于血液的癌症筛查
下一篇:GLP-1受体激动剂抗炎症作用