博文
肿瘤“定点清除” ,血小板“子弹”立功!
||
癌症,至今仍是人类难以攻克的疾病。能够对肿瘤细胞进行“定点清除”,是全世界科学家和医生的梦想。
北京时间2021年3月27日凌晨,《科学进展》(Science Advances)刊发中国科学院过程工程研究所(以下简称过程工程所)研究员马光辉、魏炜与中国科学院大学化学科学学院教授田志远等科研团队合作完成的论文。 研究人员在血小板中装载光热纳米颗粒与免疫激动剂,制备了新型血小板仿生剂型,在动物实验上实现了高效的肿瘤光热-免疫联合治疗,为肿瘤的靶向递送和联合治疗提供了新思路。

在众多肿瘤治疗方法中,“光热疗法”正在受到越来越多的关注。
简单地说,这一疗法的基本原理是将光热材料递送至肿瘤部位,把近红外激光的光能转换为热能,最终达到“热”死肿瘤细胞的目的。其具有治疗部位精确可控、杀伤效率高、副作用小等优点,一旦成功实现应用,将成为人类攻克肿瘤迈出的一大步。
论文共同第一作者、过程工程所吕岩霖博士向《中国科学报》介绍,目前,研究人员已经研发出用于抗肿瘤药物递送的多种载体。
“但是,由于肿瘤的异质性和个体差异,肿瘤部位的富集效果还有待提高。”她表示,“而且,肿瘤组织往往比较致密,载体在肿瘤内的渗透也受到限制。”
因此,研究者们普遍感到,光热疗法“理想很丰满,现实很骨感”。目前,这一新疗法仍然处在基础研究阶段,距离临床应用还有很长的距离。
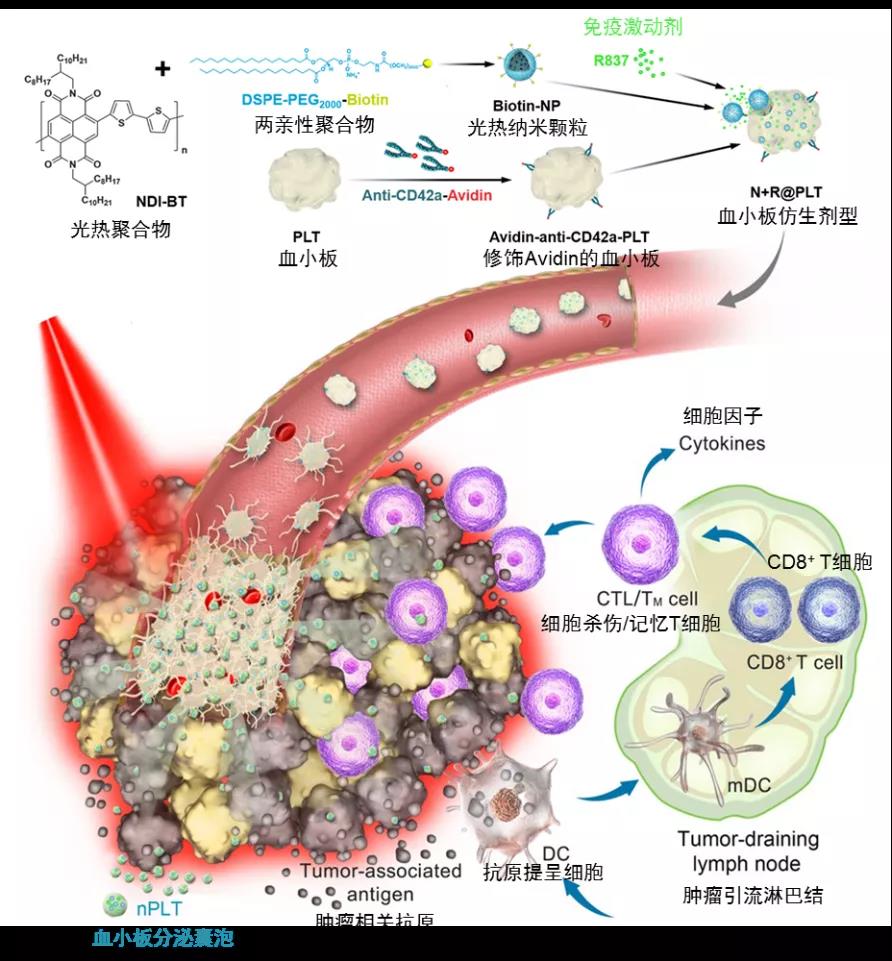
基于血小板的仿生剂型在肿瘤光热-免疫联合治疗中的作用示意图(研究团队供图)
光热材料如何准确、高效地递送至肿瘤部位,是解决当前困境的关键。自2006年起,过程工程所生化工程国家重点实验室研究员马光辉、魏炜发现和创制了一系列抗肿瘤递送新剂型,尝试了多种不同递送策略,已取得系列进展,为解决光热材料递送问题提供了基础。
最新发表的这项研究中,科研人员提出了利用血小板作为载体的递送策略。
研究人员介绍,血小板被称为“血管卫士”,天然粘附受损血管并能在激活状态下形成血栓和分泌纳米囊泡。也就是说,当血管受损时,破损处发出“信号”,血小板获得“信号”后被激活,然后聚集到破损处形成血栓;激活的血小板进一步放大“信号”,“喊来”更多血小板聚集。
血小板的“天性”让科研人员深受启发。同时,肿瘤组织普遍存在血管缺陷的部位,正是血小板能够“自觉前往”的地方。
他们把血小板当成“子弹壳”,把具有高光热转换效率的聚合物纳米颗粒作为“弹药”装进去。
中国科学院大学化学科学学院教授田志远在光热材料的选择、合成上做出了贡献。“这种新型光热纳米粒子的光热转换效率达到69.2%,因此低功率近红外光(NIR)照射可以产生足够的局部热疗”,他表示。
除了光热材料外,科研人员还将免疫激动剂也作为“弹药”装载进血小板“子弹壳”中。据了解,装载过程操作简单、条件温和。
实验中,在低功率近红外光照射下,光热所引起的肿瘤局部急性血管损伤激活血小板,通过层层放大“信号”的“级联效应”在肿瘤血管处形成血栓,以此形成光热纳米颗粒和免疫激动剂的“弹药库”。
而富集的血小板在上述激活状态下还可以进一步分泌纳米级血小板囊泡。“我们观察到纳米级血小板囊泡,将光热纳米颗粒和免疫激动剂运送到肿瘤组织深处,扩大了‘攻击’范围”,魏炜表示。
在研究人员看来,这不仅有利于光热清除更多的肿瘤细胞,而且可以增强肿瘤抗原的免疫原性,在动物实验中完全抑制肿瘤的转移和复发。
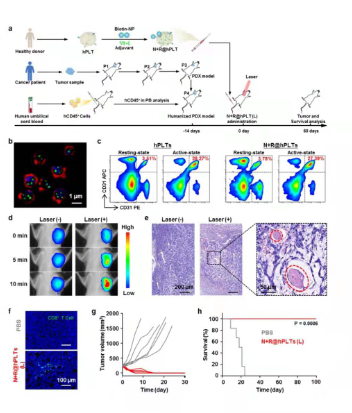
基于人源血小板的仿生剂型在重建人源化免疫系统的病人来源乳腺癌异种移植模型上的疗效:(a)模型的构建及治疗策略;(b)人源血小板仿生剂型的超分辨荧光成像;(c)流式细胞术表征人源血小板仿生剂型聚集能力;(d, e)光热诱导人源血小板仿生剂型在肿瘤部位的聚集;(f)肿瘤组织冰冻切片,显示CD8+ T细胞的浸润;(g, h)小鼠肿瘤生长曲线及生存期曲线(研究团队供图)
马光辉指出,目前,鉴于所装载的纳米颗粒、药物等具有很好的灵活性,并且血小板可从患者或者供体获得,因此,该血小板仿生剂型在肿瘤个体化精准治疗领域具有较好的临床应用前景。
据研究人员介绍,上述成果在通过伦理审批后,已完成人源化血小板剂型的构建,并在重建人源化免疫系统的病人来源肿瘤异种移植模型上确认了显著的疗效,但仍处于动物水平的临床前研究,实际临床疗效仍有待进一步确认。
吕岩霖及过程工程所博士生栗锋为该论文共同第一作者,马光辉研究员、魏炜研究员与田志远教授为该论文共同通讯作者。
该工作得到了国家自然科学基金面上项目、创新群体项目、青年基金项目,国家重点研发计划项目和中科院战略先导科技专项的支持。
相关论文信息:
doi:10.1126/sciadv.abd7614
https://wap.sciencenet.cn/blog-3423233-1278867.html
上一篇:突破!美国密西根大学邹伟平组发现T细胞调控肿瘤免疫的新机制
下一篇:《科学》突破!自身免疫疾病有了新曙光,科学家发现抑制自身免疫的新分子