博文
雌激素抵御肾脏铁死亡损伤  精选
精选
|
雌激素抵御肾脏铁死亡损伤
对 ferroptosis(铁死亡)的保护作用存在性别差异,这也解释了为何男性和绝经后女性比绝经前女性更易发生急性肾损伤。
Multiple oestradiol functions inhibit ferroptosis and acute kidney injury | Nature
急性肾损伤是临床上面临的重大挑战,其发病率高且针对性治疗手段有限。流行病学研究一致表明,女性(尤其是绝经前女性)发生急性肾损伤的概率低于男性,且预后效果更佳[1]。然而,这种性别特异性差异背后的分子机制一直不明确。托纳斯(Tonnus)等人在《自然》(Nature)杂志发表的研究[2],基于 ferroptosis(铁死亡)提出了一个极具说服力的解释——铁死亡是一种受调控的细胞死亡形式,由铁依赖性脂质过氧化反应驱动[3]。
研究人员证实,女性个体肾小管(负责过滤血液的结构)对铁死亡具有强大的抵抗能力,而这种抵抗能力是由性激素雌激素的基因组效应与非基因组效应共同介导的。关键在于,他们发现绝经后女性的这种抵抗能力会显著下降。(本文中使用“男性”“女性”的表述,是为了与该领域常用术语保持一致;但《自然》杂志认可“生理性别(sex)”与“社会性别(gender)”并非二元对立,且二者未必完全一致。)
缺血再灌注损伤是研究中广泛使用的急性肾损伤模型,指组织血液供应中断一段时间后恢复血流时发生的损伤。托纳斯团队在以往研究的基础上进一步发现,雄性小鼠的肾脏比雌性小鼠更易发生缺血再灌注损伤。从小鼠体内分离出的肾小管也保留了这种性别差异,这表明细胞层面存在固有的差异。研究发现,此类模型中细胞死亡的主要形式是铁死亡,而非凋亡(apoptosis)或坏死性凋亡(necroptosis)——这一结论可通过铁死亡抑制剂(如铁抑素-1,Fer-1)的保护作用得到证实。铁抑素-1能显著减轻雄性小鼠肾小管的损伤,但雌性小鼠肾小管本身就具备保护机制,不会从该抑制剂中获得额外益处,这提示雌性个体体内存在一种天然的抗铁死亡机制。
深入研究后,作者发现这种保护作用的关键介质是雌激素,更具体地说,是雌二醇(oestradiol)的羟基化代谢产物,如2-羟基雌二醇(2OH-E2)。铁死亡涉及一种名为脂质过氧化的氧化过程:在该链式反应中,被称为自由基的化合物会氧化膜脂质,生成脂质过氧自由基,进而损伤细胞。作者发现,羟基化雌二醇可作为“捕获自由基的抗氧化物质”——它们能向脂质过氧自由基提供氢原子,使其“失活”,从而终止铁死亡的扩散。体外和体内实验均证实,2-羟基雌二醇能为雄性小鼠肾小管及经历缺血再灌注损伤的雄性小鼠提供强有力的铁死亡保护;而雌性小鼠肾小管中本就富含内源性羟基化雌二醇,因此额外补充该物质并无明显益处。
值得注意的是,作者证实羟基化雌二醇的抗铁死亡作用并非通过“螯合铁离子”实现。他们发现,该作用会被FSP1酶(铁死亡抑制蛋白1,ferroptosis suppressor protein 1)[4,5]增强——FSP1能将氧化态的雌激素再生为活性态。FSP1缺失会使组织对铁死亡更敏感,并提高发挥保护作用所需的羟基化雌二醇浓度。但即便在FSP1缺失的情况下,雌性动物的肾小管仍对铁死亡保持较强的抵抗能力,这一发现提示体内可能存在冗余且互补的防御通路。
事实上,雌激素信号通过转录因子雌激素受体α(ERα,由ESR1基因编码)发挥的基因组效应,是抗铁死亡保护机制的另一核心支柱。与正常表达ESR1的雌性小鼠及肾小管相比,ESR1缺陷型雌性小鼠及分离出的肾小管对铁死亡的敏感性更高、羟基化雌二醇积累量更少,且促铁死亡酶(如烷基甘油磷酸合酶AGPS、脂肪酰辅酶A还原酶1 FAR1)的表达水平更高。
AGPS和FAR1参与醚脂质(ether lipids)的合成,而醚脂质是脂质过氧化反应的底物。作者发现,男性和绝经后女性肾脏中醚脂质的含量高于绝经前女性,这一结果支持“ERα可抑制促铁死亡脂质谱形成”的观点。除脂质代谢外,ERα信号还能增加硫化物的含量——硫化物也具有抵御铁死亡的作用。
引人关注的是,当小鼠的卵巢(雌激素的产生部位)被切除后,雌性动物体内这种多层面的保护作用便会消失。这一效应也体现在绝经后女性的人类肾脏样本中——绝经后女性雌激素水平下降,其肾脏中AGPS和FAR1的表达水平与男性样本相当。这些发现对理解急性肾损伤预后的性别差异具有广泛意义,同时也凸显了“以铁死亡或其上游调控因子为靶点”的潜力,可为制定减少肾脏损伤的个性化策略(尤其是针对绝经后女性)提供方向。
这项肾脏研究与日益增多的证据相呼应:性别特异性铁死亡调控在其他器官系统中也发挥着关键作用。例如,有研究表明羟基化雌二醇可在药物诱导的肝损伤模型中减轻铁死亡损伤[6];同样,绝经前女性心脏对缺血诱导铁死亡的敏感性较低,这可能与雌激素介导的“脂质水平调控”及“氧化还原平衡调节”机制有关[7]。这些器官特异性发现表明,雌激素介导的铁死亡抑制是一种全身性保守防御机制,而该机制会在绝经后减弱——这与肾脏中观察到的保护作用下降趋势一致。
这一机制不仅适用于损伤模型,还可延伸至慢性疾病领域。在神经炎症相关疾病(如多发性硬化症)中,雌性小鼠对铁死亡靶向治疗策略的反应比雄性小鼠更显著[8],这提示性激素在影响神经退行性疾病易感性方面可能具有更广泛的作用。有趣的是,这种性别差异也存在于癌症生物学中:三阴性乳腺癌(缺乏ESR1、HER2和BRCA基因表达)具有“允许铁死亡发生的脂质谱”,这与男性或绝经后女性肾脏中的脂质谱特征相似。三阴性乳腺癌中雌激素信号的缺失可能会降低铁死亡发生的阈值,这为针对这种侵袭性癌症亚型“诱导铁死亡”提供了潜在治疗窗口。
从进化角度来看,男性对铁死亡的高敏感性可能反映了一种生物学权衡。有一种假说认为,胚胎发育过程中,“穆勒管退化”(Müllerian duct regression)过程可能需要增强的铁死亡潜能——在该过程中,未成熟的雌性生殖器官会退化,这是男性性别分化的关键步骤,涉及上皮组织的靶向破坏。
铁死亡调控的性别差异也可能与衰老过程相关。平均而言,女性的寿命比男性更长,这一现象在许多其他物种中也存在。对铁死亡损伤更有效的控制,可能有助于在数十年间维持器官功能,从而为女性带来寿命优势。尽管寿命受多种因素影响,但在雌激素水平较高的生理状态下,脂质过氧化和细胞死亡得到更强抑制,这可能是女性寿命更长的部分原因。
最后,从进化角度看,女性在生育期提高铁死亡发生阈值的优势十分显著。月经周期会导致反复的铁流失和全身性氧化应激,而通过雌二醇及其羟基化衍生物增强细胞抵抗力,可能是进化过程中形成的适应机制——旨在保护女性在这一代谢需求较高的阶段免受重要器官损伤,从而在整个生育期维持肾脏及全身功能。
这项研究是科学家理解急性肾损伤性别差异的里程碑,同时也拓展了铁死亡在癌症和神经退行性疾病之外的生理意义。通过剖析雌激素介导保护作用的非基因组机制与基因组机制,作者揭示了一个“双轴防御系统”——该系统可保护雌性肾小管免受铁死亡损伤(图1)。重要的是,这些发现不仅有助于解释绝经后女性急性肾损伤易感性增加的原因,还为探索“雌激素衍生物”或“铁死亡抑制剂”作为治疗药物提供了合理依据。随着铁死亡逐渐被认可为组织损伤的共性机制,本研究也强调了“性别作为生物学变量”在铁死亡调控中的重要性。
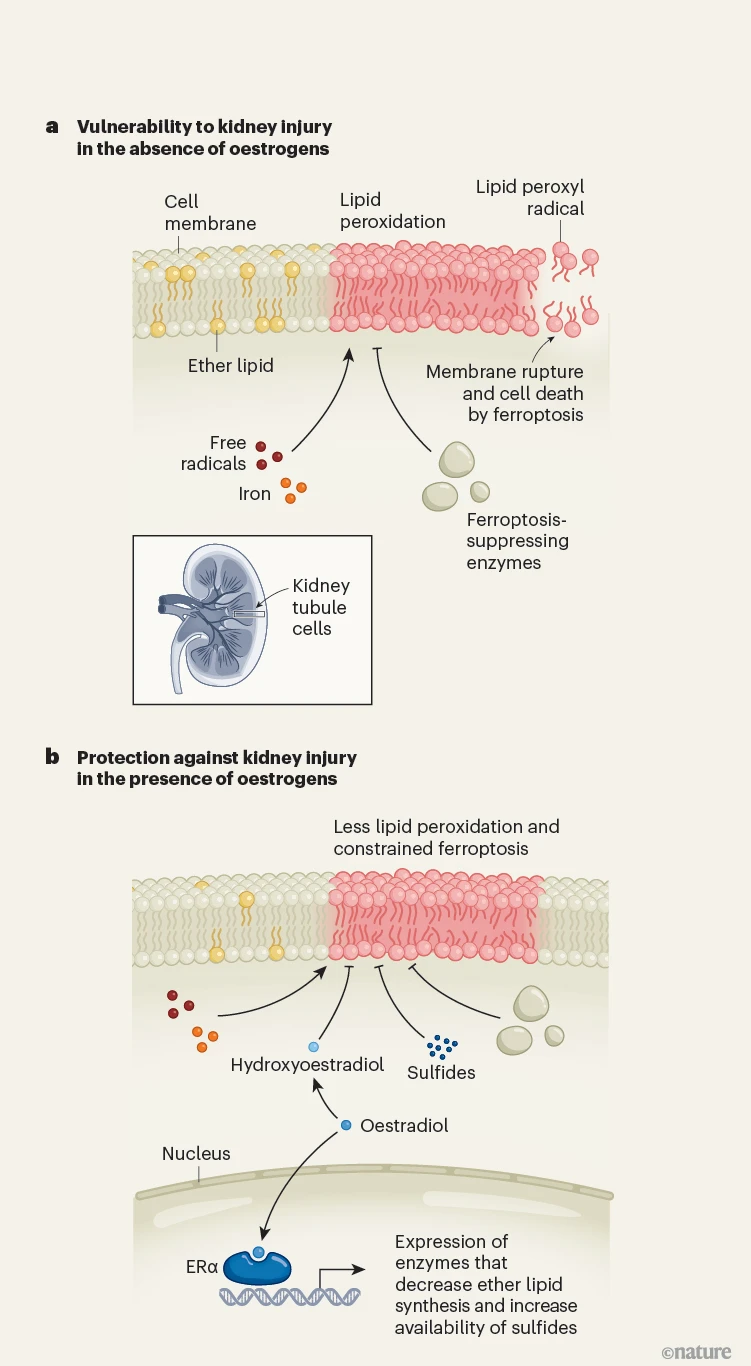
图1 肾脏中的铁死亡细胞死亡过程
托纳斯等人[2]研究了为何雌激素水平相对较高的绝经前女性,比男性和绝经后女性更不易发生急性肾损伤。
a. 缺乏雌激素时,肾小管细胞易发生铁死亡(一种铁依赖性细胞死亡形式):在此过程中,自由基分子会通过“脂质过氧化”作用氧化膜脂质(尤其是醚脂质),生成的脂质过氧自由基会损伤细胞膜并触发细胞死亡。FSP1和GPX4(谷胱甘肽过氧化物酶4)等酶可抑制铁死亡。
b. 主要雌激素——雌二醇(oestradiol)对铁死亡具有强效保护作用:雌二醇的代谢产物(羟基化雌二醇)可作为抗氧化剂,通过“灭活”脂质过氧自由基来限制铁死亡扩散;同时,雌二醇通过雌激素受体α(ERα)传递信号,调控相关酶的表达——这些酶可减少醚脂质的含量,并增加硫化物的生成(硫化物也具有抗氧化作用)。
托纳斯团队的研究还揭示了哪些与铁死亡相关的普遍规律?在稳态条件下,FSP1和GPX4(谷胱甘肽过氧化物酶4)等铁死亡抑制酶似乎是预防铁死亡启动的关键防御因子,但在缺血再灌注损伤等病理状态下(此时需要额外的保护机制),它们可能无法阻止铁死亡的扩散。值得注意的是,羟基化雌二醇现已加入“内源性自由基捕获抗氧化物质”的行列——这类物质还包括维生素E、泛醇、维生素KH₂、维生素A、角鲨烯、四氢生物蝶呤和7-脱氢胆固醇[9],它们是铁死亡的生化“守门人”。
https://wap.sciencenet.cn/blog-41174-1498084.html
上一篇:锂缺乏与阿尔茨海默病的发病
下一篇:氢气治疗免疫性心肌炎信号通路机制