博文
miBd人工合成的类似迷你TCR
||
CD8⁺T 细胞通过T细胞受体(TCR)识别细胞内抗原,这是适应性免疫对抗感染和癌症的核心机制。然而,从患者样本中鉴定出TCR仍然十分复杂。一项新研究提出了一种快速从头设计迷你结合剂(minibander, miBd)的平台,该平台利用最先进的计算机生成模型,设计出靶向识别与癌症相关的肽结合主要组织相容性复合体(pMHC)—SLLMWITQC/HLA-A*02:01(NY-ESO-1)的miBd。通俗的说,miBd是一种人工合成的能精准识别癌细胞表面pMHC复合物的小分子,像“迷你抓手”一样牢牢结合目标,起到特异性识别和结合的作用,来帮助T细胞绑定和杀伤癌细胞。
miBd的设计整合计算机的交叉筛选可实现特异性的预筛选计算,结合分子动力学模拟则有助于提高体外实验成功的可预测性。通过这个平台鉴定出一种高亲和力的NY-ESO-1(癌症相关抗原)miBd,并通过冷冻电子显微镜确认了其结构;将这种整合到嵌合抗原受体中后,可诱导对 NY-ESO-1⁺黑色素瘤细胞的杀伤。研究还设计并验证了针对新抗原 pMHC 复合体 RVTDESILSY/HLA-A*01:01(其结构未知)的结合剂,这证明了该平台在精准免疫治疗中的潜力。
研究中用到了两种关键的电脑模拟技术,来提高miBd的可靠性。一是“in silico cross-panning(计算机交叉筛选)”给miBd做“特异性测试”:在电脑里模拟它和各种相似的“目标分子变体”(比如癌细胞标签上的肽段发生微小突变后的版本)结合的情况,提前筛掉那些会“认错目标”的miBd,确保留下的只专一识别癌细胞的特定标签。二是“molecular dynamics simulations(分子动力学模拟)” miBd做“稳定性预测”:用电脑模拟miBd和目标结合时的动态变化,比如它们之间的相互作用力是否稳定、结合界面会不会轻易松动。通过模拟能更准确地预测哪些miBd在实际实验中能成功结合目标,减少失败率。基于这些模拟结果,选择如NY1-B04这种在结合界面具有最低构象多样性和最低相互作用能量波动的miBd,提高了其与目标pMHC结合的可靠性,优化了亲和力和特异性。
miBd的特点和对pMHC的识别
在该研究中,miBd是人工设计的用于识别pMHC复合物的生物分子,而pMHC(肽结合主要组织相容性复合体)是细胞表面自然存在的复合物,二者的核心区别是本质与来源不同。pMHC是细胞自身合成的天然复合物,由主要MHC(人类中称为 HLA)分子与内源性或外源性肽段结合形成,广泛存在于所有有核细胞表面,其功能是向T细胞展示细胞内的抗原信息(如癌细胞的异常肽段)。而miBd是通过人工智能生成模型(如 RFdiffusion)从头设计的人工蛋白质,不存在于自然生物体内,专门设计用于精准识别特定的pMHC复合物(如癌细胞表面的 NY-ESO-1 相关 pMHC)。
在结构与功能上的不同:pMHC的结构由MHC分子的α1、α2、α3结构域和β2微球蛋白组成,其中α1和α2结构域形成肽结合槽,用来容纳并展示9-11个氨基酸的肽段,其功能是作为T细胞受体(TCR)的识别靶点,启动免疫反应。miBd的结构则是紧密堆积的四个α 螺旋束,这些螺旋几乎平行于pMHC中的肽段排列,通过关键氨基酸残基与pMHC形成盐桥、氢键等相互作用,从而特异性结合目标pMHC;其功能是作为人工识别元件,替代TCR 在免疫疗法中引导T细胞攻击表达特定pMHC的癌细胞。
从多角度看这项技术的实用性和挑战
这项从头设计pMHC结合剂(miBd)的技术展现出显著的潜在价值,同时也存在一定挑战,
1. 临床应用:由于精准性与广谱性兼具,适配个性化治疗。靶向明确,可直接介导抗肿瘤效应。设计的miBd能特异性结合癌细胞表面的pMHC(如NY-ESO-1相关的 SLLMWITQC/HLA-A*02:01),将其整合到嵌合抗原受体(CAR)中后,可诱导 T 细胞对表达该pMHC的癌细胞产生杀伤作用(如NY1-B04 miBd能有效杀死NY-ESO-1⁺黑色素瘤细胞),直接验证了其临床治疗潜力。覆盖已知抗原与未知新抗原,适配多种场景。不仅能靶向结构明确的已知肿瘤抗原(如 NY-ESO-1),还能通过 AlphaFold2 预测结构,设计针对未知结构的新抗原 pMHC(如 RVTDESILSY/HLA-A*01:01),这意味着其可用于个性化癌症治疗 — 针对患者特有的突变抗原定制治疗方案,拓宽了临床适用范围。时间周期短,适应临床快速应用需求。从设计到验证仅需4-6周,远快于传统从患者体内筛选TCR 的数月至数年周期,能更快响应临床治疗需求(如晚期癌症患者的紧急治疗)。
2. 复杂程度:技术流程高度集成,但关键步骤已实现标准化。核心设计依赖计算工具,但流程可标准化。技术核心依赖 RFdiffusion、ProteinMPNN、AlphaFold2 等AI生成模型和结构预测工具,以及分子动力学模拟进行筛选,这些步骤已形成明确的流程(如:生成骨架→序列设计→结构评估→特异性预筛选),且计算成本可控(如单个miBd -靶标复合物的预测耗时< 10 秒)。实验验证步骤成熟,可依托现有平台完成。体外筛选(如哺乳动物试验、四聚体染色)和功能验证(如CAR-T细胞杀伤实验)均基于成熟的细胞生物学技术,无需开发全新实验体系,便于在现有临床前研究平台中推广。
3. 可实用性:具备效率与安全性,和规模化潜力,成功率与特异性能满足实用需求。针对已知抗原的筛选中,能从44个候选miBd中获得1个高亲和力结合剂miBd(NY1-B04, Kd= 6.92nM);针对新抗原的成功率约 2%(96个候选中获得2个有效miBd),且通过计算预筛选大幅降低了假阳性率,减少了后续实验成本。
4. 分子特性适合体内应用:miBd为小型蛋白(由4个α螺旋组成),尺寸远小于抗体,可能降低免疫原性(引发机体对 miBd 自身的免疫反应风险较低),且结合模式稳定(冷冻电镜验证其与 pMHC 的结合构象与预测一致),为体内应用提供了基础。
5. 潜在挑战:需解决免疫原性与体内验证问题。尽管miBd尺寸小,但作为人工设计的全新蛋白,仍有可能引发机体免疫反应(如抗miBd抗体产生);此外,目前仅验证了体外杀伤效果,其体内稳定性、长期安全性及对实体瘤的穿透能力仍需进一步验证,这是其走向临床的关键限制。
研究中提到使用基因修饰的miBd-CAR-T细胞,也称为“immune- targeting minibinder for pMHC activated cytotoxic T”细胞(IMPAC-T)增强了对标靶pMHC肽段的识别。技术上虽然TCR-T与CAR-T都属于改造T细胞的免疫疗法,但核心差异在于识别靶点的工具,TCR-T用的是天然或改造的T细胞受体(TCR),靠它识别癌细胞表面的pMHC(“坏标签”);CAR-T 用的是人工设计的“嵌合抗原受体(CAR)”,传统上CAR识别的是癌细胞表面的蛋白质抗原(而非pMHC)。
而miBd与CAR-T的联系正是通过“工具改造”实现的。研究中的miBd作为一种 “迷你探测器”也是一种 “跨界工具”。它的功能类似TCR专门识别pMHC,但最终是被“装”在CAR上(而不是直接替代TCR)。也就是说,研究团队把miBd作为CAR的“头部识别探测器”,让CAR-T细胞既能像TCR那样精准识别pMHC,又保持了CAR-T“人工改造受体”的技术框架。简单说,这是一种“给CAR-T装上TCR式识别能力”的混合技术:用CAR的结构,搭载 miBd(替代传统CAR的识别部分),让T细胞既能精准盯紧pMHC,又能像CAR-T一样高效杀癌,因此miBd和CAR-T直接联在一起了。
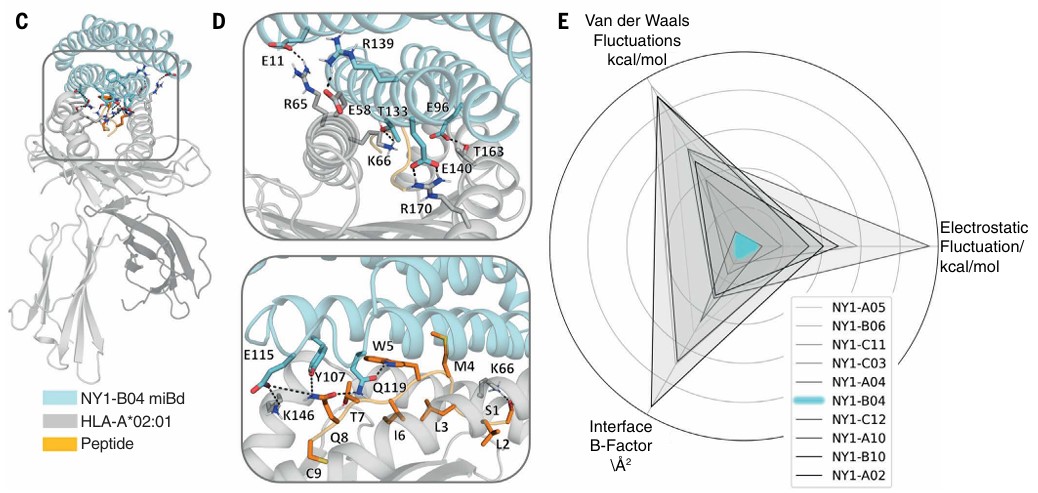
针对pMHC上呈递的NY-ESO-1(157-165)肽段设计的miBds,并采用分子动力学模拟获得的构象多样性评估指标进行筛选
De novo-designed pMHC binders facilitate T cell–mediated cytotoxicity toward cancer cells. Science 24 July 2025
https://wap.sciencenet.cn/blog-3302154-1496378.html
上一篇:大型语言模型GeneAgent预测基因集功能
下一篇:结肠癌中新辅助免疫治疗对比辅助免疫治疗