博文
活性氧跨细胞器处理管理模式《科学》
||
活性氧跨细胞器处理管理模式
过氧化物酶体与线粒体接触处的活性氧转移调控线粒体氧化还原状态
编者摘要
线粒体产生的活性氧(ROS)若未得到适当控制,可能会造成氧化损伤。人们曾认为线粒体通过自身内置的抗氧化系统来处理自身产生的活性氧。然而,富含抗氧化剂的过氧化物酶体出现缺陷会导致线粒体损伤。迪乔瓦尼(DiGiovanni)等人发现过氧化物酶体在调控线粒体活性氧方面发挥着直接作用(参见弗兰森的观点文章)。过氧化物酶体与线粒体之间的膜接触使线粒体活性氧能够直接转移到过氧化物酶体中进行处理。过氧化物酶体作为活性氧的“ sink ”,为细胞抵御氧化损伤提供了一种途径。——斯特拉·M·赫特利
摘要
维持线粒体氧化还原稳态对细胞健康至关重要。线粒体拥有多种内在的抗氧化防御机制,但外在的、非线粒体抗氧化机制的作用尚不明确。我们发现过氧化物酶体通过接触介导的活性氧(ROS)转移,在维持线粒体氧化还原稳态中发挥直接作用。研究发现,ACBD5和PTPIP51在过氧化物酶体与线粒体之间形成接触。在 mitochondrial 氧化应激时,这种接触的比例会增加,并通过将线粒体活性氧转移至过氧化物酶体腔来维持线粒体健康。我们的研究结果揭示了线粒体抗氧化防御的多细胞器层面——提出了过氧化物酶体促进线粒体健康的直接机制,并拓宽了已知膜接触位点功能的范围。
线粒体中电子传递链(ETC)产生活性氧(ROS)是氧化代谢的副产物(1)。维持线粒体氧化还原稳态被认为是一个区室化过程,其中线粒体抗氧化系统清除电子传递链产生的活性氧(2)。然而,长期以来的证据也表明,过氧化物酶体的缺陷会导致活性氧介导的线粒体损伤(3, 4)。过氧化物酶体是普遍存在的膜结合细胞器,含有高浓度的抗氧化酶,尤其是过氧化氢酶(5)。与其他细胞内环境相比,过氧化物酶体的氧化还原环境处于还原状态(6–8)。线粒体氧化应激是过氧化物酶体生物发生障碍的一个明确标志(3, 4),而线粒体功能障碍与过氧化氢酶表达、活性的丧失以及过氧化物酶体定位异常有关(7, 9, 10)。这些发现表明过氧化物酶体参与维持线粒体氧化还原稳态,但其维持机制尚不清楚。鉴于过氧化物酶体的抗氧化能力,我们推测它们作为线粒体活性氧的“ sink ”,直接作用于线粒体氧化还原稳态。
线粒体与细胞内几乎所有区室都形成膜接触位点(11)。这种接触位点通过促进脂质、代谢物和离子等分子的细胞器间转移,对维持线粒体代谢功能、脂质组成、分裂和定位至关重要(12)。已知活性氧可作为信号分子调控线粒体 - 内质网(ER)接触位点(13–17)。然而,膜接触位点是否也能作为抗氧化功能来转移细胞器之间的活性氧,目前尚不清楚。我们研究了过氧化物酶体 - 线粒体(PO-Mito)接触位点是否通过促进线粒体产生的活性氧转移至过氧化物酶体,从而在 mitochondrial 氧化还原稳态中发挥作用。
线粒体氧化应激触发过氧化物酶体 - 线粒体接触
我们开发了一种时空成像方法来测量过氧化物酶体 - 线粒体接触。我们使用高分辨率激光扫描共聚焦显微镜,收集转染了荧光过氧化物酶体和线粒体标记物的细胞的延时多 z 轴图像,并追踪每个过氧化物酶体到最近线粒体的边缘到边缘像素距离随时间的变化(图1A和图S1A)。将这些并列事件(≤1个像素)与结合持续时间作图,符合双组分指数衰减模型,表明存在两种具有不同时间特征的过氧化物酶体 - 线粒体并列事件(图1B)。我们推断,持续时间较长的并列事件可能是真正的接触事件,而短暂的事件可能是非特异性相互作用或衍射极限成像的产物,因此我们使用从双组分指数衰减模型计算出的慢 τ 值,将过氧化物酶体 - 线粒体接触经验性地定义为持续时间 >31秒且并列事件 ≤1个像素。未观察到该测量值与线粒体体积(图S1B)或过氧化物酶体体积(图S1C)之间存在相关性,这表明细胞器密度不会干扰测量。为了验证这种接触量化方法,我们测量了COS-7细胞中的过氧化物酶体 - 内质网接触。正如预期的那样,在用小干扰RNA(siRNA)敲低过氧化物酶体 - 内质网连接蛋白ACBD5 [酰基辅酶A(CoA)结合域蛋白5]、VAPA(囊泡相关膜蛋白相关蛋白A)和VAPB后,观察到过氧化物酶体 - 内质网接触减少(图S2A至D)(18, 19)。我们还观察到,在表达过氧化物酶体 - 线粒体人工连接蛋白(AT)(一种TOM20-Cer-PEX26融合蛋白)后,过氧化物酶体 - 线粒体接触显著增加(图S2E至H)。
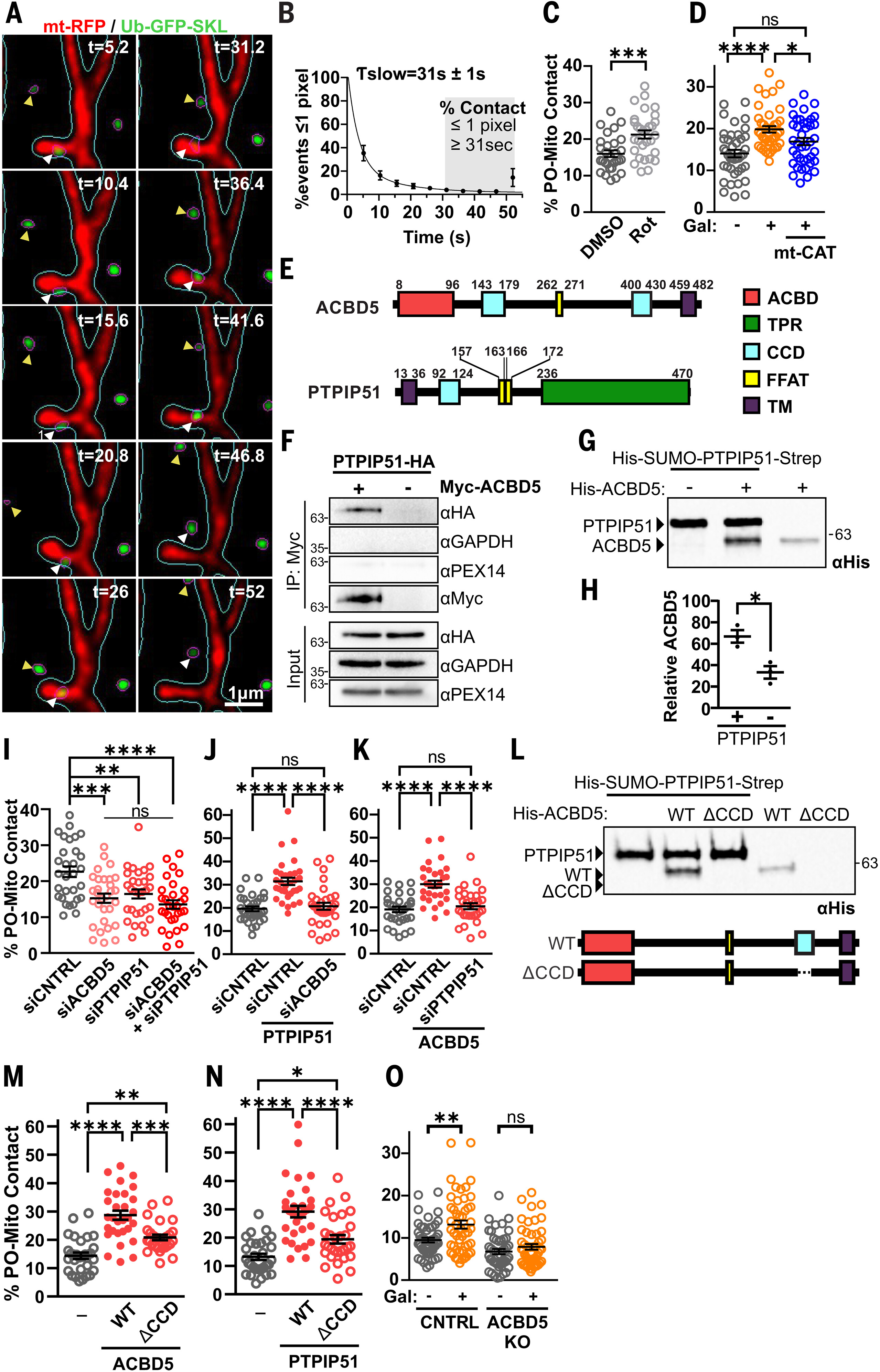
图1. ACBD5和PTPIP51在线粒体氧化应激时介导过氧化物酶体 - 线粒体接触
(A)表达mt-RFP和Ub-GFP-SKL的HeLa细胞的活细胞图像(经图像分割后)。蓝色轮廓,线粒体片段;洋红色轮廓,过氧化物酶体片段;白色箭头,长时并列;黄色箭头,短时并列;t,时间(秒)。(B)1个像素或更少的并列事件百分比与持续时间的关系,拟合双组分指数衰减模型(n = 82;N = 9)。(C和D)Huh7对照细胞用500 nM鱼藤酮(Rot)处理30分钟(n = 30;N = 3)(C)或用4.5 g/升半乳糖(+)或葡萄糖(-)±mt–myc-CAT-ΔKANL(mt-CAT)处理24小时(n = 40;N = 4)(D)后的过氧化物酶体 - 线粒体接触百分比。DMSO,二甲基亚砜。(E)ACBD5和PTPIP51的示意图。标示氨基酸位置。ACBD,乙酰辅酶A结合域;FFAT,酸性区域中的两个苯丙氨酸;CCD,卷曲螺旋域;TM,跨膜;TPR,四肽重复序列。(F)甲醛交联后,人胚肾293细胞中myc-ACBD5和PTPIP51–HA(血凝素)的共免疫沉淀(IP)。(G和H)ACBD5-PTPIP51在体外结合的免疫印迹(G)和定量(H)。通过链霉亲和标签将His-SUMO-PTPIP51-Strep固定在磁珠上,并与来自细菌裂解物的His-ACBD5一起孵育。(I至K)用ACBD5和/或PTPIP51 siRNA处理的HeLa细胞中的过氧化物酶体 - 线粒体接触百分比(n = 30;N = 3)(I)±PTPIP51-HA表达(n = 32;N = 3)(J)或myc-ACBD5表达(n = 30;N = 3)(K)。(L)如(G)中所述,PTPIP5与ACBD5WT(WT)或ACBD5ΔCCD(ΔCCD)在体外结合的免疫印迹。(M和N)过表达外源WT或ΔCCD Myc-ACBD5(M)或PTPIP51-HA(n = 30;N = 3)(N)的HeLa细胞中的过氧化物酶体 - 线粒体接触百分比。(O)在葡萄糖或半乳糖中培养的对照或ACBD5敲除Huh7细胞中的过氧化物酶体 - 线粒体接触百分比[从左到右n = 50、50、47和49;N = 5]。n,细胞数量;N,独立实验;双尾Mann-Whitney检验(C);单因素方差分析(ANOVA)与事后Tukey检验[(D)、(I)至(K)、(M)和(N)];双尾非配对t检验(H);双因素方差分析与事后Tukey检验(O)。数据为平均值±标准误。*P < 0.05;**P < 0.01;***P < 0.001;****P < 0.0001;ns,不显著。
接下来,我们使用该指标评估过氧化物酶体 - 线粒体接触是否对线粒体氧化应激有反应。用鱼藤酮(一种强效线粒体活性氧诱导剂)处理后,Huh7细胞中的过氧化物酶体 - 线粒体接触增加(图1C)(20)。当培养细胞在半乳糖或棕榈酸中生长(作为更生理的诱导线粒体活性氧产生的方法)时,观察到类似的结果(图1D和图S3A、B)(21, 22)。通过邻近连接测定进一步验证了在半乳糖处理下观察到的过氧化物酶体 - 线粒体接触增加(图S3C、D)。通过表达定位于线粒体基质的过氧化氢酶(mt-CAT,其中过氧化物酶体靶向序列已被删除)来增强线粒体氧化还原能力,可减弱在半乳糖或棕榈酸补充培养基中过氧化物酶体 - 线粒体接触的增加(图1D以及图S3B、S4)。因此,过氧化物酶体 - 线粒体接触会随着线粒体氧化应激的升高而增加。
ACBD5和PTPIP51介导过氧化物酶体 - 线粒体接触
尽管之前在哺乳动物细胞中观察到过氧化物酶体与线粒体之间的接触,但尽管在酵母中已描述了几种连接成分,哺乳动物中的连接成分尚未被鉴定(11, 23–25)。为了鉴定和表征负责这种应激响应性接触的过氧化物酶体 - 线粒体连接蛋白,我们对过氧化物酶体连接蛋白ACBD5进行了BioID筛选,据报道该蛋白可作为过氧化物酶体 - 内质网连接蛋白(图1E和数据S1)(18, 19)。线粒体外膜蛋白PTPIP51(蛋白酪氨酸磷酸酶相互作用蛋白51)——据报道可作为线粒体 - 内质网连接蛋白(26),被鉴定为潜在的ACBD5相互作用伙伴(图1E和图S5)。在PTPIP51的BioID中 reciprocal 鉴定出ACBD5,支持了这一观察结果(图S6)。
外源性表达的ACBD5和PTPIP51可被共免疫沉淀(图1F),并且通过细菌表达系统证实了这些蛋白之间的直接相互作用(图1G、H)。在siRNA介导的ACBD5或PTPIP51敲低后,HeLa细胞中的过氧化物酶体 - 线粒体接触减少,共敲低时未观察到叠加减少(图1I和图S7A)。相反,ACBD5或PTPIP51的过表达导致过氧化物酶体 - 线粒体接触增加,而对应物的siRNA敲低可阻止这种增加(图1J、K)。电子显微镜也观察到ACBD5和PTPIP51过表达后过氧化物酶体 - 线粒体接触增加(图S7B至D)。因此,ACBD5-PTPIP51的直接相互作用似乎调控着过氧化物酶体 - 线粒体接触。
ACBD5和PTPIP51在1:1异二聚体(图S8C、D)和2:2异四聚体(图S8E、F)中的AlphaFold多聚体模拟(图S8)在卷曲螺旋域(CCDs)之间产生高置信度定位,这些卷曲螺旋域被预测为反平行左手卷曲螺旋(图S8G)。与该预测一致,ACBD5的CCD缺失突变体(ACBD5ΔCCD)(图S9A)在体外不与PTPIP51相互作用(图1L和图S9B、C),即使其浓度远高于野生型(WT)ACBD5(图S9D、E)。此外,与全长蛋白相比,ACBD5ΔCCD和PTPIP51的CCD缺失突变体(PTPIP51ΔCCD)(图S9F)在HeLa细胞中增加过氧化物酶体 - 线粒体接触的能力受损(图1M、N)。因此,CCD似乎是介导ACBD5-PTPIP51相互作用所必需的,并且对过氧化物酶体 - 线粒体接触的形成至关重要。
ACBD5被敲除的Huh7细胞系(ACBD5KO)显示过氧化物酶体 - 线粒体接触减少,重新引入ACBD5可挽救这一现象,但ACBD5ΔCCD不能(图S10A至D)。ACBD5KO细胞的过氧化物酶体密度或基质蛋白输入未受损,而是过氧化物酶体基质蛋白过氧化氢酶和ACOX1的定位增强(图S10E至H)。ACBD5KO细胞中C16:0二羧酸脂肪酸(16-DCA)的过氧化物酶体β-氧化略有减少(图S10I),这与之前关于C26:0的报道一致(27–29)。在用16-DCA脉冲追踪后,乙酸盐:二氧化碳(CO2)比率未观察到差异(图S10I至K),表明过氧化物酶体来源的β-氧化中间体向线粒体的转运未受损。棕榈酸的降解也没有缺陷(图S10L),表明线粒体β-氧化未受损。然而,与对照(CNTRL)细胞不同,当半乳糖是主要碳源时,ACBD5KO Huh7细胞中的过氧化物酶体 - 线粒体接触没有增加(图1O和图S3C、D),这表明ACBD5-PTPIP51介导的接触在响应线粒体氧化代谢升高时会上调。
过氧化物酶体接触维持线粒体氧化还原稳态
还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)之间的可逆转化是催化过氧化氢(H2O2)还原的核心细胞抗氧化系统。稳态GSSG:GSH比值常被用作区室氧化还原状态的指标。通过细胞质Grx1-roGFP2(c-Grx1-roGFP2)测定,ACBD5KO细胞的细胞质谷胱甘肽库比对照细胞更具氧化性(图2A、B),这是一种用于检测GSSG:GSH比值的比率报告因子,可检测亚细胞氧化还原的内源性变化(14, 30)。ACBD5KO细胞中核因子红细胞2相关因子2(NRF2)的核水平也升高,NRF2是一种通过诱导抗氧化反应基因的表达来响应氧化应激的转录因子。NRF2的核定位通过之前显示代表核NRF2的迁移率变化来指示,并且这种变化与H2O2处理所见的响应相似(图2C、D和图S11A、B)(31)。这些数据表明,在过氧化物酶体 - 线粒体接触缺陷的细胞中,细胞整体氧化状态升高。

图2. 过氧化物酶体接触维持线粒体氧化还原稳态
(A)对照和ACBD5KO Huh7细胞中c–Grx1-roGFP2的代表性图像。光谱尺度表示400:480发射比率。(B)从(A)中量化的氧化百分比[从左到右n = 96和91;N = 6]。(C和D)对照和ACBD5KO Huh7细胞中核Nrf2的免疫印迹(C)和定量(D)。C,细胞质;L,长时间曝光;N,核;S,短时间曝光。(E)表达或不表达TOM20-GFP-PEX26(AT)的对照和ACBD5KO Huh7细胞中线粒体的代表性图像。(F和G)从(E)中量化的每个线粒体的平均面积(F)和每个感兴趣区域(ROI)的线粒体数量(G)[从左到右n = 61、42、64和44;N = 5]。(H至J)与(E)至(H)相同,但表达mt–GFP-CAT-ΔKANL(mt-CAT)[从左到右n = 46、36、37和41;N = 3]。(K)半乳糖处理后平均TMRM强度的百分比降低,从图S11F、G中量化(N = 4)。RFI,相对荧光强度。(L和N)在ACBD5KO Huh7细胞中,单独转染H2B-GFP或与AT或mt–myc-CAT-ΔKANL(mt-CAT)共表达(L),或单独转染H2B-GFP或与WT或ΔCCD Myc-ACBD5共表达,在4.5 g/升葡萄糖或半乳糖培养基中培养24小时(N)的TMRM代表性图像。虚线轮廓,转染细胞。(M和O)从(L)中量化的半乳糖处理后平均TMRM强度的百分比降低(N = 7)(M)或从(N)中量化的结果(N = 3)(O)。n,细胞数量;N,独立实验;双尾Mann-Whitney检验(B);双尾非配对t检验[(D)和(K)];双因素方差分析与事后Tukey检验[(F)、(G)、(I)和(J)];重复测量单因素方差分析与事后Tukey检验[(M)和(O)]。数据为平均值±标准误[(B)、(D)、(F)、(G)、(I)和(J)];箱线图显示四分位数,须线延伸至第5和第95百分位数[(K)、(M)和(O)]
线粒体融合会在线粒体氧化应激时被激活(32, 33)。因此,我们评估了ACBD5敲除(ACBD5KO)细胞中的线粒体形态是否发生改变,以此作为过氧化物酶体-线粒体(PO-Mito)接触缺陷细胞中线粒体氧化应激的指标。通过测量线粒体面积增加和数量减少发现,与对照(CNTRL)细胞相比,ACBD5KO细胞中的线粒体呈现出伸长形态(图2E-J)。我们观察到对照细胞和ACBD5KO细胞的线粒体密度没有差异,这表明线粒体生物合成未受影响(图S11C)。通过表达PO-Mito人工连接蛋白(AT)恢复PO-Mito接触后,ACBD5KO细胞的线粒体形态得以挽救(图2E-G),这表明伸长形态是由于PO-Mito接触缺失所致。同样,表达线粒体靶向过氧化氢酶(mt-CAT)也能挽救线粒体形态(图2H-J和图S4),这提示ACBD5KO细胞中 mitochondria 伸长形态是由线粒体氧化应激升高引起的。
线粒体通过轻微的膜解偶联作为一种抗氧化机制(34)。因此,我们在非淬灭条件下使用四甲基罗丹明甲酯(TMRM)检测ACBD5KO细胞的线粒体膜电位(图S11D、E),以此作为线粒体氧化应激升高的指标。在基础生长条件下,与对照细胞相比,ACBD5KO细胞的线粒体膜电位显著降低(图S11F、G)。与对照细胞相比,ACBD5KO细胞在应对半乳糖时,线粒体膜电位的损失也显著更大(图2K和图S11F、G)。表达PO-Mito人工连接蛋白(AT)以及ACBD5野生型(ACBD5WT)可减轻半乳糖诱导的ACBD5KO细胞线粒体膜电位下降,而ACBD5ΔCCD则不能(图2L-O)。这表明ACBD5介导的PO-Mito接触对活性氧(ROS)诱导的线粒体膜电位丧失具有保护作用。表达线粒体靶向过氧化氢酶(mt-CAT)后未观察到显著挽救效果(图2L、M),这与之前的报道一致,即线粒体靶向抗氧化剂过表达后会导致膜电位缺陷,这可能是由于线粒体功能的氧化还原调控受损所致(35)。因此,在PO-Mito接触缺陷的ACBD5KO Huh7细胞中,线粒体氧化应激标志物升高。
过氧化物酶体接触减轻线粒体氧化应激
使用线粒体基质靶向的Grx1-roGFP2(mt-Grx1-roGFP2)检测发现,对照细胞和ACBD5KO Huh7细胞的基础线粒体谷胱甘肽氧化还原状态没有差异(图3A-C和图S12A、B)。这可能是由于上述缓解氧化应激的代偿性适应变化,或者是因为PO-Mito接触可能仅在氧化应激条件下才有助于氧化还原稳态。因此,我们结合氧化应激和氧化还原探针评估了ACBD5KO细胞维持线粒体氧化还原稳态的能力(图3A)。在半乳糖中培养的ACBD5KO细胞显示线粒体谷胱甘肽氧化显著升高,而对照细胞则无显著变化(图3B、C)。表达PO-Mito人工连接蛋白(AT)以及ACBD5野生型(ACBD5WT)可消除半乳糖处理的ACBD5KO细胞中mt-Grx1-roGFP2氧化的增加,而ACBD5ΔCCD则不能(图3B-E)。因此,PO-Mito接触有助于减轻半乳糖代谢产生的线粒体活性氧,导致ACBD5KO细胞对谷胱甘肽维持氧化还原稳态的依赖性增加。
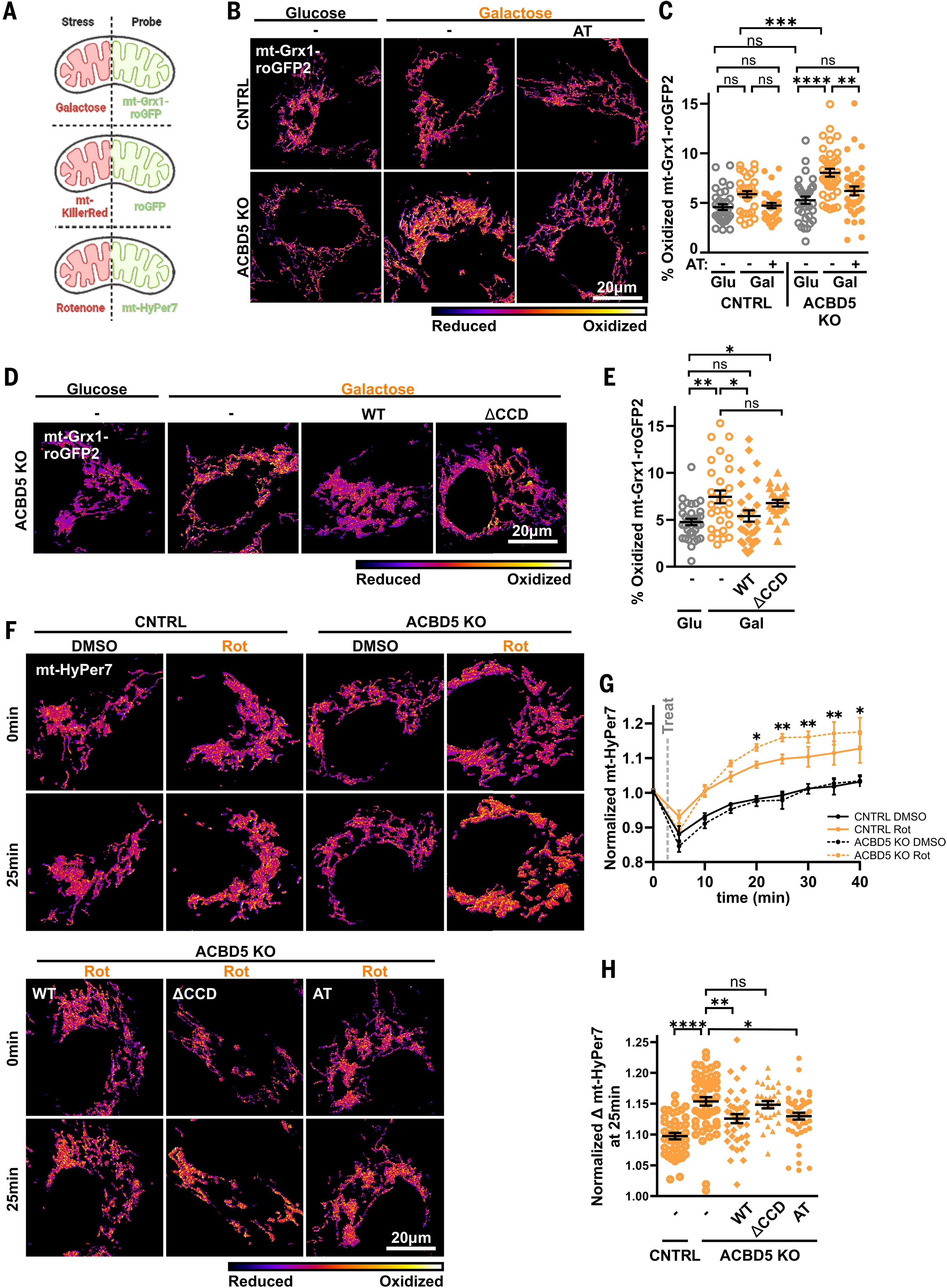
图3. 过氧化物酶体接触减轻线粒体氧化应激
(A)应激和探针实验条件示意图。(B和D)对照和ACBD5KO Huh7细胞转染mt-Grx1-roGFP2和人工连接蛋白(AT)(B),以及ACBD5KO Huh7细胞转染mt-Grx1-roGFP2和野生型或ΔCCD Myc-ACBD5,在4.5 g/升葡萄糖(Glu)或半乳糖(Gal)中培养24小时(D)的代表性图像。光谱尺度表示发射荧光的400:480比率。(C和E)从(B)中量化的mt-Grx1-roGFP2氧化百分比[从左到右n=33、32、31、34、38和37;N=3](C),或从(D)中量化的结果[从左到右n=33、29、32和27;N=3](E)。(F)在对照和ACBD5KO Huh7细胞中表达mt-HyPer7,如所示共转染人工连接蛋白(AT)、Myc-ACBD5WT或Myc-ACBD5ΔCCD,在添加20 nM鱼藤酮(Rot)之前或25分钟后的代表性图像。(G)鱼藤酮或溶媒处理后40分钟内平均mt-HyPer7比率变化的量化(N=4)。(H)鱼藤酮处理25分钟后每个细胞的mt-HyPer7比率变化的量化(n=41、49、38、29和47;N=4)。数据为平均值±标准误。n,分析的细胞数量;N,独立实验;双因素方差分析与事后Tukey检验[(C)和(G)];单因素方差分析与事后Tukey检验[(E)和(H)]。
通过线粒体靶向的KillerRed(mt-KR)进行急性氧化损伤后也观察到类似结果,mt-KR是一种荧光团,其诱导线粒体活性氧产生的方式与mt-KR表达呈线性相关(36)。通过光漂白mt-KR诱导急性线粒体活性氧产生,并通过比较漂白前后的mt-roGFP2来确定线粒体谷胱甘肽氧化还原状态的变化。在ACBD5KO细胞中,mt-roGFP2的变化作为mt-KR表达的函数比在对照细胞中更大(图S12C、D),这表明与对照细胞相比,ACBD5KO细胞在清除同等水平的活性氧时更依赖谷胱甘肽。共表达PO-Mito人工连接蛋白(AT)可挽救这种增加,证实PO-Mito接触有助于减少线粒体产生的活性氧。
我们还使用靶向线粒体基质的HyPer7(37)(mt-HyPer7),在鱼藤酮诱导线粒体活性氧产生后直接测量线粒体过氧化氢(H₂O₂)。鱼藤酮处理后40分钟内,ACBD5KO Huh7细胞中mt-HyPer7的氧化程度比对照细胞更大(图3F、G)。我们在通过siRNA敲低ACBD5的A549细胞中也观察到这种鱼藤酮诱导的应激增强(图S12E、F)。表达PO-Mito人工连接蛋白(AT)和ACBD5野生型(ACBD5WT)可减弱鱼藤酮对ACBD5KO细胞中mt-HyPer7的影响,而ACBD5ΔCCD则不能(图3F、H)。这表明线粒体减轻鱼藤酮诱导的过氧化氢(H₂O₂)的能力依赖于ACBD5介导的接触。因此,ACBD5介导的PO-Mito接触是氧化应激期间维持线粒体氧化还原稳态的关键机制。
接触促进线粒体活性氧转移至过氧化物酶体
我们假设PO-Mito接触促进线粒体产生的活性氧转移至过氧化物酶体,以减轻线粒体氧化应激。支持这一模型的是,尽管过氧化氢酶总丰度没有变化(图S13E、F),但在半乳糖补充培养基中培养的细胞中,过氧化氢酶向过氧化物酶体的定位显著增强(图S13A-D)。鱼藤酮处理后,过氧化氢酶向过氧化物酶体的定位也增强,当细胞先在半乳糖中培养时,这种增强更为明显(图S13G、H),这与鱼藤酮诱导的活性氧形成对还原型烟酰胺腺嘌呤二核苷酸(NADH):氧化型烟酰胺腺嘌呤二核苷酸(NAD⁺)的依赖性一致。这种响应线粒体氧化应激而增加的过氧化物酶体氧化还原能力,与过氧化物酶体作为线粒体活性氧的还原“ sink ”相符。对照细胞中应激诱导的过氧化氢酶表型也与ACBD5KO细胞中过氧化氢酶的基础过氧化物酶体定位增强相似(图S10E、G、H),这表明ACBD5KO细胞在基础条件下经历更高的氧化应激,与我们之前的观察结果一致。
为了直接验证过氧化物酶体作为线粒体产生的活性氧的还原“ sink ”的作用,我们在诱导线粒体氧化应激时测量了过氧化物酶体的氧化还原状态(图4A)。使用靶向过氧化物酶体基质的Grx1-roGFP2(Grx1-roGFP2-SKL)(图S14A、B),我们发现对照Huh7细胞在半乳糖诱导的线粒体氧化应激后,过氧化物酶体谷胱甘肽氧化增加(图4B、C)。共表达线粒体靶向过氧化氢酶(mt-CAT)可减弱这种增加,证实半乳糖诱导的过氧化物酶体氧化还原状态变化与线粒体中产生的活性氧直接相关。遗憾的是,靶向过氧化物酶体基质的HyPer7(图S14C、D)不适合评估响应线粒体氧化应激的过氧化物酶体过氧化氢(H₂O₂),因为鱼藤酮处理后过氧化氢酶定位的变化(图S13G、H)对HyPer7直接测量过氧化氢(H₂O₂)有干扰影响(图S15)。
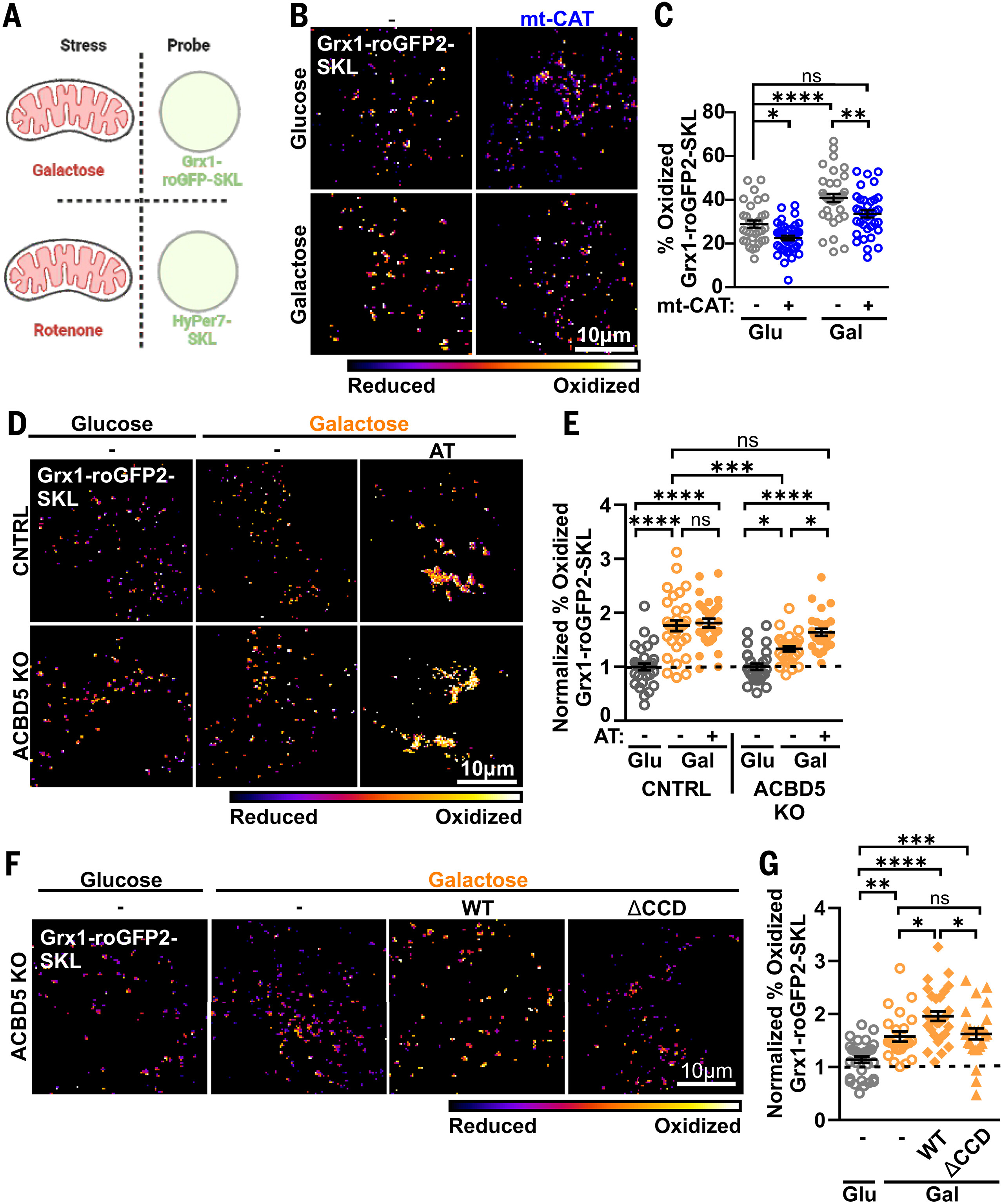
图4. 线粒体产生的活性氧在接触位点转移至过氧化物酶体
(A)应激和探针实验条件示意图。(B)转染Grx1-roGFP2-SKL并在4.5 g/升葡萄糖(Glu)或半乳糖(Gal)中培养24小时,且共表达或不共表达mt-myc-CAT-ΔKANL(mt-CAT)的对照Huh7细胞的代表性图像。光谱尺度表示发射荧光的400:480比率。(C)从(A)中量化的Grx1-roGFP2-SKL氧化百分比[从左到右n=32、40、37和36;N=4]。(D和F)转染mGrx1-roGFP2-SKL和人工连接蛋白(AT)的对照和ACBD5KO Huh7细胞(D),以及转染Grx1-roGFP2-SKL且共转染或不共转染Myc-ACBD5WT或Myc-ACBD5ΔCCD的ACBD5KO Huh7细胞(F),在4.5 g/升葡萄糖、半乳糖中培养24小时的代表性图像。光谱尺度表示发射荧光的400:480比率。(E和G)从(D)中量化的Grx1-roGFP2-SKL氧化百分比[从左到右n=33、31、28、29、29和27;N=3](E),或从(F)中量化的结果[从左到右n=43、38、41和35;N=3](G),在每种细胞类型内归一化至葡萄糖处理条件。n,分析的细胞数量;N,独立实验;双因素方差分析与事后Tukey检验[(C)和(E)];单因素方差分析与事后Tukey检验(G)。数据为平均值±标准误。
为了测试线粒体活性氧向过氧化物酶体的转移是否通过PO-Mito接触发生,我们评估了ACBD5KO细胞中过氧化物酶体氧化还原状态对线粒体氧化应激的响应性是否受损。尽管与对照相比,ACBD5KO细胞中基础过氧化物酶体谷胱甘肽氧化升高,但表达PO-Mito人工连接蛋白(AT)(图S16A、B)或线粒体靶向过氧化氢酶(mt-CAT)(图S16C、D)后均未观察到变化,这表明这种增加与PO-Mito接触和线粒体氧化还原均无关。ACBD5KO细胞过氧化物酶体中这种升高的基础谷胱甘肽氧化可能是由于ACOX1升高(之前在ACBD5KO小鼠中已有描述(29),我们在本研究中也观察到了这一点(图S10G)),或者是由于ACBD5KO细胞中观察到的胞质谷胱甘肽氧化升高(图2A、B)导致过氧化物酶体氧化型谷胱甘肽(GSSG)的胞质还原受损(38)。
在ACBD5KO细胞中,半乳糖诱导的过氧化物酶体谷胱甘肽氧化增加显著低于对照细胞(图4D、E和图S16E),这表明在PO-Mito接触缺陷的细胞中,线粒体活性氧向过氧化物酶体的转移受损。表达PO-Mito人工连接蛋白(AT)以及ACBD5野生型(ACBD5WT)可挽救ACBD5KO细胞中过氧化物酶体氧化还原状态对半乳糖的响应,而ACBD5ΔCCD则不能(图4F、G和图S16F)。因此,线粒体活性氧向过氧化物酶体的转移是通过依赖于PO-Mito接触的机制发生的。
讨论
尽管过氧化物酶体功能障碍与线粒体氧化应激之间的相关性已得到充分证实,但尚未发现其机制联系。我们的研究表明,过氧化物酶体通过接触介导的活性氧转移在维持线粒体氧化还原稳态中发挥直接作用。我们鉴定了一个由过氧化物酶体膜蛋白ACBD5和线粒体外膜蛋白PTPIP51介导的PO-Mito接触位点。我们证明,这种接触以及过氧化物酶体氧化还原能力会响应线粒体氧化应激而动态调节,以促进活性氧转移并维持线粒体氧化还原稳态(图S17)。这项研究揭示了过氧化物酶体在维持线粒体氧化还原稳态中的直接功能作用,并表明过氧化物酶体疾病中的线粒体应激可能是由于接触介导的线粒体活性氧向过氧化物酶体的转移丧失所致。我们描述了细胞器腔和基质之间的活性氧交换作为一种抗氧化机制的证据,这改变了我们对细胞如何应对氧化应激的理解,并表明氧化还原稳态是一个多细胞器过程。
线粒体活性氧外流至过氧化物酶体是一种在概念上具有吸引力的防止线粒体氧化损伤的机制。由于线粒体含有大量铁,将活性氧转移至过氧化物酶体可防止羟基自由基形成和线粒体氧化损伤。此外,由于过氧化氢酶还原过氧化氢(H₂O₂)时不消耗还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH),与谷胱甘肽系统不同,过氧化物酶体对线粒体活性氧的还原不受还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)再生限制的直接影响。
我们的研究表明,接触位点介导细胞器腔和基质之间的活性氧转移。我们推测,细胞器之间的活性氧运输可能比之前假设的更为普遍,并且过氧化物酶体可能还调节其他细胞器(如吞噬体(39)和内质网(40, 41))的氧化还原稳态。
为了解释过氧化物酶体接触如何有效地转移整个线粒体网络产生的活性氧,我们推测过氧化物酶体接触位点在空间上与电子传递链(ETC)活性和活性氧产生相偶联。空间特异性与其他线粒体接触相关;例如,内质网-线粒体接触与线粒体接触位点和嵴组织系统(MICOS)复合物并列,酵母中的PO-Mito接触与线粒体乙酰辅酶A合成位点相邻(42, 43)。尽管线粒体内部的代谢亚结构域尚未得到充分证实,但研究表明单个嵴具有不同的膜电位并且功能独立,这表明线粒体中的活性氧产生可能受到空间调控(44)。
https://wap.sciencenet.cn/blog-41174-1493229.html
上一篇:氢(氢化镁)增强声动力疗法
下一篇:6小时吸氢对新生儿缺氧缺血性脑损伤的保护作用