博文
小胶质细胞替代治疗脑部疾病  精选
精选
|
小胶质细胞替代治疗脑部疾病
今日,由复旦大学彭勃、饶艳霞,上海交通大学曹立课题组联合的科研团队在顶级期刊《科学》发文[1],首次在人类患者中验证了小胶质细胞替代疗法的可行性。不过研究者们选择的疾病大家可能不太熟悉,是一种由集落刺激因子1受体基因(CSF1R)突变导致的常染色体显性遗传病,成人起病的脑白质病伴轴索球样变和色素胶质细胞(ALSP)。
换掉大脑的免疫细胞可以减缓毁灭性神经系统疾病的进展
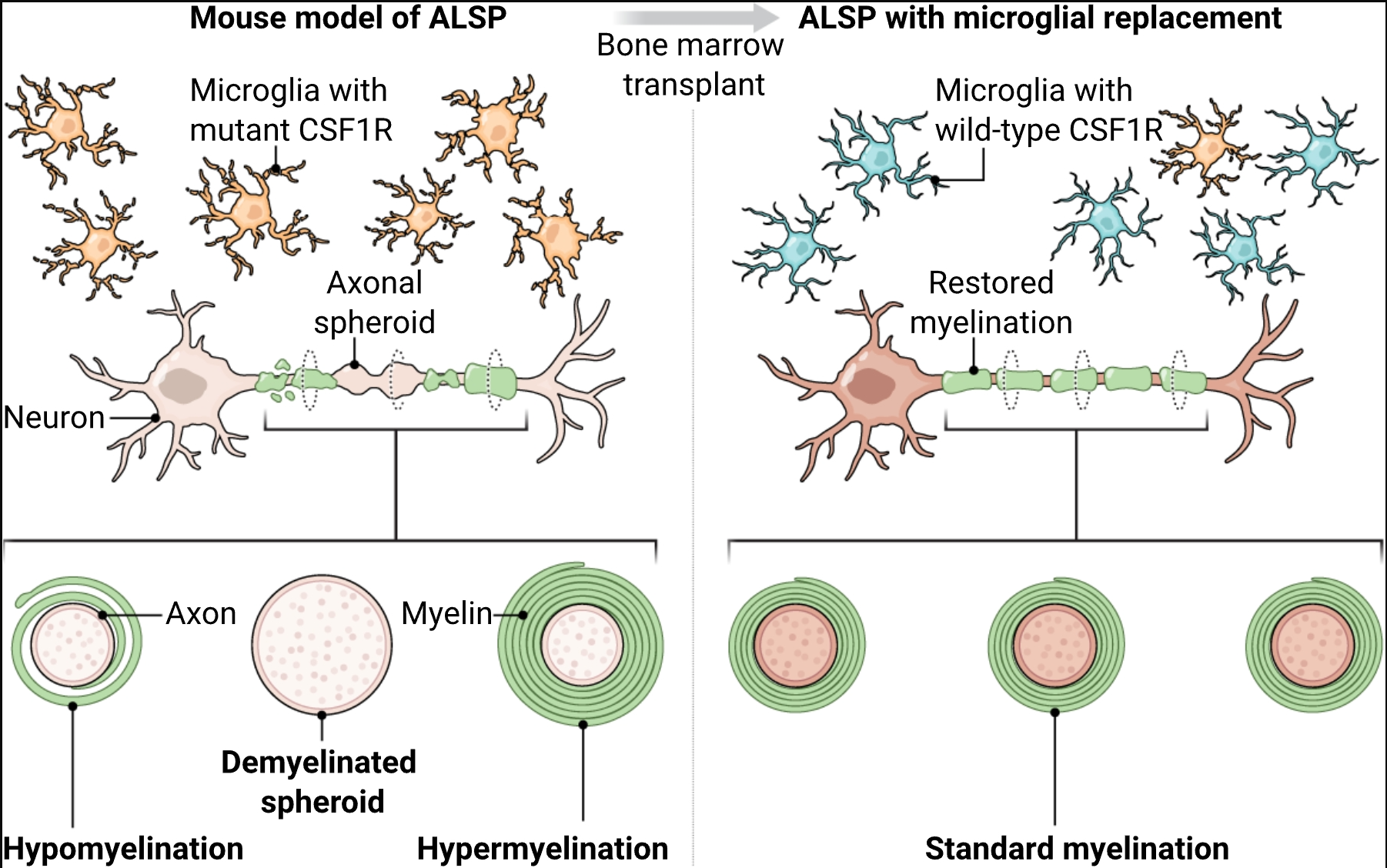
小胶质细胞是大脑中的常驻巨噬细胞,对于维持中枢神经系统稳态和协调免疫反应至关重要。小胶质细胞的内在功能障碍可能引发一组被称为原发性小胶质细胞病的疾病。一个典型例子是成人发病的伴轴突 spheroids 和色素性神经胶质的白质脑病(ALSP),这是一种致命的神经系统疾病,由集落刺激因子1受体基因(CSF1R)突变引起,该基因对小胶质细胞的发育和存活至关重要(1)。十余年前,人们就已明确ALSP的遗传基础,但针对其根源的有效治疗策略仍难以捉摸(1)。在本期杂志第145页,Wu等人(2)报道,用野生型骨髓来源细胞替代含有CSF1R突变的小胶质细胞,可阻止ALSP小鼠模型和人类患者的疾病进展,这凸显了小胶质细胞替代疗法的治疗前景。
ALSP的特征是进行性小胶质细胞功能障碍和丢失,导致认知和运动功能障碍,以及明显的神经病理学特征,如轴突 spheroids(变性轴突上的局灶性肿胀)、色素性神经胶质、白质变性和脑钙化(1)。该病为常染色体显性遗传,这意味着单个突变的CSF1R拷贝就足以引发ALSP。缺失一个Csf1r拷贝的小鼠(Csf1r+/-小鼠)再现了该病的若干特征,包括记忆缺陷、运动障碍和白质异常(3)。然而,这些小鼠不会出现脑钙化,且小胶质细胞密度增加,这与ALSP中观察到的小胶质细胞丢失形成对比。另一种用于研究小胶质细胞丢失影响的模型是Csf1rΔFIRE/ΔFIRE小鼠,该小鼠靶向缺失了一个调控DNA元件[Fms内含子调控元件(FIRE)],而该元件可驱动小胶质细胞中Csf1r的表达(4)。Csf1rΔFIRE/ΔFIRE小鼠完全缺乏小胶质细胞,并表现出与年龄相关的ALSP样表型,包括轴突 spheroids、脑钙化和白质异常(5, 6)。尽管这些模型有助于研究小胶质细胞中CSF1R部分或完全缺失的后果,但均不适用于研究突变型CSF1R的其他负面影响。
小胶质细胞替代可恢复髓鞘形成
在编码集落刺激因子1受体(Csf1r)的基因其中一个拷贝存在致病性突变的小鼠中(以此模拟成人发病的伴轴突 spheroids 和色素性神经胶质的白质脑病(ALSP)),小胶质细胞功能障碍与轴突 spheroids 和异常髓鞘形成相关。骨髓移植后,野生型骨髓来源的巨噬细胞浸润大脑并替代突变的小胶质细胞,从而改善髓鞘完整性并减少轴突损伤。
图表来源:A. FISHER/SCIENCE
Wu等人培育出Csf1rWT/I792T小鼠,该小鼠在Csf1r的一个等位基因中携带与临床观察到的突变(Ile794→Thr)相当的小鼠突变,从而模拟ALSP中所见的常染色体显性遗传。这些小鼠出现小胶质细胞数量减少、脑钙化、髓鞘异常(包括髓鞘过多和髓鞘过少)、轴突肿胀、运动障碍和认知下降——这些都是ALSP的关键特征。为探究小胶质细胞替代是否能改变Csf1rWT/I792T小鼠的疾病进展,作者测试了两种方法:传统骨髓移植(tBMT)和通过骨髓移植进行小胶质细胞替代(Mr BMT),后者是一种先前开发的方案,将小胶质细胞的药理学耗竭与tBMT相结合(7)。在tBMT中,含有造血干祖细胞的供体骨髓在清髓性预处理(通过化疗或放疗)后静脉输注给受体小鼠,清髓性预处理可清除受体现有的骨髓细胞并促进供体细胞植入。Mr BMT通过将清髓性预处理与耗竭内源性小胶质细胞的CSF1R抑制剂相结合来增强这一过程,从而促进供体来源细胞植入大脑(7)。值得注意的是,在Csf1rWT/I792T小鼠中,Mr BMT和tBMT均能有效用野生型小胶质细胞替代突变小胶质细胞,并成功逆转髓鞘缺陷、轴突肿胀以及运动和认知障碍(见图)。
为将研究结果转化至临床,Wu等人对8名ALSP患者实施了tBMT,并进行了为期2年的随访研究。通过磁共振成像(MRI)评估脑病理学变化(白质病变和萎缩),结果显示24个月期间疾病进展减缓。相比之下,未接受治疗的ALSP患者在较短时间内脑病理学表现迅速恶化。此外,与未接受BMT的对照组相比,接受移植的患者运动和认知功能更稳定。这些发现表明,通过细胞替代纠正小胶质细胞基因缺陷可阻止人类疾病进展。
过去十年中,小胶质细胞替代策略不断完善,以提高安全性和有效性。在小鼠模型中,Mr BMT方案已显示出比tBMT更高的植入效率(7–9);然而,该方法仍需要有毒的预处理方案(9)。最近的研究在无预处理小胶质细胞替代方面取得了可喜进展。一项研究发现了一种对CSF1R抑制剂具有抗性的CSF1R变体(10)。经基因工程改造以表达该变体的供体细胞在CSF1R抑制剂处理后仍能存活,而内源性小胶质细胞则被耗竭。在小鼠中,这种方法无需清髓即可促进选择性植入。另一项研究的初步结果显示,使用CSF1R抑制剂反复进行小胶质细胞耗竭,可使外周细胞植入大脑,无需放疗或化疗(11)。用于小胶质细胞替代的供体细胞也在改进——供体细胞的发育起源会影响其植入后的特性(8, 11, 12)。尽管骨髓来源的细胞可以整合到大脑中并呈现小胶质细胞样形态,但它们保留的转录组谱与常驻小胶质细胞不同(8, 11)。相比之下,胎肝单核细胞似乎能产生在分子水平上更接近原生小胶质细胞的植入细胞(12),但其功能意义仍不明确。此外,源自诱导多能干细胞的小胶质细胞是一种很有前景的供体来源。值得注意的是,将源自iPSCs的小胶质细胞移植到人性化Csf1rΔFIRE/ΔFIRE小鼠中,可显著挽救ALSP相关病理(6)。
Wu等人研究结果的意义不仅限于ALSP。最近的一项研究表明,小胶质细胞替代还能挽救克拉伯病小鼠模型的病理,克拉伯病是一种由半乳糖脑苷脂酶(GALC)编码基因突变引起的单基因神经退行性疾病(13)。此外,tBMT可阻止雷特综合征小鼠模型的疾病进展,雷特综合征是一种由甲基-CpG结合蛋白2(MECP2)编码基因功能缺失突变引起的严重神经发育障碍(14)。这些发现共同凸显了小胶质细胞替代在改变单基因神经系统疾病进程方面的治疗潜力。该方法是否也能应用于更复杂的神经退行性疾病,如阿尔茨海默病和额颞叶痴呆,仍有待探索。
尽管小胶质细胞替代策略具有治疗潜力,但仍存在几个关键问题。接受移植巨噬细胞的ALSP患者细胞间通讯网络发生的变化有待阐明,特别是考虑到神经胶质改变和细胞间相互作用对疾病发病机制至关重要(15)。移植细胞的个体发生和特性对治疗效果有多关键?确定最佳供体细胞来源以实现可扩展、安全且持久的小胶质细胞替代至关重要。目前也尚不清楚在不影响植入的情况下,能否将移植前预处理引起的全身毒性降至最低。未来的策略必须在替代效率、全身毒性和植入细胞的功能能力之间取得平衡。展望未来,或许最终能够从内部重编程大脑的免疫格局,并找到最佳的小胶质细胞替代方法,不仅用于小胶质细胞病,还可用于一系列神经系统疾病。
https://wap.sciencenet.cn/blog-41174-1493228.html
上一篇:氢(氢化镁)增强声动力疗法
下一篇:活性氧跨细胞器处理管理模式《科学》