博文
氢水改善运动疲劳的细胞信号通路研究
||
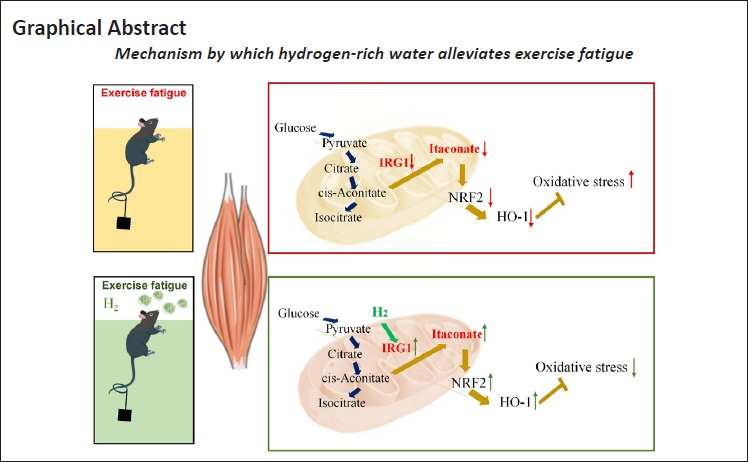
运动诱导的疲劳会限制运动表现。分子氢是缓解疲劳的有效手段,但其确切机制尚不明确。本研究建立了小鼠疲劳模型,旨在探究富氢水减轻运动诱导疲劳的分子机制。结果显示,富氢水可改善疲劳小鼠的运动功能,降低疲劳相关生物标志物(血尿素氮、乳酸和肌酸激酶)水平,并减轻腓肠肌损伤。此外,超高效液相色谱-质谱分析表明,富氢水可上调免疫应答基因1(IRG1)的表达,升高因疲劳而异常降低的衣康酸水平,进而激活下游的核因子 erythroid 2 相关因子 2(Nrf2)/血红素加氧酶 1(HO-1)通路。最后,对暴露于 IRG1 抑制剂(IRG1-IN)或 4-辛基衣康酸(4-OI)的 C2C12 细胞进行富氢水处理,结果显示富氢水可有效上调细胞中 Nrf2 和 HO-1 的表达。综上,富氢水通过激活 IRG1-衣康酸/Nrf2/HO-1 通路、抑制氧化应激,从而缓解运动诱导的疲劳。
引言
剧烈或长时间运动会导致疲劳,这是一种常见现象,会限制运动表现以及其他剧烈或长时间的活动。作为对肌肉收缩的反应,早期疲劳表现为力量或功率输出的下降,这并非病理性的1。然而,累积性疲劳会加剧多种病理状态,包括衰老和虚弱,以及神经病变、肌病和心血管疾病,最终损害人体健康2。根据运动通路的不同起源,疲劳可分为中枢性疲劳和外周性疲劳3。中枢性疲劳是指中枢神经元对肌肉的驱动减弱,而外周性疲劳是指在神经肌肉接头处或其远端发生的变化。在最大强度和高强度运动中,神经肌肉功能的变化主要发生在肌肉内⁴。外周性疲劳与代谢物、活性氧和活性氮的增加有关1˒3。然而,肌肉疲劳的确切机制尚未完全明确。
在过去几十年中,人们做出了大量努力来提高抗氧化能力,从而改善运动表现。人体的抗氧化防御系统包括酶类抗氧化剂(如超氧化物歧化酶(SOD)、过氧化氢酶和谷胱甘肽过氧化物酶)和非酶类抗氧化剂(包括维生素A、C、E、辅酶Q10和谷胱甘肽)⁵。在人类、啮齿动物和离体肌肉标本中,抗氧化剂(如生物活性肽和氨基酸、多糖和寡糖、酚类化合物、生物碱、类胡萝卜素、皂苷、维生素等)能有效延缓疲劳症状并缩短恢复时间⁶。尽管如此,抗氧化剂在应用时仍存在诸多弊端⁷˒⁸。首先,相当一部分有效证据来自动物实验,而关于给药剂量和持续时间的临床试验仍不充分。其次,由于训练类型、饮食习惯和氧化还原状态的差异,一种抗氧化剂很难持续对疲劳产生积极影响。第三,抗氧化剂的药效有限,过量使用甚至会诱发肝毒性。氢分子(H₂)除了具有较高的生物安全性外,还是一种很有前景的缓解运动诱导疲劳的候选物质。
先前的研究表明,吸入氢气⁹ˉ11、运动前饮用富氢水1⁰˒12、在高氢环境(补充2%氢气)中运动13,以及运动后氢浴或饮用富氢水1⁴ˉ1⁷,都能有效减轻肌肉疲劳。抗氧化和抗炎作用是氢气在包括疲劳在内的多种疾病中发挥保护作用的重要机制1⁸。此外,氢气还能刺激免疫系统、改善代谢平衡,从而促进身体疲劳的恢复1⁹˒2⁰。然而,氢气抗疲劳的分子机制仍不明确,特别是内源性抗氧化系统如何被调控。
转录因子核因子erythroid 2相关因子2(Nrf2,由NFE2L2基因编码)是细胞抵御氧化应激的核心调控因子。已有研究表明,在其他疾病中,氢气可诱导Kelch样ECH相关蛋白1(Keap1)/Nrf2抗氧化通路并改善线粒体功能21ˉ2⁵。运动可激活外周组织中的Nrf22⁶ˉ2⁹,但这种激活的确切机制尚未阐明。在氧化应激或其他刺激条件下,代谢微环境是激活Nrf2的重要刺激因素。
本研究假设,富氢水可上调免疫应答基因1(IRG1)和衣康酸的表达,通过刺激Nrf2/血红素加氧酶-1(HO-1)通路来减轻氧化应激,从而缓解疲劳。本研究为衣康酸与氢气抗疲劳作用之间的关联机制提供了新的见解。
方法
动物
为减少潜在的雌激素相关混杂效应,本研究使用雄性小鼠。21只8周龄雄性C57BL/6小鼠(购自上海杰思捷实验动物有限公司,许可证号:SCXK(沪)2024-004),体重18±2g,饲养于温度20-25°C、12小时光暗循环的笼具中,自由摄食饮水。实验结束后,通过颈椎脱臼法处死小鼠。实验过程遵循《实验动物护理和使用指南》3⁰,并经海军军医大学机构动物护理和使用委员会批准(批准号:NMUMREC-2021-006;2021年3月10日)。
疲劳模型建立与富氢水处理
将小鼠随机分为三组:对照组(Ctrl)、运动诱导疲劳组和富氢水组(每组n=7)。所有小鼠均饲喂正常饮食,但饮用不同的水。在4周的实验期间,对照组和运动诱导疲劳组小鼠自由饮用蒸馏水,富氢水组小鼠自由饮用由纳米气泡装置(上海Nanobab纳米科技有限公司)制备的富氢水(>1.5ppm)。为减少氢气损失,富氢水储存于铝袋中,每8小时更换一次31。实验流程如图1A所示。
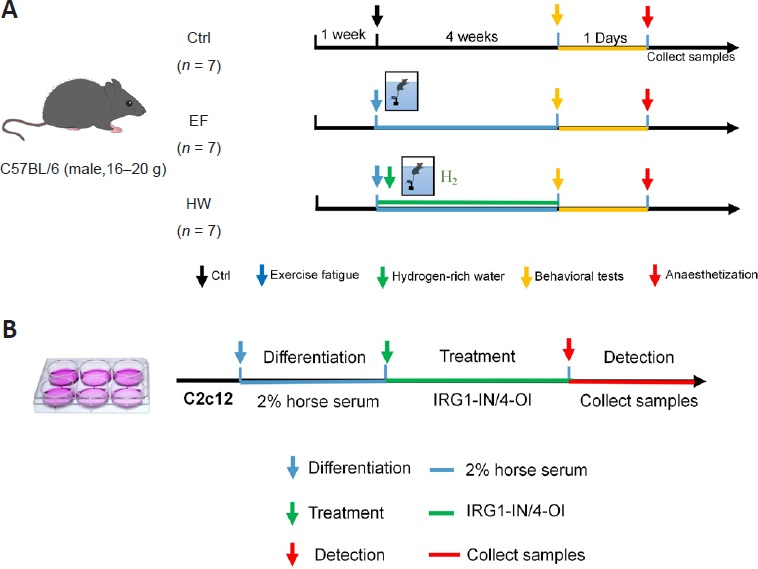
体内(A)和体外(B)实验流程图。4-OI:4-辛基衣康酸;Ctrl:对照;EF:运动诱导疲劳;H₂:氢气;HW:富氢水;IRG1-IN:免疫应答基因1抑制剂。
为达到过度训练的效果,常通过增加运动方案的负荷来建立游泳训练的运动诱导疲劳模型32⁻3⁷。因此,我们建立了为期4周的小鼠强迫游泳模型。具体而言,将运动诱导疲劳组和富氢水组的小鼠置于水箱(高30 cm、直径30 cm)中,水深20 cm,水温20-25°C。经过3天的适应性游泳(每日无负荷游泳1小时)后,小鼠每天被迫负重游泳1小时,负荷(体重的7.5%)附着在尾部近端。根据小鼠的身体状态适当调整游泳时间。若小鼠过度疲劳,下沉超过10秒且无法自主返回水面,则视为完成当日运动,当天暂停训练。
行为学测试
力竭跑步机测试
本实验用于评估运动耐力,操作方法如前所述3⁸。简而言之,经过4周强迫游泳后,运动诱导疲劳模型建立。24小时后,所有小鼠均进行跑步机能力测试。将小鼠单独置于跑步机平台(上海吉量软件科技有限公司)上,速度每3分钟从15 m/min增至40 m/min。监测力竭跑步里程,直至小鼠连续3次无法跟上速度增加并出现滞后,此时记录的总跑步里程即为力竭跑步里程。
转棒测试
本实验用于评估运动耐力,操作方法如前所述3⁹。运动诱导疲劳模型建立后,所有小鼠均进行转棒测试。第一天,所有小鼠接受3次独立的适应性训练。具体而言,将小鼠置于静止的转棒(上海吉量软件科技有限公司)上,在旋转装置上以恒定速度在10分钟内从0增至20转/分钟,共进行3次,间隔1小时。适应性训练后,第二天进行正式实验。将小鼠置于静止的转棒上,允许其在5分钟内以恒定速度从5转/分钟加速至35转/分钟,记录小鼠从转棒上掉落的时间。
样本制备
实验期结束后,所有小鼠均用异氟烷(3%诱导,1.5%维持;默克集团,达姆施塔特,德国,货号792632)麻醉,从眼球采集血液样本。收集的血液静置后,在室温下以1500×g离心5分钟,获取上清液用于后续分析。小鼠安乐死后,取出肝脏和腓肠肌用于进一步实验。
血清生化检测
血液在室温下以1500×g离心15分钟。获取血清样本,采用分光光度检测法,通过市售试剂盒(南京建成生物工程研究所)测定生化指标,包括血尿素氮、乳酸、肌酸激酶、丙二醛、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶。
病理染色
分离腓肠肌和肝脏组织,置于4%甲醛中固定24小时。将各组织放入处理盒中,脱水后包埋于石蜡块中。将4μm厚的组织切片在二甲苯和一系列浓度递减的乙醇中脱蜡,然后进行苏木精-伊红(HE;武汉赛维尔生物科技有限公司)和过碘酸-希夫(PAS)染色(武汉赛维尔生物科技有限公司)。免疫组织化学分析中,石蜡切片与抗HO-1抗体(兔源,1:200,武汉云克隆科技股份有限公司,货号PAA584Hu01,RRID:AB3676640)、抗Nrf2抗体(兔源,1:200,Cell Signaling Technology,丹弗斯,马萨诸塞州,美国,货号12721S,RRID:AB_2715528)、抗IRG1抗体(兔源,1:200,Affinity,辛辛那提,俄亥俄州,美国,货号DF7723,RRID:AB_2841191)和抗环氧合酶2(COX2;抗体(兔源,1:200,Cell Signaling Technology,货号12282T,RRID:AB_2571729)在4°C孵育过夜。将生物素标记的山羊抗兔IgG(H+L)(1:100,上海碧云天生物技术有限公司,货号A0277,RRID:AB_3678552)作为二抗,在室温下孵育1小时。使用光学显微镜(徕卡,韦茨拉尔,黑森州,德国)拍摄照片。
代谢组学超高效液相色谱-质谱分析
简要来说,将血清样本与甲醇混合并离心。将上清液转移至进样瓶中进行超高效液相色谱-质谱(HPLC-MS)分析。使用配备安捷伦6530精确质量四极杆飞行时间质谱仪的安捷伦1290 Infinity液相色谱系统(安捷伦科技公司,圣克拉拉,加利福尼亚州,美国)进行超高效液相色谱-四极杆飞行时间/质谱分析2⁴。
定量聚合酶链反应
按照制造商的方案(Applied Biosystems,福斯特城,加利福尼亚州,美国),采用TRIzol法从腓肠肌中提取总RNA。使用纳米滴分光光度计(ND2000,赛默飞世尔科技公司,沃尔瑟姆,马萨诸塞州,美国)评估每个样本中提取的RNA的纯度和量。随后,通过mRNA逆转录试剂盒(南京诺唯赞生物科技股份有限公司)进行逆转录。使用基于SYBR Green的实时定量聚合酶链反应试剂盒(Applied Biosystems)分析mRNA表达水平。引物序列如下:IRG1:正向5’-AAT GAA ACC TTG GGT CTT ATG CC -3’,反向5’-TGC CCA TGA CTT ATC CAG ACA G-3’;NRF2:正向5’-AAG CAC AGC CAG CAC ATT CTC C-3’,反向5’-TGA CCA GGA CTC ACG GGA ACT TC-3’;HO-1:正向5’-ACC GCC TTC CTG CTC AAC ATT G-3’,反向5’-CTC TGA CGA AGT GAC GCC ATC TG-3’;18S:正向5’-GTA ACC CGT TGA ACC CCA TT -3’,反向5’-CCA TCC AAT CGG TAG TAG C-3’。基因表达数据以18S rRNA的相对mRNA表达水平进行标准化。
细胞培养与干预
C2C12小鼠成肌细胞购自国家实验细胞资源共享平台(上海,中国,货号GNM26,RRID:CVCL_0188),在含 Dulbecco改良 Eagle培养基、10%胎牛血清和1%青霉素/链霉素的生长培养基中,于生理温度(37°C)、5% CO₂浓度下培养。当细胞融合度达到70%时,将生长培养基更换为含2%马血清的Dulbecco改良Eagle培养基的分化培养基。C2C12细胞在含2%马血清的培养基中孵育7天,之后使用分化的肌管细胞进行进一步实验。在富氢分化培养基中,用5μM免疫应答基因1抑制剂(IRG1-IN;一种IRG1抑制剂;MedChemExpress,新泽西州,美国)处理细胞24小时,或用250μM 4-辛基衣康酸(4-OI;一种细胞渗透性衣康酸类似物;MedChemExpress)处理6小时,然后用于实验。实验流程如图1B所示。使用商业试剂盒检测活性氧(上海碧云天生物技术有限公司,货号S0033S)、MitoSO™ Red线粒体超氧化物检测试剂盒(上海碧云天生物技术有限公司)和JC-1(MCE)。
蛋白质印迹分析
使用总蛋白提取试剂盒(南京凯基生物科技发展有限公司)从腓肠肌和C2C12细胞中提取总蛋白。使用二辛可宁酸试剂盒(赛默飞世尔科技公司)对蛋白质浓度进行标准化后,将样本通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,电转移至硝酸纤维素膜上,并在4°C下与相关一抗孵育过夜:抗HO-1抗体(1:1000)、抗Nrf2抗体(1:1000)、抗IRG1抗体(1:1000)、抗甘油醛-3-磷酸脱氢酶(GAPDH)抗体(兔源,1:2000,武汉赛维尔生物科技有限公司,货号GB15004,RRID AB_2943040)和抗β-微管蛋白抗体(兔源,1:10000,武汉普洛麦格生物科技有限公司,货号80713-1-RR,RRID AB_2918906)。将生物素标记的山羊抗兔IgG(H+L)(1:2000)作为二抗,在室温下孵育1小时。通过SynGene软件包(上海天能科技有限公司)的GeneSnap,以体内GAPDH和体外β-微管蛋白为参照对灰度数据进行标准化。
统计分析
数据以均数±标准误(SEM)表示。使用GraphPad Prism v9.5.0(GraphPad Software,圣迭戈,加利福尼亚州,美国;www.graphpad.com)绘制统计图表。采用单因素方差分析,随后进行Tukey事后检验评估组间的统计学显著性,P<0.05被认为具有统计学显著性。
结果
富氢水有效缓解运动诱导的疲劳
为探究富氢水缓解运动疲劳的能力,我们构建了运动诱导疲劳模型,让小鼠接受4周的强迫游泳训练并饮用富氢水。先前的一项研究表明,富氢水不会显著影响小鼠的食物和水摄入量,且富氢水对正常小鼠非常安全⁴⁰。因此,在本研究中,小鼠接受4周的强迫游泳训练并采用富氢水处理。结果表明我们的疲劳模型是有效的。富氢水提供的H₂可改善运动功能方面的运动诱导疲劳(图2A和B),降低疲劳模型小鼠中升高的血清疲劳生化指标,减轻运动诱导的肌纤维损伤以及肌糖原(图2C-E)和肝糖原(图2F)的消耗。这些结果与先前的研究一致,表明富氢水可有效缓解疲劳。我们在体内进一步研究了其潜在机制。
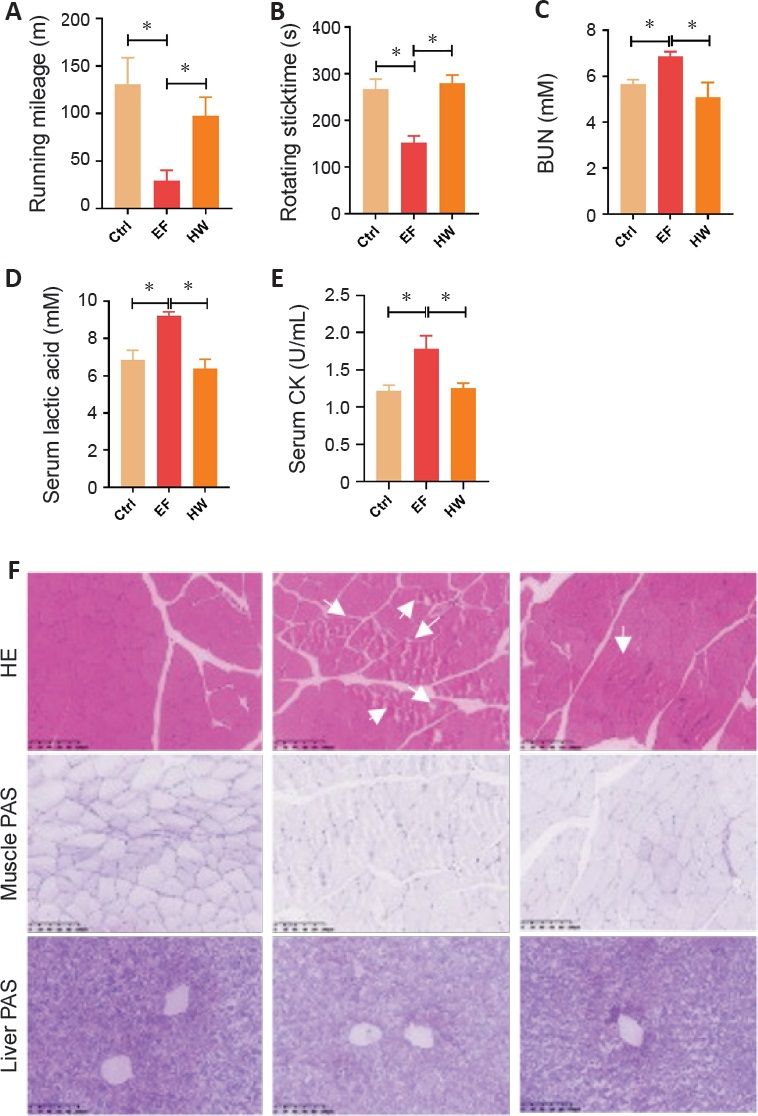
图2:富氢水对小鼠疲劳指标的影响
通过强迫小鼠游泳4周建立运动诱导疲劳模型。(A、B)用于评估全身疲劳状态的行为学测试。(A)跑步机测试中的力竭距离。(B)转棒测试中的转棒时间。(C)血尿素氮(BUN)定量分析。(D)血清乳酸定量分析。(E)血清肌酸激酶水平定量分析。数据以均数±标准差表示(n=7)。*P<0.05(单因素方差分析后进行Tukey事后检验)。(F)肌肉组织切片的HE染色(上)、肌糖原染色(中)和肝糖原染色(下)。白色箭头指示受损肌纤维。比例尺:100μm。BUN:血尿素氮;CK:肌酸激酶;Ctrl:对照组;EF:运动诱导疲劳组;HW:富氢水组;HE:苏木精-伊红;PAS:过碘酸-希夫。
富氢水通过增加衣康酸缓解疲劳
考虑到代谢物在关联异常能量代谢中的重要作用,我们采用超高效液相色谱-四极杆飞行时间质谱(UPLC/Q-TOF-MS)对三组小鼠血清样本中的代谢变化进行了表征。我们在血清样本中检测到31种异常代谢变化,涉及嘌呤代谢、胞嘧啶代谢、葡萄糖代谢、氨基酸代谢、脂肪酸代谢和磷脂代谢通路(附加表1)。UPLC/Q-TOF-MS分析过程纳入了严格的质量控制措施以确保数据可靠性(图3A、B),代谢变化以热图形式呈现(图3C)。富氢水处理可逆转上述代谢紊乱,尤其是衣康酸。衣康酸由三羧酸循环中间产物顺乌头酸经免疫应答基因1蛋白(IRG1)催化脱羧生成。我们进一步检测了腓肠肌中IRG1的表达(图3D-G)。这些结果表明,富氢水可上调IRG1的表达,以恢复顺乌头酸的脱羧反应,从而升高因疲劳而异常降低的衣康酸水平。
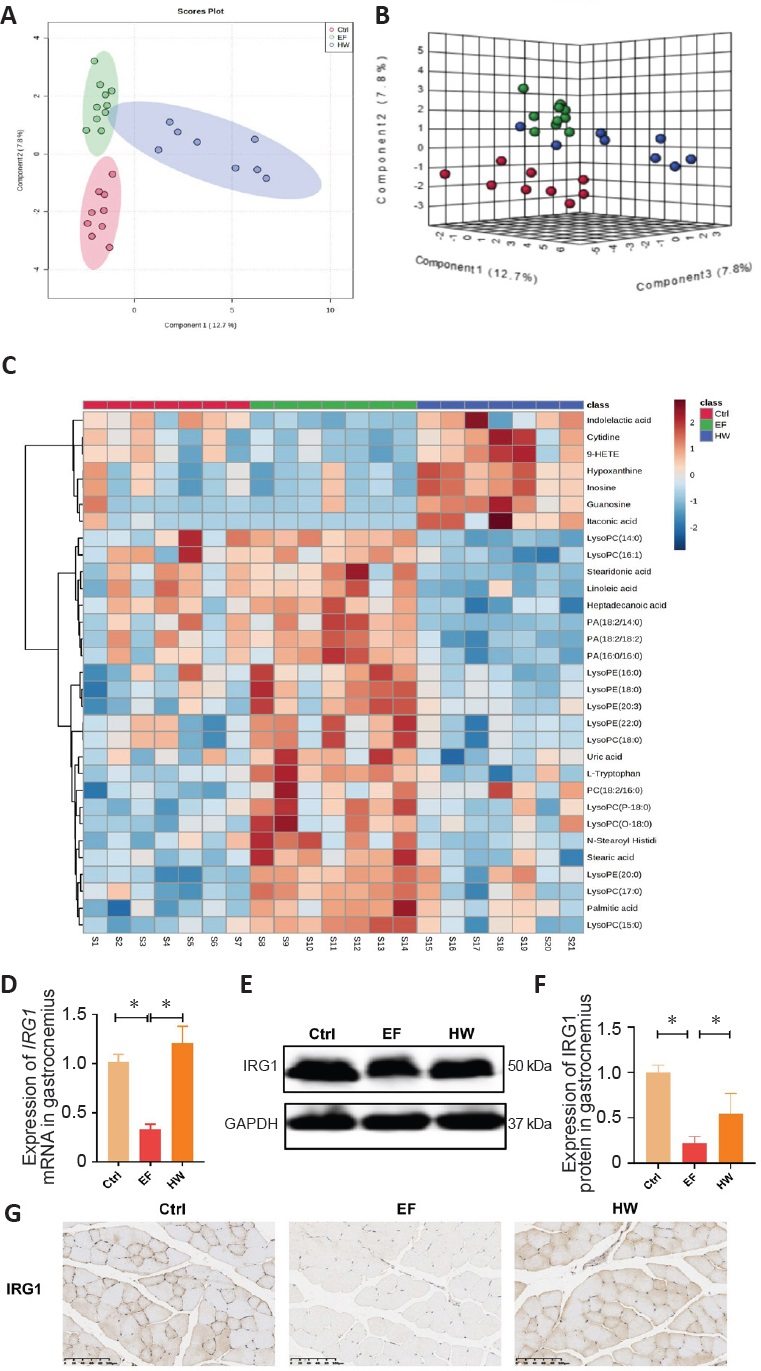
图3:通过超高效液相色谱-四极杆飞行时间质谱分析富氢水对疲劳小鼠代谢变化的影响
(A-C)对照组(红色)、运动诱导疲劳组(绿色)和富氢水组(蓝色)的稀疏偏最小二乘判别分析。(A)二维得分图和(B)同步三维图。(C)代谢变化热图。(D)腓肠肌中IRG1 mRNA的表达。(E、F)腓肠肌中IRG1蛋白的表达。数据以均数±标准差表示(n=7)。*P<0.05(单因素方差分析后进行Tukey事后检验)。(G)腓肠肌中IRG1的免疫组织化学染色。比例尺:100μm。Ctrl:对照组;EF:运动诱导疲劳组;GAPDH:甘油醛-3-磷酸脱氢酶;HW:富氢水组;IRG1:免疫应答基因1;UPLC/Q-TOF-MS:超高效液相色谱-四极杆飞行时间质谱;PLS:偏最小二乘。
富氢水通过升高衣康酸水平激活疲劳小鼠的Nrf2/HO-1通路,以减轻氧化应激
衣康酸是内源性免疫系统中一种重要的效应分子。已有研究报道,衣康酸或其衍生物(2-甲基衣康酸或4-辛基衣康酸)可激活巨噬细胞和其他实质细胞中的Nrf2,并驱动下游Nrf2依赖性基因表达2⁷⁻2⁹˴⁴1。然而,在疲劳情况下,衣康酸与Nrf2/HO-1之间的确切调控机制尚未阐明。在本研究中,富氢水可激活腓肠肌中的Nrf2,并驱动下游HO-1的表达(图4A-F)。在此基础上,我们通过商业试剂盒检测了血清氧化应激指标(包括丙二醛、超氧化物歧化酶和谷胱甘肽过氧化物酶)(图5A-C),并通过免疫组织化学检测了腓肠肌中的环氧合酶2(图5D)。这些结果进一步表明,富氢水可缓解疲劳引起的氧化应激,这与我们的假设(衣康酸激活Nrf2/HO-1级联反应以减轻氧化应激损伤)一致。

图4:富氢水对疲劳小鼠Nrf2/HO-1表达的调控作用
(A、B)Nrf2和HO-1的mRNA表达水平。(C-E)Nrf2和HO-1的蛋白表达水平。数据以均数±标准差表示(n=7)。*P<0.05(单因素方差分析后进行Tukey事后检验)。(F)Nrf2和HO-1的免疫组织化学结果。比例尺:100μm。Ctrl:对照组;EF:运动诱导疲劳组;GAPDH:甘油醛-3-磷酸脱氢酶;HO-1:血红素加氧酶-1;HW:富氢水组;Nrf2:核因子erythroid 2相关因子2。

图5:富氢水减轻疲劳小鼠的氧化应激
(A)血清丙二醛(MDA)浓度定量分析。(B)血清超氧化物歧化酶(SOD)浓度定量分析。(C)血清谷胱甘肽过氧化物酶(GSH-Px)定量分析。数据以均数±标准差表示(n=7)。*P<0.05(单因素方差分析后进行Tukey事后检验)。(D)肌肉中环氧合酶2(COX2)的免疫组织化学结果。比例尺:100μm。Ctrl:对照组;EF:运动诱导疲劳组;GSH-Px:谷胱甘肽过氧化物酶;HW:富氢水组;MDA:丙二醛;ns:无统计学意义;SOD:超氧化物歧化酶。
富氢水调控疲劳小鼠的IRG1-衣康酸/Nrf2/HO-1通路
为验证富氢水对IRG1和衣康酸的调控作用,以分化的C2C12细胞作为体外模型。用IRG1抑制剂和富氢水处理C2C12细胞。在肌管细胞中,富氢水可恢复IRG1/Nrf2/HO-1通路的表达(图6A-D),并逆转氧化应激损伤(图6E-G)。此外,使用衣康酸衍生物4-辛基衣康酸阐明富氢水对衣康酸/Nrf2/HO-1通路的调控作用。定量聚合酶链反应和蛋白质印迹结果显示,富氢水在mRNA和蛋白水平均上调Nrf2和HO-1的表达(图6H-J)。这些结果表明,富氢水在肌管细胞中调控IRG1-衣康酸/Nrf2/HO-1通路。

图6:富氢水在C2C12细胞中调控IRG1-衣康酸/Nrf2/HO-1通路
对分化的C2C12细胞进行IRG1抑制剂(IRG1-IN)和富氢水处理,检测IRG1/Nrf2/HO-1的表达及氧化应激指标。(A-C)IRG1、Nrf2和HO-1的mRNA表达水平。(D)IRG1、Nrf2和HO-1的蛋白表达水平。(E)活性氧(ROS)。白色箭头指示ROS阳性染色。(F)线粒体超氧化物(Mito-SOX)。白色箭头指示Mito-SOX阳性染色。(G)JC-1(线粒体膜电位ΔΨm)。白色箭头指示JC-1聚集体/单体阳性染色。比例尺:100μm。对分化的C2C12细胞进行4-辛基衣康酸(4-OI)和富氢水处理,检测Nrf2/HO-1的表达。(H、I)Nrf2和HO-1的mRNA表达水平。数据以均数±标准差表示(n=7)。*P<0.05(单因素方差分析后进行Tukey事后检验)。(J)Nrf2和HO-1的蛋白表达。4-OI:4-辛基衣康酸组;Ctrl:对照组;HO-1:血红素加氧酶-1;HW:富氢水组;IRG1:免疫应答基因1;IRG1-IN:免疫应答基因1抑制剂组;JC-1:线粒体膜电位ΔΨm;Mito-SOX:线粒体超氧化物指示剂;Nrf2:核因子erythroid 2相关因子2;ROS:活性氧。
讨论
本研究证实,富氢水可缓解运动诱导的疲劳,并通过激活衣康酸/Nrf2/HO-1通路减轻氧化应激。为探究富氢水缓解疲劳的机制,我们采用超高效液相色谱-质谱法对模型小鼠进行了血清代谢组学分析。由于疲劳涉及复杂的成分和精密的调控机制,非靶向代谢组学方法在疲劳的生物活性评估中得到广泛应用⁴2˒⁴3。代谢组学通过全面评估代谢变化,直接描述生物功能中的异常代谢物,并提供生物体应对疲劳时高代谢水平的详细生化反应⁴⁴。因此,通过代谢组学探索富氢水的抗疲劳机制是可行且必要的。一项关于肠道微生物群的天然食物代谢物尿石素A作为补充剂的临床试验表明,它可增强肌肉耐力和线粒体健康⁴⁵。然而,尚未有研究描述血清代谢物在富氢水抗疲劳中的作用。我们的研究填补了这一空白,通过非靶向代谢组学分析血清代谢组学,发现衣康酸的显著差异是最具价值的结果。作为三羧酸循环的代谢物,衣康酸具有抗炎特性,这源于在代谢重编程的巨噬细胞中顺乌头酸的重新利用,同时可刺激Nrf2⁴⁶。它是一种重要的免疫代谢物,在多种疾病中介导感染、免疫和代谢之间的相互作用。慢性疲劳综合征模型大鼠的尿液中衣康酸存在异常⁴⁷。另一项研究表明,在体外,肌肉衣康酸是miR93-干扰素调节因子9-IRG1-衣康酸通路中的重要分子,通过旁分泌作用调节M2型巨噬细胞极化并诱导骨骼肌损伤⁴⁸。然而,衣康酸在运动诱导疲劳中的作用尚未阐明。已有研究证实,富氢水可通过重编程骨骼肌糖酵解缓解运动诱导的疲劳3⁹,但遗憾的是未检测代谢组学。在该疲劳模型中,Nrf2的表达无显著变化。对比我们研究与该研究的相应数据,我们认为本研究中Nrf2的异常变化可能是由于我们的疲劳模型中氧化应激和肌肉损伤更为严重。衣康酸对Nrf2的激活至关重要。它可使Keap1上的特定半胱氨酸残基(C151、C257、C288、C273和C297)烷基化,从而破坏Keap1介导的Nrf2降解。此过程随后会增加具有强大抗氧化和抗炎功能的下游基因的表达⁴⁹。
因此,需要更深入地探索Nrf2氧化还原应激反应信号在运动诱导疲劳中的作用。作为抗氧化反应的核心,Nrf2可刺激数百个基因的表达,其中大多数编码抗氧化/解毒酶,尤其是HO-1。我们的研究结果进一步证实,IRG1-衣康酸/Nrf2/HO-1通路参与了富氢水的抗疲劳作用。通过过氧化氢处理的成骨细胞和神经元细胞的氧化损伤,证实了衣康酸对Nrf2/HO-1的调控作用⁴1˒⁵⁰。在系统性硬化症中,Nrf2对于衣康酸发挥抗氧化应激和抗炎作用是必需的⁵⁰。我们的研究结果表明,富氢水通过上调IRG1来恢复衣康酸水平。作为一种催化酶,IRG1的作用取决于其数量和酶活性。富氢水通过两种方式调节酶:调节酶的数量和调节酶的活性。在本研究中,富氢水在mRNA和蛋白水平均上调IRG1的表达。然而,由于技术限制,我们未检测IRG1的酶活性,这也是本研究的局限性之一。我们将在未来进一步探索和研究这一点。
我们的研究结果强调,富氢水通过上调IRG1以恢复衣康酸水平,并激活下游Nrf2/HO-1以减轻氧化应激损伤,从而对运动诱导的疲劳发挥保护作用。富氢水具有便捷、廉价和低毒性的特点,有望成为改善运动表现和减轻损伤的有效措施。衣康酸作为一种糖酵解产物,可能作为连接糖酵解和氧化应激的新型中间分子,并可作为氢气治疗的新靶点。
主要参考文章
Zhang Y, Ying Y, Zu X, Ding L, Shi X, Wang J, Li X, Li C, Zhou Q, Shen H, Li H, Lu H, Cheng J. Mechanism by which hydrogen-rich water mitigates exercise-induced fatigue: activation of the immunoresponsive gene 1-itaconate/nuclear factor erythroid 2-related factor 2/heme oxygenase-1 pathway. Med Gas Res. 2026 Mar 1;16(1):26-32. doi: 10.4103/mgr.MEDGASRES-D-24-00148. Epub 2025 Jun 28. PMID: 40580185.
https://wap.sciencenet.cn/blog-41174-1492465.html
上一篇:结合微藻与氢氧化细菌的新型光-化能自养系统用于从二氧化碳生产微生物蛋白
下一篇:金属镁微球增效肝癌介入栓塞治疗【Sci.Adv.】