博文
[转载]极端制造 | 双相载细胞嵌入介质打印助力复杂三维血管化肝组织模型体外构建
||


作者:
吕为康,于浩然,Abdellah Aazmi,娜仁图雅,程万里,俞梦飞,王震,许晓斌,杨华勇,马梁
机构:
浙江大学
Citation:
Lv W K, Yu H R, Aazmi A, Naren T, Cheng W L, Yu M F, Wang Z, Xu X B, Yang H Y, Ma L. 2025. Construction of complex three-dimensional vascularized liver tissue model in vitro based on a biphasic cell-laden embedding medium. Int. J. Extrem. Manuf. 7 035002.
扫码获取全文

https://doi.org/10.1088/2631-7990/ada836
撰稿:文章作者
1. 文章导读
肝脏的体外功能化模型构建是药物筛选与再生医学的关键挑战,但传统生物打印技术受限于低模量材料的成形难题,难以构建复杂血管网络。
近期,浙江大学机械工程学院杨华勇院士生物制造团队马梁副教授课题组,提出一种基于载细胞嵌入介质的牺牲打印策略,解决了难以在体外正常模量肝组织中快速构建复杂三维血管的问题,并探究了不同血管密度对于肝组织功能的影响(图1)。相关研究成果以题为《基于双相细胞负载嵌入介质的复杂三维血管化肝组织模型体外构建》发表在SCI期刊《极端制造》(International Journal of Extreme Manufacturing)上。
图1 基于载细胞支持浴的复杂三维血管化肝组织模型构建。
2. 图文解析
双相载细胞嵌入介质实现低模量材料中三维血管成形
传统生物墨水因粘度低难以支撑复杂结构,研究团队将明胶微凝胶与低粘度生物材料混合,形成兼具屈服应力与自修复特性的支撑浴,并通过微凝胶比例与尺寸调节组织孔隙率,优化细胞微环境(图2)。该介质允许在多种软材料中连续打印含有内皮细胞的牺牲墨水,血管直径可精准调控,从而实现三维功能化血管的快速构建(图3)。
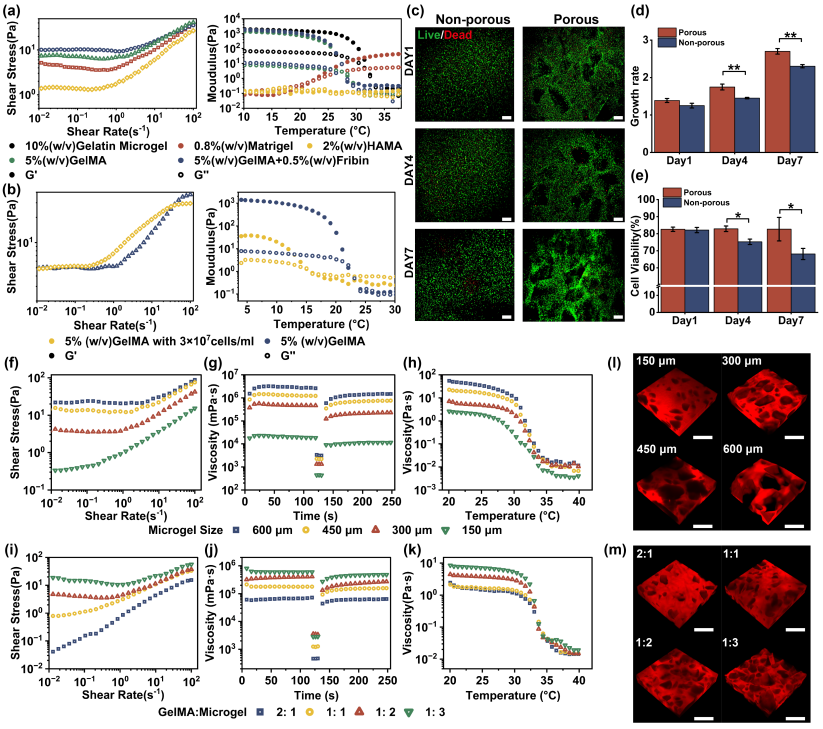
图2 支持浴的流变性能和生物相容性。
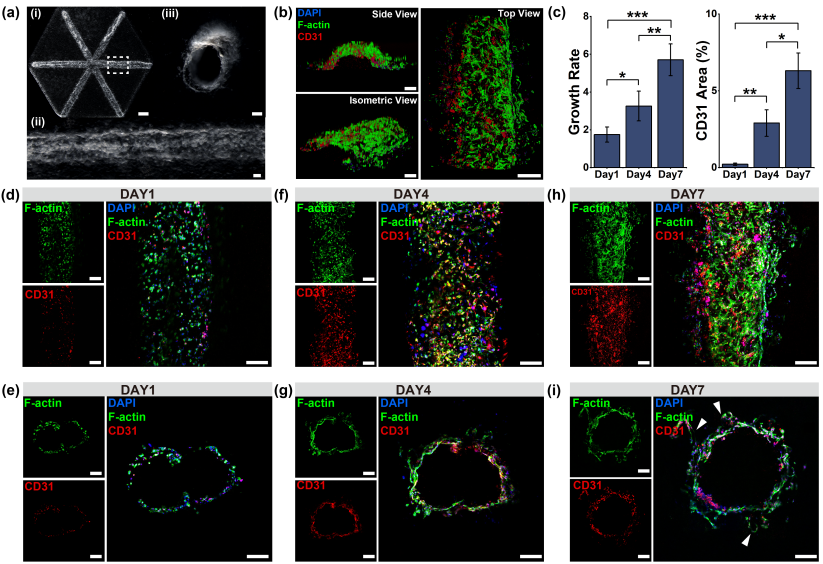
图3 肝小叶血管结构模拟及体外微血管形成。
功能性血管网络调控肝组织功能
研究团队利用该技术开发了一种体外血管化肝组织模型,该模型可复现人体肝组织的生理硬度特性,并通过蛋白质分泌、代谢功能及肝损伤标志物检测发现,血管化模型表现出更优越的生理功能(图4)。此外,通过设计不同血管拓扑结构,研究团队构建了高/低血管密度的肝组织模型。转录组分析表明,高血管密度肝组织在代谢和血管生成相关通路中(如CYP家族、VEGF基因)的表达显著上调,这对维持肝组织功能及体外微环境适应性至关重要(图5)。
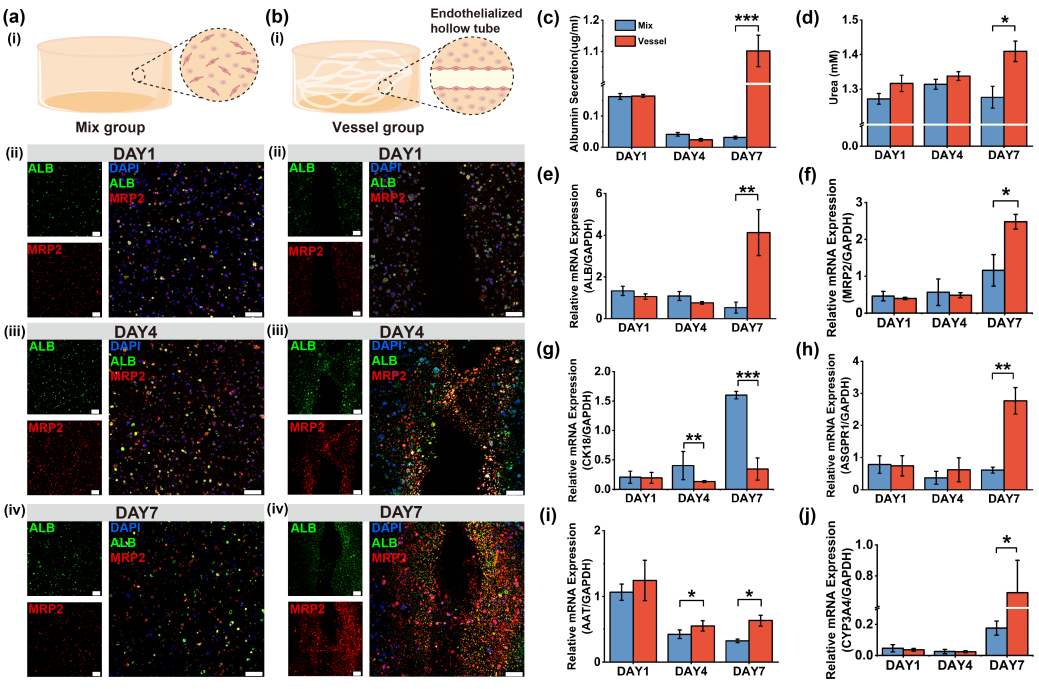
图4 有无血管化肝组织的功能评估。
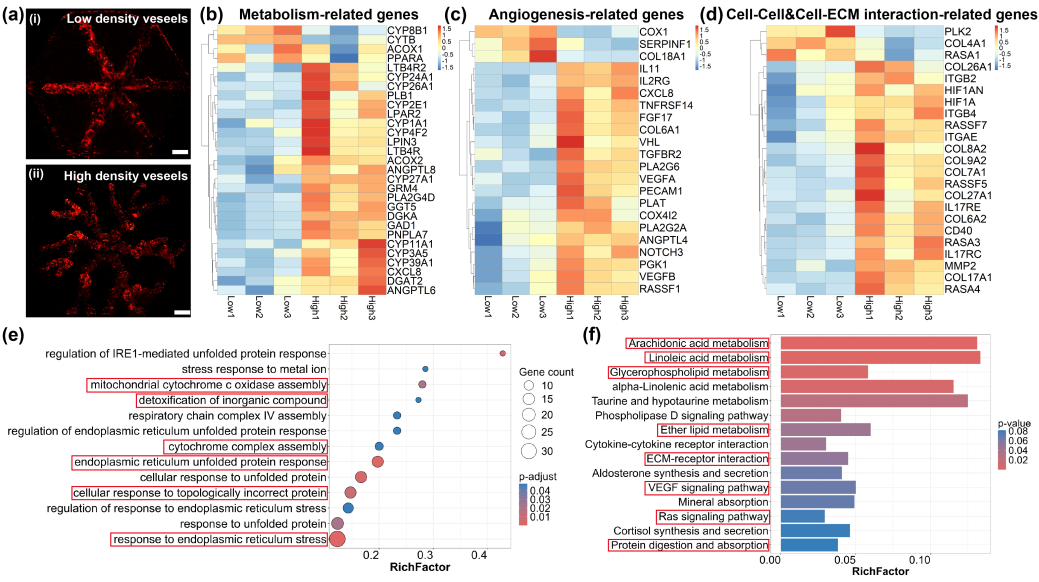
图5 高/低血管密度的肝组织转录组测序分析。
3. 总结与展望
本研究通过双相载细胞支持浴与牺牲打印技术,实现了复杂血管化肝组织的高效构建,并验证了血管网络对肝组织功能的增强作用。未来可以结合多材料打印技术构建多尺度血管网络,并进一步应用于肝纤维化等病理机制研究。
4. 作者与团队简介
浙江大学机械工程学院杨华勇院士生物制造团队马梁副教授长期致力于生物制造与组织工程研究,聚焦复杂器官体外模型构建与微纳生物制造技术,在《Bioactive Materials》《Engineering》等期刊发表多篇SCI论文70余篇,获国家自然科学基金、国家重点研发计划支持。
https://wap.sciencenet.cn/blog-3589572-1484873.html
上一篇:[转载]极端制造 | 基于飞秒激光打印光热微壁的多功能形状记忆智能窗
下一篇:[转载]极端制造 | 透明材料超快激光焊接进展:从机理到应用