博文
线粒体内膜损伤后翻转外出的路径  精选
精选
|
线粒体器官是如何移除内膜的受损部分以便在胞质中进行回收的?发现一种将内膜翻转至器官外的出口路径,提供了一些答案。
诸如线粒体这样的细胞器使用多种机制来回收其组件。Prashar等人在《自然》杂志上发表文章,报告了这些事件可能发生的一个令人惊讶的新转折。
Lysosomes drive the piecemeal removal of mitochondrial inner membrane | Nature (sjuku.top)
线粒体是双膜封闭的细胞器,包含由膜间空间隔开的外膜和内膜(图1)。线粒体的功能远不止控制能量代谢。将这些细胞器描述为细胞的能量工厂已经更新,现在用计算机类比将其称为细胞的处理器。
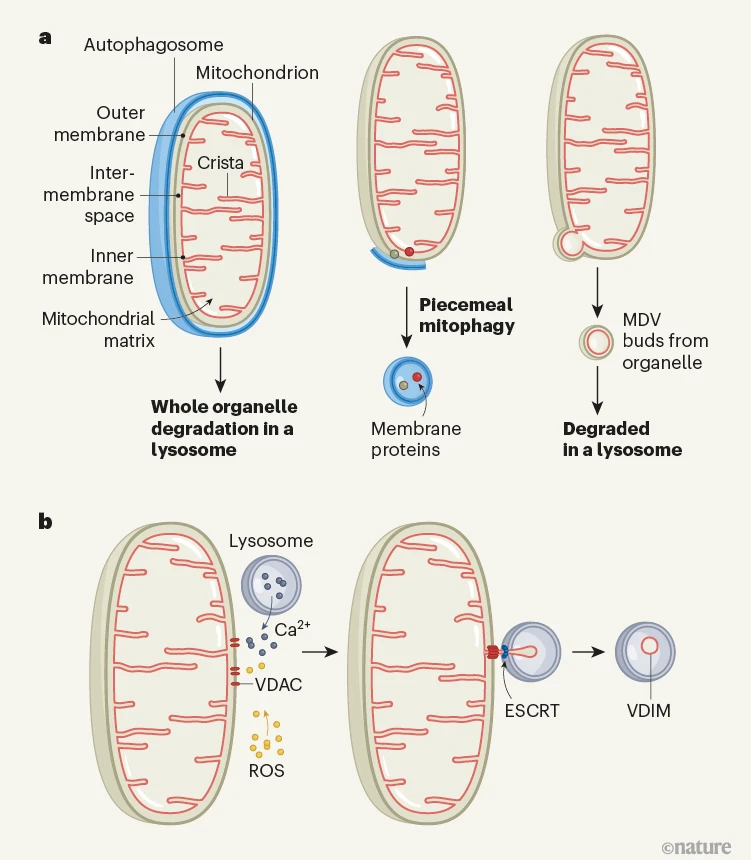
图1 | 降解和回收线粒体细胞器组分的方式。a, 线粒体具有由膜间空间分隔的内膜和外膜以及一个名为线粒体基质的内部区域。内膜可以形成一种称为嵴的结构,该结构在能量产生中发挥作用。之前已经识别出各种降解线粒体组分的途径。在称为自噬的通路中,一个名为自噬体的结构和整个细胞器结合,然后与一种名为溶酶体的细胞器融合(未显示),线粒体被降解。内外线粒体膜的蛋白质可以在被自噬体包裹后被破坏;这个过程称为分块式线粒体自噬。此外,线粒体的部分可以通过芽生形成线粒体衍生囊泡(MDVs),这些囊泡与溶酶体融合后被降解。b, Prashar等人揭示了一种特异性降解线粒体内膜部分的通路。响应于从溶酶体释放的压力相关分子,如活性氧种类(ROS)和钙离子(Ca2+),内膜通过电压依赖性阴离子通道(VDAC)蛋白形成的孔被挤出并被一个叫做ESCRT的蛋白质复合物包围。这产生了源自线粒体内膜的囊泡,称为VDIMs,它们在溶酶体内被降解。
线粒体相关功能的损害与衰老、免疫功能减弱以及包括癌症、神经退行性疾病和糖尿病在内的大量疾病有关。毫不奇怪,线粒体的质量控制在维持细胞健康中至关重要。线粒体质量控制的经典观点涉及多种形式的调节,以识别和处理显示出损伤迹象的线粒体。自从发现了一种选择性降解整个线粒体的过程(称为自噬)以来,研究主要集中在理解移除整个细胞器上。
一般而言,有缺陷的线粒体通过外膜蛋白的一种修饰(泛素化)或直接被自噬受体识别而被识别。识别触发了细胞器被膜结构包裹的过程,这些结构称为自噬体。然后,在自噬体与溶酶体细胞器融合后,线粒体将被降解。在哺乳动物细胞中,一种涉及PINK1和PARKIN蛋白的自噬途径得到了早期关注,因为它与帕金森病的熟悉形式有直接联系。
如今,我们知道线粒体的更新不仅限于整个细胞器,也适用于线粒体片段、蛋白质、线粒体DNA(mtDNA)和其他组成分子。一种称为分块式自噬的过程针对的是相互连接的线粒体网络的末端部分,并以依赖自噬体的过程移除外膜和内膜的蛋白质复合物。线粒体物质也可以独立于自噬体通过涉及其他细胞器的通路被降解,这些细胞器称为内体。这些在内体中通过依赖于VPS35蛋白的机制消除线粒体基因组。
此外,一种被称为线粒体衍生囊泡(MDVs)的小型膜结构从线粒体上芽生出来,并移除特定的货物——包括线粒体的内部内容物,即所谓的线粒体基质,以及外膜和内膜的组分。其他降解途径,如涉及线粒体衍生区室(MDCs)和线粒体-溶酶体相关细胞器(MLRO)的途径,确保了根据特定条件对线粒体材料的降解。
Prashar等人深入研究并提供了关于如何移除内膜某些部分的新见解。作者报告了一种之前未描述的过程中形成的源自线粒体内膜的囊泡,他们称之为VDIMs,其中内膜被翻转“内外颠倒”。
关键是,这些VDIMs仅包含线粒体内膜组分和mtDNA,缺乏外膜或膜间空间的组分。此外,在一种称为氧化应激的细胞压力类型下,VDIMs富含mtDNA和氧化的心脏磷脂,这是一种仅在线粒体膜中发现的脂质,指向VDIMs在从线粒体中移除受损部分的作用。
解释线粒体内膜组分如何穿过外膜到达胞浆是一个长期的难题。Prashar等人报告了一条与迄今为止发现的回收途径不同的路线,显示VDIMs是通过内膜的突出(外翻)形成的。在内膜和线粒体基质的内容物在外膜通透化期间通过一种称为凋亡的细胞死亡类型发生时,VDIMs却通过由电压依赖性阴离子通道蛋白形成的孔离开,保持整个连接的线粒体网络稳定并确保细胞完整性。
与其他用于移除内膜的自噬相关机制不同,VDIMs未被发现与自噬相关蛋白p62和LC3有关。VDIMs的一部分显示出泛素修饰,但VDIMs可以独立于PARKIN形成。此外,VDIMs的形成不依赖于Drp1、Miro1和SNX9等蛋白质,这些是MDV形成和传递的关键调节因子。
强调这一新描述途径的独特性,Prashar及其同事揭示了VDIMs是如何从器官中分离出来的。线粒体和溶酶体之间的钙离子交换招募了吞噬(吸收)VDIMs的溶酶体,可能使突出的材料能够迅速移除。一个叫做ESCRT的蛋白质复合物,也已知在内涵体出芽过程中起作用,很可能负责将VDIMs从线粒体中分离(剪切)。
这项研究的另一个特别有趣的方面是发现VDIM的形成还依赖于蛋白质MIC60。这是称为线粒体接触位点和嵴组织系统(MICOS)的蛋白质复合物的中心亚基。MICOS需要使内膜内陷(向器官内部突出,与外翻相反)以形成称为嵴的结构,这是能量生产所需的。
这些嵴不是静态结构,它们不断地经历形成和解体(融合和分裂)的循环,这个过程称为嵴膜动力学。鉴于研究表明单个线粒体中的个别嵴作为独立的能源生产单元,VDIMs可能确保了针对性地消除嵴,从而避免整个线粒体网络的部分更替。
这一发现揭示了线粒体质量控制的另一层面,突显了这些细胞器的精细进化。线粒体已经发展出了精确识别和回收受损组分的机制,确保了细胞健康和效率——这是一个保护我们细胞处理器的关键过程。
尚未发现的是,这些多种移除线粒体物质的途径在多大程度上彼此独立——换句话说,它们代表部分重叠(冗余)还是截然不同(互补)的过程。未来的挑战将是理解每个途径在特定压力条件下的重要性。如何识别并选择性移除受损的嵴,以及嵴膜动力学是否与VDIM形成和嵴质量控制相关联,将是未来研究的激动人心的领域。
https://wap.sciencenet.cn/blog-41174-1448124.html
上一篇:干细胞通过平衡垂死细胞的清除和再生来保持组织健康
下一篇:高压氧对久坐老年人体能和心脏灌注的影响