博文
衰老细胞的正面生理作用【警】
|
衰老细胞的正面生理作用
全球人口的老龄化加剧了人们对理解衰老过程和制定延长健康寿命策略的兴趣。细胞衰老,当细胞在体外增殖一段时间后或响应于亚致死性压力或癌基因表达而变得不可逆地生长停滞时(1,2),在衰老表型和与年龄相关的疾病中发挥作用(1)。越来越多的证据表明,衰老细胞还具有关键的生理功能,如肿瘤抑制、发育、伤口愈合、组织重塑、再生和血管生成。这引发了关于不同类型衰老细胞之间的相似性和差异以及它们如何在稳态和病理中发挥作用的重要问题,并为将它们作为治疗目标带来了额外的挑战。
尽管细胞衰老在肿瘤抑制和衰老表型中很重要,但其确切定义仍有争议。此外,没有单一的衰老生物标志物,而是使用了几个标志物——包括生长停滞、衰老相关β-半乳糖苷酶活性、端粒相关DNA损伤以及细胞周期抑制剂p16和p21的表达——来识别并有时定量体内外衰老细胞(1,2)。已发现衰老细胞会分泌促炎细胞因子和其他因子,这一特性称为衰老相关分泌表型(SASP),可能破坏组织稳态并导致促炎状态(1)。事实上,一项开创性的研究证明,通过使用一种诱导系统在表达p16的细胞中触发凋亡从而遗传上消除衰老细胞,改善了衰老迹象并将小鼠的平均寿命延长了24%到27%(3)。因此,近年来开发选择性杀死衰老细胞的药物——senolytics——受到了关注(1)。
虽然在小鼠模型中的几项研究支持衰老细胞可以触发或促进与年龄相关表型的假设,但最近的研究揭示了衰老细胞在非有害甚至生理过程中的其他作用。事实上,消除小鼠体内的衰老细胞可能对健康有害,这凸显了这些细胞在哺乳动物稳态和生理学中的重要性。例如,随着年龄的增长,特别是在肝脏中,衰老细胞变得更加普遍,通常是血管内皮细胞。在小鼠中连续或急性去除这些衰老细胞破坏了血液-组织屏障,导致血液中大分子废物的积累,进而在不同组织中引起血管周围纤维化和随后的健康恶化(4)。这些结果强调了衰老细胞在对机体健康重要的组织中所扮演的功能和结构角色。
另一项最近的研究使用p16作为标记物,在年轻小鼠中鉴定出位于肺部上皮干细胞附近基底膜的一群衰老成纤维细胞,这些细胞监测屏障完整性并响应组织炎症以促进上皮再生(5)。另一项不同的研究检测到新生小鼠肺部多种细胞类型的衰老,并证明通过药物或遗传方式(通过删除p21)减少衰老细胞会干扰肺部发育(6)。这些发现表明,程序化的衰老显然不是作为损伤反应而诱导的,而是与发育过程相关,对于小鼠的肺发育至关重要。然而,一旦在7天大的小鼠中肺已经发育完全后减少衰老细胞,会减轻高氧引起的肺损伤,这表明衰老细胞也可以限制组织修复(6)。矛盾的是,消除衰老细胞可能会加剧小鼠的肺高压,尽管在患有高血压的小鼠和患者肺中发现衰老标记物增加(7)。值得注意的是,一项使用p16转基因小鼠的研究还发现p16和细胞衰老在促进胰腺β细胞分泌胰岛素方面发挥作用,这也在人类细胞中观察到,这表明在某些情况下细胞衰老可以增强细胞功能(8)。
体内衰老的研究通常使用衰老消除小鼠,这些小鼠经过基因工程改造,可以通过靶向表达p16的细胞来选择性消除衰老细胞。一个重要的考虑因素是,许多这样的小鼠模型使用了不同的构建体来靶向p16(3,4)。不同的构建体可能导致衰老细胞消除的速度和效果上的差异。因此,技术上的差异可能解释了某些结果的不一致性,并进一步表明组织内一定比例或类型的衰老细胞可能是健康的,而其他类型的衰老细胞和数量可能是病理性的。同样重要的是要注意,尽管p16是这些实验中最广泛使用的标记物,但它不是细胞衰老的通用标记物,而且可以独立于p16表达观察到衰老细胞(9)。
尽管在小鼠和其他生物体的发育过程中观察到了细胞衰老(1,2),但其在发育中的功能仍在被揭示。人类胎盘中观察到了衰老细胞和衰老信号的激活,而在患有子宫内生长受限的孕妇胎盘中,这些细胞的表达被下调(9)。有趣的是,由于删除编码关键衰老相关信号蛋白(p16、p21和p53)的基因,导致衰老缺陷的小鼠表现出胎盘形态异常,这表明细胞衰老及其背后的信号通路调节胎盘结构和功能(9)。此外,小鼠中的衰老细胞促进毛发生长,且衰老细胞群似乎增强邻近干细胞的活动以刺激组织更新(10)。因此,非损伤依赖性程序化衰老在不同哺乳动物组织的发育过程中具有各种功能,这些衰老细胞的精确功能需要进一步研究。
细胞衰老在伤口愈合和修复中的作用已被认识多年,据推测,衰老细胞可能通过SASP招募免疫细胞以促进组织修复(2)。然而,关于不同动物中细胞衰老在再生和组织修复中作用的更广泛图景正在浮现。在一种无脊椎动物刺胞动物(Hydractinia symbiolongicarpus)中,衰老细胞可以诱导邻近体细胞重编程为干细胞,驱动全身再生(11)。遗传或药理学抑制细胞衰老阻止了重编程和再生,这表明衰老细胞在损伤部位向邻近细胞发出信号,为再生做准备(11)。类似地,在蝾螈(Notophthalmus viridescens)中,细胞衰老增强了肢体再生,特别是通过促进肌肉去分化和产生再生祖细胞(12)。在斑马鱼中,切除鱼鳍后出现衰老细胞,其药理学去除会损害组织再生(13)。尽管这些观察结果对哺乳动物的相关性尚不清楚,但几项小鼠研究也证明了衰老细胞对组织再生的重要性。例如,肝损伤后诱导肝星状细胞的衰老,药理或遗传消除这些衰老细胞会损害肝脏再生(14)。
细胞衰老是一种适应性过程;衰老细胞不是老化、功能失调的细胞,它们是对几种生理过程重要的功能性细胞(见图)。不幸的是,“衰老”这个词暗示了一种有害或非功能性的角色,这已经不再准确(15)。尽管缺乏通用的衰老标记物和明确的细胞衰老定义带来了挑战,但毫无疑问,展现出与衰老相关的标记物的细胞在各种正常生理功能中以及维持组织稳态方面发挥着至关重要的作用。尽管损伤和应力可以诱导细胞衰老,可能是为了通过SASP招募免疫细胞并促进组织修复和重塑,但细胞衰老也可以独立于分子损伤或伤害发生,例如在发育期间。此外,由伤害引起的衰老可以鼓励再生和伤口愈合,不同组织再生中涉及的衰老细胞程度是未来研究的令人兴奋的方向。尽管许多研究表明衰老细胞在衰老中起作用(1-3),但最近发现的衰老细胞的正常生理功能揭示了一个更为复杂的画面,即细胞衰老在哺乳动物衰老中的潜在角色。
应该承认一些局限性。越来越多的药物干预,即所谓的抗衰老药物,已被证明在衰老小鼠中具有健康益处(1)。但这些药物具有非靶向效应,因此,如本文所关注的遗传操作可能提供一种更精确的方式来测试衰老细胞在健康、衰老和疾病中的作用。尽管如此,几项在小鼠中的研究已经使用遗传和药物方法来针对衰老细胞,并表明它们的消除可能会损害正常生理功能,如器官发育和组织再生(6, 14)。
另一个重要的警告是,大多数关于细胞衰老的体内研究都是在小鼠中进行的,其在人类中的作用仍然鲜为人知。在与年龄相关的人类疾病的上下文中已观察到衰老细胞(2),通常是作为炎症反应的一部分。然而,衰老细胞在人类病理学中是保护性的还是有害的(或两者兼有)还有待确定。正如炎症促进组织修复但可能无意中导致组织功能障碍一样,衰老也可能是多效性的,并且根据上下文,可能在人类中是有害的或是有益的。也许某些类型的衰老细胞通过促进再生以及维持结构和功能来防止组织退化,从而有助于健康维护,而其他类型——或过量——则会导致退化。值得注意的是,并非所有的衰老细胞都是相同的。它们可以有不同的诱导剂,表达不同的标记物,起源于不同的组织和细胞类型;我们对不同类型的衰老细胞的理解仍然非常有限。关于不同类型的衰老细胞的时间动态、它们的功能以及它们被免疫系统清除的问题仍有许多疑问。也许短期、暂时性的细胞衰老是有益的,而长期、慢性的衰老则变得有害。确实,衰老细胞不仅异质性,而且可能是动态的,随着时间和组织微环境的变化而变化。需要更多的研究来区分健康和病理性衰老细胞,目前正在进行的项目,如细胞衰老网络(SenNet; https://sennetconsortium.org/),旨在识别、分类和表征人类和模型生物中的衰老细胞,以提高理解。
衰老细胞的日益增长的生理作用对开发针对它们的抗衰老药物和其他抗衰老疗法提出了挑战。也许在某些组织中去除某些类型的衰老细胞是有益的,而去除其他类型的衰老细胞或过多的它们则是有害的。因此,有效的治疗方法需要精确性——以一定的剂量和给药方式——以消除病理性衰老细胞同时保留健康的衰老细胞。或者可能需要探索调节细胞衰老的调节剂,这些调节剂改变衰老细胞的功能而不必然消除它们。因此,围绕针对衰老细胞的衰老疗法的开发仍然是一个有前景的途径,但可能比最初预期的要复杂得多。
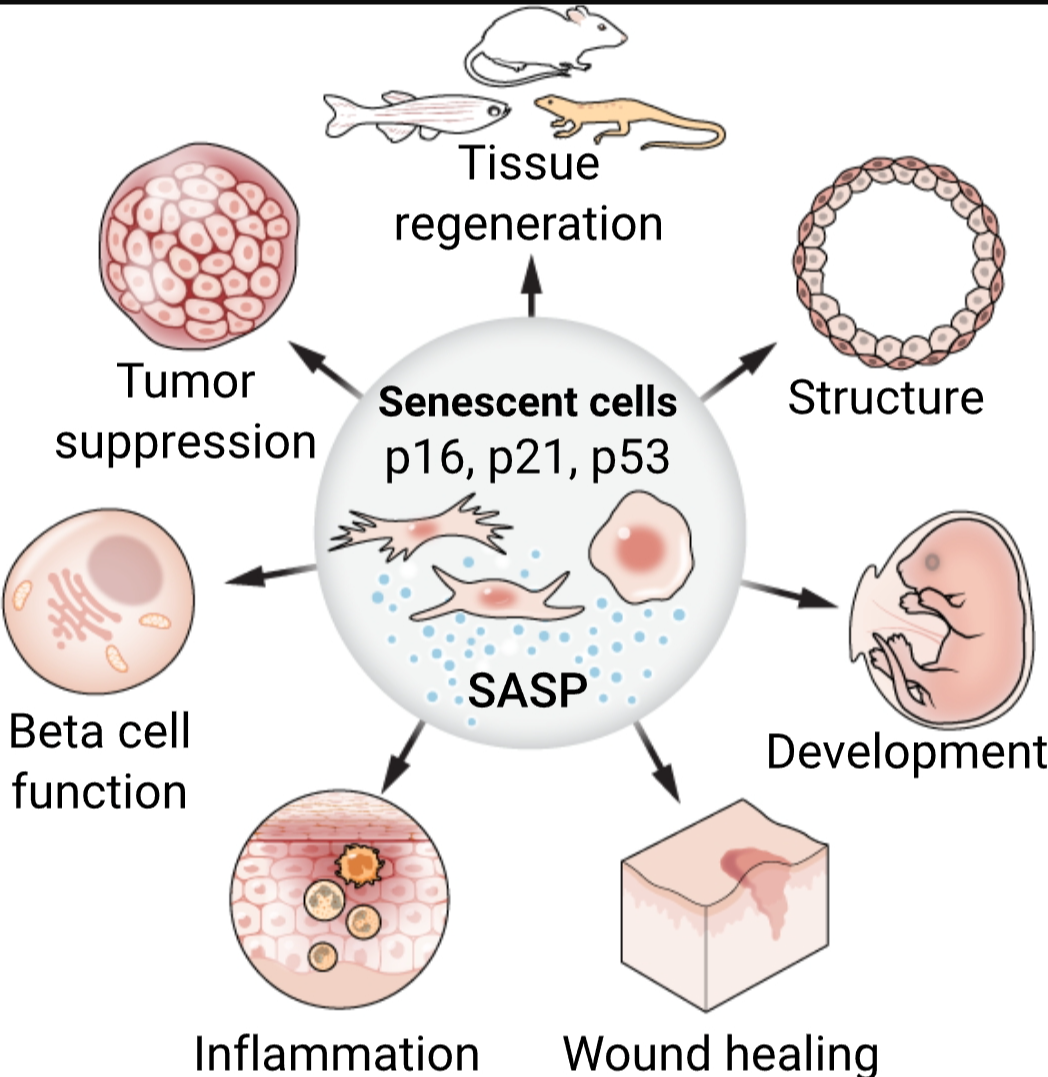
衰老细胞的功能
来自小鼠和其他模型生物的最新证据揭示了细胞衰老在几个组织和器官的发育、几种动物的组织再生、炎症和伤口愈合、肿瘤抑制、胰岛β细胞中的胰岛素分泌以及在血管系统和胎盘中的结构角色中的重要性。可能存在不同类型的衰老细胞,它们具有与衰老相关的分泌表型(SASP),并与p16和p21等标记物的表达相关联。
https://wap.sciencenet.cn/blog-41174-1439212.html
上一篇:唤醒沉睡的巨人:单链 DNA 结合 Schlafen 11 启动先天免疫反应
下一篇:氢纳米气泡可显著提高土豆抗氧化能力【中外合作】