延胡索酸(Fumarate),又名富马酸,除了参与代谢过程,还具有直接调控信号通路的功能,包括对半胱氨酸进行共价修饰形成琥珀酸化(succination),调控蛋白功能。 例如,延胡索酸能够竞争性抑制α-酮戊二酸(α-KG)依赖的HIF家族和去甲基化酶,调控表观遗传修饰和基因表达。近年来多项研究解析延胡索酸传统功能以外的新功能,逐渐发展出全新的概念:即延胡索酸作为关键信号,连接代谢与免疫系统,是调控癌症和自身免疫性疾病的关键代谢信号分子。近期,清华大学生命学院的江鹏团队/华中科技大学基础医学院的程洁团队在《Trends in Endocrinology & Metabolism》发表了题为“Fumarate integrates metabolism and immunity in diseases”的综述。该文系统总结了延胡索酸在免疫领域中的前沿研究进展,阐述了延胡索酸在癌症、自身免疫性疾病以及其他疾病中的调节机制,并探讨了延胡索酸及其酯类对自身免疫性疾病和癌症免疫疗法的临床意义。
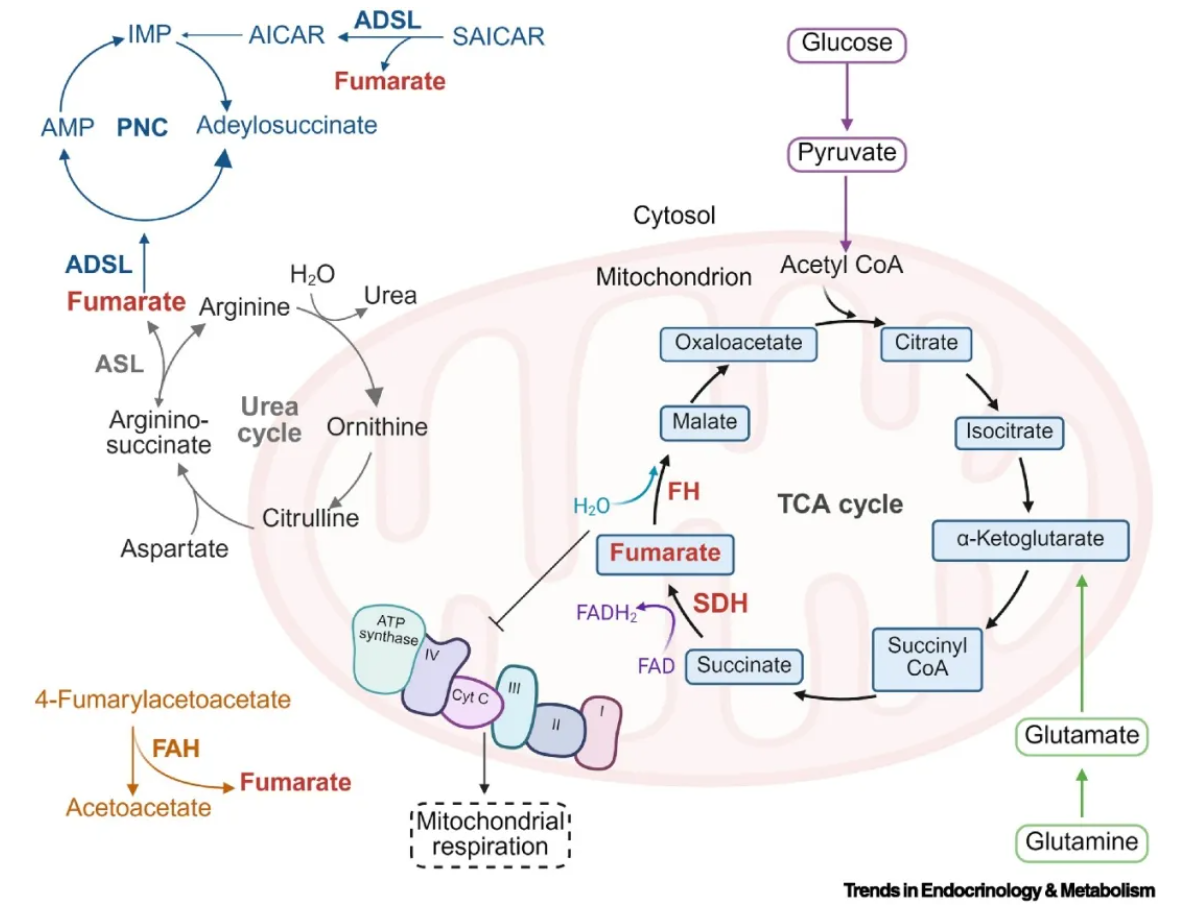
图1. 延胡索酸代谢
延胡索酸作为信号分子行使功能
延胡索酸的结构决定了其作为信号分子的重要性。延胡索酸可自发与Cys的巯基发生迈克尔加成反应,产物为2-(琥珀酸)半胱氨酸(2-(succino)cysteine,2SC),这种共价修饰被定义为琥珀酸化(succination)(图2)。自2SC修饰发现以来,已经有多种代谢和信号蛋白被报到为琥珀酸化靶点。例如,关键的代谢酶GAPDH、ADH和G6PDH[1],Fe-S簇蛋白和铁代谢酶IRP2均会被琥珀酸化抑制。此外,KEAP1、PTEN的琥珀酸化则会调控下游的NRF2和PI3K/AKT信号[2]。这些研究表明,通过对不同蛋白的琥珀酸化,延胡索酸行使连接代谢和信号通路的作用,暗示延胡索酸在复杂生理过程中的关键作用(图2)。
与α-KG相似的结构导致延胡索酸可竞争性抑制α-KG依赖性酶(图2),调控HIF以及表观遗传通路。多项研究揭示,在体外和遗传性平滑肌瘤病和肾细胞癌(hereditary Leiomyomatosis and Renal Cell Cancer, HLRCC)、乳头状肾细胞癌(papillary renal cell carcinoma, pRCC)等肿瘤细胞内,延胡索酸通过与 α-KG竞争以抑制HIF-P4Hs活性,阻碍HIF蛋白的正常降解,导致HIFs及其调控基因的上调[3]。α-KG依赖性组蛋白去甲基化酶JmjC-KDMs、DNA去甲基化酶TET和RNA m6A去甲基化酶ALKBH5和FTO等也被延胡索酸抑制,在表观遗传学层面调控基因的表达。
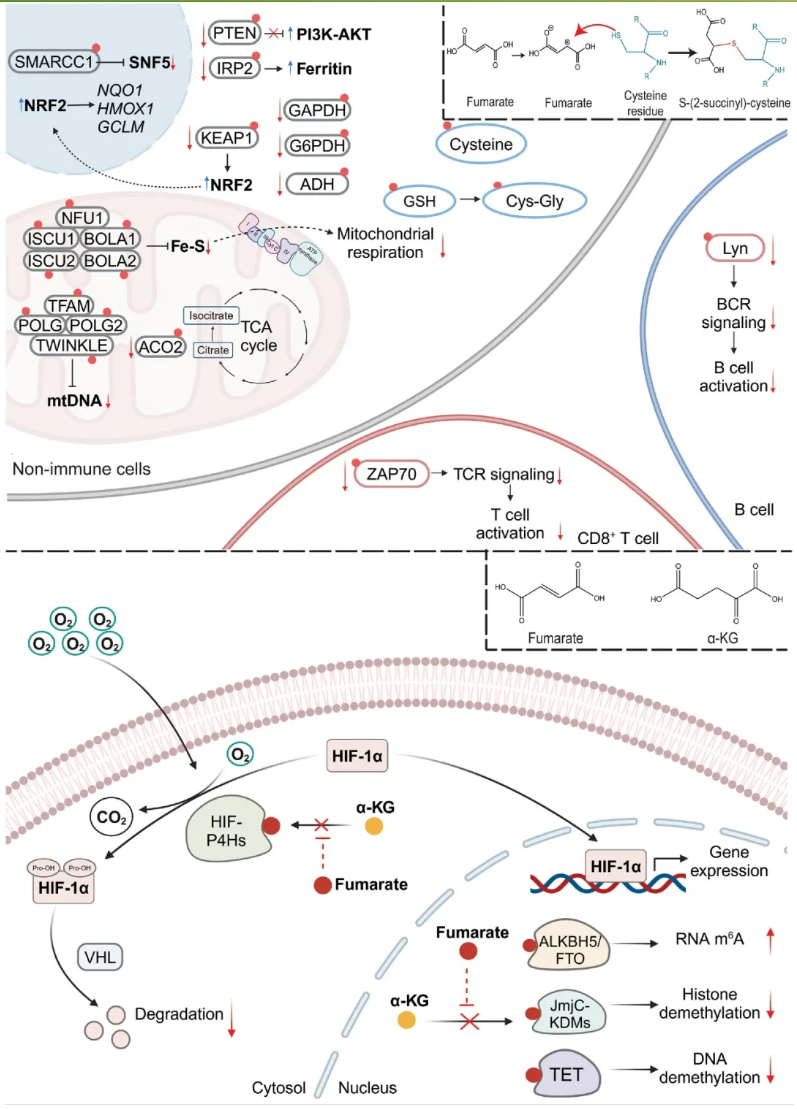
图2. 延胡索酸是一种信号分子
延胡索酸对免疫系统的调控概述
近来多项研究解析了延胡索酸调控各种免疫反应的功能,这些前沿工作突出了延胡索酸作为信号分子对免疫相关疾病的重要性。
1、 延胡索酸对先天性免疫信号通路的调控
延胡索酸调控先天性免疫信号通路。在FH缺失的HLRCC细胞中,延胡索酸积累会诱导mtDNA释放到细胞质,激活 cGAS-STING通路,激活ISG(interferon stimulated genes, ISG),最终诱导肾细胞炎症(图3)。虽然机制研究发现mtDNA 的释放由依赖SNX9的线粒体衍生囊泡所介导,但延胡索酸如何诱导mtDNA上调还有待解释。近期江鹏实验室发现了病毒感染早期,巨噬细胞代谢重组生成大量的延胡索酸,通过琥珀酸化修饰MAVS而提高机体的抗病毒天然免疫能力[4, 5]。
2、 延胡索酸对巨噬细胞的调控
延胡索酸是调控巨噬细胞功能的重要代谢分子。在巨噬细胞受到脂多糖(Lipopolysaccharide, LPS)刺激时,延胡索酸的积累诱导mtRNA释放,触发RIG-I和MDA5 信号通路,激活IRF3并诱导I型干扰素,抑制IL-10、IL-1β 和 IL-6的表达,促进炎症反应。然而,当前研究无法解释延胡索酸如何感知LPS刺激和诱导mtRNA释放。延胡索酸对巨噬细胞的调控还包括:琥珀酸化GSDMD-C192位点,抑制焦亡[6],延胡索酸二甲酯(DMF)治疗有效防止炎症性疾病的LPS休克。另有研究指出,在感染性疾病的情况下,DMF可通过抑制巨噬细胞I型IFN[7]。因此延胡索酸对巨噬细胞的调控呈现出促炎和抑炎的复杂功能,有待更深入的研究(图3)。
3、延胡索酸对单核细胞和中性粒细胞的调控
DMF对银屑病患者的中性粒细胞具有关键的作用。具体而言,DMF抑制中性粒细胞的活化,包括减少活化标志物的表达、活性氧的产生和NETs的形成[8]。此外,DMF减少多发性硬化症患者中单核细胞产生促炎细胞因子,抑制炎症反应[9] (图3)。然而,调控的分子机制尚不清楚。由于中性粒细胞和单核细胞在肿瘤、自身免疫病等疾病中富集,上述发现暗示内源性延胡索酸在疾病进展中存在未知的功能。
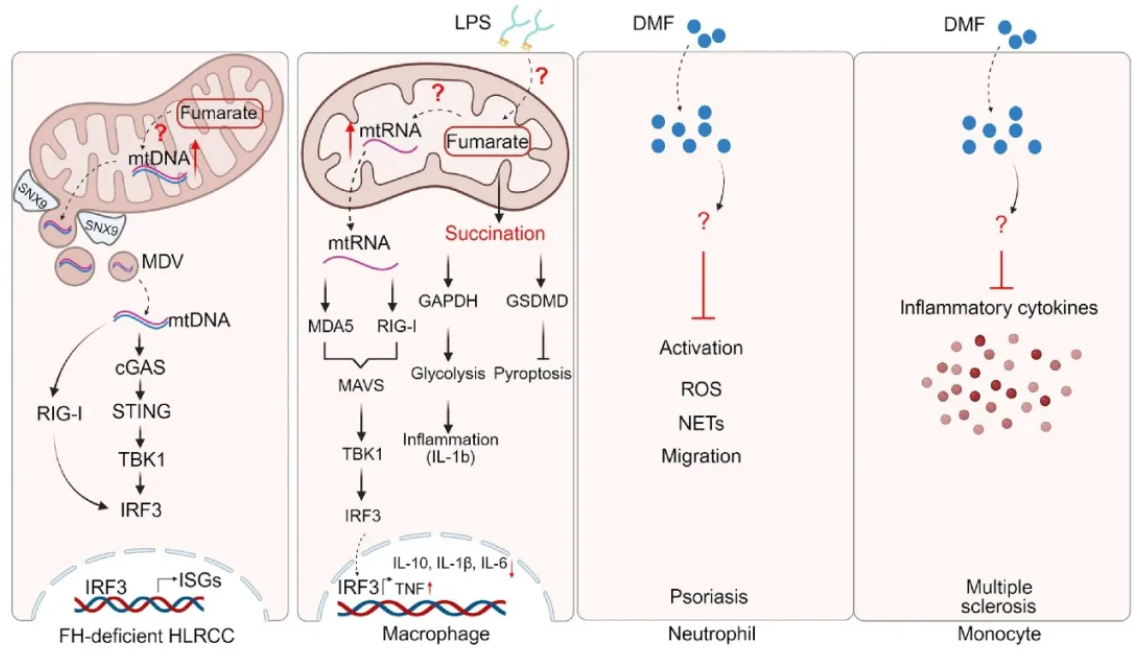
图3. 延胡索酸调控先天免疫
4、 延胡索酸抑制CD8+ T细胞的激活和功能
传统观点认为,延胡索酸衍生物抑制CD8+ T细胞的功能,其天然代谢物的调控功能与机制则不清楚。延胡索酸对CD8+ T细胞的研究进展得益于近期江鹏实验室的工作。肿瘤微环境中的延胡索酸可直接抑制CD8+ T细胞的TCR 信号,帮助肿瘤细胞实现免疫逃逸。该工作对分子机制做了深入研究,揭示延胡索酸琥珀酸化ZAP70-C96/C102位点,抑制Y493的磷酸化和ZAP70的激活,导致CD8+ T细胞的TCR信号阻断,抑制其激活和杀伤肿瘤的功能[10](图4)。后续其他实验室的报道验证了延胡索酸在CD8+ T细胞中的功能[11]。另外,两项研究分别报道,DMF可抑制或促进记忆CD8+ T细胞的发育,暗示天然代谢物延胡索酸具有调节CD8+ T细胞的分化的潜在功能。
5、延胡索酸对CD4+ T细胞的影响
与CD8+ T细胞的研究类似,CD4+ T细胞的研究目前仍局限于延胡索酸衍生物。DMF治疗多发性硬化症后,Th1细胞和记忆CD4+ T 细胞减少,Th2细胞和Treg细胞增加,TH17细胞无变化(图4)。然而,天然代谢物延胡索酸对CD4+ T细胞的影响和机制均缺乏研究。
6、延胡索酸抑制B细胞激活和抗体产生
延胡索酸水平是B细胞活化和功能的关键代谢信号。江鹏实验室报道,在B细胞活化过程中增强FH的表达,导致延胡索酸水平降低。延胡索酸作为信号分子,琥珀酸化LYN -C381位点,抑制LYN活性,从而阻断BCR信号的激活[12] (图4)。延胡索酸衍生物DMF的功能与该研究一致,多项研究表明DMF 有效减少B细胞介导的炎症效应以及多发性硬化症患者的B细胞数量[13]。
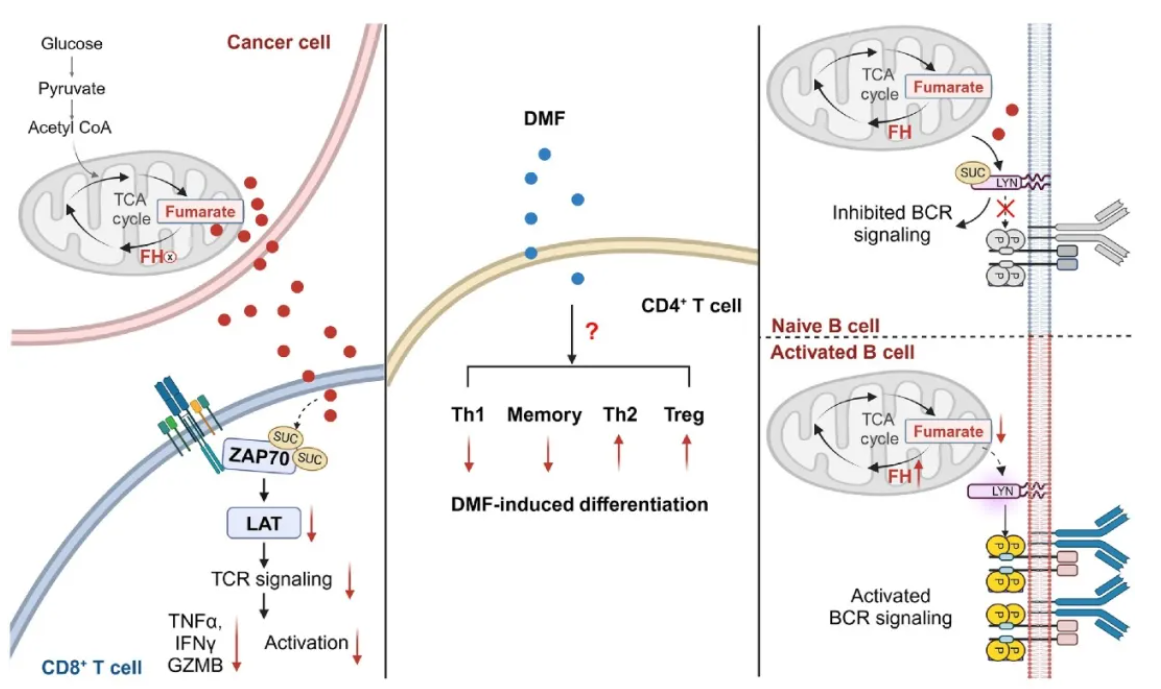
图4. 延胡索酸在适应性免疫中的作用
延胡索酸和疾病概述
1、延胡索酸衍生酯类对自身免疫病的治疗
目前,四种延胡索酸酯已批准用于治疗人类疾病:延胡索酸单甲酯(MMF)(Bafiertam™)、DMF(Tecfidera®、Skilarence®、Fumaderm®)、延胡索酸二羟甲酯(DRF)(Vumerity™)以及延胡索酸单乙酯(MEF)的锌盐、镁盐和钙盐(Fumaderm®)。其中DMF最为历史悠久,用于缓解自身免疫病中的炎症,包括银屑病、系统性红斑狼疮和多发性硬化症。近年来,其分子机制逐渐被揭示:DMF通过琥珀酸化KEAP1和GAPDH,抑制炎症反应。然而,延胡索酸盐在这些自身免疫性疾病中的代谢变化和功能,以及延胡索酸盐代谢是否可以作为靶点,有待进一步的研究。
2、延胡索酸是一种致癌代谢物
延胡索酸是目前已知的唯一诱发特定癌症的代谢物。Fh基因突变导致延胡索酸积累是导致HLRCC的主要原因。功能性FH的缺失导致延胡索酸的毫摩尔级积累,调控表观遗传。具体机制包括,延胡索酸抑制Tet介导的mir-200ba429的去甲基化,从而导致EMT相关转录因子的表达和迁移特性的增加,促进HLRCC的肿瘤发生。此外,延胡索酸积累的另一重要特征是诱导缺氧诱导基因和ARE控制基因的表达。KEAP1是首个报道的延胡索酸靶点,其琥珀酸化修饰促进NRF2的功能,上调抗氧化途径。
虽然延胡索酸对 HLRCC的发生至关重要,但它是否发挥广泛作用一直是未决问题。近来,江鹏实验室和其他研究小组的研究表明,除HLRCC外,包括结肠癌、乳腺癌、膀胱癌和透明细胞癌等其他各癌种患者的FH水平表达都可能以基因缺失、突变和表达抑制的方式降低,进而与更低的生存率相关(图5),表明FH可能会以广泛的方式促进癌症进展[10, 14]。
3、延胡索酸和其他疾病
内源性延胡索酸在其他疾病中的功能还有待研究。基于 DMF 的抗炎功效能,天然代谢物延胡索酸在其他炎症性疾病中的作用已引起关注。例如,在神经退行性疾病(阿尔兹海默、帕金森病和亨廷顿病模型中,DMF治疗具有有益的效果。DMF治疗在慢性淋巴细胞白血病(NCT02784834)。治疗颅内动脉瘤(NCT05959759)、肌萎缩侧索硬化症、急性缺血性中风(NCT04890366、NCT04890353)和肾上腺白质营养不良症(NCT06513533)的临床试验也在进行中。此外,DMF还被用于治疗SARS-CoV-2感染模型(图5)。
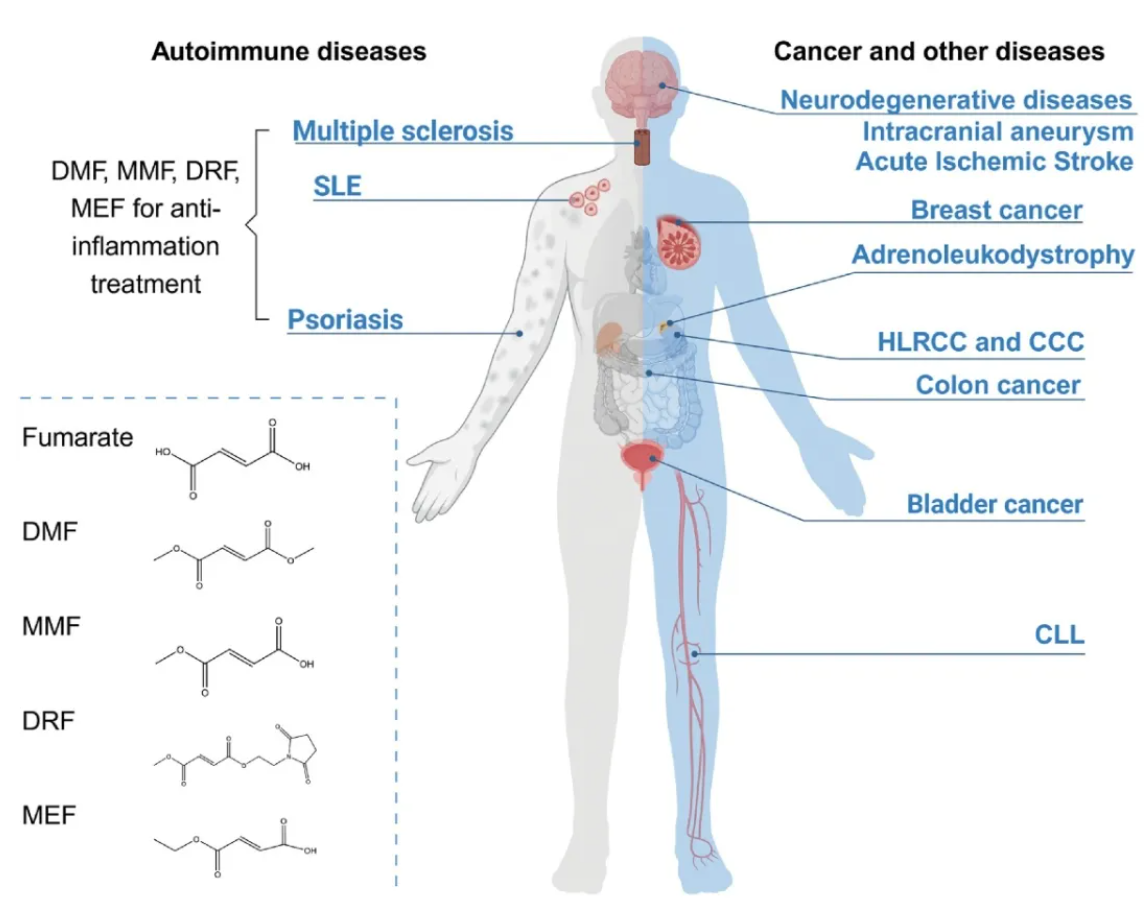
图5. 延胡索酸及其相关的人类疾病。
原文摘要:Abstract
Fumarate is a key metabolite produced primarily by the tricarboxylic acid (TCA) and urea cycles. In addition to having a metabolic role, its electrophilicity enables it to covalently modify cysteines; moreover, because of its α-ketoglutarate (α-KG)-like structure, it can also act as a competitive inhibitor of α-KG-dependent dioxygenases for epigenetic remodeling. Recent advances have broadened the role of fumarate as a bridge between metabolism and both innate and adaptive immunity, suggesting potentially important functions in anticancer immunity and autoimmune diseases. Here we review the connections between fumarate metabolism and immunity; we describe the mechanisms of fumarate regulation in cancer, autoimmunity, and other diseases; and we explore the clinical implications of fumarate and its esters for immunotherapy.
DOI: https://doi.org/10.1016/j.tem.2025.03.008
原文链接:https://www.cell.com/trends/endocrinology-metabolism/fulltext/S1043-2760(25)00051-7
参考文献
1. Alderson, N.L., et al., S-(2-Succinyl)cysteine: a novel chemical modification of tissue proteins by a Krebs cycle intermediate. Arch Biochem Biophys, 2006. 450(1): p. 1-8.
2. Ge, X., et al., Fumarate inhibits PTEN to promote tumorigenesis and therapeutic resistance of type2 papillary renal cell carcinoma. Mol Cell, 2022. 82(7): p. 1249-1260.e7.
3. Koivunen, P., et al., Inhibition of hypoxia-inducible factor (HIF) hydroxylases by citric acid cycle intermediates: possible links between cell metabolism and stabilization of HIF. J Biol Chem, 2007. 282(7): p. 4524-4532.
4. Xia, W., et al., Metabolic remodelling produces fumarate via the aspartate-argininosuccinate shunt in macrophages as an antiviral defence. Nat Microbiol, 2025.
5. Min, Y. and L.A.J. O'Neill, MAVS is a sensor of fumarate during antiviral immunity. Nat Microbiol, 2025.
6. Humphries, F., et al., Succination inactivates gasdermin D and blocks pyroptosis. Science, 2020. 369(6511): p. 1633-1637.
7. Ryan, T.A.J., et al., Dimethyl fumarate and 4-octyl itaconate are anticoagulants that suppress Tissue Factor in macrophages via inhibition of Type I Interferon. Nat Commun, 2023. 14(1): p. 3513.
8. Hoffmann, J.H.O., et al., Dimethyl fumarate modulates neutrophil extracellular trap formation in a glutathione- and superoxide-dependent manner. Br J Dermatol, 2018. 178(1): p. 207-214.
9. Michell-Robinson, M.A., et al., Effects of fumarates on circulating and CNS myeloid cells in multiple sclerosis. Ann Clin Transl Neurol, 2016. 3(1): p. 27-41.
10. Cheng, J., et al., Cancer-cell-derived fumarate suppresses the anti-tumor capacity of CD8(+) T cells in the tumor microenvironment. Cell Metab, 2023. 35(6): p. 961-978.e10.
11. Zhang, Z., et al., Malic enzyme 2 maintains metabolic state and anti-tumor immunity of CD8(+) T cells. Mol Cell, 2024. 84(17): p. 3354-3370.e7.
12. Cheng, J., et al., Fumarate suppresses B-cell activation and function through direct inactivation of LYN. Nat Chem Biol, 2022. 18(9): p. 954-962.
13. Mills, E.A., et al., Emerging Understanding of the Mechanism of Action for Dimethyl Fumarate in the Treatment of Multiple Sclerosis. Front Neurol, 2018. 9: p. 5.
14. Valcarcel-Jimenez, L. and C. Frezza, Fumarate hydratase (FH) and cancer: a paradigm of oncometabolism. Br J Cancer, 2023. 129(10): p. 1546-1557.
转载本文请联系原作者获取授权,同时请注明本文来自汪凯科学网博客。
链接地址:https://wap.sciencenet.cn/blog-446272-1489869.html?mobile=1
收藏

