生物体已经进化出多种机制来应对潜在有害的突变。这些机制包括基因重复、代谢因子或通路的冗余以及反馈回路,所有这些都能形成备份系统和隐藏储备,从而确保细胞的稳定性(1)。在本期杂志的687页,El-Brolosy等人(2)报道了转录适应这一机制,它是一种双重的反馈和前馈机制,利用遗传冗余来弥补蛋白质编码基因中的突变。作者们发现,细胞会将突变信使RNA(mRNA)的降解片段从细胞质运输到细胞核,以上调所谓“适应基因”的转录,这些适应基因包括发生突变的基因、其旁系同源基因(源自同一复制事件的基因),在某些情况下还包括生物学上相关的基因。El-Brolosy等人还利用他们对转录调控机制的理解,开发出了能够人工激活细胞中靶基因表达的短核酸序列。
DNA中编码的遗传信息通过转录被复制到mRNA中。mRNA的编码区——通常以起始密码子和终止密码子为界——充当合成功能性蛋白质的模板(mRNA翻译)。在真核生物中,这两个步骤在物理上是分隔的,基因转录发生在细胞核内,而mRNA翻译则在细胞质中进行。此外,在人类、小鼠和大多数其他多细胞生物中,蛋白质编码基因会生成前体mRNA,这些前体mRNA必须在细胞核中经过精确加工才能形成成熟的mRNA。值得注意的是,基因转录、前体mRNA加工和mRNA翻译过程都容易出错。遗传性和体细胞DNA突变也可能导致产生突变的或异常加工的mRNA。真核生物已经进化出多种细胞核和细胞质质量控制通路,以标记并快速清除可能导致有毒蛋白质产生的突变前体mRNA和mRNA(3,4)。例如,无义介导的mRNA降解(NMD)和无终止降解(NSD)会分别检测并降解细胞质中因突变或加工错误而产生提前终止密码子或缺乏任何终止密码子的mRNA(4)。
在过去10年中,人们还发现NMD和NSD能通过诱导适应基因的转录上调来帮助细胞应对基因突变(5,6)。这种被称为转录适应的机制可以触发遗传补偿,这一过程能够阻止或减轻因基因功能丧失而原本可能出现的表型(5,6)。El-Brolosy等人确定,RNA结合蛋白白细胞介素增强子结合因子3(ILF3)是NSD或NMD诱导的转录适应的关键介质。他们的NSD模型依赖于小鼠胚胎成纤维细胞中肌动蛋白γ胞质1基因(Actg1-NSD)突变等位基因编码的、特征明确的mRNA(5,7)。相比之下,他们的NMD模型则依赖于在人类白血病细胞中对数十个基因进行单独突变。
应对mRNA突变
带有提前终止密码子或缺乏任何终止密码子的信使RNA(mRNA)会分别在细胞质中被无义介导的mRNA降解(NMD)或无终止降解(NSD)机制降解,产生mRNA降解片段。白细胞介素增强子结合因子3(ILF3)可能会结合其中一些片段,并将它们运送至细胞核。在反馈转录适应过程中,ILF3 - mRNA降解片段复合物会与突变基因产生的互补核反义RNA杂交,从而刺激基因转录。在前馈转录适应机制中,ILF3 - mRNA降解片段复合物还能与其他适应基因(即旁系同源基因或功能相关基因)产生的反义RNA或调控RNA杂交,刺激它们的转录。
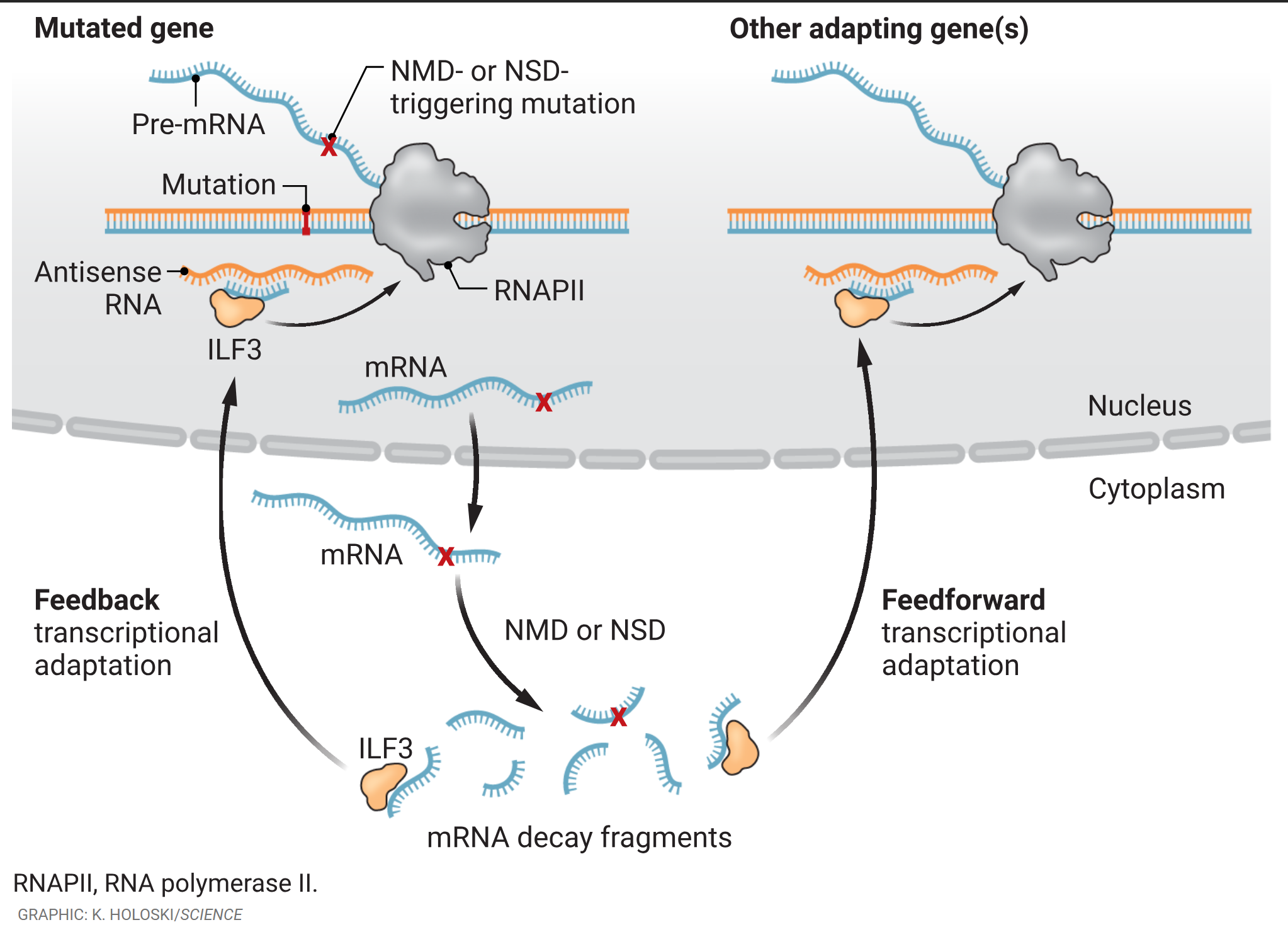
El-Brolosy等人观察到,ILF3会与NSD机制降解Actg1-NSD mRNA所产生的RNA片段结合(见图)。来自NSD和NMD模型的实验结果支持这样一种模型:结合了ILF3的mRNA降解片段随后被导入细胞核,在那里它们与适应基因的非模板链转录的RNA(反义RNA)或调控区域(启动子或增强子)转录的RNA进行碱基配对。ILF3结合的mRNA降解片段与反义RNA的完美互补能有效触发突变基因两个等位基因的转录,这是一种“反馈机制”。El-Brolosy等人还发现,短的(20至30个核苷酸)mRNA降解片段无需与核反义RNA完全互补就能触发转录适应。因此,在“前馈机制”中,NSD触发的转录适应是通过mRNA降解片段与源自该基因旁系同源基因的核反义RNA,或源自具有相似生物学功能的其他适应基因的启动子或增强子的RNA之间的碱基配对来介导的。mRNA降解片段与这些启动子或增强子衍生的核RNA之间的部分序列互补性表明,它们是为了转录适应而共同进化的。
ILF3介导的转录适应可能涉及多种机制。例如,El-Brolosy等人报道,NSD介导的转录适应需要招募基因转录激活因子,如WD重复蛋白5(WDR5),它是染色质修饰因子COMPASS的支架组件,通过催化组蛋白H3第4位赖氨酸的三甲基化(H3K4me3)使DNA能够被转录因子接近。值得注意的是,NMD因子无义转录本调节因子3A(UPF3A)——和ILF3一样,被预测为一种RNA结合蛋白(8)——与COMPASS形成复合物,并且至少在斑马鱼中,介导NMD依赖的转录适应以及适应基因的H3K4三甲基化(9)。未来的研究将确定ILF3、UPF3A和其他蛋白质是共同还是独立地促进转录适应,以及这些机制是否会因物种、细胞类型、条件或质量控制机制(NMD或NSD)的不同而有所差异。
尽管反义RNA在转录适应中发挥作用,但它们也会对其来源基因的有义链转录产生负面影响。相应地,El-Brolosy等人发现,在小鼠胚胎成纤维细胞和人类胚胎肾细胞中引入间隙mer(类DNA)反义寡核苷酸(ASOs)以促使靶标反义RNA降解,会诱导有义链转录。作者们开发了一种大规模平行报告基因测定法,将数百个重叠的RNA片段分别插入对NMD敏感的报告基因mRNA中,以在不同细胞类型中识别能有效触发转录适应的短mRNA序列。这些序列还被用于设计最适合激活靶基因的间隙mer ASOs。尽管与CRISPR激活相比,间隙mer ASOs激活基因转录的效率较低,但它们具有低免疫原性、稳定性好且易于施用于患者等优点(10)。因此,它们为上调基因表达提供了治疗机会,可用于治疗由单倍体不足(由单个等位基因的突变引起)(11)或非突变肿瘤抑制因子的表观遗传沉默(12)导致的遗传性疾病或癌症。
值得注意的是,NMD在细胞中始终处于活跃状态,并且值得关注的是,5%至10%的生理性mRNA是天然的NMD靶标(13)。转录适应可能对于编码这些生理性NMD靶标的基因及其旁系同源基因(如果存在并产生相应的反义RNA)的适当调控很重要。相应地,通过使致病mRNA易受NMD影响来触发转录适应的间隙mer ASOs,已经在小鼠和人类细胞中进行了治疗杜氏肌营养不良症的测试(14)。对RNA - RNA相互作用以及介导转录适应的因子的更深入理解,可能会产生更多实验性激活基因表达的方法,并开发出新的治疗手段。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1522284.html?mobile=1
收藏

