新型Hydrogen-PT2385-silncARSR纳米复合物可抑制舒尼替尼耐药性肾癌的肿瘤血管生成与线粒体活性
本文原作者来自上海交大医学院附属瑞金医院
氢疗法已成为一种极具潜力的癌症治疗手段。前期研究表明,氢分子(H₂)在多种肿瘤类型中均具有抗血管生成作用。然而,目前尚无研究探讨H₂在舒尼替尼耐药性透明细胞肾细胞癌(ccRCC)中的抗血管生成效应,也未阐明其相关作用机制。此外,缺氧诱导因子2α(HIF-2α)和肾癌舒尼替尼耐药相关长链非编码RNA(lncARSR)在介导ccRCC舒尼替尼耐药过程中均发挥关键作用。但传统多药联合策略无法在气体疗法的基础上,实现对耐药相关靶点的精准、有效抑制。因此,本研究设计了一种肿瘤靶向性纳米复合物,该复合物可在局部生成H₂,并高效递送PT2385与靶向lncARSR的小干扰RNA(silncARSR),从而在舒尼替尼耐药性ccRCC中抑制HIF-2α活性并下调lncARSR表达。机制层面,原位生成的H₂与lncARSR敲低可通过下调舒尼替尼耐药性癌细胞及M2型肿瘤相关巨噬细胞(TAMs)分泌的血管内皮生长因子A(VEGFA),有效抑制肿瘤血管生成。由此,H₂与silncARSR显著增强了PT2385(HIF-2α抑制剂)的抗血管生成活性。此外,H₂、silncARSR与PT2385联合作用可显著调控凋亡相关蛋白的表达,最终促进癌细胞线粒体凋亡,大幅提升治疗效果。该Hydrogen-PT2385-silncARSR纳米复合物展现出优异的治疗效果与良好的生物相容性,这凸显了其在克服ccRCC舒尼替尼耐药性方面的临床转化潜力。
1. 引言
在所有组织学亚型中,透明细胞肾细胞癌(ccRCC)占肾癌病例的75%-80%[1,2]。舒尼替尼是一种酪氨酸激酶抑制剂(TKI),可阻断肿瘤血管生成与生长,被批准用于晚期或转移性ccRCC患者的一线治疗[3]。然而,对于初始接受舒尼替尼治疗有效的患者,其体内不可避免会在1年内出现耐药性,进而导致肿瘤进展、复发或转移,最终对5年生存率产生不利影响[4,5]。此外,当前的联合治疗方案因毒性增加、靶点覆盖范围狭窄及对肿瘤细胞的选择性有限等问题,为舒尼替尼耐药性肾癌患者带来的生存获益十分有限[6,7,8]。因此,研发一种高效、系统的策略以克服舒尼替尼耐药性,已成为亟待解决的关键问题。
舒尼替尼耐药性的产生与肿瘤自身及肿瘤微环境的多种变化相关[9,10]。作为一种固有高血管化实体瘤,ccRCC在获得舒尼替尼耐药性后,其血管生成会出现反跳性增加[11,12,13]。大量研究表明,抗血管生成TKI的逃逸性耐药源于多种适应性机制,包括缺氧诱导因子(HIF)信号通路的上调、替代性促血管生成通路的激活,以及能稳定肿瘤血管的周细胞覆盖增加等[14,15]。此外,M2型极化肿瘤相关巨噬细胞(M2 TAMs)在ccRCC中显著富集,进而构建出促血管生成且具有免疫抑制作用的肿瘤微环境(TME),为肿瘤恶性进展与治疗耐药性的产生提供了有利条件[16,17]。
除上述肿瘤微环境特征外,舒尼替尼耐药性肿瘤细胞还表现出广泛的内在适应性改变与重编程。线粒体是一种复杂的细胞器,可根据可用营养物质、氧气水平及细胞维持与增殖需求,调控能量的产生与分配[18]。前期研究证实,舒尼替尼耐药性肾癌细胞的线粒体膜电位与线粒体含量升高,同时线粒体功能增强,抗凋亡蛋白表达上调[19,20]。因此,本研究旨在开发一种多功能平台,通过同时调控细胞内与细胞外机制,实现对ccRCC舒尼替尼耐药性的高效、协同且安全的克服。
氢分子(H₂)是自然界最轻的分子,具有优异的渗透性与生物相容性,被广泛认为是最具潜力的治疗性气体之一[21,22,23]。前期研究显示,H₂的治疗作用源于其可选择性清除羟基自由基(·OH)与过氧亚硝酸盐(ONOO⁻),同时保留正常细胞信号传导所需的必需活性氧(ROS)[24]。在癌症治疗领域,越来越多的研究表明,H₂可通过介导凋亡信号、阻断肿瘤诱导的血管生成,以及促进TAMs向具有抗肿瘤活性的M1型表型极化等方式,抑制肿瘤发展[25,26,27]。然而,H₂在舒尼替尼耐药性ccRCC中的作用机制仍未得到充分阐明。本研究构建了一种纳米平台,该平台包含叶绿素(Chlα,一种光敏剂)、L-抗坏血酸(AA,一种电子供体)与金纳米颗粒(AuNPs,一种催化剂),可在660nm近红外光(NIR)照射下生成H₂[28]。此外,为实现H₂在肿瘤组织中的原位生成,并更好地探究其对耐药性ccRCC的作用,研究人员将针对耐药性肿瘤细胞表面过表达蛋白的抗体偶联至该纳米平台。后续研究结果证实,这一修饰克服了传统氢给药方式的主要缺陷,即扩散随机、释放失控与疗效欠佳[29,30]。
HIF-2α与lncARSR是ccRCC舒尼替尼耐药性的关键调控因子,二者均为预后不良的独立预测指标[31,32]。HIF-2α是一种在ccRCC中累积的转录因子,可通过调控下游分子(如血管内皮生长因子A(VEGFA)、细胞周期蛋白D1(CCND1)、溶质载体家族2成员1(SLC2A1)等),参与肿瘤血管生成、细胞增殖与代谢重编程等多种恶性进程[33,34]。PT2385是一种高选择性小分子抑制剂,专门用于靶向并破坏HIF-2α与HIF-1β的功能性二聚化,从而抑制其转录活性[12]。此外,临床与临床前研究均证实,PT2385可通过显著抑制肿瘤血管生成、抑制细胞增殖与代谢适应,发挥优异的治疗效果[35,36]。长链非编码RNA(lncRNA)是指长度超过200个核苷酸的非蛋白质编码转录本,可通过多种机制在多水平调控基因表达[37,38]。前期研究已证实,lncARSR(肾癌舒尼替尼耐药相关激活长链非编码RNA)可通过上调AXL/c-MET信号通路以促进细胞增殖,并通过stat-3通路促进巨噬细胞向M2型极化,从而诱导ccRCC产生舒尼替尼耐药性[39,40]。因此,同时抑制HIF-2α与lncARSR可实现对关键舒尼替尼耐药基因的多靶点调控,为克服耐药性提供了一种极具潜力的策略。
纳米技术近年来取得了长足进展[41]。两亲性甲氧基聚乙二醇-聚(D,L-丙交酯-乙交酯)-聚(L-赖氨酸)三嵌段共聚物(mPEG-PLGA-PLL)具有良好的生物相容性与优异的载药效率[42]。此外,由于该材料能显著抑制网状内皮系统(RES)的识别,包裹于其中的药物与核酸在体内的循环时间可有效延长[43,44,45,46]。值得注意的是,PLL中的氨基可通过缩合反应实现抗体修饰,从而增强对特定组织的靶向能力。基于上述认识,本研究旨在利用聚合物载体PEAL的生物医学潜力,构建一种多功能治疗平台,实现气体疗法、靶向分子疗法与基因疗法的精准协同整合,专门用于克服肾细胞癌的舒尼替尼耐药性。
如示意图1所示,本研究以PEAL为载体骨架,包裹用于选择性抑制HIF-2α的PT2385、用于下调lncARSR的小干扰RNA(silncARSR),以及用于生成H₂的物质(Chlα、AA与AuNPs)。此外,基于前期对ccRCC舒尼替尼耐药性的研究,发现整合素α1(ITGA1,一种膜相关整合素亚基)在耐药性肿瘤细胞表面显著上调[47,48]。因此,研究人员将抗ITGA1抗体进一步偶联至该纳米复合物表面,以实现肿瘤特异性靶向,从而在舒尼替尼耐药性ccRCC中高效、定点共递送H₂、PT2385与silncARSR(即P/S/CVA@NPs-AI纳米复合物)。本研究中,H₂与lncARSR敲低通过两种不同机制协同抑制肿瘤血管生成:直接下调ccRCC肿瘤细胞分泌的VEGFA,以及促进M2型巨噬细胞向M1型巨噬细胞极化,进而减弱其促血管生成功能。结合PT2385的作用,耐药性ccRCC中的病理性高血管化得到有效抑制。此外,Hydrogen-PT2385-silncARSR纳米复合物的联合干预还破坏了舒尼替尼耐药性肾癌细胞的线粒体完整性,从而增强促凋亡信号级联反应,最终实现对癌细胞的有效清除。研究人员还建立了舒尼替尼耐药性ccRCC原位肿瘤模型,以评估该纳米复合物(P/S/CVA@NPs-AI)在体内的治疗效果与生物相容性。综上,本研究开发了一种可共递送H₂、PT2385与silncARSR的多功能纳米复合物,整合了气体疗法、分子靶向疗法与基因沉默技术,可精准靶向舒尼替尼耐药性ccRCC的细胞及肿瘤微环境特征,为高效、低毒克服耐药性提供了新方案。
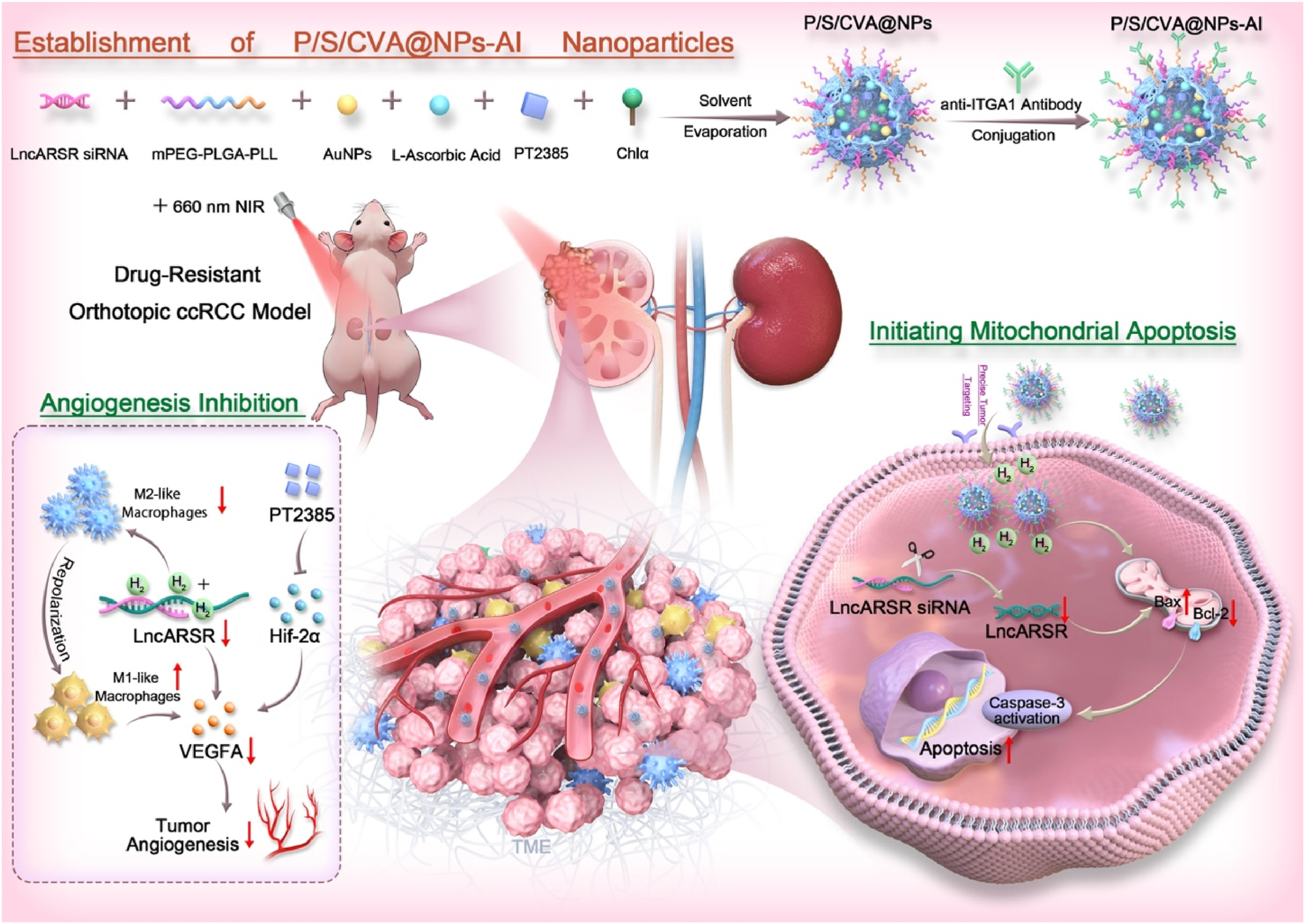
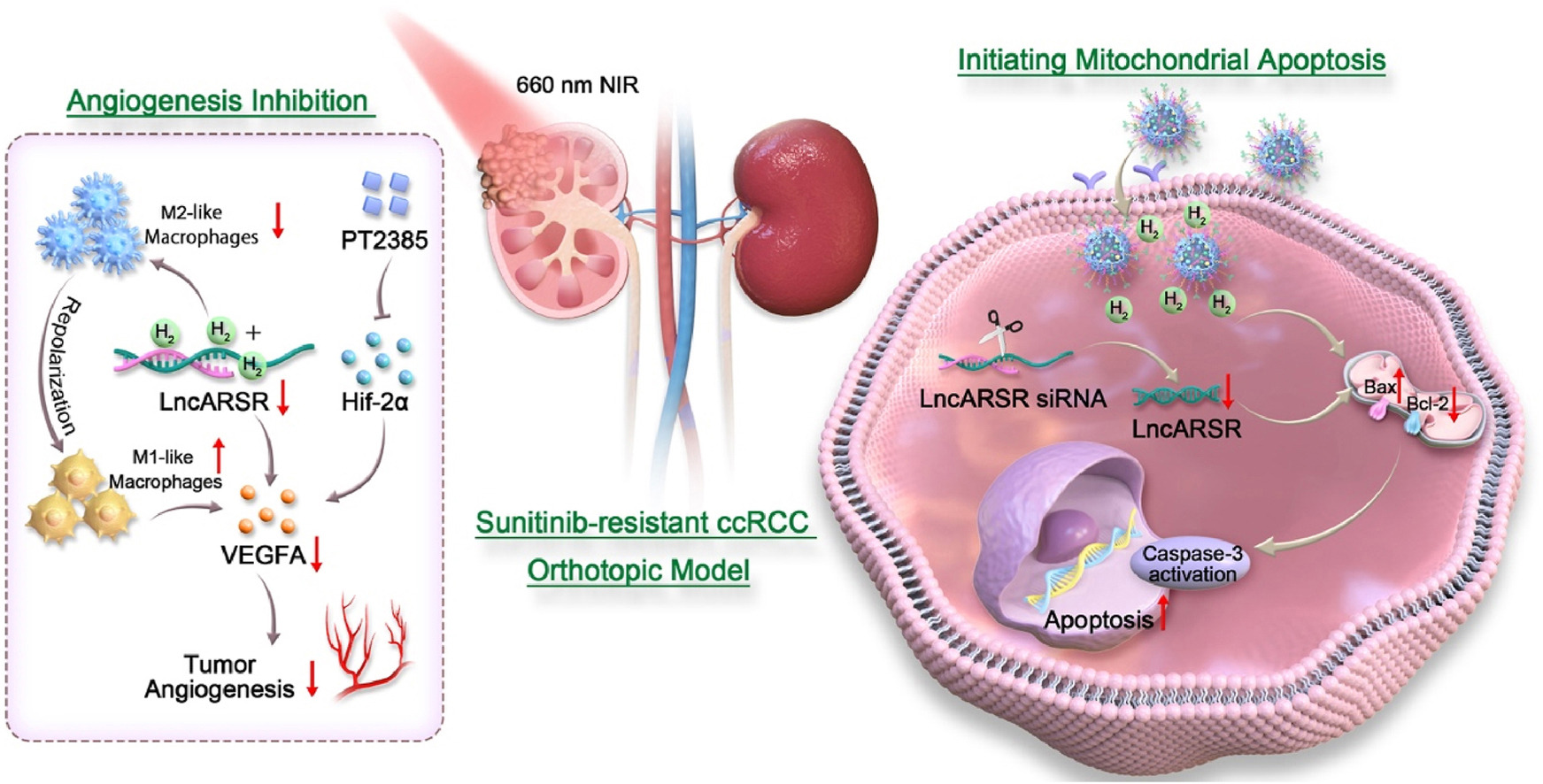
示意图1 P/S/CVA@NPs-AI+激光在PT2385、silncARSR与H₂协同作用下克服ccRCC舒尼替尼耐药性的示意图:1)P/S/CVA@NPs表面偶联的抗ITGA1抗体提升了递送的特异性与效率;2)纳米复合物+激光通过破坏线粒体膜电位与调控凋亡相关关键蛋白,启动杀瘤效应;3)H₂、PT2385与silncARSR通过不同机制协同抑制肿瘤血管生成。
2. 结果与讨论
2.1 肿瘤靶向性P/S/CVA@NPs-AI纳米复合物的构建与表征
图1A示意性展示了P/S/CVA@NPs-AI的构建过程。简要来说,通过双乳化法制备P/S/CVA@NPs后,利用EDC/NHS催化的氨酰化反应,将抗ITGA1抗体偶联至PLL的氨基上。采用动态光散射(DLS)技术对该纳米复合物的水动力学直径与zeta电位进行表征,结果显示其直径为218±2.7nm,zeta电位为1.20±0.13mV(图S1)。通过流式细胞术分析抗ITGA1抗体在纳米颗粒表面的偶联效率,结果如图S2所示:P/S/CVA@NPs-AI+激光组的蛋白表达水平最低,表明偶联抗ITGA1抗体的纳米颗粒占据了786-O-R细胞表面的大部分靶点,证实抗体已成功偶联至纳米复合物表面。此外,该纳米复合物具有良好的储存稳定性:在4℃与25℃条件下放置7天,其粒径与多分散指数(PDI)均未出现明显变化(图S3)。透射电子显微镜(TEM)观察显示,P/S/CVA@NPs-AI呈球形,且分散性良好(图1B)。元素mapping图像显示,Au、F、Mg与P元素分布均匀,证实该纳米复合物结构完整(图1C)。

图1 P/S/CVA@NPs-AI的合成与表征:A)P/S/CVA@NPs-AI的合成步骤示意图;B)P/S/CVA@NPs-AI的TEM图像;C)相应的Au/F/Mg/P元素mapping图像及基于纳米颗粒追踪分析(NTA)的粒径分布;D-F)通过荧光显微镜与流式细胞术检测不同条件下纳米复合物的细胞摄取能力(比例尺=50μm);G)不同时长激光照射后,P/S/CVA@NPs-AI中包裹的Chlα吸收峰的变化;H)激光(660nm近红外光)照射下,纳米反应器与本体溶液中H₂的生成浓度;I)在亚甲蓝(MB)染色的786-O-R细胞中,不同处理组释放还原性H₂的代表性图像(比例尺=100μm)。数据以均值±标准差(SD)表示,*P<0.05,P<0.01,*P<0.001。
高效的细胞摄取能力是纳米复合物发挥最佳抗肿瘤效果的前提。因此,在成功构建纳米复合物后,研究人员对其细胞摄取能力进行了评估。如图1D-E与图S4所示,包裹于PEAL材料中的罗丹明(Rhodamine)被786-O细胞与786-O-R(舒尼替尼耐药性786-O)细胞的内吞量显著高于游离罗丹明,且RhB NPs组的红色荧光强度更高。关键的是,抗ITGA1抗体修饰可进一步增强纳米复合物的摄取能力:RhB@NPs-AI组的红色荧光强度高于RhB@NPs组。这一结果证实,将抗ITGA1抗体偶联至纳米颗粒表面可提升其递送效率,并加速内化过程。通过流式细胞术对细胞内荧光强度进行定量分析,进一步验证了上述结论的一致性(图1E与图S5)。综上,这些结果证实P/S/CVA@NPs-AI纳米复合物已成功制备,且具有优异的细胞靶向性与良好的储存稳定性。
受自然光合作用启发,叶绿素(Chlα,一种光敏剂)、L-抗坏血酸(AA,一种电子供体)与金纳米颗粒(AuNPs,一种催化剂)在660nm近红外光照射下可协同生成氢气(H₂)[28]。相较于本体溶液,甲氧基聚乙二醇-聚(D,L-丙交酯-乙交酯)-聚(L-赖氨酸)(mPEG-PLGA-PLL,简称PEAL)能为上述组分(Chlα、AA、AuNPs)提供更适宜的反应环境。随后,研究采用紫外线(UV)法与亚甲蓝(MB)-铂(Pt)法,进一步评估不同条件下H₂的生成情况。叶绿素α的紫外特征吸收峰位于669nm处,图1G展示了近红外光照射下纳米颗粒中包裹的Chlα的消耗过程:随着照射时间延长,669nm处的吸收强度逐渐降低,且在11分钟后保持稳定,表明此时一定量的Chlα已完全消耗。此外,研究还通过MB-Pt探针进一步定量H₂的生成量:在铂纳米颗粒催化下,H₂可将亚甲蓝(MB)还原为无色的亚甲蓝氢化物(MBH₂),且MB在664nm处的吸光度变化与H₂生成量呈线性相关[29]。因此,借助MB标准浓度曲线(图S6),可通过MB吸光度的降低程度计算氢气的生成量[49]。如图1H所示,与Chlα、AA、AuNPs处于本体溶液中的组(游离P/S/CVA组)相比,P/S/CVA@NPs-AI+激光组在660nm近红外光照射下的H₂生成效率更高。此外,图1I直观展示了纳米复合物+激光组的细胞内H₂还原活性:在以纳米颗粒为反应平台的处理组(CVA@NPs+激光组、P/S/CVA@NPs+激光组、P/S/CVA@NPs-AI+激光组)中,亚甲蓝的颜色明显浅于未包裹产氢组分的组(游离CVA+激光组);且相较于P/S/CVA@NPs+激光组,P/S/CVA@NPs-AI+激光组的还原反应更强,这表明抗ITGA1抗体修饰提升了纳米复合物对舒尼替尼耐药性肿瘤细胞的靶向能力,从而实现了高效的原位产氢。
2.2 P/S/CVA@NPs-AI破坏ccRCC细胞线粒体活性并诱导其凋亡
越来越多的证据表明,lncARSR在多种癌症的发生发展中起关键作用,有望成为癌症诊断标志物与治疗靶点。在肾细胞癌研究中,Qu等人发现lncARSR可通过Yes相关蛋白(YAP)前馈环路驱动肿瘤起始细胞的侵袭性——该环路能抑制大肿瘤抑制激酶1(LATS1)的磷酸化,并促进YAP进入细胞核[50]。此外,Liao等人与Li等人的研究显示,在膀胱癌与结直肠癌中,lncARSR可作为内源性竞争RNA(ceRNA)结合miR-129-5p/miR-34a-5p,从而上调SRY-box转录因子4(SOX4)与己糖激酶1(HK1)的表达,最终促进肿瘤进展[51,52]。Tian等人与Yang等人还报道,在胶质瘤与肝细胞癌中,lncARSR可激活信号转导与转录激活因子3(STAT3)信号通路,进而促进肿瘤生长、代谢重编程与干细胞特性维持[53,54]。与此同时,分子氢作为一种新型肿瘤治疗气体,近年来逐渐受到关注,前期研究已证实其可调控线粒体能量代谢并诱导癌细胞凋亡[55]。
基于此,在成功合成P/S/CVA@NPs-AI后,研究进一步探究了该纳米复合物的抗肿瘤效果及潜在机制。首先,通过细胞计数试剂盒-8(CCK-8)实验,评估PEAL、660nm近红外光、Chlα与AuNPs对786-O细胞(ccRCC细胞系)及786-O-R细胞(舒尼替尼耐药性786-O细胞系)的潜在毒性,同时还考察了不同浓度的上述材料(PEAL纳米颗粒、Chlα、AuNPs)对正常人肾近端小管上皮细胞(HK-2细胞)的安全性。图S7-S11的结果显示,该纳米复合物具有良好的生物安全性。随后,研究通过CCK-8实验与流式细胞术,进一步评估了纳米复合物+激光的体外抗癌效果。图2E-F显示:游离silncARSR组(因缺乏核酸递送载体)、游离PT2385组与P@NPs组(PT2385纳米颗粒组)的细胞致死率极低,这是因为PT2385仅高选择性抑制HIF-2α信号通路,而非产生广谱细胞毒性;而产氢组(游离CVA+激光组、CVA@NPs+激光组)、核酸递送组(S@NPs组,silncARSR纳米颗粒组)及联合作用组(P/S/CVA@NPs+激光组、P/S/CVA@NPs-AI+激光组)的细胞存活率则显著降低。此外,P/S/CVA@NPs-AI+激光组对786-O细胞与786-O-R细胞的杀伤率高于P/S/CVA@NPs+激光组,表明表面偶联抗ITGA1抗体的纳米颗粒能更高效、精准地被肿瘤细胞内吞。流式细胞术分析(图2A-D)也得出了与上述CCK-8实验一致的结论,且在所有处理组中,P/S/CVA@NPs-AI+激光组诱导的细胞总凋亡率最高(32.31±2.82%)。
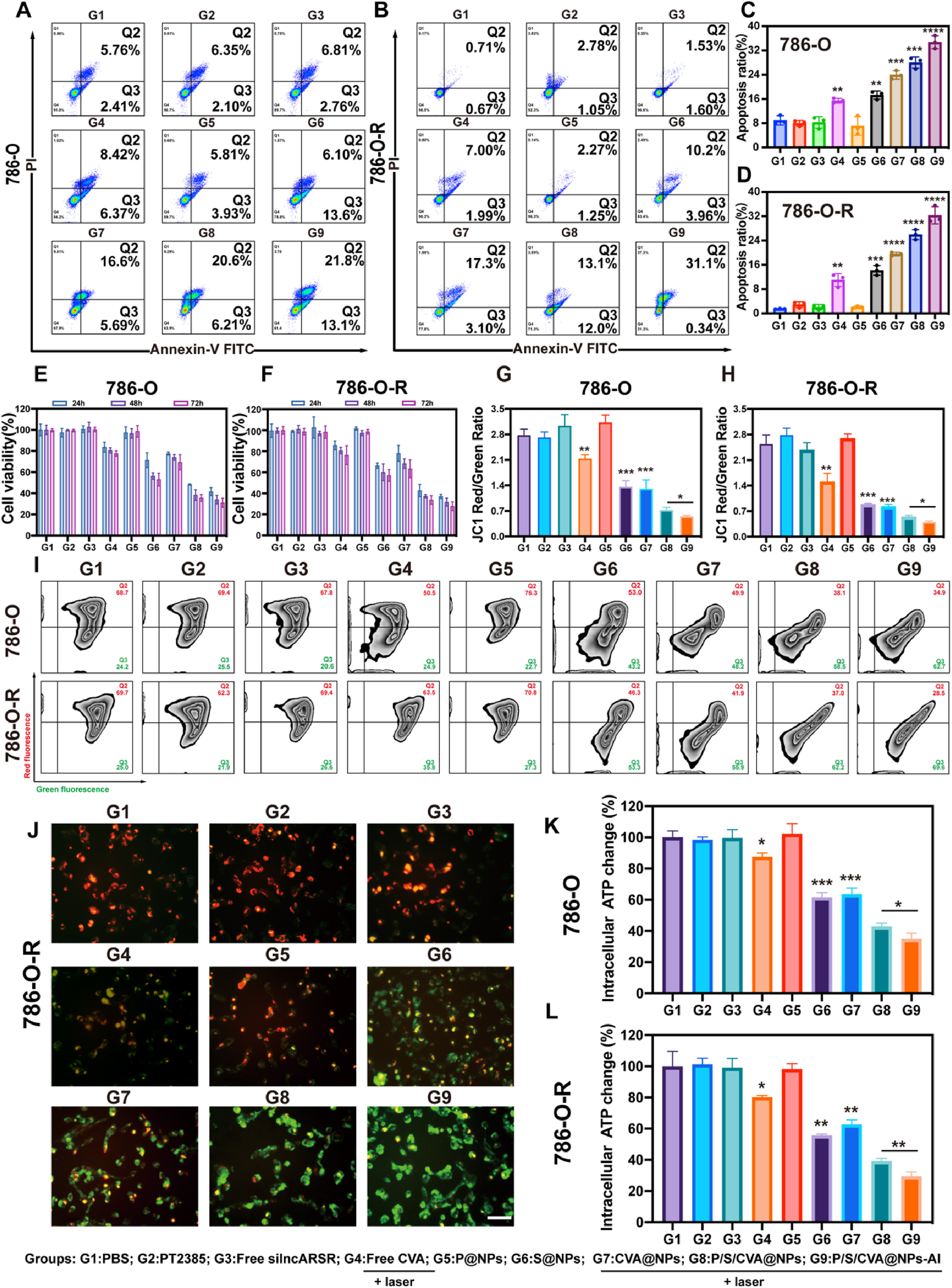
图2 P/S/CVA@NPs-AI+激光的体外抗肿瘤效果:A-D)不同处理条件下786-O细胞与786-O-R细胞凋亡的流式细胞术分析;E、F)786-O细胞与786-O-R细胞分别与纳米药物共培养24、48、72小时后的细胞存活率;G-J)通过流式细胞术与荧光显微镜检测不同处理组癌细胞的线粒体膜电位(比例尺=100μm);K-L)不同条件下786-O细胞与786-O-R细胞的胞内ATP水平。数据以均值±标准差(SD)表示,*P<0.05,P<0.01,*P<0.001,P<0.0001。
线粒体是调控内源性凋亡通路的核心细胞器[28,56]。因此,研究进一步检测了不同处理组癌细胞的线粒体膜电位与胞内ATP水平。如图2G-I所示,流式细胞术检测及定量分析结果显示:PBS组、PT2385组、游离silncARSR组与P@NPs组的红绿荧光比值最高,表明这些组的线粒体处于健康状态;而游离CVA+激光组、S@NPs组、CVA@NPs+激光组、P/S/CVA@NPs+激光组与P/S/CVA@NPs-AI+激光组的红绿荧光比值显著降低,提示氢气与lncARSR敲低可干扰线粒体功能。其中,CVA@NPs+激光组的红绿荧光比值低于游离CVA+激光组,表明纳米颗粒体系的H₂生成效率更高;而P/S/CVA@NPs-AI+激光组的比值显著低于P/S/CVA@NPs+激光组,说明抗ITGA1抗体实现了对癌细胞更高效的靶向。荧光显微镜拍摄的代表性图像(图2J、图S12)也验证了这一结果。同时,不同条件下胞内ATP水平的检测结果呈现出相似趋势(图2K、2L):产氢组(游离CVA+激光组、CVA@NPs+激光组)与lncARSR敲低组(S@NPs组)的胞内ATP水平均降低,且联合作用组(P/S/CVA@NPs+激光组、P/S/CVA@NPs-AI+激光组)的降低幅度在所有组中最为显著。研究还进一步评估了P/S/CVA@NPs-AI+激光处理对Bcl-2过表达肿瘤细胞凋亡的影响,结果如图S13所示:Bcl-2过表达组的细胞凋亡率显著降低,提示该纳米复合物通过线粒体功能障碍诱导细胞死亡。
2.3 P/S/CVA@NPs-AI抑制肿瘤细胞与M2型巨噬细胞的促血管生成能力
肿瘤血管生成在实体瘤的存活、进展及治疗耐药性产生中发挥关键作用[57,58,59]。舒尼替尼耐药性ccRCC的特征之一是血管异常增生,且ccRCC肿瘤细胞会分泌大量不同类型的促血管生成因子[5,13,60]。因此,研究通过体外管腔形成实验,评估纳米复合物+激光的抗血管生成效果。如图3A-C所示,纳米药物可广泛抑制人脐静脉内皮细胞(HUVEC)的管腔形成能力。研究首次发现,氢气与lncARSR敲低可削弱ccRCC肿瘤细胞的促血管生成能力。随后,通过实时荧光定量聚合酶链反应(qPCR)与酶联免疫吸附实验(Elisa),进一步探究其潜在机制。血管内皮生长因子A(VEGFA)、血管生成素-2(Angpt2)与碱性成纤维细胞生长因子(bFGF)是公认的促血管生成因子,在血管生成的启动与进展中起核心作用[10,61]。基于此,研究系统考察了不同治疗方案对786-O-R细胞分泌促血管生成因子的影响。如图3E-G所示:HIF-2α拮抗剂(PT2385)组(PT2385组、P@NPs组)、产氢组(游离CVA+激光组、CVA@NPs+激光组)与lncARSR敲低组(S@NPs组)均能降低786-O-R细胞的VEGFA分泌量;在抑制效果更强的联合治疗组中,偶联抗ITGA1抗体的纳米复合物(P/S/CVA@NPs-AI+激光组)对VEGFA分泌的抑制作用显著强于未修饰组(P/S/CVA@NPs+激光组),证实了该递送系统的有效性。值得注意的是,所有处理组均未能显著下调ccRCC肿瘤细胞中Angpt2与bFGF的表达。

图3 纳米复合物+激光通过多种机制抑制体外血管管腔形成:A、C)管腔形成实验证实,P/S/CVA@NPs-AI+激光显著削弱786-O-R细胞的促血管生成能力(比例尺=100μm);B)共培养体系示意图:将各处理组的786-O-R细胞共培养72小时后,收集人脐静脉内皮细胞(HUVEC)进行后续实验;D)不同干预条件下M1型与M2型巨噬细胞的比值;E-M)通过Elisa实验检测不同处理组中786-O-R细胞、THP-1细胞(人单核细胞系)与HUVEC细胞中VEGFA、Angpt2与bFGF的表达水平。所有数据以均值±标准差(SD)表示,*P<0.05,P<0.01,*P<0.001,P<0.0001,NS表示无统计学差异。
M2型肿瘤相关巨噬细胞通过促进血管生成、细胞外基质重塑、免疫抑制及多药耐药性,参与肿瘤恶性进展[62]。前期研究证实,氢气与silncARSR可促进巨噬细胞从M2型向M1型极化,且lncARSR下调能显著削弱巨噬细胞介导的血管生成[25,49]。然而,目前关于氢气与silncARSR在M2型巨噬细胞再极化后调控的特定促血管生成介质,尚未得到充分研究。因此,在通过流式细胞术与qRT-PCR证实氢气与silncARSR可诱导M2型巨噬细胞向M1型转化(图3D、图S14-S15)后,研究进一步检测了巨噬细胞中VEGFA、Angpt2与bFGF的表达水平。如图3H所示:游离CVA+激光组、CVA@NPs+激光组、S@NPs组、P/S/CVA@NPs+激光组与P/S/CVA@NPs-AI+激光组的VEGFA表达量显著降低;其中,P/S/CVA@NPs-AI+激光组因silncARSR与氢气的协同作用,以及抗ITGA1抗体增强的靶向能力,对VEGFA分泌的抑制效果最为显著。而对于Angpt2与bFGF的表达,纳米复合物+激光对M2型巨噬细胞未表现出统计学意义上的抑制作用(图3I-J)。
此外,图3K-M的结果显示,纳米复合物+激光对人脐静脉内皮细胞(HUVEC)中促血管生成因子的分泌无影响,这表明P/S/CVA@NPs-AI+激光是通过调控786-O-R细胞和M2型巨噬细胞分泌的血管内皮生长因子A(VEGFA)表达水平,来改变体外血管生成平衡的。所有酶联免疫吸附实验(Elisa)结果的趋势均与图S16-S18中的实时荧光定量聚合酶链反应(qPCR)分析结果一致。
2.4 P/S/CVA@NPs-AI在耐药性透明细胞肾细胞癌(ccRCC)原位模型中的治疗效果
受上述体外实验结果的启发,研究进一步在携带舒尼替尼耐药性ccRCC肿瘤的原位小鼠模型中,评估了不同制剂的治疗效果。首先,通过小动物活体成像系统验证了纳米复合物的肿瘤靶向能力。在BALB/c裸鼠体内成功构建舒尼替尼耐药性ccRCC原位肿瘤模型后,通过尾静脉向小鼠注射游离DIR(一种荧光染料)、DIR标记的纳米颗粒(Dir@NPs)和DIR标记的靶向纳米颗粒(Dir@NPs-AI),以研究纳米颗粒随时间的体内分布特征及在肿瘤组织中的富集情况。由图4A和4B可知,注射48小时后,游离DIR组在小鼠体内的荧光信号显著低于Dir@NPs组和Dir@NPs-AI组,这表明小鼠对游离DIR的代谢速度较快;而Dir@NPs组和Dir@NPs-AI组的荧光强度在肝脏和肿瘤部位显著富集,且Dir@NPs-AI组在肿瘤组织中的荧光强度高于Dir@NPs组。综上,荧光成像结果直观表明,经抗ITGA1抗体修饰的纳米复合物具有更优异的肿瘤靶向能力——这一特征不仅有利于提高治疗效果,还能减少对非靶器官的治疗毒性。
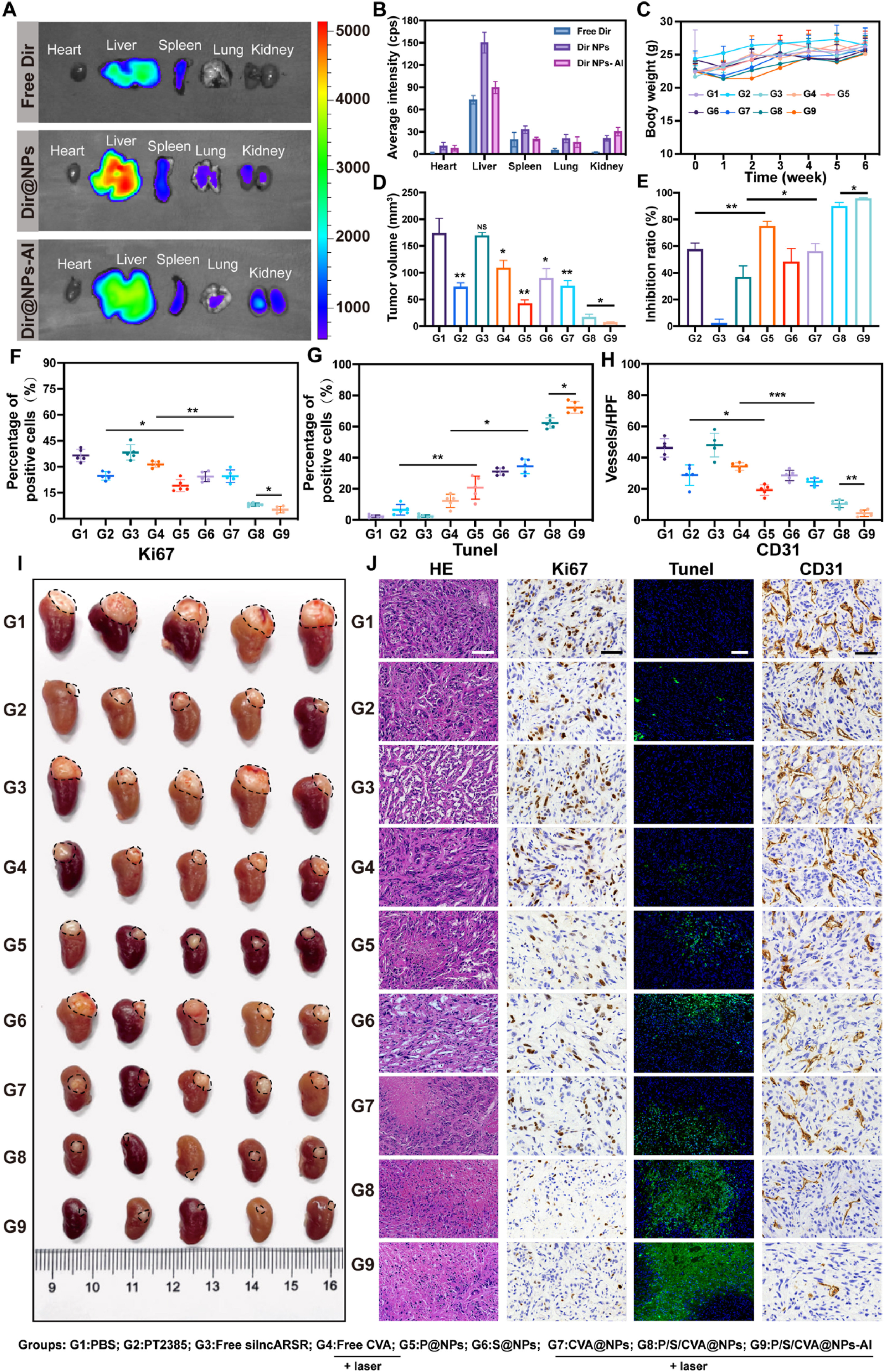
图4 P/S/CVA@NPs-AI+激光在舒尼替尼耐药性ccRCC原位模型中的抗肿瘤活性:A)尾静脉注射游离DIR、Dir@NPs和Dir@NPs-AI 48小时后,主要器官和ccRCC肿瘤组织的代表性活体荧光图像;B)体内定量平均辐射强度的统计分析;C)6周内不同处理组荷瘤小鼠的体重变化;D、E)不同处理组的肿瘤体积及相应抑制率;F-H)通过Image J软件对末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)、Ki67(细胞增殖标志物)和CD31(血管内皮标志物)染色结果进行免疫荧光/免疫组化分析;I)不同组原位移植瘤的图像(每组n=5);J)不同组肿瘤组织的苏木精-伊红(HE)染色、TUNEL免疫荧光染色及Ki67、CD31免疫组化染色代表性图像。所有数据以均值±标准差(SD)表示,*P<0.05,P<0.01,*P<0.001。
随后,将荷瘤小鼠随机分为9组,通过尾静脉注射不同制剂进行治疗(每周3次,持续6周,图S19)。对于需激光处理的组(游离CVA组、CVA@NPs组、P/S/CVA@NPs组和P/S/CVA@NPs-AI组),在注射后12小时对小鼠进行激光照射。如图4I所示,在所有处理组中,P/S/CVA@NPs-AI+激光组的肿瘤体积最小。通过计算肿瘤体积和抑制率,对治疗效果进行定量分析(图4D、4E),结果显示:P/S/CVA@NPs+激光组和P/S/CVA@NPs-AI+激光组的肿瘤抑制率分别为89.96%和95.78%。这一结果表明,经抗ITGA1抗体修饰后,纳米复合物的肿瘤靶向效率提升,进而产生了更强的治疗效果。此外,研究还在整个治疗期间监测了小鼠的体重变化,图4C的数据显示,所有干预组小鼠的体重均保持相对稳定增长,证实了该纳米复合物具有优异的生物安全性。
肿瘤组织的HE染色结果显示,P/S/CVA@NPs-AI+激光治疗组的肿瘤坏死面积显著大于PBS对照组,这表明PT2385、silncARSR与氢气(H₂)联合作用可有效诱导肿瘤细胞死亡(图4J)。TUNEL染色结果显示,P/S/CVA@NPs-AI+激光组的绿色荧光强度最强,说明纳米复合物+激光诱导肿瘤细胞凋亡的能力更优。此外,Ki67和CD31的免疫组化分析结果表明,P/S/CVA@NPs+激光可显著抑制ccRCC肿瘤细胞的增殖和微血管密度(MVD)(图4J)。
2.5 P/S/CVA@NPs-AI在体内调控凋亡及血管生成相关蛋白
上述结果已证实,P/S/CVA@NPs-AI+激光在体外和体内均可诱导肿瘤细胞线粒体凋亡,并减少肿瘤血管生成。研究随后进一步评估了不同治疗方案处理后,肿瘤组织中与凋亡和血管生成相关的关键蛋白的差异表达情况。
Bcl-2(抗凋亡蛋白)、Bax(促凋亡蛋白)和切割型半胱天冬酶3(cleaved-caspase 3,凋亡执行蛋白)是重要的凋亡相关指标[63]。研究通过免疫组化(IHC)染色评估了这些蛋白的表达水平。如图5A-D所示,P/S/CVA@NPs-AI+激光组中抗凋亡蛋白Bcl-2的表达水平最低,而促凋亡蛋白Bax和cleaved-caspase 3的表达水平最高。值得注意的是,与体外凋亡模型中蛋白表达相对无变化的情况不同,经PT2385处理后,肿瘤组织中凋亡相关蛋白的表达发生了显著改变。这一观察结果与前期研究一致:PT2385并非传统细胞毒性药物,其通过破坏缺氧诱导因子2α(HIF-2α)的功能,下调HIF-2α靶基因(包括VEGFA、葡萄糖转运蛋白1(GLUT1)、纤溶酶原激活物抑制剂1(PAI-1)和细胞周期蛋白D1(CCND1))的mRNA表达,从而发挥抗肿瘤作用[12,35]。此外,PT2385具有良好的耐受性,且无剂量限制性毒性,这使其具备与其他治疗方式长期联合使用的潜力。

图5 P/S/CVA@NPs-AI在体内调控凋亡及血管生成相关关键蛋白的表达:A)肿瘤组织中Bcl-2(比例尺=100μm)、Bax(比例尺=100μm)、cleaved-caspase 3(比例尺=50μm)和VEGFA(比例尺=100μm)的免疫组化染色图像;B-E)不同组肿瘤组织中Bcl-2、Bax、cleaved-caspase 3和VEGFA的免疫组化染色评分。所有数据以均值±标准差(SD)表示,*P<0.05,P<0.01,*P<0.001,P<0.0001。
VEGFA是血管生成的核心调控因子[64]。因此,研究通过免疫组化实验评估了不同干预方案下肿瘤部位VEGFA的表达水平。图5A和5D的结果显示,HIF-2α拮抗剂组(游离PT2385组、P@NPs组)、产氢组(游离CVA+激光组、CVA@NPs+激光组)、lncARSR敲低组(S@NPs组)及联合作用组(P/S/CVA@NPs+激光组、P/S/CVA@NPs-AI+激光组)的VEGFA表达水平均有所降低。结合上述体外实验数据及CD31免疫组化染色结果,可得出核心结论:通过以下三种途径可有效减少ccRCC的血管生成:①抑制HIF-2α/VEGFA通路(使用HIF-2α拮抗剂PT2385)[35];②直接抑制肿瘤细胞分泌VEGFA;③抑制巨噬细胞的促血管生成能力(通过H₂和silncARSR)。
2.6 P/S/CVA@NPs-AI在体内的生物相容性与生物安全性评估
生物相容性是指外来材料与机体之间的相互作用,理想状态下应不会对接受者产生不良副作用[65,66]。因此,评估纳米药物的生物相容性和生物安全性对于判断其临床转化潜力至关重要。本研究通过向健康BALB/c裸鼠静脉注射纳米药物(每周3次,持续3周),收集各组小鼠血清以进行生物安全性评估。
由于纳米颗粒主要在肝脏、脾脏和肾脏中富集,并通过肝脏和肾脏代谢,因此检测肝肾功能指标尤为重要。评估肝肾功能的关键指标包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、血尿素氮(BUN)和肌酐(Crea)。如图6A-E所示,与PBS组相比,P/S/CVA@NPs-AI+激光组的上述指标均无显著变化,这表明该纳米复合物未对实验小鼠的肝肾功能造成明显损伤。此外,对心脏、肝脏、脾脏、肺和肾脏等重要器官的HE染色结果显示,这些器官均无明显损伤或病理改变,说明P/S/CVA@NPs-AI+激光具有良好的组织生物相容性。

图6 P/S/CVA@NPs-AI+激光在体内的生物安全性(n=3次独立实验):A-E)每周静脉给药3次,连续给药21天后,通过检测血清中丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、血尿素氮(BUN)和肌酐(Crea)水平评估肝肾功能;F)静脉注射21天后,不同干预组重要器官的HE染色图像(比例尺=100μm)。
上述结果表明,P/S/CVA@NPs-AI+激光在体内具有较高的生物安全性和生物相容性。结合其优异的肿瘤靶向能力、对肿瘤血管生成的协同抑制作用以及对线粒体凋亡的增强效应,这种精心设计的纳米复合物在未来临床转化中,有望成为有效克服ccRCC舒尼替尼耐药性的重要手段。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1507429.html?mobile=1
收藏

