裸鼹鼠长寿命机制《科学》
裸鼹鼠(Heterocephalus glaber)是寿命最长的啮齿动物,最长寿命可达近40年。图片来源:尼尔·布罗姆霍尔/NPL/明登图片社
细胞抵御外来病原体的第一道防线是先天免疫反应。环鸟苷酸-腺苷酸合成酶(cGAS)在这一反应中起着关键作用,它能检测宿主细胞胞质中的病原体来源DNA或RNA,并启动信号级联反应,从而引发I型干扰素编码基因的转录[1]。炎症加剧是衰老的一个标志[2],而衰老过程中cGAS信号的失调会导致破坏性炎症过程[3,4]。因此,cGAS被认为是一个潜在的治疗靶点。然而,尽管cGAS存在于细胞质中,但它主要与染色质结合,其在细胞核中的作用尚不明确[5]。在本期杂志第150页,中国同济大学学者陈等人[6]报告称,裸鼹鼠的cGAS在其N端有一组独特的四个突变,这些突变可促进DNA修复——这一机制对该生物的超长寿命至关重要。
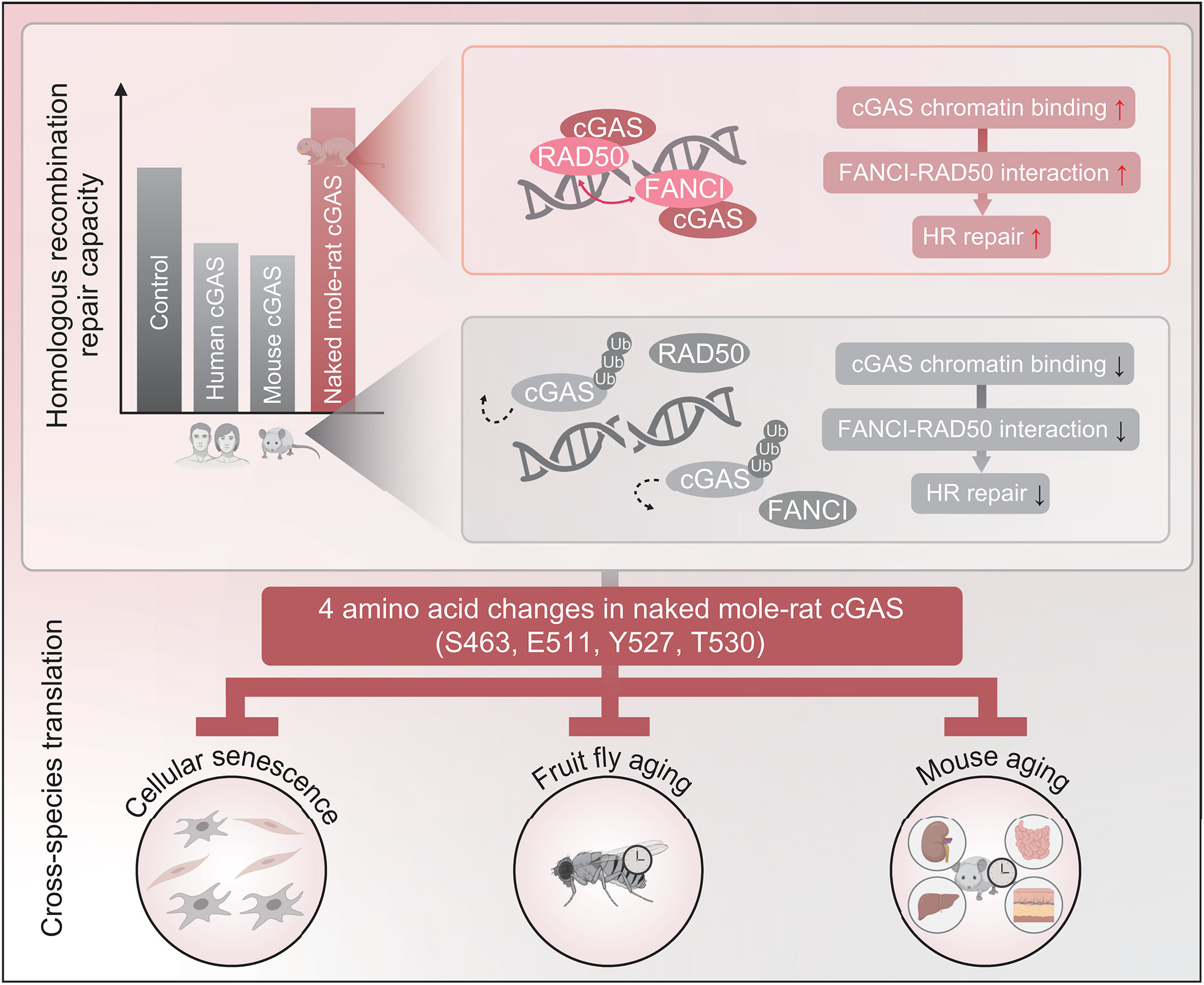
裸鼹鼠的最长寿命接近40年,是寿命最长的啮齿动物,并且对多种与年龄相关的疾病具有抵抗力,包括癌症、神经退行性疾病和关节炎。陈等人评估了裸鼹鼠、小鼠和人类培养细胞中cGAS活性的差异。他们发现,在DNA损伤时,与小鼠和人类的cGAS亚型相比,裸鼹鼠cGAS中的氨基酸替换使其泛素化和降解减少。cGAS丰度的增加增强了DNA修复因子FANCI和RAD50之间的相互作用,从而促进了同源重组。同源重组对于修复DNA双链断裂至关重要。作者还发现,在培养细胞中敲除裸鼹鼠的cGAS会导致DNA损伤增加。这些结果表明,裸鼹鼠cGAS中观察到的氨基酸差异增强了该蛋白与染色质的结合能力,最终提高了DNA修复率。值得注意的是,cGAS在细胞核内的这种增强束缚有望减轻炎症,这一点在未来的研究中值得探索。此外,陈等人证明,表达带有裸鼹鼠四个突变的人类cGAS的黑腹果蝇(Drosophila melanogaster),比表达无突变人类cGAS的果蝇寿命更长。这一结果表明cGAS在裸鼹鼠的长寿中发挥着作用。
目前尚不清楚除裸鼹鼠外,其他物种从细胞核中cGAS的作用中获得了什么益处。先前对人类和小鼠细胞的研究表明,cGAS会抑制DNA修复和复制[7,8]。这与cGAS在染色质维持中发挥作用是一致的,而去除cGAS可能会导致不受控制的重组或复制。来自敲除cGAS的基因修饰小鼠的初步数据显示,转座因子(可从基因组一个位置移动到另一个位置的"跳跃基因")的抑制解除,最终导致炎症信号增强和寿命缩短[9]。与陈等人的发现类似,这些研究结果表明cGAS通过保护基因组完整性,在调节染色质组织和维持方面具有重要作用。
如果裸鼹鼠的cGAS通过某种修饰获得了对DNA损伤的抵抗力,那么其他长寿生物是否也会以类似方式改变其cGAS呢?一些蝙蝠物种相对于与其体型相当的哺乳动物也具有更长的寿命。此外,与大多数哺乳动物不同,这些蝙蝠的免疫系统能够耐受病毒[10]——这是数百种蛋白质发生谱系特异性进化适应的结果。这些适应包括干扰素基因刺激因子(STING)磷酸化位点的单残基突变(STING编码一种跨膜蛋白,位于cGAS下游,对启动干扰素产生很重要),以及PYHIN基因家族的完全缺失(该家族编码的胞质传感器与cGAS识别相同的双链核酸底物)[11,12]。
但是蝙蝠的cGAS是如何修饰的呢?蝙蝠体内存在cGAS基因,且该蛋白相对于PYHIN传感器在进化中被保留,这表明cGAS可能在免疫感知之外具有其他非典型作用,或者它可能比PYHIN传感器更重要的免疫调节因子。事实上,扩展的系统发育分析证实了cGAS的重要性——在无脊椎动物和细菌中都存在其同源物[13]。然而,对蝙蝠cGAS与其他哺乳动物cGAS之间氨基酸差异的分析发现,其变化率很高,包括旧大陆果蝠(翼手目)cGAS N端(对先天免疫激活至关重要)存在一个高度分化的区域,其中一些果蝠表现出更长的寿命[14]。值得注意的是,这些蝙蝠的cGAS中三个环中的两个环存在氨基酸突变,而这些环先前被确定为对结合核小体(染色质的基本构建块)很重要[15]。这些突变有可能增强cGAS与染色质的相互作用。值得注意的是,陈等人发现的裸鼹鼠cGAS中四个有助于增强DNA修复的氨基酸突变之一(Glu511→Lys,在小鼠和人类的cGAS中均不存在),也存在于翼手目动物中。因此,导致cGAS与染色质结合的进化力量(可能通过不同的突变集)可能是长寿物种的一个特征,作为促进DNA修复或避免自身免疫(与衰老相关的炎症加剧的一个主要因素)的机制。
陈等人的发现描述了裸鼹鼠cGAS在细胞核中一个意想不到的、影响寿命的作用。还需要进一步的研究来确定cGAS在其他生物(无论是短寿还是长寿生物)的细胞核中可能发挥的作用,但答案可能比最初预测的要复杂得多。
引言
裸鼹鼠(*Heterocephalus glaber*)是一种极具特殊性的长寿啮齿动物,最长寿命可达约37年。尽管学界认为其卓越的长寿能力源于影响多种生物学过程的适应性特征共同作用,但保护裸鼹鼠免受基因组不稳定性(衰老的核心标志之一)影响的分子机制,目前仍不明确。
研究依据
DNA修复是维持基因组稳定的关键机制。早期研究表明,DNA传感器环鸟苷酸-腺苷酸合成酶(cGAS)可通过抑制同源重组(HR)通路参与调控DNA双链断裂修复,进而加剧基因组不稳定性。尽管DNA修复蛋白功能的增强有助于长寿性状的进化,但目前尚未明确,进化过程是否对cGAS这类“负调控因子”的活性衰减进行了选择。
研究结果
通过一系列实验,我们发现:与人类和小鼠的cGAS不同,裸鼹鼠的cGAS可提高同源重组修复效率。这种功能逆转由cGAS蛋白C端结构域中四个特定氨基酸残基的替换介导。从机制上看,这种氨基酸改变通过调控自身泛素化状态,使裸鼹鼠cGAS在DNA损伤后能更长时间地滞留于染色质上,进而改变其与分离酶P97的相互作用。
裸鼹鼠cGAS在染色质上的持续存在,促进了经典同源重组因子RAD50与范可尼贫血通路核心因子FANCI之间形成复合物。我们进一步证实,FANCI可促进RAD50向染色质募集,从而增强同源重组修复。
最终结果显示:裸鼹鼠cGAS可减轻应激诱导的细胞衰老、缓解器官退化,并延长果蝇的寿命。关键在于,若逆转这四个氨基酸残基的改变,上述保护效应将完全消失。此外,通过腺相关病毒将裸鼹鼠cGAS递送至老年小鼠体内,可降低小鼠的虚弱程度、延缓毛发变白、减少循环系统中免疫球蛋白G和白细胞介素-6的水平,并降低多个组织中的细胞衰老标志物水平。同样,这些有益效应均依赖于这四个特定氨基酸。
结论
通过比较分子生物学研究,我们发现:在最长寿的啮齿动物——裸鼹鼠中,cGAS对同源重组修复的负调控功能因四个特定氨基酸残基的改变而逆转。这种改变使裸鼹鼠cGAS具备更强的基因组稳定能力,能对抗细胞衰老与器官老化,并延长寿命和健康寿命。
裸鼹鼠cGAS的功能分化
在最长寿的啮齿动物裸鼹鼠中,cGAS介导的“同源重组修复抑制效应”被逆转。四个氨基酸的改变(E,谷氨酸;S,丝氨酸;T,苏氨酸;Y,酪氨酸)使其cGAS在DNA损伤后维持低泛素化水平,从而实现染色质的长效结合。这一过程促进FANCI与RAD50的相互作用,增强同源重组修复。这些分子层面的改变最终有助于减少细胞衰老、延缓器官老化并延长寿命。[图由BioRender.com制作]
摘要
高效的DNA修复能力可能是裸鼹鼠实现长寿的关键。但目前尚不清楚,裸鼹鼠是否具备独特机制以优化DNA修复抑制因子的功能。本研究发现,裸鼹鼠的环鸟苷酸-腺苷酸合成酶(cGAS)在进化过程中因四个氨基酸的改变,失去了人类或小鼠同源蛋白对同源重组修复的抑制功能。
这种改变通过减弱TRIM41介导的泛素化及与分离酶P97的相互作用,使cGAS在DNA损伤后能更长时间地滞留于染色质上。cGAS在染色质上的持续结合促进了修复因子FANCI与RAD50的相互作用,助力RAD50向损伤位点募集,从而增强同源重组修复。
此外,这四个氨基酸还介导了cGAS在对抗细胞与组织衰老、延长寿命中的作用。因此,对cGAS进行调控或可成为延长寿命的一种潜在机制。
裸鼹鼠(*Heterocephalus glaber*)是一种极具特殊性的长寿啮齿动物,最长寿命约为37年[1]——较体型相近的近缘物种高出一个数量级。裸鼹鼠的转录组和蛋白质编码序列与人类的相似度高于小鼠[2],这使其成为研究“成功衰老”背后分子机制的理想模型。
在不同物种的长寿进化过程中,基因组稳定至关重要[3-5]。然而,目前对于裸鼹鼠如何通过DNA修复相关的分子适应性改变(以应对内源性或外源性DNA损伤、维持基因组稳定),学界的认知仍较为有限。
DNA双链断裂(DSBs)是最具破坏性的DNA损伤类型,其积累与衰老密切相关[6-9]。同源重组(HR)修复是DNA双链断裂修复的通路之一,该过程复杂且涉及多个关键步骤[10];在小鼠和人类中,同源重组修复缺陷均与早衰相关[7, 11-13]。
范可尼贫血(FA)通路负责修复DNA链间交联,与同源重组通路关系密切[14, 15]。作为链间交联修复的核心调控因子之一,FANCI除参与范可尼贫血通路外,还能独立参与复制应激应答[16, 17]。因此,范可尼贫血通路相关因子或也参与其他类型的DNA修复过程。
环鸟苷酸-腺苷酸(GMP-AMP)合成酶(cGAS)是主要的胞质DNA传感器,可识别内源性或外源性胞质DNA,催化环鸟苷酸-腺苷酸(cGAMP)的合成,进而触发干扰素基因刺激因子(STING)介导的先天免疫应答[18, 19]。
此外,cGAS还定位于细胞核中,通过抑制同源重组修复,可能在人类和小鼠细胞中促进肿瘤发生[20, 21],而这一过程或会缩短寿命。在长寿进化过程中,DNA修复领域的多个正调控因子(如去乙酰化酶SIRT6、乳腺癌易感基因1 BRCA1)已被证实受到正向选择[22, 23],但目前尚未明确,裸鼹鼠体内的cGAS是否会像在人类或小鼠中那样抑制同源重组修复。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1505282.html?mobile=1
收藏

