纳米生物催化剂驱动的时空特异性氢递送诱导休眠增强型催化肿瘤治疗
Cao Z, Xin R, Ma Q, Wang Q, Feng S, Su H, Zhao A, Li K, Liu S, He L, Liu S. Nanobiocatalyst-Driven Spatiotemporal Hydrogen Delivery Induces Dormancy Potentiated Catalytic Tumor Therapy. ACS Nano. 2025 Sep 11.
说明:该标题为典型的生物医学研究主题,核心术语翻译遵循领域惯例:“Nanobiocatalyst”译为“纳米生物催化剂”,指具备生物催化功能的纳米级材料;“Spatiotemporal”译为“时空特异性”,强调在时间和空间维度上的精准调控;“Hydrogen Delivery”译为“氢递送”,特指分子氢(H₂)的靶向输送过程;“Dormancy Potentiated”译为“休眠增强型”,体现“诱导肿瘤休眠”与“增强治疗效果”的协同关系;“Catalytic Tumor Therapy”译为“催化肿瘤治疗”,指代通过催化反应(如生成活性氧等)发挥抗肿瘤作用的治疗方式。整体标题准确反映了研究的核心技术路径(纳米生物催化剂介导氢递送)与治疗机制(时空精准诱导肿瘤休眠、增强催化治疗效果)。
题目:结直肠癌治疗相关研究:基于金属有机框架的双模态休眠疗法
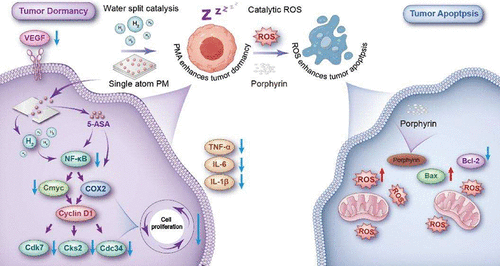
由于全身毒性以及传统疗法疗效欠佳,结直肠癌仍是一大治疗难题。新证据表明,分子氢(H₂)可通过抑制细胞增殖、诱导“肿瘤休眠”表型(表现为细胞周期停滞与代谢静息)发挥抗肿瘤作用。基于这一机制,我们设计了一种含铂金属有机框架(PM),该框架整合了H₂介导的休眠诱导作用与5-氨基水杨酸(5-ASA)增强的核因子κB(NF-κB)抑制作用。
该系统可通过光控水分解实现时空特异性H₂生成,在破坏氧化还原稳态的同时,同步释放5-ASA以阻断NF-κB的核转位,从而共同诱导肿瘤细胞持续的增殖停滞,并重塑免疫抑制性肿瘤微环境。肿瘤局部的PM分解会产生光敏剂,通过催化活性氧(ROS)爆发增强治疗效果,形成一种将H₂驱动的肿瘤休眠与ROS介导的细胞毒性相结合的双模态策略。
机制分析显示,通过调控H₂/5-ASA介导的氧化还原-炎症轴可实现NF-κB抑制,这一结论已通过对三种肿瘤模型及临床样本的多组学分析得到系统验证。H₂诱导的肿瘤休眠可加剧肿瘤细胞的代谢脆弱性,从而提高其对催化性ROS攻击的敏感性;而5-ASA则通过持续抑制NF-κB,防止肿瘤摆脱休眠状态。
本研究提出了一种基于纳米材料的肿瘤休眠治疗方法,证实了单原子催化剂在精准催化H₂生成与免疫调节整合中的双重功能,并为通过协同调控细胞周期与重编程微环境来阻断肿瘤进展提供了新框架。
Cao Z, Xin R, Ma Q, Wang Q, Feng S, Su H, Zhao A, Li K, Liu S, He L, Liu S. Nanobiocatalyst-Driven Spatiotemporal Hydrogen Delivery Induces Dormancy Potentiated Catalytic Tumor Therapy. ACS Nano. 2025 Sep 11. doi: 10.1021/acsnano.5c10754. Epub ahead of print. PMID: 40931918.
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1501586.html?mobile=1
收藏

