氢医学的现状、挑战与未来方向【何前军】
氢分子(H₂)在广谱抗炎、高生物安全性和强组织渗透性方面具有独特的特点和优势,在多种与炎症和氧化应激相关的疾病中展现出治疗潜力。本文从H₂的生物学机制、代谢行为以及递送材料和技术等方面,试图清晰阐述氢医学的现状、挑战与未来方向。首先,我们介绍了目前对H₂的生物学效应及相关机制(包括对H₂分子靶点的认识)的理解,并指出了解释H₂多方面生物学行为所面临的挑战。然后,为探索和理解H₂的代谢行为,我们总结了现有的H₂检测技术,并借助新开发的H₂分子生物探针,证实了H₂具有较强的生物载体穿透能力。接下来,为制定提高氢疗法疗效的策略,我们展示了H₂递送材料从H₂载体到水解和催化产H₂材料的演变。最后,我们概述了氢医学的未来发展方向。
1. 引言
由于氢分子(H₂)的化学反应性较弱,长期以来被误认为是一种生理惰性气体。直到1975年,Dole等人观察到,将肿瘤小鼠置于8个大气压的氢/氧混合气体环境中处理2周后,其鳞状细胞癌显著消退,这表明H₂具有显著的生物学效应[1]。然而,高压氢舱的高安全风险和低操作性,以及对H₂抗癌机制的了解有限,导致H₂的生物医学效应在很长一段时间内被忽视。直到2007年,Ohta等人发现,吸入2%的低浓度氢气可以选择性清除细胞内剧毒的羟基自由基(·OH),从而显著减轻心肌梗死[2]。这一关键发现不仅进一步证实了H₂的生物学效应,还点燃了“氢医学”这一新兴研究领域的火花。
近年来,氢疗法的优势逐渐得到认可,包括其广谱抗炎特性、高生物安全性和强组织渗透性。氢医学领域引起了广泛关注和深入研究,研究成果不断涌现,已发表超过1500篇基础研究论文和60项临床试验[3,4]。从这些文献中可以看出,H₂在治疗多种炎症/氧化应激(OS)相关疾病(如心血管疾病、癌症、关节炎、肝炎、肾炎、肺炎、肠炎、胃炎、胰腺炎、皮炎等)方面具有明确的益处。重要的是,迄今为止尚未观察到任何毒副作用。随着研究的进展,人们发现H₂除了选择性抗氧化外,还具有多种生物学效应,包括抗炎、抗癌、抗凋亡/促凋亡、促愈合和抗衰老等。然而,许多相关机制仍不明确,有些效应甚至看似相互矛盾。阐明H₂在体内的转运和代谢行为,对于探索其治疗机制和理解其生物学特性至关重要。在此背景下,首个H₂生物探针的成功研发,证实了H₂能够快速穿越生物屏障(如血脑屏障),同时也揭示了由于H₂的高扩散性,持续供应H₂的必要性。以H₂载体、水解和催化产H₂材料为代表的创新性H₂递送材料,克服了传统H₂递送方法的局限性,实现了H₂的局部、持续和高剂量递送。尽管取得了这些进展,H₂向病灶部位的递送效率仍需进一步提高。本文将从H₂的生物学机制、代谢行为以及H₂递送材料等角度,探讨氢医学的现状、挑战与未来方向。
2. H₂的生物学机制
基于大量的基础研究和临床试验,H₂已显示出治疗益处,成为一种极具应用前景的治疗性气体分子。人们提出了几种关于H₂生物学机制的假说,以解释其相关的生物学效应。据推测,H₂可以物理激活酶,如乙酰胆碱酯酶、辣根过氧化物酶和线粒体复合体I[5],但这一假说在解释H₂清除和调节自由基的原因方面面临挑战。大量研究表明,H₂在调节多种信号通路(包括ASK1、P38、MAPK、JNK和Nrf2)中发挥着重要作用,从而影响多种生理和病理过程[3],但其靶点和潜在机制仍不明确。尽管如此,H₂清除·OH的观点最被广泛接受。然而,人们逐渐认识到,H₂的还原性非常弱,H₂与·OH直接反应的速率常数(4.2×10⁷ M⁻¹s⁻¹)远低于谷胱甘肽(GSH)与·OH的反应速率常数(10¹⁰ M⁻¹s⁻¹)。此外,这也无法解释H₂在肿瘤中刺激活性氧(ROS)生成的现象。
受细菌中氢化酶的启发,有人提出,体内可能存在一种特定的酶或催化剂,能够催化H₂以增强其反应性。然而,由于缺乏直接证据,这一假说停滞了一段时间。令人兴奋的是,2023年我们发现,铁卟啉具有与氢化酶类似的铁配位化学微环境(Fe-H/NO/CO),可作为H₂的分子靶点/生物催化剂/生物传感器(图1)[6]。游离态和蛋白质束缚态的铁卟啉都能通过与H₂反应自催化加氢,增强氢的还原性,加速其对·OH的中和(图1)。在线粒体电子传递链(ETC)中,电子泄漏产生的·OH可在多种含铁血卟啉的细胞色素催化下被H₂局部清除,从而防止线粒体ETC蛋白因电子泄漏损伤而失活,保护线粒体功能[6,7]。这介导了H₂的抗氧化、抗炎、抗凋亡和抗衰老作用。在缺氧的肿瘤微环境中,铁卟啉可通过催化加氢将CO₂还原为CO(图1),进而原位介导CO信号通路,抑制肿瘤细胞的线粒体呼吸,最终实现抗癌治疗和免疫调节[6]。
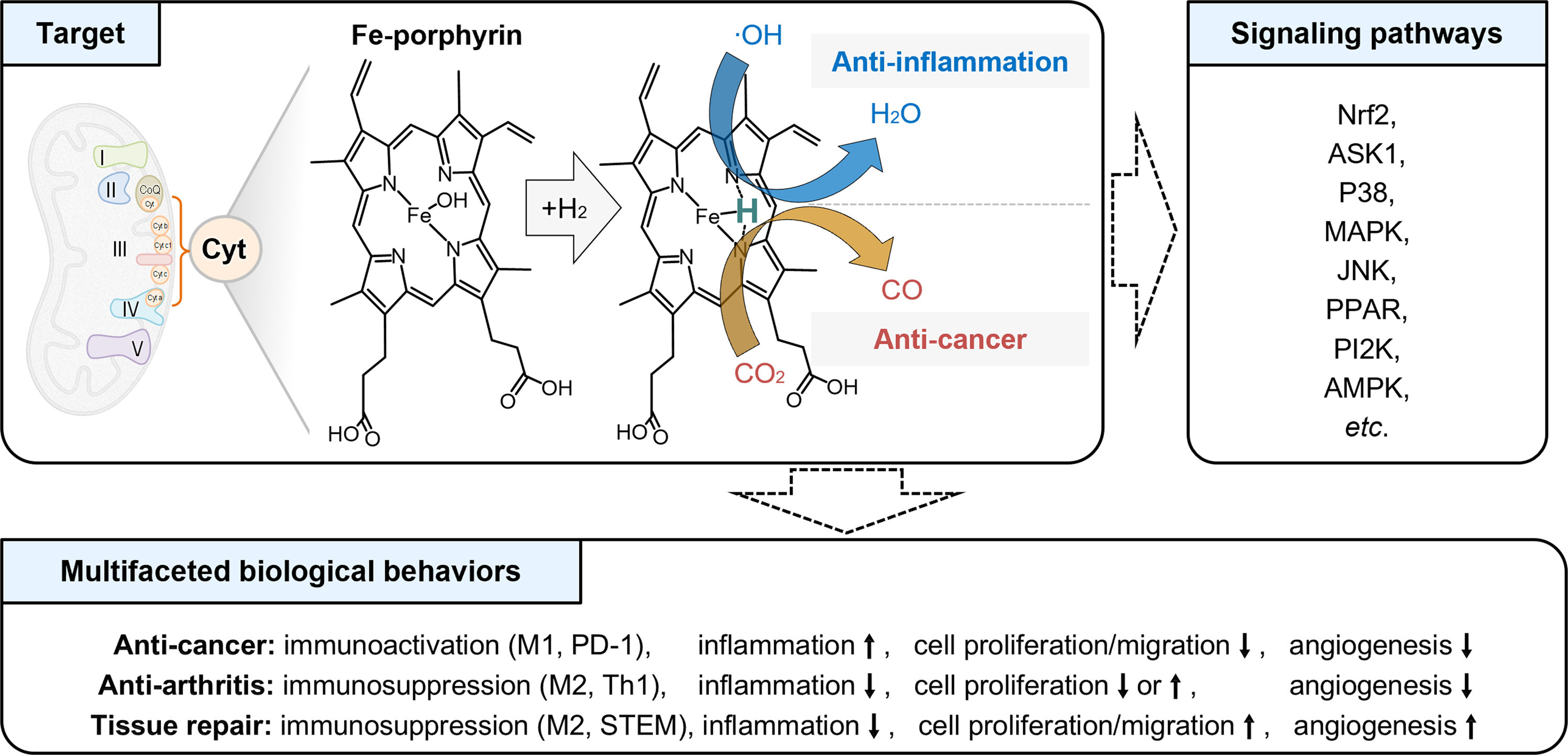
图1. H₂分子靶点的作用机制,以及它们与信号通路/多方面生物学行为之间的差距。Cyt,细胞色素;STEM,干细胞。
铁卟啉假说初步解释了H₂的抗氧化、抗癌、抗凋亡、抗炎和抗衰老作用,但H₂在不同病理微环境中“多功能”效应的潜在机制仍不明确。例如,在肿瘤治疗中,H₂可以激活肿瘤免疫,包括巨噬细胞M2向M1极化,促进细胞凋亡和细胞内ROS生成,抑制肿瘤细胞的增殖和迁移,以及抑制肿瘤血管生成(图1)[8,9]。然而,在组织修复过程中,H₂可以抑制巨噬细胞的炎症表型,激活干细胞进行组织修复,抑制正常细胞凋亡和细胞内ROS生成,促进其增殖和迁移,并增强组织/器官的血管生成(图1)[10]。即使在关节炎的微环境中,H₂也能抑制巨噬细胞的炎症表型,抑制滑膜免疫和血管生成,抑制ROS产生,促进软骨细胞增殖,但抑制滑膜细胞的增殖和迁移(图1)[11,12]。这种“多功能”生物学效应的机制——在不同病理环境中,甚至在同一病理环境中不同细胞间表现出不同的细胞行为——仍然是一个复杂且未解决的挑战。迫切需要进行更多的机制研究,以理解H₂这种复杂的、多方面的生物学行为,从而推动氢医学的发展和临床应用。
3. H₂的代谢行为
长期以来,由于H₂分子体积小、极性弱,人们认为它具有较高的组织渗透性,能够穿越传统药物无法穿越的生理屏障。然而,H₂的药代动力学行为仍不明确,这主要是由于缺乏合适的氢检测方法。目前,H₂检测方法主要包括亚甲基蓝滴定法、气相色谱法和氢微电极法。亚甲基蓝滴定法操作简单,但缺乏选择性和精确性,仅适用于体外检测。气相色谱法具有较高的选择性和检测准确性,但操作复杂,仅限体外使用,无法用于体内检测。相比之下,氢微电极法可以在固定位置对体内外的H₂进行实时、准确的检测,但无法实现体内实时空间检测。此外,氢微电极容易受到周围光、声、酸性物质和还原性物质的干扰。与传统的H₂检测方法相比,开发具有高选择性和检测准确性的H₂生物探针,将能够实现体内H₂的实时和空间检测,这对于探索和理解H₂的体内代谢行为和生物学机制具有重要意义。然而,H₂的低化学活性、高扩散性和低水溶性,为开发高灵敏度的H₂生物探针带来了巨大挑战。
最近,我们提出了一种催化加氢策略,开发了一种比率荧光H₂生物探针(NDI-N3/Pd@MSN,图2),实现了体内H₂的快速、灵敏和准确检测[13]。我们首次利用该探针直接观察到H₂快速穿越动植物屏障,证实了H₂强大的组织渗透性(图2)。此外,我们还发现,停止吸入H₂气体和向植物根部供应富氢水后,大脑和叶片中的H₂浓度迅速下降[13],这凸显了H₂的快速扩散性,并强调了持续供应对可持续治疗的重要性。我们预计,未来开发其他成像模式的H₂探针,如近红外荧光、光声、磁共振和拉曼成像,将有助于提高体内H₂检测的空间分辨率(图2)。此外,开发低分子量、高渗透性的小分子探针,将有助于更准确、快速地检测组织深处的H₂。值得注意的是,平衡H₂探针的灵敏度和选择性仍然是一个难题。如何提高H₂探针的催化加氢活性,同时避免被体内氧化物质淬灭,是一个重大挑战。

图2. 比率荧光H₂生物探针NDI-N3/Pd@MSN的结构、工作原理及体内检测性能[13],以及未来对H₂生物探针的需求。NDI-N3/Pd@MSN是一种比率荧光H₂探针,由钯纳米颗粒和叠氮基/香豆素修饰的荧光团(NDI-N3)包裹在聚乙二醇修饰的介孔二氧化硅纳米颗粒(MSN)中构成;HRW,富氢水。
4. H₂递送材料
传统的H₂递送方法主要包括吸入氢气、饮用富氢水(HRW)、注射富氢盐水和富氢水浴。向呼吸系统和消化系统直接递送氢气和富氢水,可提高局部病灶部位H₂的生物利用度。然而,在远端病灶部位,由于H₂水溶性低(水的H₂负载能力低)且扩散性强,其浓度和持续时间极为有限,这在一定程度上限制了H₂的治疗效果。新兴的固体H₂递送生物材料为H₂向病灶部位的靶向、高效和可控递送提供了新途径。根据H₂递送材料的演变过程,我们在此依次总结H₂载体、水解产H₂材料和催化产H₂材料。
与常见药物分子大不相同,由于H₂分子体积小且极性弱,在常温(RT)常压(NP)下很难被一般药物载体负载。基于钯(Pd)最强的H₂结合能力,钯纳米颗粒被开发为H₂载体,实现了常温常压下H₂的快速有效负载,首次实现了肿瘤靶向递送、光控释放H₂以及氢热联合治疗(图3a)[14]。此外,一种纳米级卟啉-钯金属有机框架(Pd-MOF)被开发出来,以降低氢吸附势垒并增加Pd-H配位位点(图3a),从而提高H₂负载能力[15]。这些载体的H₂负载能力比饱和富氢水(1.6μg/g)高三个数量级,但很难进一步提高其H₂负载效率[15]。另一方面,值得注意的是,多功能载体可以提供辅助治疗功能,如载药和光热治疗,这些功能可与氢疗法结合以增强治疗效果,包括减轻化疗对正常细胞的非特异性毒性[16]。
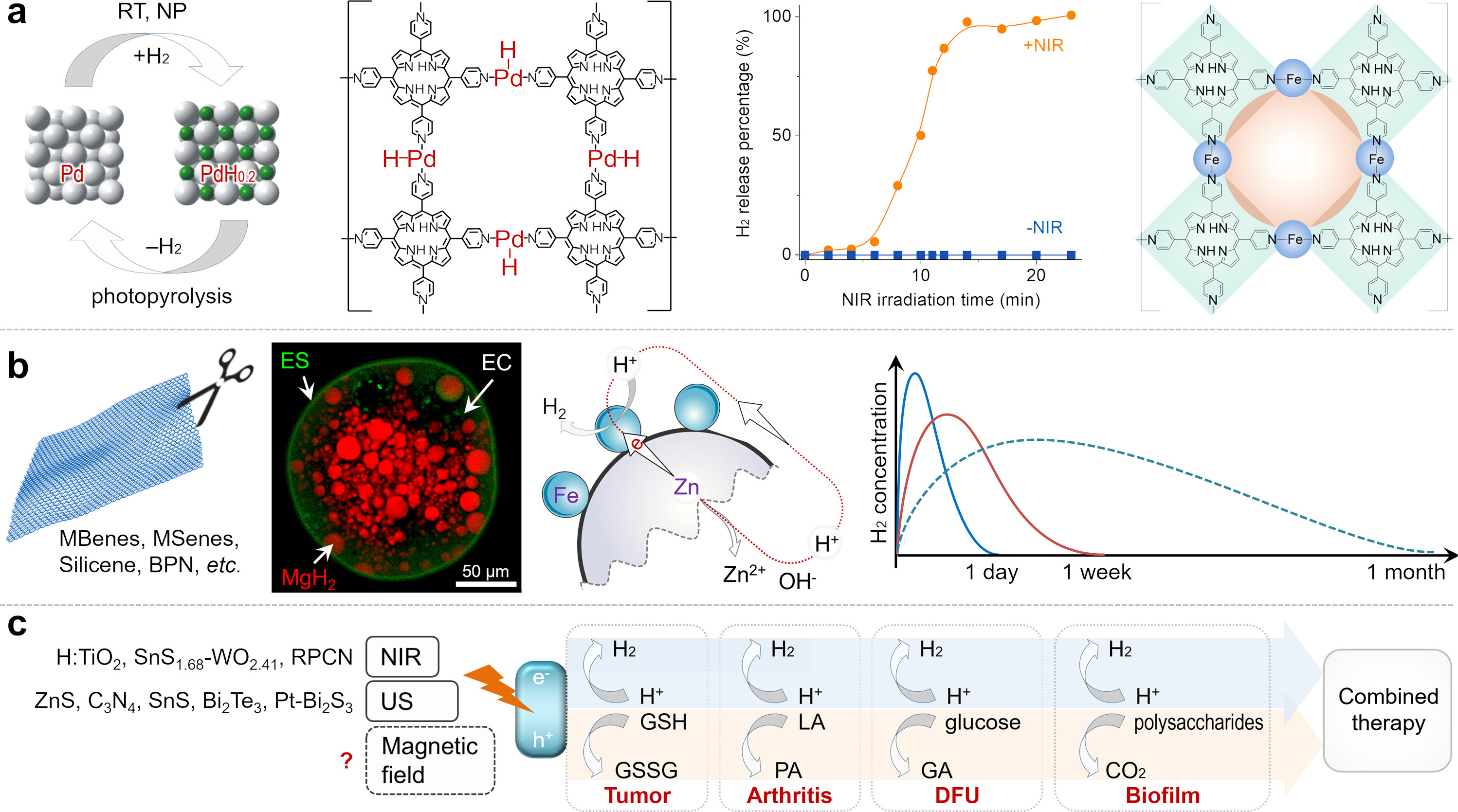
图3. 三类H₂递送材料及其代表性特征:H₂载体[[14], [15], [16]](a)、水解产H₂材料[7,18](b)和催化产H₂材料(c)。RT,室温;NP,常压;MBenes,二维金属硼化物纳米片;MSenes,二维金属硅化物纳米片;BPN,黑磷纳米片;RPCN,红色聚合氮化碳;NIR,近红外光;US,超声;GSH,谷胱甘肽;GSSG,氧化型谷胱甘肽;LA,乳酸;PA,丙酮酸;GA,葡萄糖酸;DFU,糖尿病足溃疡。
此外,基于金属、金属氢化物、金属硼化物和金属硅化物的水解产H₂材料已被开发出来,与H₂载体相比,其H₂递送效率提高了两个数量级(图3b)。控制它们的水解产H₂行为是最大限度提高H₂生物利用度的关键。纳米级铁(Fe)和Fe(0)-MOF被设计为对肿瘤中的弱酸性环境作出响应,实现H₂的可控释放[16,17],而通过欧巴代S100(ES)包裹氢化镁(MgH₂)微粒构建的碱基响应性微胶囊(MgH₂@EC@ES,图3b),可实现肠道靶向的H₂可控释放[7]。为了控制它们的水解产H₂速率,原电池技术也被引入氢医学领域,开发出各种原电池微/纳米结构,如锌-铁(Zn-Fe)和镁@铂(Mg@Pt)[18,19]。游离血红素已被确定为H₂的分子靶点,也是非酒精性脂肪肝等一些疾病的关键诱导剂,因此,通过用N-(3-三乙氧基硅丙基)葡萄糖酰胺修饰硅化镁纳米片(MSN),构建了肝细胞靶向递送系统(MSN-Glu),以实现肝炎的肝靶向递送、局部持续释放和分子靶向治疗。这一发现强调了H₂靶点与疾病发病机制之间的相关性,为定制靶向H₂递送材料以实现高效氢疗法提供了启发[20]。此外,骨关节炎和骨缺损等一些慢性疾病的治疗周期需要数月,而现有的水解产H₂材料无法满足这一需求。因此,开发能够持续产氢数月的材料,将更符合慢性疾病的治疗窗口,为氢疗法的效果带来更多益处(图3b)。
与上述两类H₂递送材料相比,催化产H₂材料由于其底物(如H₂O)在体内充足,可实现可持续产H₂。值得注意的是,催化产氢策略还可以通过氧化消耗构建病理微环境的底物(如肿瘤中的谷胱甘肽(GSH)、糖尿病足溃疡(DFU)创面中的葡萄糖、生物膜中的多糖、关节炎中的乳酸等),协同调节病变微环境(图3c)[11,[21], [22], [23]]。例如,基于TiO₂:H纳米棒的光催化耗糖/产H₂敷料,因其高生物安全性和治疗有效性,已被批准用于DFU创面治疗的临床试验[21]。对于深部疾病,基于硫化锌(ZnS)、氮化碳(C₃N₄)、硫化锡(SnS)、碲化铋(Bi₂Te₃)和铂-硫化铋(Pt-Bi₂S₃)等一些经典压电材料的超声介导压电催化产H₂,已在肝癌和生物膜的动物模型中被证明是有效的[8,9,[23], [24], [25]]。未来,开发响应具有更高组织穿透性的刺激(如X射线、磁场和热电场)的催化产H₂材料将是理想的,但这具有挑战性,因为具有合适能带结构且符合催化产H₂要求的一般半导体,其热电/磁电/X射线-电转换效率相当低。此外,我们预计,未来开发余辉产H₂材料将有利于减少对外部刺激的依赖,实现持续氢疗法。
5. 展望
总之,氢医学作为一个新兴领域,具有广阔的应用潜力。然而,其发展仍面临诸多挑战,需要多领域研究人员的协同努力(图4)。需要更多证据来证实铁卟啉理论,并且必须填补靶点与各种信号通路之间的空白。提高H₂探针的化学反应性、检测灵敏度和准确性,拓展H₂探针的成像模式,进一步追踪H₂在体内的代谢行为,将有助于探索其生物学机制和理解其生物学效应。在此基础上,成像引导的H₂可控释放将实现重大疾病的诊疗一体化。目前,氢疗法的剂量、频率和给药途径尚未标准化,导致各种结果的可比性降低。氢疗法治疗多种疾病的量效关系是明确的,但高浓度H₂的长期副作用仍不明确。H₂递送材料可实现靶向、定时、定量递送,有利于建立氢医学的标准化治疗方案,提高临床应用的可行性。此外,大多数氢医学研究仍处于动物实验和小规模临床试验阶段。迫切需要开展针对多种疾病的大规模、多中心、随机双盲对照氢疗法临床试验,以进一步验证H₂的有效性和安全性,并为其临床转化提供更坚实的证据。未来,氢医学将对重大难治性炎症相关疾病的治疗大有裨益。
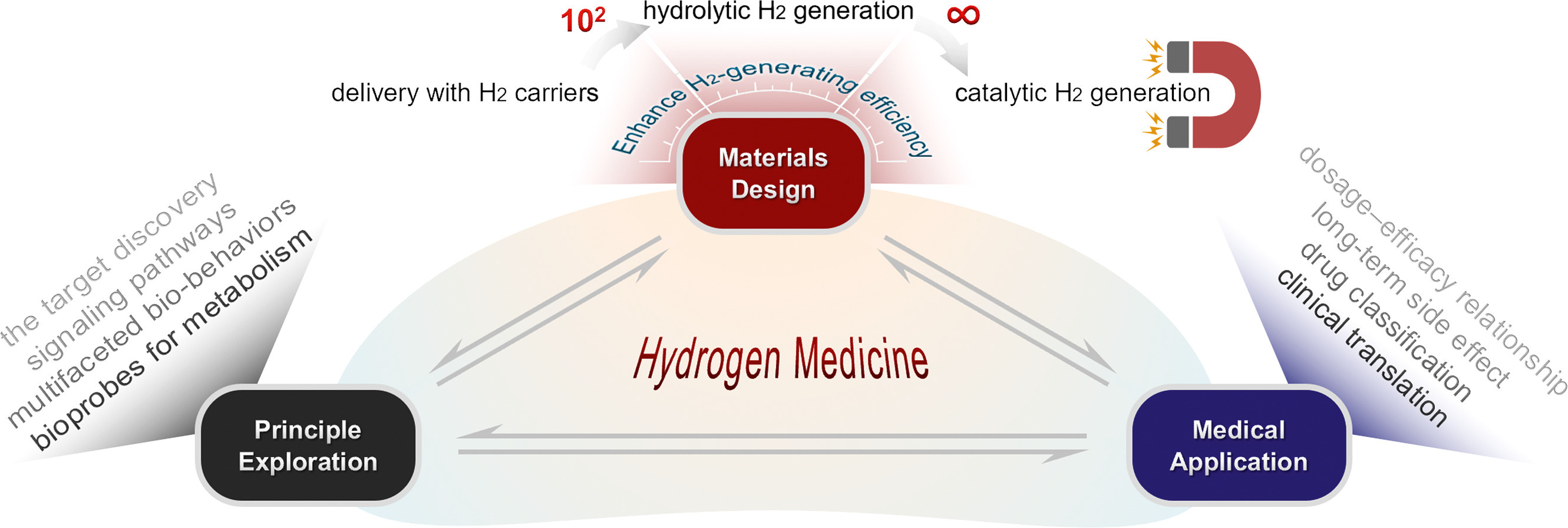
图4. 氢医学的总结与展望。
文献来源
Chen, Shengqiang, Lingting Zeng, and Qianjun He. "Status quo, challenges and future directions of hydrogen medicine." Fundamental Research (2025).
原文作者

Shengqiang Chen received his master's degree from the School of Biomedical Engineering, Shenzhen University, in June 2023. Currently, he is conducting a PhD program at the School of Materials Science and Engineering, Shanghai Jiao Tong University. His main research interests focus on the development, application and clinical transformation of H2 delivery biomaterials, especially in the field of tissue engineering.

Lingting Zeng received her master's degree from the School of Biomedical Engineering, Shenzhen University, in June 2022. She is currently conducting a PhD program at the School of Materials Science and Engineering, Shanghai Jiao Tong University. Her main research interests involve the development and clinical transformation of H2-delivering biomaterials, especially catalytic H2-generating nanomaterials.

Qianjun He is a winner of the Distinguished Young Scientists of the National Natural Science Foundation of China, and a Tenured Professor at Shanghai Jiao Tong University (SJTU). He was awarded Distinguished Leadership in Molecular Hydrogen Research by the European Academy for Molecular Hydrogen Research in Biomedicine. He is now the vice-chair of the International Society for Hydrogen Medicine and Hydrogen Biology. His research focuses on the engineering and development of advanced nanomaterials and nanomedicines for precision theranostics and hydrogen therapy of major diseases.
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1497011.html?mobile=1
收藏

