肿瘤微环境(TME)通常具有免疫抑制性,在肿瘤进展、免疫逃逸和治疗抵抗中发挥关键作用,这些均显著阻碍癌症治疗的效果1。本文提出,氢化镁(MgH₂)诱导的氢气(H₂)疗法可协同增强钛酸钡(BTO)介导的声动力治疗(SDT),同时调节肿瘤微环境以提高免疫检查点抑制剂(aPD-1)的疗效。具体而言,超声(US)激活BTO触发声动力治疗并诱导免疫原性细胞死亡(ICD),而氢化镁微球持续释放的氢气可放大肿瘤细胞的破坏作用,从而促进免疫细胞向肿瘤部位募集。同时,氢化镁产生的氢氧根离子(OH⁻)和镁离子(Mg²⁺)可缓解酸性肿瘤微环境,逆转免疫抑制并增强T细胞介导的抗肿瘤反应。在CT26肿瘤模型中,与单独使用BTO相比,声动力治疗与氢化镁疗法的协同组合显著增强了声动力治疗的抗肿瘤效果,延长了受治小鼠的生存期。此外,氢化镁上调T细胞中PD-1的表达,显著提高肿瘤对aPD-1疗法的敏感性。该策略为增强声动力治疗提供了一种可推广的方法,展示了其在抗肿瘤治疗中的广泛潜力,并为克服免疫检查点抑制剂耐药性开辟了一条新途径。
新概念
恶性肿瘤给患者带来巨大的身体、心理和经济负担,而传统治疗方法存在严重副作用、应用条件苛刻和耐药性等问题。因此,具有不依赖肿瘤类型、无创性和高安全性等特点的新型抗肿瘤疗法应运而生。然而,声动力治疗的效率受到肿瘤微环境的严重影响。肿瘤微环境通常具有免疫抑制性,在肿瘤进展、免疫逃逸和治疗抵抗中起关键作用。为此,我们提出了一种基于氢气疗法和声动力治疗的联合治疗策略(BUM)。氢化镁诱导的氢气疗法可通过调节肿瘤微环境,增强基于钛酸钡的声动力治疗效果,提高肿瘤治疗效率。此外,BUM通过将免疫抑制性肿瘤微环境调节为免疫刺激性微环境,增强了aPD-1的疗效。
1. 引言
声动力治疗(SDT)是一种新兴的无创治疗方式,它利用低频、低强度超声刺激声敏剂,从而清除肿瘤细胞。与光、温度、电等其他外源性刺激相比,超声作为一种外源性能量,因其无创性、组织穿透深度大(>10 cm)和副作用小等特点,已成为纳米医学领域的研究热点2-4。它可催化声敏剂在肿瘤细胞中产生细胞毒性活性氧(ROS),通过氧化脂质、破坏蛋白质和损伤DNA来实现抗肿瘤效果5。然而,由于肿瘤微环境的独特属性(低pH值、缺氧)6,7,活性氧的持续产生受到显著限制,导致治疗效果有限8。此外,尽管过去十年中开发了许多性能增强的声敏剂,但其治疗效果仍有进一步提升的空间9,10。因此,将这些敏剂与其他治疗方式(如放大肿瘤氧化应激、调节肿瘤微环境以激活肿瘤免疫的方法)相结合11-14,可能是提高肿瘤治疗效果的有效手段。
氢气作为一种内源性气体,近年来因其优异的安全性、高扩散性以及在多种病理过程中的调节作用而备受关注15-17。在过去几十年中,氢气在多种疾病的治疗中显示出良好的前景,包括肿瘤1,17-21、伤口愈合22,23、动脉粥样硬化24、急性缺血性卒中25、阿尔茨海默病26和关节炎27等。尽管氢气抗肿瘤作用的确切机制尚不清楚,但其治疗效果与病变部位、暴露时间和氢气浓度密切相关。研究表明,低浓度氢气可特异性清除细胞中高毒性的羟基自由基(˙OH)和过氧亚硝酸盐(ONOO⁻),同时保留正常细胞中其他活性氧的生理功能28,29。这使其更适合治疗炎症相关疾病30,但对癌症治疗的作用有限。相反,高浓度氢气可抑制癌细胞的线粒体能量代谢18,31,并破坏细胞内氧化还原稳态,导致活性氧产生增加15,32-34,36,最终诱导肿瘤细胞凋亡,产生更显著的抗肿瘤效果。因此,氢气和活性氧在细胞中并非简单的拮抗作用。活性氧的积累取决于氢气的作用时间和浓度以及细胞状态15,32-34,36。氢气的常见递送方式包括吸入富氢空气、注射富氢盐水和口服富氢水。然而,由于氢气溶解度低且分子体积小,这些传统递送方式往往难以在肿瘤部位达到足够高的氢气浓度,从而限制了其治疗效果。因此,为应对这一挑战,创新策略应运而生,特别是涉及将纳米材料递送至肿瘤部位,并利用内源性或外源性刺激在局部产生氢气31,35。例如,氢化钯(PdH0.2)纳米晶体36、[FeFe]TPP/GEM/FCS纳米催化剂37、氨硼烷(AB)21,38、纳米氢化钙18以及PtBi₂S₃等纳米材料已被用于实现氢气的原位释放,从而提高氢气递送效率,并显示出显著的抗肿瘤效果17,39,40。尽管氢气疗法具有潜力,但单独的氢气疗法在实现最佳治疗效果方面仍存在局限性。因此,将声动力治疗与氢气疗法相结合,可为肿瘤治疗提供一种更精准、有效且毒性更低的方法。然而,如何有效地将氢气疗法与声动力治疗相结合以获得更好的抗癌效果,仍是一个关键挑战。氢化镁是一种固态氢气源,具有高储氢容量41,且可通过水解产生所需的氢气。此外,其副产品氢氧化镁(Mg(OH)₂)可中和酸性肿瘤微环境,且镁离子(Mg²⁺)已被证实在免疫反应中发挥重要作用42。因此,氢化镁已成为一种极具前景的癌症治疗候选药物,值得进一步研究和应用。
本文提出将氢化镁作为一种新型肿瘤治疗剂,与声动力治疗协同使用。首先,通过液相剥离法获得氢化镁纳米颗粒。然后,通过电喷雾法43,44将其制备成氢化镁-聚己内酯(MgH₂-PCL)微球,以实现氢气在肿瘤局部的缓慢释放。通过水热法制备钛酸钡纳米颗粒。随后,将氢化镁-聚己内酯微球和钛酸钡纳米颗粒递送至CT26肿瘤部位。钛酸钡介导的声动力治疗可直接杀死肿瘤细胞。微球中包裹的氢化镁可在肿瘤部位与水反应,产生氢气、氢氧根离子和镁离子。生成的氢气通过诱导肿瘤细胞线粒体功能障碍进一步促进肿瘤细胞凋亡,而氢氧根离子可缓解酸性微环境7。因此,更多的免疫细胞浸润到肿瘤部位,肿瘤免疫抑制微环境得到改善。此外,镁离子可募集更多的CD8⁺T细胞,且aPD-1的使用可增强T细胞的细胞毒性,以获得更好的治疗效果。因此,氢化镁诱导的氢气疗法不仅增强了肿瘤治疗效果、实现了氢气治疗,还实现了酸性肿瘤微环境的中和以及免疫抑制微环境的调节。声动力治疗与氢气疗法的协同作用极大地提高了肿瘤治疗效果。此外,由于肿瘤微环境得到改善,免疫检查点抑制剂(aPD-1)的疗效也得到了增强(图1)。
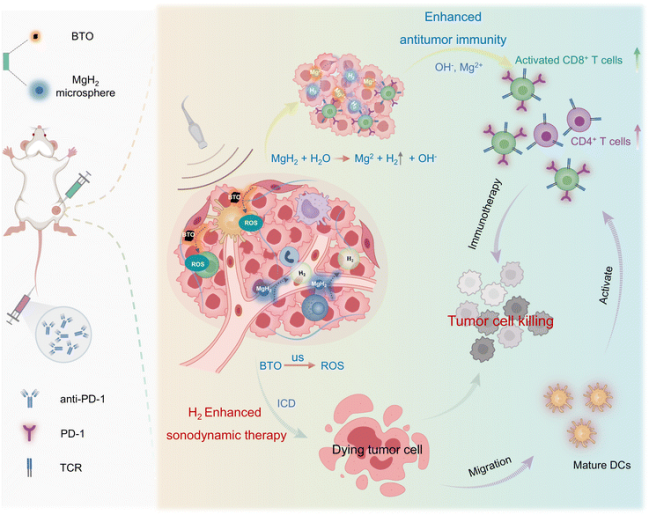
图1 氢化镁诱导原位氢气治疗通过破坏肿瘤细胞 redox 稳态和调节肿瘤微环境增强声动力治疗的示意图(TCR:T细胞受体)
2. 结果与讨论
2.1 钛酸钡纳米颗粒和氢化镁-聚己内酯微球的合成与表征
采用水热法合成钛酸钡纳米颗粒,方法如前所述45。透射电子显微镜(TEM)显示,钛酸钡纳米颗粒呈四方形状(图2(a)),直径为12±2 nm(图S1a,ESI†)。高分辨率透射电子显微镜(HRTEM)图像进一步显示,晶面间距为0.28 nm,对应于钛酸钡的(110)晶面(图2(b))。此外,钛酸钡的X射线衍射(XRD)图谱显示出分离的(002)和(200)反射峰,与四方压电钛酸钡的特征一致(图2(c))5。傅里叶变换红外光谱(FTIR)显示,钛酸钡在约550 cm⁻¹处有吸收峰,氢化镁在约450-500 cm⁻¹处有吸收峰,如图S2a(ESI†)所示。拉曼光谱在247 cm⁻¹处检测到一个显著的A1(2TO)信号,在307 cm⁻¹处检测到E(3TO)+E(2LO)+B1信号(图S2b,ESI†),这些都是四方相钛酸钡的特征拉曼散射模式,进一步证实了钛酸钡的四方结构。图S2d(ESI†)显示了四个主要峰,分别对应C 1s、Ti 2p、O 1s和Ba 3d。458 eV和463.9 eV处的峰分别对应Ti 2p3/2和Ti 2p1/2。在钛酸钡的Ba 3d光谱中检测到了钛酸钡的Ba 3d3/2(794.4 eV)和Ba 3d5/2(779.0 eV)。从不对称的O 1s光谱中分离出529.5 eV和531.2 eV处的峰,分别对应晶格氧和氧空位,证实了氧空位的存在,如图S2e(ESI†)所示45。
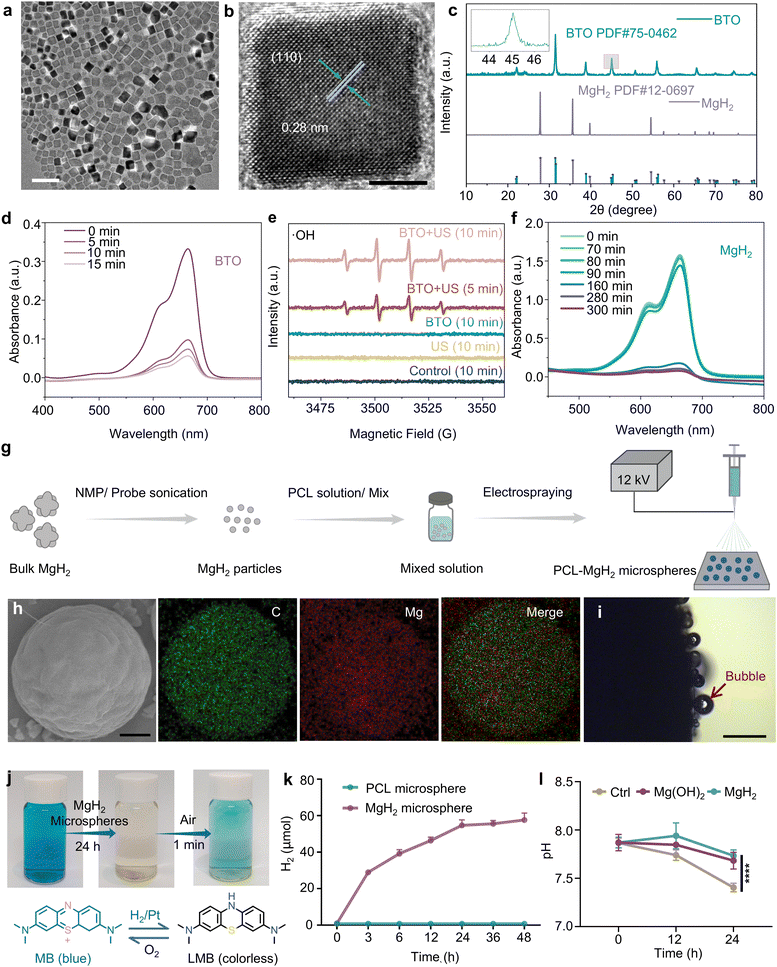
图2 钛酸钡纳米颗粒和氢化镁微球的表征。(a)钛酸钡纳米颗粒的透射电子显微镜图像(比例尺=50 nm)和(b)高分辨率透射电子显微镜图像(比例尺=5 nm)。(c)钛酸钡纳米颗粒和氢化镁颗粒的X射线衍射图谱(插图为(002和200)峰的放大图)。(d)在钛酸钡纳米颗粒存在下,超声照射(1.0 MHz,1.0 W cm⁻²,50%占空比)下亚甲基蓝(MB)的紫外-可见吸收光谱。(e)不同实验条件下,5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)捕获羟基自由基(˙OH)的电子自旋共振(ESR)光谱。(f)不同时间点,氢化镁产生的氢气还原亚甲基蓝后,亚甲基蓝-铂(MB-Pt)的紫外-可见吸收光谱。(g)聚己内酯-氢化镁(PCL-MgH₂)微球的制备过程(在最新文章中简称为氢化镁微球)。(h)氢化镁微球的扫描电子显微镜(SEM)图像和元素映射(比例尺=1 μm)。(i)含有氢化镁的聚己内酯片剂表面产生气泡的照片(与氢化镁微球相比,片剂表面的气泡更容易观察到,比例尺=500 μm)。(j)氢气还原后以及与空气接触后,亚甲基蓝-铂探针(10 μg mL⁻¹亚甲基蓝+60 μg mL⁻¹铂)的蓝色可逆消失的照片。(k)通过气相色谱(GC)测定的×1磷酸盐缓冲液(PBS)中释放的氢气量。(l)通过pH微电极测定的,在氢氧化镁微球和氢化镁微球存在下缓冲液的pH值变化。
钛酸钡在超声刺激下的压电催化活性通过亚甲基蓝(MB)降解实验得到证实,结果如图2(d)所示。随着超声作用时间的延长,含有钛酸钡纳米颗粒的亚甲基蓝溶液在664 nm处的吸光度逐渐降低,表明活性氧的产生量相应增加。此外,利用5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)自旋捕获的电子自旋共振(ESR)光谱证实了染料降解过程中羟基自由基(˙OH)的产生(图2(e))。与仅超声组和仅钛酸钡组相比,钛酸钡+超声组表现出更强的DMPO-˙OH加合物信号,证明了钛酸钡纳米颗粒的协同催化活性。
采用液相剥离法18,46,47合成氢化镁纳米颗粒(图2(g))。扫描电子显微镜(SEM)图像显示,微米级氢化镁粉末成功剥离为尺寸为122±54 nm的小纳米颗粒(图S1b-d,ESI†)。特征X射线衍射峰与氢化镁的晶格表面相对应,证实该多晶体属于氢化镁(PDF#12-0697)(图2(c))。为了控制氢气的释放,将氢化镁纳米颗粒与聚己内酯溶液混合后,采用电喷雾技术制备氢化镁微球(图2(g))。通过调整电压、聚己内酯溶液浓度和喷雾距离,得到直径约为5 μm的均匀微球(图S3,ESI†)。扫描电子显微镜显示微球呈均匀的球形形貌,元素映射表明碳和镁在微球内均匀分布,证实氢化镁在微球内的均匀分布(图2(h))。为了更好地观察氢化镁释放氢气的过程,制备了氢化镁-聚己内酯片剂并将其置于磷酸盐缓冲液中进行观察。在光学显微镜下,可观察到片剂表面持续产生氢气气泡(图2(i))。
采用亚甲基蓝-铂(MB-Pt)作为探针进一步证实微球释放的气体为氢气。如图2(f)所示,随着时间的推移,蓝色亚甲基蓝的吸光度降低,这是因为在铂催化剂存在下,氢化镁产生的氢气促进蓝色亚甲基蓝还原为无色的亚甲基白(LMB)。在同一反应体系中,当与空气接触后,无色的亚甲基白通过氧气氧化迅速转化回亚甲基蓝(图2(j))48。随后,通过气相色谱法对氢化镁微球释放的氢气进行定量测量。如图2(k)所示,氢化镁微球在磷酸盐缓冲液中能够释放氢气长达48小时。将氢化镁与肿瘤细胞共培养后,氢化镁组的培养基pH值显著高于对照组,这可能是由于氢化镁与水反应生成氢氧化镁所致,表明氢化镁具有调节酸性肿瘤微环境的潜力(图2(l))。
2.2 体外协同抗肿瘤效果评估
为了确定单独的钛酸钡和氢化镁微球对正常细胞的影响,进行了细胞计数试剂盒8(CCK8)实验。结果显示,对于正常人永生化角质形成细胞(HaCat),在钛酸钡浓度高达500 μg mL⁻¹、氢化镁浓度高达400 μg mL⁻¹的情况下,细胞活力未受到显著影响(图S4a、b,ESI†)。为了研究在超声作用下钛酸钡和氢化镁微球对肿瘤细胞的杀伤效果,我们首先将材料与细胞孵育4小时,待氢气发挥作用后,进行超声干预以实现协同治疗。在黑色素瘤B16F10细胞中,钛酸钡在超声刺激下的抗肿瘤效果呈剂量依赖性增强,当钛酸钡浓度为100 μg mL⁻¹时,细胞存活率为70%,而在500 μg mL⁻¹时进一步降至31%。当向100 μg mL⁻¹钛酸钡溶液中加入300 μg mL⁻¹氢化镁时,细胞存活率保持在90%以上,与单独使用钛酸钡的结果一致,表明仅将这两种材料组合并不能增强抗肿瘤效果。然而,当施加超声时,细胞活力显著降至60%,低于钛酸钡+超声组,表明氢化镁增强了超声触发的声动力治疗效果(图3(a)及图S5a、b,ESI†)。对于4T1和CT26细胞,分别如图3(b)和(c)所示,在超声刺激下,钛酸钡+氢化镁的组合也表现出最显著的肿瘤抑制作用,表明其在不同肿瘤细胞中具有协同抗肿瘤效果。
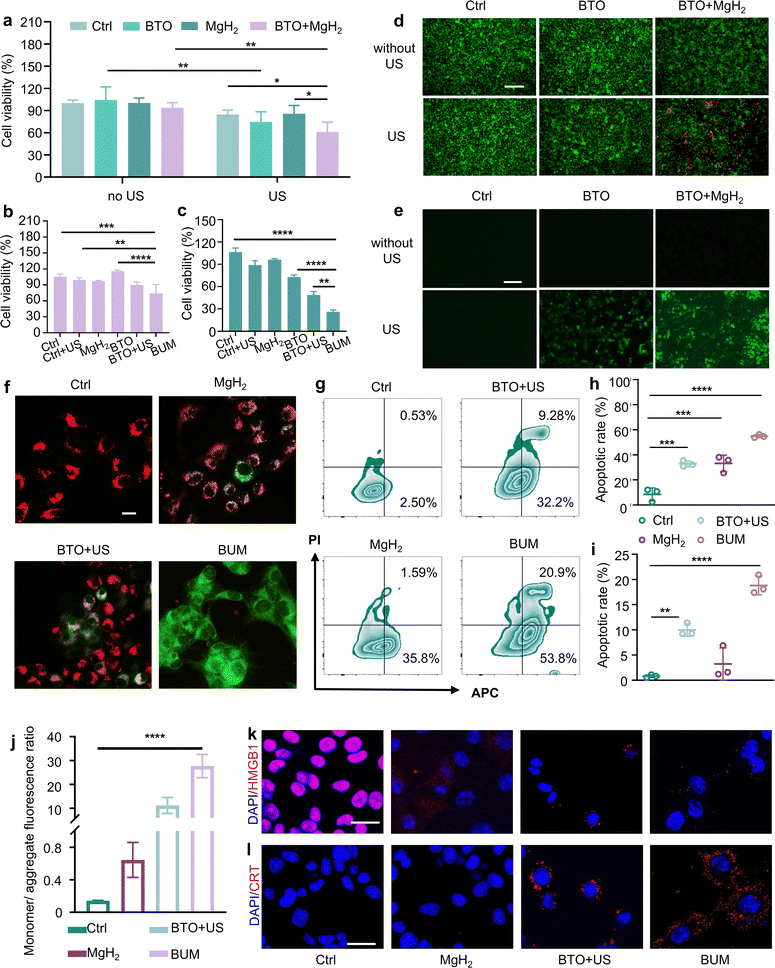
图3 钛酸钡纳米颗粒和氢化镁微球的体外治疗效果。(a)B16F10细胞、(b)4T1细胞和(c)CT26细胞在不同条件下孵育后的相对活力(钛酸钡:100 μg mL⁻¹;氢化镁:300 μg mL⁻¹;超声照射:1 W cm⁻²,5分钟;n=4)。(d)不同处理后B16F10细胞的钙黄绿素-AM/碘化丙啶(Calcein-AM/PI)荧光图像。通过钙黄绿素-AM/碘化丙啶染色分别检测活细胞(绿色)和死细胞(红色)(比例尺:200 μm)。(e)通过二氯二氢荧光素二乙酸(DCFH-DA)染色检测不同处理后B16F10细胞中活性氧的水平(比例尺=100 μm)。(f)不同处理后B16F10细胞线粒体膜电位的共聚焦荧光图像(钛酸钡:100 μg mL⁻¹;氢化镁:300 μg mL⁻¹;超声照射:1 W cm⁻²,5分钟;比例尺=15 μm)。(g)不同处理后B16F10细胞凋亡的流式细胞术分析。(h)B16F10细胞早期凋亡率和(i)晚期凋亡率的统计分析(n=3)。(j)线粒体膜电位的统计分析。不同处理后B16F10细胞中免疫原性细胞死亡标志物(k)高迁移率族蛋白1(HMGB1)和(l)钙网蛋白(CRT)的荧光图像。比例尺=25 μm。(a、b、c、h和i)中的数据以平均值±标准差表示。*P<0.05,**P<0.01,***P<0.001。
为了进一步证明钛酸钡+氢化镁的协同抗肿瘤功效,对经过不同处理的B16F10细胞进行活死染色(图3(d)及图S7c、d,ESI†)。结果显示,钛酸钡+超声+氢化镁(BUM)组的红色荧光强度最强,表明其清除肿瘤细胞的效率最高。已有研究表明,在超声存在下,钛酸钡通过产生活性氧诱导凋亡5,8。因此,为了研究不同条件下活性氧的产生情况,我们采用二氯二氢荧光素二乙酸染色对B16F10细胞进行分析(图3(e)及图S7a、b,ESI†)。在对照组、钛酸钡组、钛酸钡+氢化镁组和仅超声组中观察到的绿色荧光极少,表明活性氧的产生可忽略不计。相比之下,钛酸钡+超声组显示出明显的绿色荧光,而加入氢化镁后,绿色荧光进一步增强,表明活性氧水平显著增加。活性氧水平升高可能与肿瘤细胞内氧化还原稳态的破坏有关,导致细胞内氧化应激。肿瘤细胞比正常细胞对氢气更敏感,因为它们具有更高的活性氧水平。与正常细胞相比,癌细胞对氧化还原应激的抑制作用更强36。最初,氢气进入肿瘤细胞后会选择性地降低细胞内活性氧水平;然而,由于细胞的氧化还原稳态能力,活性氧会出现反弹升高12,31-36。随后,钛酸钡介导的声动力治疗加剧了肿瘤细胞的氧化应激,导致肿瘤细胞内活性氧显著升高。
考虑到活性氧与线粒体功能之间的密切相关性32,以及线粒体膜电位(MMP)在维持线粒体完整性方面的关键重要性,我们采用JC-10探针评估线粒体膜电位的变化(图3(f)和(j))。在高线粒体膜电位条件下,如对照组所观察到的,JC-10聚集形成聚合物,发出红色荧光。相反,线粒体膜电位降低会导致JC-10解离为单体,发出绿色荧光。在各处理组中,BUM组的绿色荧光最强,表明线粒体膜电位显著降低,这是凋亡早期的标志性事件。对线粒体膜电位的统计分析显示,与对照组、氢化镁组和钛酸钡+超声组相比,BUM组的单体/聚集体荧光强度比显著更高,表明BUM诱导线粒体膜电位去极化,从而触发凋亡性细胞死亡。在氢化镁组中也观察到绿色荧光,表明氢化镁产生的氢气可通过抑制线粒体功能对线粒体造成损伤49。随后,通过膜联蛋白V-别藻蓝蛋白(Annexin V-APC)/碘化丙啶染色对处理24小时后各组的凋亡率进行定量(图3(g)-(i))。结果显示,对照组的凋亡水平可忽略不计。钛酸钡+超声处理诱导早期凋亡(32.87%)和晚期凋亡(9.97%)均明显增加,而氢化镁组的早期凋亡水平与钛酸钡组相近(33.17%),但晚期凋亡可忽略不计(3.23%)。相比之下,BUM组的早期和晚期凋亡水平最高(分别为54.9%和18.8%),总凋亡率达到73%。BUM组中线粒体膜电位的大幅降低和高凋亡率与氢气协同声动力治疗导致肿瘤细胞内产生大量活性氧有关。这些发现表明,钛酸钡+超声与氢化镁联合应用显著增强了肿瘤细胞的凋亡,突出了联合治疗的协同效应。
免疫原性细胞死亡的标志主要包括垂死细胞释放三磷酸腺苷(ATP)、凋亡前细胞表面暴露钙网蛋白以及死后向细胞外空间释放高迁移率族蛋白150。通过共聚焦激光扫描显微镜(CLSM)观察高迁移率族蛋白1的释放和钙网蛋白的暴露(图3(k)和(l))。如图3(k)所示,BUM组的红色荧光强度最低,表明高迁移率族蛋白1显著释放。同时,该组观察到最强的核外红色荧光,显示出最多的钙网蛋白暴露(图3(l))。此外,我们还检测了三磷酸腺苷的含量。根据图S6(ESI†),BUM组肿瘤细胞中的三磷酸腺苷含量明显最低,表明BUM组的三磷酸腺苷分泌量最多。上述所有结果表明,BUM可导致免疫原性细胞死亡,这有利于肿瘤微环境的调节。
2.3 体内联合肿瘤治疗
在皮下CT26荷瘤小鼠中评估BUM的治疗效果,完整的治疗过程如图4(a)所示。将小鼠分为四组,包括对照组、氢化镁组、钛酸钡+超声组和BUM组,在最初6天内分别接受不同的治疗。如图4(b)和(c)所示,氢化镁组、钛酸钡+超声组和BUM组的肿瘤生长速度均慢于对照组,其中BUM组的生长速度最慢,显著显示出对肿瘤进展最强的抑制作用。治疗后第14天,对照组的平均肿瘤体积为1102 mm³,氢化镁组为632 mm³,钛酸钡+超声组为489 mm³,而BUM组的平均肿瘤体积仅为235 mm³。统计分析显示,与对照组相比,BUM组的肿瘤体积显著减小(P<0.001)。这表明声动力治疗与氢气的协同治疗对肿瘤生长的抑制作用比单一治疗更强。此外,BUM组的肿瘤重量最低,平均质量仅为167.6 mg(图4(e)),且肿瘤尺寸最小(图4(f)及图S5,ESI†),进一步凸显了其优越的治疗效果。压电催化与氢气的联合作用显示出显著的抑制肿瘤生长的能力。
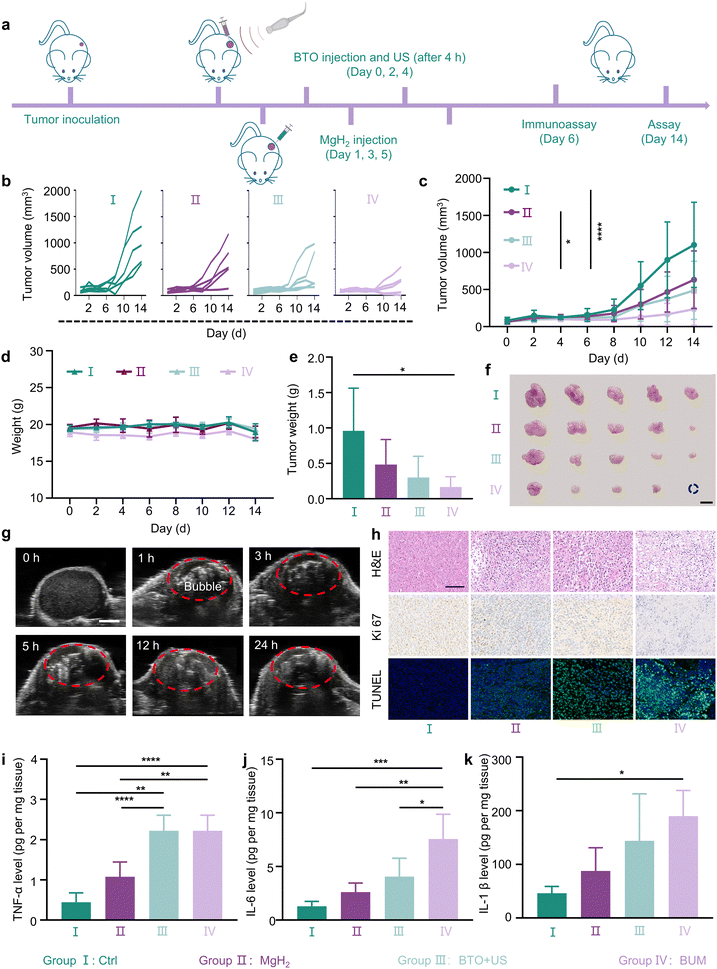
图4 体内联合治疗(n=5)。(a)癌症治疗过程示意图。(b)个体随时间变化的肿瘤生长曲线、(c)不同处理后CT26荷瘤小鼠随时间变化的肿瘤生长曲线,包括对照组、氢化镁组、钛酸钡+超声组和钛酸钡+超声+氢化镁组(钛酸钡:10 mg kg⁻¹;氢化镁微球:每只小鼠130 μg;超声照射:1 W cm⁻²,8分钟)。(d)随时间变化的体重曲线和(e)不同处理后CT26荷瘤小鼠的肿瘤重量。(f)抗肿瘤研究结束时从CT26荷瘤小鼠收集的肿瘤数字图像(比例尺=1 cm)。(g)注射氢化镁微球后CT26荷瘤小鼠的超声成像(增强的信号强度表明产生了氢气气泡,比例尺=2 mm)。(h)不同处理后从小鼠收集的肿瘤切片的苏木精-伊红(H&E)、末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)和ki67染色的显微镜图像(比例尺=100 μm)。(i)肿瘤坏死因子-α(TNF-α)、(j)白细胞介素-6(IL-6)和(k)白细胞介素-1β(IL-1β)在肿瘤部位的水平。(a、b、c、h和i)中的数据以平均值±标准差表示。*P<0.05,**P<0.01,***P<0.001。
此外,为了准确确定肿瘤内氢气的产生程度,通过超声成像进行观察。将氢化镁微球注射到肿瘤后,观察到明亮的回声,这与氢化镁微球产生的氢气气泡相对应,在超声成像下表现出强烈的对比度。如图4(g)所示,明亮的回声持续超过24小时,表明氢化镁微球能够在肿瘤部位持续释放氢气51。值得注意的是,在超声照射下,这种氢气囊泡也可能对肿瘤造成破坏33。
为了进一步验证治疗效果,我们采用苏木精-伊红染色、末端脱氧核苷酸转移酶介导的dUTP缺口末端标记和ki67来评估不同处理后肿瘤组织的病理状态,如图4(h)所示。苏木精-伊红染色显示,BUM组的细胞核显著减少,出现严重的核固缩和核分裂,表明典型的组织病理学损伤。同时,末端脱氧核苷酸转移酶介导的dUTP缺口末端标记染色显示该组的绿色荧光最强,表明肿瘤细胞凋亡水平最高。ki67染色结果显示,对照组中带有棕色沉积物的细胞核最丰富,而BUM组中最少,表明对照组细胞增殖活跃,而BUM组细胞增殖极少,从而证实该治疗能有效抑制肿瘤生长。
在细胞水平上,将RAW 264.7细胞和骨髓来源的巨噬细胞与经过不同处理的B16F10细胞的上清液共培养,以研究BUM的促炎作用。如图S8(ESI†)所示,BUM组中促炎细胞因子白细胞介素-1β、白细胞介素-6和肿瘤坏死因子-α的表达水平最高,表明BUM诱导肿瘤细胞发生免疫原性细胞死亡,从而增强巨噬细胞的促炎反应。
检测不同处理后肿瘤部位促炎因子的释放情况。图4(i)-(k)显示,BUM组的肿瘤坏死因子-α、白细胞介素-1β和白细胞介素-6水平最高,与细胞层面的研究结果一致。值得注意的是,BUM组的白细胞介素-6含量是氢化镁组和钛酸钡+超声组的两倍。
在整个治疗期间,对材料进行了全面系统的生物安全性评估。在整个治疗期间,实验组和对照组小鼠的体重均保持稳定,未出现显著变化(图4(d))。收集血液样本以分析一系列血液学参数,包括平均红细胞血红蛋白量(MCH)、血小板(PLT)、红细胞(RBC)、嗜碱性粒细胞(BA)、嗜酸性粒细胞(EO)、单核细胞(MO)、血红蛋白(HGB)、淋巴细胞(LY)、中性粒细胞(NE)、血细胞比容(HCT)、红细胞分布宽度标准差(RDW-SD)、血小板分布宽度(PDW)、平均红细胞体积(MCV)和平均血小板体积(MPV)(图S10,ESI†)。结果表明,各治疗组之间这些血液学指标无统计学显著差异,仅在预期的生理范围内有微小波动。此外,实验组主要器官的苏木精-伊红染色显示,各治疗组之间未出现显著的组织损伤(图S12,ESI†),证实该治疗方案具有良好的生物安全性。
2.4 体内免疫反应
肿瘤相关巨噬细胞(TAMs)是浸润在肿瘤组织中的巨噬细胞,其表型激活因肿瘤微环境而异。已知M1型肿瘤相关巨噬细胞可杀死肿瘤细胞并抵御病原体,而M2型肿瘤相关巨噬细胞主要促进肿瘤生长、侵袭和转移。酸性肿瘤微环境通过抑制巨噬细胞的M1极化、促进其向免疫抑制性M2表型转化以及抑制T细胞增殖和细胞毒性功能,阻碍抗肿瘤免疫。已有研究表明,中和肿瘤酸性环境并引入氢气可调节肿瘤微环境的免疫抑制特性,从而增强抗肿瘤免疫18,52。
鉴于此,我们研究了氢气协同压电催化对CT26荷瘤小鼠免疫微环境和抗肿瘤免疫的影响。治疗后第7天处死小鼠,收集肿瘤组织进行流式细胞术分析,以测量免疫细胞的百分比。进一步表征肿瘤微环境中肿瘤相关巨噬细胞的表型。如图5(a)-(c)所示,对照组主要表现为M2型巨噬细胞,表明存在免疫抑制性肿瘤微环境。单独使用氢化镁或钛酸钡+超声处理可有效增加M1型肿瘤相关巨噬细胞(F4/80+巨噬细胞中的CD80+)的比例,同时减少M2型巨噬细胞(F4/80+巨噬细胞中的CD206+),表明这些单独治疗可改善肿瘤免疫微环境。值得注意的是,BUM组中M1型肿瘤相关巨噬细胞的比例显著高于其他组,而M2型肿瘤相关巨噬细胞的比例则明显较低。进一步的定量分析证实,与单一治疗组相比,BUM组中M1和M2型巨噬细胞的变化更为显著。这些发现表明,虽然单独治疗可有效改善肿瘤免疫微环境,但氢化镁和声动力治疗的联合应用表现出更强的协同效应,导致M2型肿瘤相关巨噬细胞更显著地极化为M1型,从而更有效地增强抗肿瘤免疫微环境20。
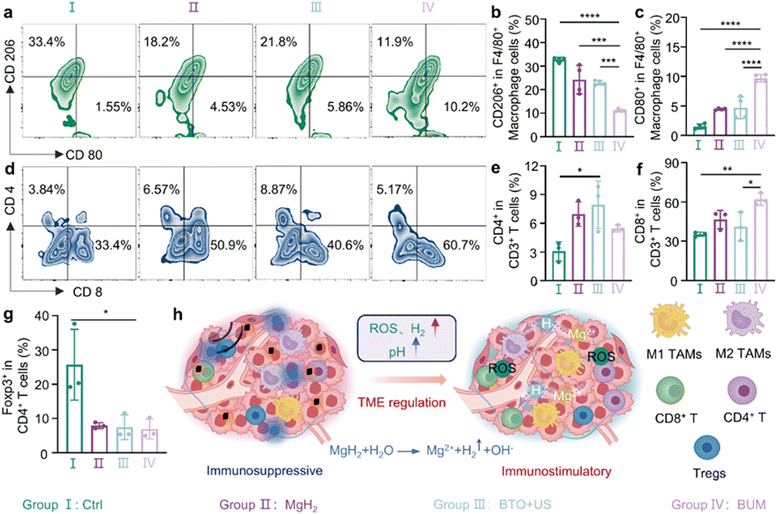
图5 体内免疫反应。(a)不同处理后肿瘤内M1型巨噬细胞(CD11b+F4/80+CD80+)和M2型巨噬细胞(CD11b+F4/80+CD206+)的流式细胞术分析结果以及(b)和(c)定量结果(n=4)。(d)不同处理后肿瘤内CD4+T细胞(CD45+CD3+CD4+)和CD8+T细胞(CD45+CD3+CD8+)的流式细胞术分析结果以及(e)和(f)定量结果(n=3)。(g)不同处理后肿瘤内调节性T细胞(Treg,CD3+CD4+Foxp3+)的定量结果(n=3)。(h)示意图显示钛酸钡纳米颗粒在超声照射下以及氢化镁微球产生的氢气可激活免疫系统。(a、b、c、h和i)中的数据以平均值±标准差表示。*P<0.05,**P<0.01,***P<0.001。
T细胞通过直接杀死肿瘤细胞或帮助激活其他免疫细胞在抗肿瘤免疫中发挥关键作用,从而产生强大的抗肿瘤效果。因此,我们进一步分析了不同治疗组中T细胞的变化,以评估治疗对肿瘤免疫反应的影响。流式细胞术显示,与对照组和氢化镁组相比,BUM组的肿瘤部位T细胞(CD8+T细胞和CD4+T细胞)数量显著增加(图5(d)-(f))。具体而言,CD8+T细胞的百分比是对照组和钛酸钡+超声组的1.5倍。这种增加可能归因于两个因素。主要是,压电催化导致活性氧的产生,从而诱导免疫原性细胞死亡8,53,54,并刺激免疫细胞募集。其次,肿瘤部位氢化镁产生的镁离子和氢氧根离子可能通过改善微环境减少T细胞失活。此外,BUM组淋巴结中CD4+T细胞的百分比显著高于其他组(图S13,ESI†)。这可以通过直接杀死肿瘤细胞和激活CD8+T细胞来增强抗肿瘤免疫。此外,BUM组中具有免疫抑制作用的调节性T细胞(Treg)的百分比低于对照组(图5(g)),这支持在肿瘤内构建免疫刺激性微环境。上述结果表明,氢化镁和钛酸钡+超声可产生氢气、活性氧和碱性物质,通过将免疫抑制性肿瘤微环境调节为免疫刺激性微环境,激活巨噬细胞和T细胞,抑制调节性T细胞,从而实现更好的免疫治疗效果(图5(h))。
2.5 联合免疫检查点阻断治疗(ICB)
据报道,镁离子可以调节CD8+T细胞的效应功能,并表达更高水平的PD-1。在给予氯化镁联合a-PD-1抑制剂后,小鼠的肿瘤进展得到更有效的控制39。考虑到治疗过程中氢化镁会释放镁离子,我们还通过流式分析检测了T细胞表面PD-1受体的表达。如图6(a)和(b)所示,氢化镁组和BUM组T细胞表面PD-1的表达几乎是对照组的10倍。因此,将BUM与PD-1抑制剂联合用于治疗CT26荷瘤小鼠,并观察其治疗效果。实验方案如图6(c)所示。
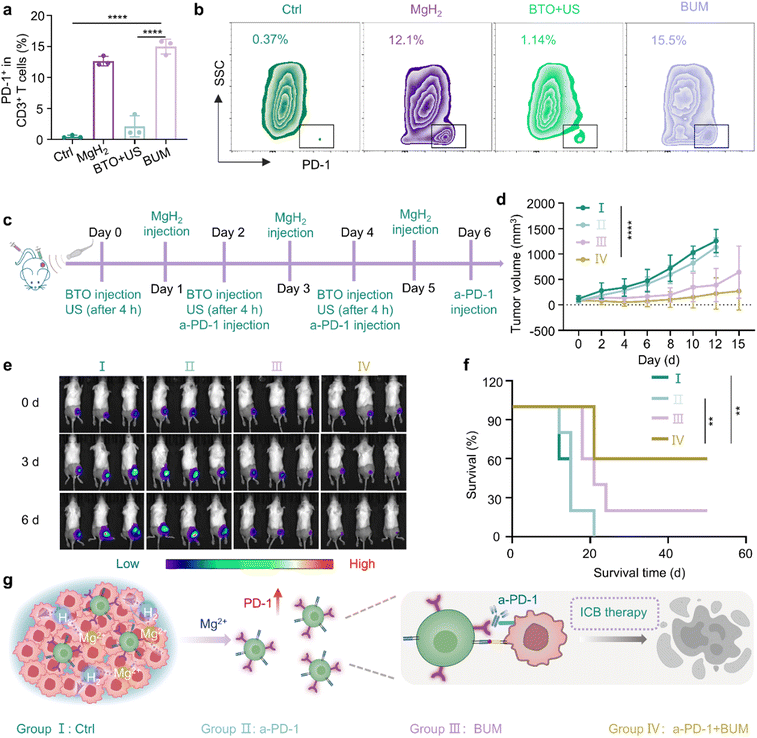
图6 免疫治疗联合a-PD-1。(a)不同处理后表达PD-1的CD3+T细胞的定量结果和(b)流式细胞术分析结果(n=3)。(c)钛酸钡纳米颗粒和氢化镁微球触发的联合a-PD-1免疫治疗的治疗过程示意图。(d)不同处理后CT26荷瘤小鼠随时间变化的肿瘤生长曲线,包括对照组、a-PD-1组、BUM组和a-PD-1+BUM组(钛酸钡:10 mg kg⁻¹;氢化镁微球:每只小鼠130 μg;a-PD-1:每只小鼠20 μg;超声照射:1 W cm⁻²,8分钟;n=5)。(e)不同处理后表达萤火虫荧光素酶的CT26荷瘤小鼠的体内生物发光图像(n=3)。(f)不同处理后荷瘤小鼠的存活率(n=5)。(g)钛酸钡纳米颗粒和氢化镁微球联合a-PD-1诱导抗肿瘤免疫反应的机制示意图。(a、b、c、h和i)中的数据以平均值±标准差表示。*P<0.05,**P<0.01,***P<0.001。
为了直观地确认治疗效果,我们使用了携带表达萤火虫荧光素酶的皮下CT26肿瘤的小鼠。如图6(d)所示,a-PD-1+BUM组的肿瘤荧光最弱,表明该组的治疗效果最佳。相比之下,a-PD-1单药治疗对肿瘤的抑制作用有限,表明其单独使用时疗效较弱。肿瘤体积曲线进一步凸显了a-PD-1+BUM组肿瘤治疗的潜力(图6(e))。值得注意的是,BUM组和a-PD-1+BUM组小鼠的存活时间均显著延长,在第50天时存活率分别为20%和60%(图6(f))。这些结果表明,BUM与免疫检查点抑制剂联合使用可进一步增强抗肿瘤治疗效果,如图6(g)所示。
3. 结论
总之,本研究提出了一种协同的声动力治疗/氢气疗法策略。通过液相剥离法合成纳米级氢化镁,同时采用聚己内酯结合电喷雾技术制备微米级微球,以实现氢气的可控释放。这种方法作为一种新型抗癌剂,可破坏线粒体功能,与钛酸钡介导的声动力治疗相结合,大大提高了治疗效果。
这种方法的一个关键创新点是解决了传统声动力治疗的局限性,传统声动力治疗常因肿瘤微环境的酸性pH而受阻。氢化镁微球与水反应产生的氢氧根离子可中和酸性肿瘤微环境,创造更有利的治疗环境。同时,产生的氢气可与声动力治疗协同促进肿瘤细胞的氧化应激,从而诱导显著的肿瘤细胞凋亡。除了直接影响肿瘤细胞外,氢化镁诱导的氢气疗法和声动力治疗的协同效应显著增加了免疫细胞浸润并减弱了免疫抑制。这种效应体现在CD8+和CD4+T细胞数量的增加、M2型肿瘤相关巨噬细胞向M1表型的极化以及调节性T细胞的减少。此外,镁离子的释放激活了CD8+T细胞并增强了抗肿瘤免疫。在荷瘤小鼠体内进行的研究表明,这种联合治疗有效抑制了肿瘤生长。此外,这种协同方法可增强免疫检查点阻断疗法的疗效,取得更好的治疗效果。此外,值得强调的是,氢化镁的降解产物(镁离子、氢氧根离子和氢气)以及美国食品药品监督管理局(FDA)批准的可生物降解聚己内酯不会对人体产生任何不良影响。因此,由于其广泛的适用性,氢化镁微球可作为一种多功能平台用于协同联合治疗,如免疫检查点抑制、放射治疗和化学治疗,显著提高抗肿瘤疗效。这使得氢化镁微球成为一种具有巨大临床应用潜力的有前景的候选药物。
4. 实验部分
4.1 化学品和试剂
硝酸钡(Ba(NO3)2)、氢氧化钠(Na(OH))、钛酸四丁酯(Ti(OBu)4)、N-甲基吡咯烷酮(NMP)、1-丁醇、正己烷和乙醇(C2H5OH)购自阿拉丁。DNase I重组酶和油酸(OA)购自Sigma-Aldrich。D-荧光素、JC-10检测试剂、钙黄绿素-AM/碘化丙啶、亚甲基蓝(MB)、聚乙二醇200(PEG 200)和细胞计数试剂盒8购自Solarbio。二氯二氢荧光素二乙酸和膜联蛋白V-别藻蓝蛋白/碘化丙啶凋亡试剂盒购自碧云天。聚己内酯(PCL,分子量:80000)购自麦克林。抗体购自BioLegend公司。IV型胶原酶购自Gibco。所有试剂均直接使用,未进一步纯化。
4.2 材料制备
钛酸钡纳米颗粒的制备:如先前研究所述,通过水热法合成钛酸钡纳米颗粒。简而言之,将1 mmol硝酸钡(Ba(NO₃)₂)和12.5 mmol氢氧化钠(NaOH)分别溶解在5 mL去离子水中。然后,将1 mmol钛酸四丁酯(Ti(OBu)₄)和2.5 mmol油酸(OA)分别分散在5 mL 1-丁醇中。将上述溶液混合,在135°C下反应18小时。冷却后,将混合物以8000 rpm离心5分钟,用己烷和乙醇(己烷:乙醇=1:5)洗涤三次,并在真空下干燥。
异硫氰酸荧光素(FITC)偶联钛酸钡纳米颗粒的制备:将含有70 mg DSPE-PEG2000-FITC、50 mg钛酸钡和500 μL四氢呋喃(THF)的混合物在超声处理下分散于10 mL去离子水中30分钟,随后在室温下以800 rpm持续磁力搅拌12小时。通过离心(12000 rpm,15分钟)收集所得的异硫氰酸荧光素-钛酸钡纳米颗粒,并用去离子水洗涤三次以去除未反应的成分。
氢化镁-聚己内酯微球的制备:通过液相剥离法获得小直径的氢化镁颗粒。简要来说,首先将氢化镁粉末分散在N-甲基吡咯烷酮中,然后将混合溶液在4°C下用超声探头处理8小时。随后,将处理后的溶液置于4°C的恒温超声水浴中过夜。最后,将混合溶液以12000 rpm离心30分钟,获得氢化镁纳米颗粒。将所得氢化镁纳米颗粒用乙醇洗涤数次,并在真空干燥箱中干燥。将0.3 g聚己内酯溶解在10 mL二氯甲烷中,得到3%的聚己内酯溶液,随后将洗涤后的75 mg氢化镁颗粒分散在该溶液中。使用静电纺丝机在12 kV的高电压和1.2 cm h⁻¹的流速下获得微球(含20%氢化镁)。
4.3 表征
通过扫描电子显微镜(SU8020,日立,日本)观察微球的形貌和元素分布。通过透射电子显微镜和高分辨率透射电子显微镜(Tecnai G2 F20 STWIN TMP,FEI,美国)观察钛酸钡的微观形貌和结构。使用X射线衍射仪(X’Pert,帕纳科,荷兰),以Cu Kα为辐射源,分析钛酸钡纳米颗粒和氢化镁纳米颗粒的物相结构。在室温下使用紫外-可见-近红外分光光度计(UV3600,岛津,日本)记录吸收光谱。通过拉曼光谱仪(LabRAM HR Evolution,HORIBA JY,法国)观察钛酸钡的分子结构。
4.4 氢气释放和pH值变化的测量
在铂催化剂的催化下,亚甲基蓝可以快速且简便地检测氢气的产生。将10 mg氢化镁微球分散在亚甲基蓝-铂溶液(10 μg mL⁻¹亚甲基蓝和60 μg mL⁻¹铂)中,然后在不同时间点使用紫外-可见-近红外分光光度计测量吸光度。通过气相色谱(GC-7820,惠分,中国)对氢气产生量进行定量。将10 mg微球分散在带有顶空盖的顶空瓶中(含2 mL 1×磷酸盐缓冲液),在不同时间点(每3小时)将400 μL气体注入气相色谱仪以测定氢气浓度。将微球与肿瘤细胞共培养24小时,收集上清液,使用pH计(FiveEasy Plus,梅特勒-托利多,美国)进行测量。
4.5 体外活性氧生成
将20 mg钛酸钡纳米颗粒与5 mL亚甲基蓝溶液(5 μg mL⁻¹)混合过夜,以达到解离吸附平衡。超声照射(1 MHz,1 W cm⁻²,50%占空比)后,取出上清液测量吸光度。整个降解实验在黑暗条件下进行。
4.6 电子自旋共振测量
使用捕获剂5,5-二甲基-1-吡咯啉-N-氧化物(Sigma)检测产生的活性氧。将200 μL钛酸钡(5 mg mL⁻¹)分别与10 μL 5,5-二甲基-1-吡咯啉-N-氧化物在超声照射(1.2 W cm⁻²,50%占空比,5分钟和10分钟)下混合。随后使用电子自旋共振波谱仪(A300-10/12,布鲁克,德国)检测特征性的羟基自由基信号。
4.7 细胞实验
鼠乳腺癌4T1细胞、黑色素瘤B16F10细胞、结肠癌CT26细胞和人永生化角质形成细胞(HaCat)在含有10%胎牛血清(Gibco)和1%青霉素-链霉素溶液(Solarbio,中国)的DMEM培养基(Solarbio,中国)中培养,培养条件为37°C、5%二氧化碳。
4.8 生物相容性测试
将B16F10细胞以8×10³个/孔的密度接种在96孔板(康宁,美国)中。然后,将B16F10细胞与不同浓度的氢化镁(0、100、300、500和700 μg mL⁻¹)在37°C下共培养24小时。将人永生化角质形成细胞(密度为8×10³个/孔)接种在96孔板(康宁,美国)中,并与不同浓度的氢化镁(0、100、200、300和400 μg mL⁻¹)和钛酸钡(0、50、100、200和500 μg mL⁻¹)在37°C下共培养24小时。加入200 μL含10%细胞计数试剂盒8试剂的培养基,在37°C下孵育1小时。使用酶标仪(Varioskan LUX,赛默飞世尔科技)在450 nm和650 nm处测量吸光度。
4.9 体外细胞毒性测试
将B16F10细胞(密度为8×10³个/孔)接种在96孔板中过夜,并分为八组,如下:(1)对照组,(2)对照组+超声组,(3)钛酸钡组,(4)钛酸钡+超声组,(5)氢化镁组,(6)氢化镁+超声组,(7)钛酸钡+氢化镁组,(8)BUM组。将4T1和CT26细胞(密度为8×10³个/孔)接种在96孔板(康宁,美国)中过夜,并分为五组,如下:(1)对照组,(2)对照组+超声组,(3)钛酸钡组,(4)钛酸钡+超声组,(5)BUM组。与不同材料(钛酸钡:100 μg mL⁻¹;氢化镁:300 μg mL⁻¹)共培养4小时后,将肿瘤细胞暴露于超声(1 MHz,1 W cm⁻²,50%占空比)下5分钟。然后,将细胞在37°C下再孵育18小时。通过细胞计数试剂盒8测定法检测细胞活力。
4.10 体外活性氧检测和细胞毒性分析
将B16F10细胞(密度为5×10³个/孔)接种在96孔板中过夜,并分为六组,如下:(1)对照组,(2)对照组+超声组,(3)钛酸钡组,(4)钛酸钡+超声组,(5)钛酸钡+氢化镁组,(6)BUM组。
使用二氯二氢荧光素二乙酸探针评估细胞内活性氧的生成。与不同材料(钛酸钡:100 μg mL⁻¹;氢化镁:300 μg mL⁻¹)共培养4小时后,将细胞与100 μL含二氯二氢荧光素二乙酸(10 μmol L⁻¹)的无胎牛血清DMEM培养基共培养15分钟。接下来,将肿瘤细胞暴露于超声(1 MHz,1 W cm⁻²,50%占空比)下5分钟。然后,用磷酸盐缓冲液冲洗细胞。使用荧光显微镜(DM6000,徕卡,德国)观察细胞内活性氧的产生。
使用钙黄绿素-AM/碘化丙啶溶液观察细胞毒性情况。与不同材料(钛酸钡:100 μg mL⁻¹;氢化镁:300 μg mL⁻¹)共培养4小时后,将肿瘤细胞暴露于超声(1 MHz,1 W cm⁻²,50%占空比)下5分钟。然后,将细胞在37°C下再孵育18小时。最后,用磷酸盐缓冲液冲洗处理后的细胞,并用钙黄绿素-AM/碘化丙啶溶液染色。使用荧光显微镜进行荧光成像。
4.11 线粒体膜电位检测和细胞凋亡定量分析
将B16F10细胞(密度为1×10⁵个/孔)在共聚焦玻璃底培养皿中培养过夜,并分为四组,如下:(1)对照组,(2)氢化镁组,(3)钛酸钡+超声组,(4)BUM组。与不同材料(钛酸钡:100 μg mL⁻¹;氢化镁:300 μg mL⁻¹)共培养4小时后,将B16F10细胞暴露于超声(1 MHz,1 W cm⁻²,50%占空比)下5分钟。
为了观察细胞内线粒体膜电位的变化,按照制造商的方案用JC-10染料对处理后的细胞进行染色。使用共聚焦激光扫描显微镜(TCS SP8,徕卡,德国)获取图像。
为了定量细胞凋亡,收集处理后的上清液和贴壁细胞。然后使用膜联蛋白V-别藻蓝蛋白/碘化丙啶检测试剂盒(Multi sciences)对收集的细胞进行染色。最后,通过流式细胞术(CytoFLEX,贝克曼库尔特,美国)对细胞凋亡进行定量。
4.12 细胞内三磷酸腺苷的检测
将B16F10细胞以4×10⁵个/孔的密度接种在6孔板中,并分为四组,如下:(1)对照组,(2)氢化镁组,(3)钛酸钡+超声组,(4)BUM组。与不同材料(钛酸钡:100 μg mL⁻¹;氢化镁:300 μg mL⁻¹)共培养4小时后,将B16F10细胞暴露于超声(1 MHz,1 W cm⁻²,50%占空比)下5分钟。孵育4小时后,通过裂解细胞收集上清液,并通过三磷酸腺苷测定试剂盒检测和计算三磷酸腺苷含量。
4.13 异硫氰酸荧光素偶联钛酸钡纳米颗粒的体内生物分布
将异硫氰酸荧光素偶联的钛酸钡(10 mg kg⁻¹)注射到肿瘤中。注射钛酸钡24小时后,对处理的小鼠实施安乐死,然后将切除的肿瘤组织在4%多聚甲醛中于4°C固定2小时,随后在30%蔗糖溶液中于4°C冷冻保护10小时。然后,将样品包埋在最佳切割温度复合物中,并使用冷冻切片机(徕卡CM1950)切成30 μm厚的切片。通过共聚焦激光扫描显微镜分析肿瘤切片内纳米颗粒的分布。
4.14 巨噬细胞中炎症因子的表达
使用免疫细胞化学染色观察肿瘤坏死因子-α、白细胞介素-6和白细胞介素-1β。将RAW 264.7细胞分为六组,如下:(1)空白组(仅含培养基),(2)对照组,(3)氢化镁组,(4)钛酸钡+超声组,(5)BUM组,(6)脂多糖组(1 μg mL⁻¹)。将骨髓来源的巨噬细胞分为六组,如下:(1)空白组(仅含培养基),(2)对照组,(3)氢化镁组,(4)钛酸钡+超声组,(5)BUM组。将B16F10细胞以4×10⁵个/孔的密度接种在6孔板中,并分为四组,如下:(1)对照组,(2)氢化镁组,(3)钛酸钡+超声组,(4)BUM组。与不同材料(钛酸钡:100 μg mL⁻¹;氢化镁:300 μg mL⁻¹)共培养4小时后,将B16F10细胞暴露于超声(1 MHz,1 W cm⁻²,50%占空比)下5分钟。孵育24小时后,收集上清液并与巨噬细胞共培养48小时。然后,用磷酸盐缓冲液彻底洗涤细胞,并用4%甲醛固定。固定的细胞在5%山羊血清中室温封闭1小时,然后在含5%山羊血清的肿瘤坏死因子-α、白细胞介素-6或白细胞介素-1β(Abcam)一抗中孵育过夜。然后,将细胞在适当的二抗中室温避光孵育2小时,再用4',6-二脒基-2-苯基吲哚孵育10分钟。最后,使用共聚焦激光扫描显微镜捕获图像。
4.15 材料诱导的体内全身治疗
所有动物实验均经北京纳米能源与系统研究所伦理委员会批准(2023029LZ),所有动物操作均按照《实验动物环境及设施要求》(GB14925-2001)国家标准进行。将50 μL CT26细胞(1×10⁵个细胞)皮下接种到Balb/c小鼠的右背部以建立肿瘤模型。7天后(观察到肿瘤已形成,但此时体积难以测量,记录体积为0),将小鼠随机分为四组(n=5),如下:(1)对照组,(2)氢化镁组,(3)钛酸钡+超声组,(4)BUM组。将含不同材料和不含材料的聚乙二醇-200注射到肿瘤中(钛酸钡:10 mg kg⁻¹;氢化镁微球:每只小鼠130 μg)。注射钛酸钡4小时后,进行超声(1 MHz,1 W cm⁻²,50%占空比,8分钟)照射。在治疗过程中,每两天监测小鼠的体重和肿瘤体积。肿瘤体积按以下公式计算:
V(mm³)=L×W²/2(L:长度,W:宽度)
实验结束时,对每组处理的小鼠实施安乐死,收获所有肿瘤并拍照。然后,将器官和肿瘤用10%福尔马林固定,并用苏木精-伊红、末端脱氧核苷酸转移酶介导的dUTP缺口末端标记和Ki-67染色进行组织病理学分析。
从眼眶采集血液样本进行血液生化检测,使用血液分析仪(Celltac Es,日本光电,日本)进行检测。给CT26荷瘤小鼠注射氢化镁微球,然后在Vevo LAZR小动物超声成像系统下进行体内超声成像。当小鼠的肿瘤大小超过2000 mm³时,对其实施安乐死。
4.16 细胞因子检测
将携带CT26肿瘤的小鼠分为四组,并按上述方法进行处理。处理4天后,处死小鼠。收集肿瘤,在冰浴磷酸盐缓冲液(1:9重量/体积)中匀浆,然后超声处理。将裂解物在4°C下以12,000 rpm离心20分钟,使用商业酶联免疫吸附测定试剂盒按照制造商的方案分析上清液中的细胞因子含量。
4.17 体内免疫测定
将携带CT26肿瘤的小鼠分为四组,并按上述方法进行处理。处理7天后,处死小鼠。收集肿瘤和淋巴结,用含0.2% IV型胶原酶和100 U mL⁻¹ DNase I重组酶的磷酸盐缓冲液在37°C下消化2小时,制成单细胞悬液。然后,将细胞重悬于磷酸盐缓冲液中,并用抗体染色。所有抗体在染色前稀释200倍。通过流式细胞术对染色的细胞进行定量,并使用FlowJo软件(10.8.1版本,TreeStar)进行分析。
4.18 材料联合程序性死亡受体-1抗体诱导的体内全身治疗
将50 μL CT26细胞(5×10⁵个细胞)皮下接种到Balb/c小鼠的右背部以建立肿瘤模型。当小鼠的肿瘤达到约100 mm³时,将小鼠分为四组(n=4),如下:(1)对照组,(2)程序性死亡受体-1抗体组,(3)BUM组,(4)BUM+程序性死亡受体-1抗体组。在第0、2和4天,将钛酸钡(每次每只小鼠10 mg kg⁻¹)注射到肿瘤中,并进行超声照射(1 MHz,1 W cm⁻²,50%占空比,8分钟,注射钛酸钡后4小时)。在第1、3和5天,将氢化镁微球(每次每只小鼠130 μg)注射到肿瘤中。此外,在第2、4和6天,静脉注射程序性死亡受体-1抗体(每次每只小鼠20 μg)。腹腔注射D-荧光素,然后在第0、3和6天通过小动物活体成像系统(IVIS Lumina III,珀金埃尔默,美国)获取携带皮下CT26肿瘤的小鼠的体内生物发光图像。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1493054.html?mobile=1
收藏

