 精选
精选
普遍认为,去甲肾上腺素和多巴胺等神经调质会与神经元上的受体结合并激活受体,从而影响神经元回路的活动以及突触连接的可塑性(强度或连接模式的变化),进而塑造生物体的行为。与典型的神经递质(如谷氨酸)通常介导快速的点对点突触通讯不同,神经调质会广泛扩散通过神经组织,调节神经元信号的强度、持续时间和可塑性。现在,越来越多的证据表明,传统上被视为被动支持细胞的星形胶质细胞,实际上是神经调节中的活跃参与者(1-3)。然而,星形胶质细胞是神经调节中不可或缺的中介,还是仅作为神经元活动的辅助调节者,目前尚不清楚。在《科学》杂志的2025年5月16日第763、769和776页,Guttenplan等人(4)、Chen等人(5)和Lefton等人(6)分别针对这些知识空白展开研究,发现星形胶质细胞在不同神经回路、行为背景和物种的神经调节信号传导中不可或缺。
Related Research Articles
Norepinephrine changes behavioral state through astroglial purinergic signaling
Norepinephrine signals through astrocytes to modulate synapses
GPCR signaling gates astrocyte responsiveness to neurotransmitters and control of neuronal activity
星形胶质细胞紧密包裹大脑中的神经元突起,尤其是突触,并且可以通过G蛋白偶联受体(GPCRs)感知神经调质。GPCRs是一类细胞表面受体,通过调节钙或环磷酸腺苷(cAMP)等第二信使的水平,将外部信号传递到细胞内。随后,星形胶质细胞通过释放三磷酸腺苷(ATP)或腺苷等神经胶质递质作出反应,这些递质会影响神经元活动,进而影响行为。此前对果蝇幼虫的研究表明,章鱼胺和酪胺(哺乳动物去甲肾上腺素的功能类似物)通过星形胶质细胞的GPCR信号传导,调节嗅觉驱动的运动和触觉诱发的惊吓反应(1)。Guttenplan等人基于这一发现,进一步研究了星形胶质细胞如何利用GPCR信号传导调节果蝇以及从大鼠大脑分离的星形胶质细胞的神经元回路活动和行为。他们发现,酪胺激活星形胶质细胞的章鱼胺-酪胺受体(一种GPCR)会导致果蝇细胞内钙浓度升高,并使星形胶质细胞对多巴胺和谷氨酸等神经递质更敏感。
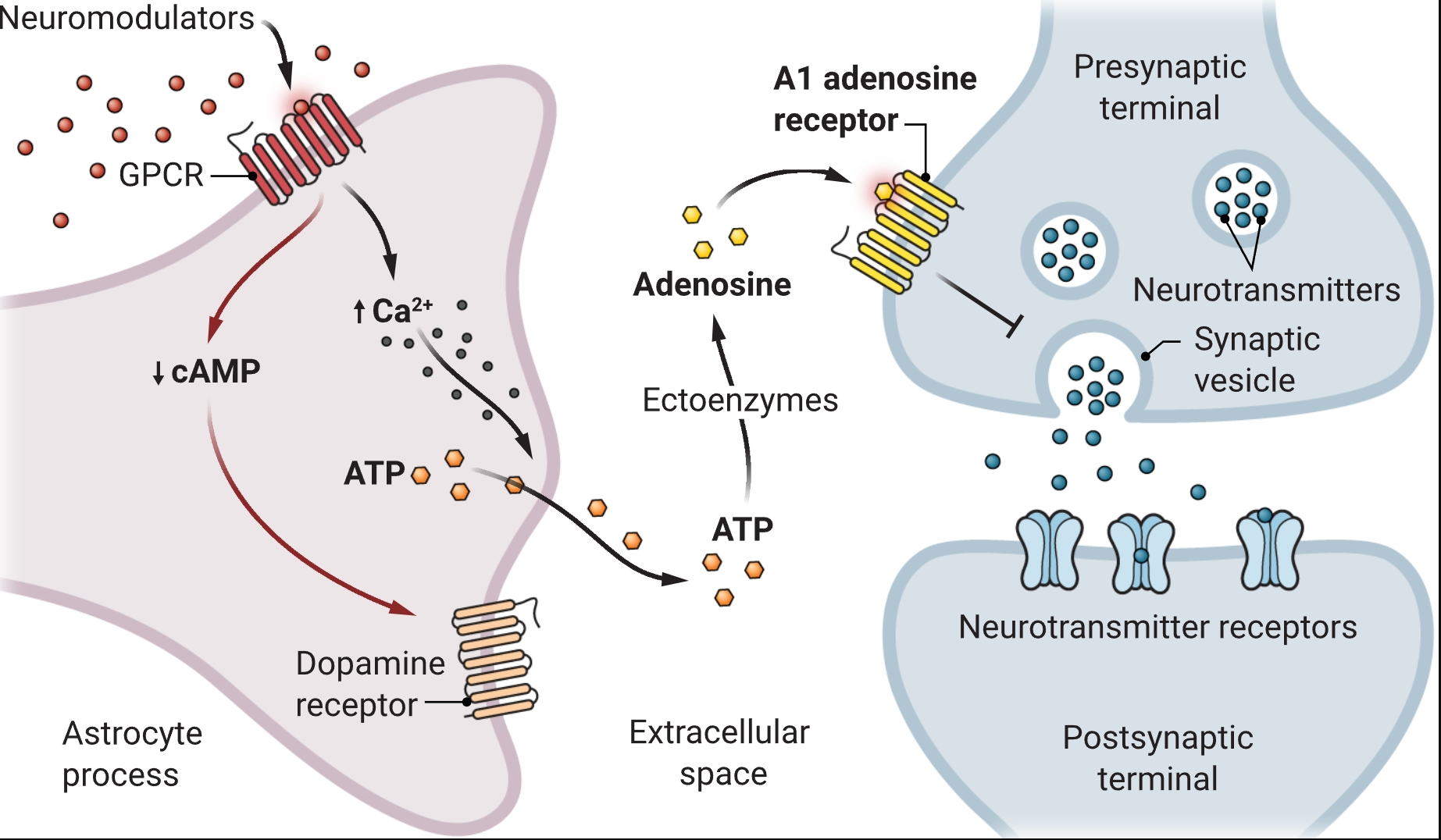
星形胶质细胞在神经调节中占据核心地位
神经调质(哺乳动物和鱼类中具体为去甲肾上腺素,果蝇中为酪胺)与星形胶质细胞表面的G蛋白偶联受体(GPCRs)结合,引发细胞内钙(Ca²⁺)浓度升高和环磷酸腺苷(cAMP)信号传导减少。钙浓度升高会触发三磷酸腺苷(ATP)的释放,ATP在细胞外空间转化为腺苷。腺苷与突触前末端的受体结合,抑制突触小泡释放神经递质,从而调节神经元回路活动。cAMP信号传导的减少导致多巴胺受体向星形胶质细胞表面的转运增加,从而调节星形胶质细胞对多巴胺的反应能力。
图表:K. HOLOSKI/SCIENCE
Guttenplan等人发现,星形胶质细胞对多巴胺反应的调节是由GPCR驱动的cAMP水平降低介导的,这一过程独立于钙信号传导并与之平行发生,进而调节多巴胺受体在星形胶质细胞表面的定位。作者利用遗传学方法,进一步研究了果蝇中星形胶质细胞cAMP信号传导的作用。为此,他们通过阻断通常控制cAMP水平的特定蛋白质(称为Gai蛋白)的表达,降低星形胶质细胞中的cAMP水平。通过成像多巴胺能神经元的钙信号,他们发现这种操作改变了释放多巴胺的神经元的活动。星形胶质细胞cAMP信号传导受损的果蝇幼虫,其翻正反射(一种用于测量运动协调性的先天行为)出现异常。幼虫恢复直立的能力延迟,表明星形胶质细胞cAMP信号传导直接参与了运动行为的神经调节。
Guttenplan等人还在培养的大鼠大脑分离星形胶质细胞中,发现了类似的响应多巴胺和去甲肾上腺素的GPCR-cAMP信号级联反应,这表明该机制在进化上具有保守性。作者利用遗传学(RNA干扰)和药理学(腺苷酸环化酶抑制剂)方法,对星形胶质细胞对各种神经递质的钙反应进行成像。他们发现,直接降低cAMP信号传导或使用α2肾上腺素能受体激动剂模拟去甲肾上腺素,均可使星形胶质细胞对多巴胺产生强烈反应,这支持了哺乳动物中存在保守的星形胶质细胞神经调节信号传导机制。作者承认,在自然脑环境外培养的大鼠星形胶质细胞可能存在反应性改变,以及体内哺乳动物星形胶质细胞中肾上腺素能受体表达和特异性的验证不完整,是该研究的局限性。尽管如此,这些发现为未来研究奠定了重要基础,有助于进一步探索和确认完整哺乳动物大脑中的星形胶质细胞调节机制,并理解其在体内调节神经元回路和行为中的广泛作用。
此前对斑马鱼的研究表明,星形胶质细胞对去甲肾上腺素产生钙信号反应,触发ATP释放,在主动-被动行为实验中影响行为转换(2)。在该实验中,斑马鱼幼虫暴露于重复的视觉或触觉刺激下,会引发剧烈的游泳反应(活跃状态)。随着多次尝试响应刺激向前游泳失败,幼虫逐渐过渡到被动、不活跃状态,表现为游泳努力减少。这项先前的研究明确了星形胶质细胞在行为控制中的作用;然而,去甲肾上腺素激活的特定星形胶质细胞受体,及其激活如何导致行为状态转换,仍不清楚。Chen等人填补了这些知识空白,他们发现蓝斑核(一个对调节注意力、压力和觉醒很重要的小大脑区域)释放的去甲肾上腺素,会激活斑马鱼幼虫的星形胶质细胞α1肾上腺素能受体,触发钙信号传导和ATP释放。他们还报告称,星形胶质细胞来源的ATP会在细胞外迅速转化为腺苷,腺苷通过神经元腺苷受体在突触前发挥作用,调节神经元活动(见图)。
为了将星形胶质细胞信号传导与行为状态联系起来,Chen等人将主动-被动行为实验与星形胶质细胞中钙指示剂的实时成像相结合。作者发现,去甲肾上腺素驱动的星形胶质细胞钙升高与向被动行为状态的逐渐转变之间存在直接关联。针对星形胶质细胞的定向操作——包括对星形胶质细胞钙信号的化学遗传学和光遗传学控制,或ATP向腺苷转化的药理学抑制——进一步证明,星形胶质细胞的ATP-腺苷信号传导是调节神经元回路(决定主动参与或退出行为)的关键机制。值得注意的是,此前在小鼠中也有类似的星形胶质细胞驱动机制的报道,多巴胺诱导伏隔核中的星形胶质细胞钙升高和ATP释放,调节与奖赏相关的突触传递,并影响对精神兴奋剂的行为反应(3),这表明星形胶质细胞介导的神经调节在进化上具有广泛的保守性。
Lefton等人的研究通过离体小鼠海马脑片的电生理实验,提供了令人信服的证据,表明去甲肾上腺素仅通过星形胶质细胞调节突触传递。他们确定星形胶质细胞的α1A肾上腺素能受体是将去甲肾上腺素信号转化为星形胶质细胞内钙升高的关键受体。与Chen等人在斑马鱼幼虫中的观察一致,星形胶质细胞钙升高导致ATP释放,随后ATP在细胞外代谢为腺苷。腺苷随后与突触前末端的A1腺苷受体结合,抑制突触前神经递质释放。Lefton等人利用光遗传学选择性刺激去甲肾上腺素释放,并使用电生理方法(膜片钳记录和双脉冲易化实验)研究突触活动和可塑性,证明去甲肾上腺素诱导的突触抑制特别依赖于星形胶质细胞功能。通过遗传学方法选择性删除星形胶质细胞或神经元的α1A肾上腺素能受体,也证明星形胶质细胞而非神经元是海马突触可塑性中去甲肾上腺素神经调节作用的主要介导者。未来研究的一个重要领域是,这种星形胶质细胞机制如何影响海马依赖的行为,如空间学习和其他记忆过程。
Guttenplan等人、Chen等人和Lefton等人的研究,将星形胶质细胞确立为连接神经调质与神经元活动和行为的活跃中介。这些发现共同将星形胶质细胞定位为神经信号网络中的关键节点。然而,仍有几个关键问题有待解决,例如为什么星形胶质细胞进化为神经调节的中介?此外,星形胶质细胞神经调节在决策、感觉感知以及学习和记忆等高级脑功能中的作用,在很大程度上尚未探索。一项在清醒小鼠中使用实时成像的研究发现,海马星形胶质细胞主动编码奖赏位置的空间信息,这表明星形胶质细胞可能直接参与传统上仅归因于神经元的认知功能(7)。未来的研究可以考察其他哺乳动物脑区(如皮层、杏仁核、基底神经节和丘脑)中的星形胶质细胞神经调节,以及与高级脑功能相关的行为,这将有助于进一步揭示其作用。一些技术问题,尤其是细胞类型特异性和基因操作效率的问题,也需要解决。基因工具的进步使得选择性减弱星形胶质细胞中的Gq GPCR信号传导成为可能(8)。这种减弱导致小鼠出现特定的行为缺陷,突显了使用精确基因方法剖析星形胶质细胞功能及其对行为影响的必要性。
Guttenplan等人、Chen等人和Lefton等人的发现,表明了扩展研究涉及神经调节失调的神经和精神疾病概念框架的重要性。例如,传统上归因于神经元神经调质受体功能障碍的抑郁症、焦虑症和精神分裂症等疾病,可能源于星形胶质细胞信号传导的紊乱。探索靶向星形胶质细胞干预措施的潜在临床应用,可能为这些疾病开辟新的治疗途径。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1485939.html?mobile=1
收藏

