氢气改善天疱疮相关间质性肺病【复旦】
氢气通过抑制氧化应激改善抗桥粒芯蛋白1抗体诱导的天疱疮相关间质性肺疾病
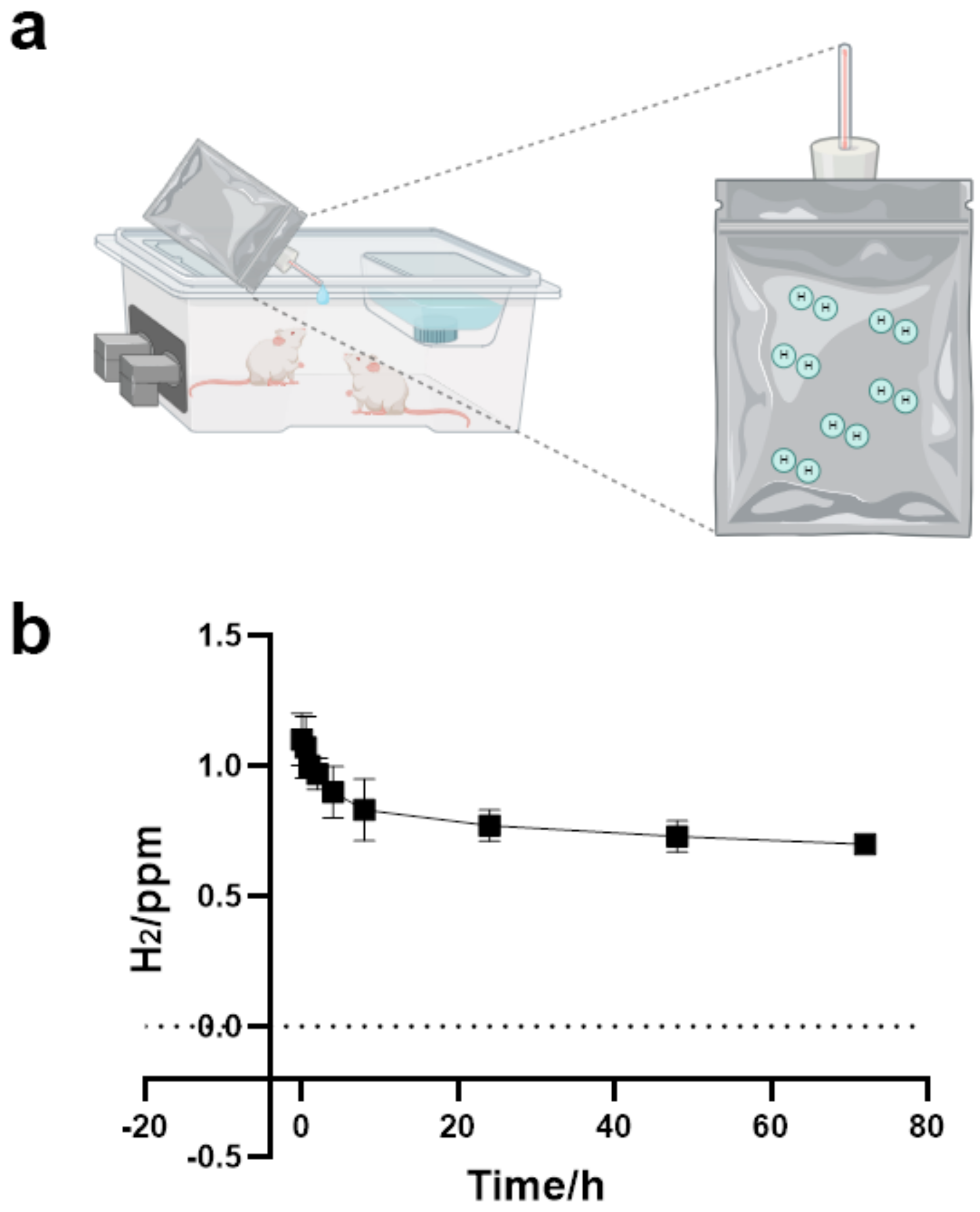
图 8. 给小鼠喂食富氢水。(a)小鼠饮用富氢水的示意图;(b)铝箔袋中氢分子的浓度 - 时间曲线。
天疱疮相关间质性肺疾病(P-ILD)是在天疱疮患者中观察到的一种严重并发症,其特征为肺间质炎症和纤维化。本研究探究了抗桥粒芯蛋白(Dsg)1/3抗体在P-ILD发病机制中的作用,并评估了氢气(H₂)的治疗潜力。我们利用BALB/cJGpt小鼠模型证明,是抗Dsg 1抗体而非抗Dsg 3抗体诱导了间质炎症和纤维化。免疫荧光染色证实了IgG在肺泡上皮中的沉积,这表明免疫复合物形成和上皮损伤。基因表达分析显示,在P-ILD进展过程中,促炎细胞因子(IL-1β、IL-13)水平升高,促纤维化标志物(α-平滑肌肌动蛋白、S100A4、转化生长因子-β和胶原蛋白基因)表达上调。氧化应激水平升高和活性氧(ROS)代谢受损进一步暗示了氧化损伤在疾病发病机制中的作用。为了评估H₂的治疗潜力,我们给P-ILD小鼠给予了富氢水。H₂治疗显著降低了氧化应激,减轻了间质炎症,并预防了肺纤维化。这些保护作用归因于H₂的抗氧化特性,它恢复了氧化-抗氧化平衡。我们的研究结果强调了抗Dsg 1抗体和氧化应激在P-ILD中的关键作用,并突出了H₂作为一种有前景的治疗剂,可减轻抗Dsg 1抗体诱导的肺损伤。
Tang, C.; Wang, L.; Chen, Z.; Shi, X.; Chen, Y.; Yang, J.; Gao, H.; Guan, C.; He, S.; Zhang, L.; et al. Molecular Hydrogen Ameliorates Anti-Desmoglein 1 Antibody-Induced Pemphigus-Associated Interstitial Lung Disease by Inhibiting Oxidative Stress. Int. J. Mol. Sci. 2025, 26, 4203.
1. 引言
以前人们认为天疱疮是一种器官特异性自身免疫性皮肤病,仅累及皮肤和黏膜[1,2]。先前对天疱疮并发症的研究主要集中在类固醇和免疫抑制剂的副作用上[3]。然而,通过对573例天疱疮患者的统计分析,Chen等人发现间质性肺疾病(ILD)是天疱疮确诊后最常见的合并症之一,也是该队列患者的主要死亡原因[4]。此外,Tang等人通过给小鼠皮下注射天疱疮患者的血清免疫球蛋白G(IgG)建立了天疱疮小鼠模型,并发现天疱疮小鼠的肺部存在间质性肺病变[5]。这表明天疱疮与ILD之间可能存在相关性,并且患有ILD的天疱疮患者可被视为患有天疱疮相关间质性肺疾病(P-ILD)。
更重要的是,Tang等人发现天疱疮小鼠的肺部有血清来源的IgG沉积,这表明这种间质变化可能与皮下注射人IgG对小鼠肺组织的直接作用有关[5]。一些病例研究报道,在天疱疮肺部受累患者的支气管肺泡上皮中发现了IgG沉积,并且桥粒芯蛋白(Dsg)抗原在肺组织中异位表达[6,7,8,9]。因此,我们推测天疱疮患者血清中高滴度的抗Dsg 1/3抗体可能作用于肺上皮组织,导致肺损伤,从而导致天疱疮患者发生ILD。探索P-ILD的发病机制对于早期发现和干预这种疾病具有重要意义。
氧化应激在ILD的发生发展中起着关键作用[10]。活性氧(ROS)的产生导致氧化应激,进而诱导机体炎症,激活肺成纤维细胞增殖,产生胶原蛋白沉积,最终形成肺纤维化[10]。由于肺纤维化是不可逆的,早期炎症阶段的有效干预被认为是治疗ILD的重要手段[11]。N-乙酰半胱氨酸(NAC)是还原型谷胱甘肽的前体,可清除体内的氧自由基[12]。作为一种常用的抗氧化剂,它已在临床上用于治疗早期ILD患者[13,14,15]。然而,口服NAC在肺组织中的生物利用度有限,并且它对氧自由基的非特异性清除可能会无意中清除具有重要信号作用的ROS[16,17]。这可能会导致机体氧化还原平衡的破坏,从而限制其治疗效果。最近的两项随机对照试验未能观察到NAC单药治疗对ILD患者有显著的生存益处,这表明我们需要更有效、更安全的抗氧化药物来治疗早期ILD[18,19]。
氢气(H₂)由通过共价键紧密连接的两个氢原子组成,是最轻、最小的气体分子[20]。得益于其低密度、强渗透性和快速扩散速度,H₂可以直接到达细胞内产生ROS的线粒体附近[20]。最具细胞毒性的ROS被选择性还原,包括羟基自由基(·OH)和过氧亚硝酸盐(ONOO⁻),且不干扰代谢氧化还原反应[21]。因此,使用这种高效且无害的抗氧化剂治疗许多疾病已成为公认的做法[22,23]。因此,我们认为H₂可能对P-ILD有良好的治疗效果。早期发现并及时治疗P-ILD对于改善天疱疮患者的预后具有重要意义。
2. 结果
2.1. 抗Dsg 1抗体在天疱疮小鼠模型中诱导的间质性肺疾病
通过给BALB/cJGpt小鼠皮下注射具有不同抗Dsg 1/3抗体滴度的血清IgG,成功在HL、LH和HH组中建立了天疱疮小鼠模型(图1)。

图1. 通过皮下注射高滴度抗Dsg 1/3抗体血清IgG建立天疱疮小鼠模型。M显示对小鼠皮肤的影响;HE显示小鼠皮肤的苏木精-伊红染色(显微镜放大倍数为100倍);DIF显示小鼠皮肤的直接免疫荧光染色(荧光显微镜放大倍数为40倍);HL——小鼠皮下注射天疱疮患者血清中高抗Dsg 1抗体/低抗Dsg 3抗体滴度的IgG组;LH——小鼠皮下注射天疱疮患者血清中低抗Dsg 1抗体/高抗Dsg 3抗体滴度的IgG组;HH——小鼠皮下注射天疱疮患者血清中高抗Dsg 1抗体/高抗Dsg 3抗体滴度的IgG组;LL——小鼠皮下注射天疱疮患者血清中低抗Dsg 1抗体/低抗Dsg 3抗体滴度的IgG组;N——小鼠皮下注射正常健康人血清IgG组;NS——小鼠接受皮下注射生理盐水组。IgG沉积(绿色);DAPI,细胞核(蓝色)。
1周后收集各组小鼠的肺组织进行组织病理学检查。苏木精-伊红(HE)染色显示,HL和HH组小鼠的肺组织中存在肺泡间隔增厚、局部肺组织破坏和明显的炎症细胞浸润。相比之下,LH组的炎症反应较轻,仅观察到局部炎症细胞浸润。LL、N和NS组小鼠的肺组织未观察到明显的病理改变。Masson染色显示,HL和HH组小鼠的肺泡腔内有轻微的成纤维细胞增殖,而LH、LL、N和NS组未发现类似情况(图2a)。3周后,与LH、LL、N和NS组相比,HL和HH组小鼠的肺组织中成纤维细胞增殖和胶原纤维沉积更为明显(图2b)。此外,从建模后的天疱疮小鼠获取肺组织样本进行直接免疫荧光分析。结果显示,HL和HH组的肺泡上皮中存在IgG沉积,并且与1周时的沉积情况相比,3周后IgG沉积明显增加。相反,在LH、LL、N和NS组的肺组织中,两个时间点均未检测到IgG沉积(图2c)。
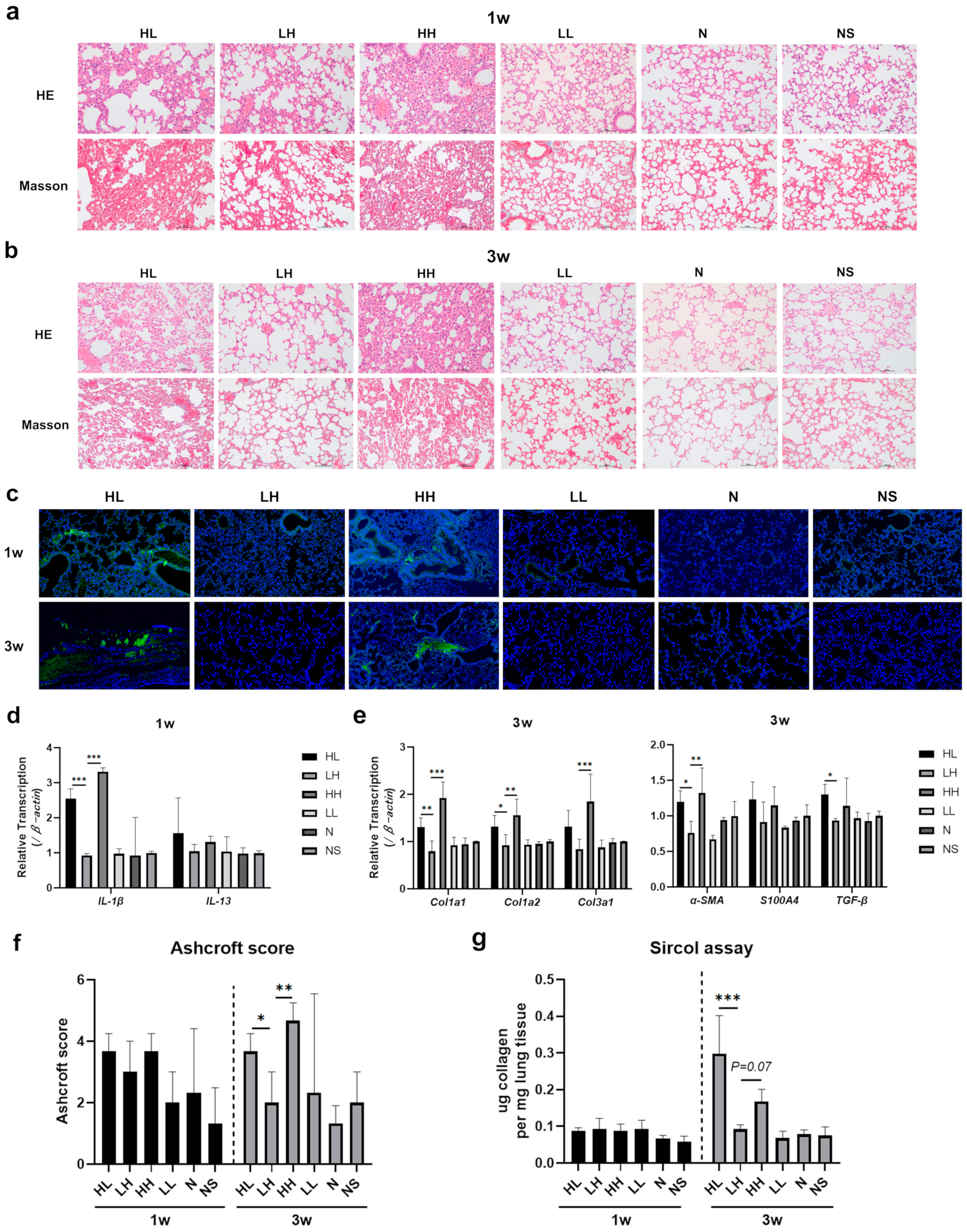
图2. 抗Dsg 1抗体在小鼠中诱导的间质性肺疾病。(a)1周后小鼠肺组织的苏木精-伊红(HE)染色和Masson染色(显微镜放大倍数为100倍);(b)3周后小鼠肺组织的HE染色和Masson染色(显微镜放大倍数为100倍);(c)小鼠肺组织的直接免疫荧光染色(荧光显微镜放大倍数为20倍);(d)采用逆转录-定量聚合酶链式反应(RT-qPCR)检测1周后小鼠肺组织中IL-1β和IL-13基因表达的变化;(e)采用RT-qPCR检测3周后小鼠肺组织中α-SMA、S100A4、转化生长因子-β(TGF-β)、Ⅰ型胶原蛋白α1链(Col1a1)、Ⅰ型胶原蛋白α2链(Col1a2)和Ⅲ型胶原蛋白α1链(Col3a1)基因表达的变化;(f)小鼠肺组织的Ashcroft评分;(g)通过Sircol法检测各组小鼠肺组织中的胶原蛋白含量。IgG沉积(绿色);4',6-二脒基-2-苯基吲哚(DAPI),细胞核(蓝色)。数据采用单因素方差分析结合Bonferroni事后检验进行多重比较。柱状图表示平均值±标准差;* p < 0.05,** p < 0.01,*** p < 0.001。
一致地,RT-qPCR结果显示,1周时HL和HH组中促炎因子IL-1β和IL-13的表达增加,而其他四组的表达没有变化(图2d)。3周后,与LH、LL、N和NS组相比,HL和HH组小鼠肺组织中促纤维化基因(α-SMA、S100A4、TGF-β)和胶原蛋白基因(Col1a1、Col1a2、Col3a1)的表达显著增加(图2e)。采用Ashcroft评分对小鼠肺纤维化进行半定量评估。1周后,任何一组小鼠的肺部均未观察到明显的纤维化。各组之间的Ashcroft评分和Sircol胶原蛋白含量没有显著差异。相反,3周后,HL和HH组的肺纤维化严重程度明显增加(图2f, g)。
这些发现表明,给小鼠皮下注射抗Dsg 1抗体可在1周后引发肺部间质炎症反应,随后在3周时出现肺纤维化。P-ILD小鼠肺部的炎症和纤维化与抗Dsg 1抗体产生的免疫复合物的积累有关。
2.2. 抗Dsg 1抗体诱导小鼠肺部氧化应激增加
氧化应激被认为在ILD的发展中起关键作用。我们对建模后各组小鼠的肺组织冷冻切片进行了ROS荧光染色,发现HL和HH组小鼠肺组织中的ROS水平在建模1周后升高,与其他组相比显著更高(图3a)。然而,建模3周后,各组小鼠肺组织中的ROS水平没有显著差异(图3b)。过氧化氢酶(Cat)、谷胱甘肽过氧化物酶家族(GPx)和超氧化物歧化酶家族(Sods)是清除体内ROS的基因。随后对与ROS代谢相关的基因表达水平进行分析,结果显示,建模1周后,HH组和LH组中与ROS清除相关基因的表达没有统计学差异。然而,与LH组相比,HL组小鼠肺组织中Cat和Sod2基因的表达水平明显升高(图3c)。建模3周后,HL组和LH组在ROS清除相关基因的表达上没有观察到统计学差异。然而,与LH组相比,HH组小鼠肺组织中的Cat、GPx-2和Sod1基因上调,而GPx-1、GPx-3和Sod3基因下调(图3d)。这些发现表明,给小鼠皮下注射抗Dsg 1抗体引发的肺间质炎症可能与抗Dsg 1抗体在肺泡上皮中的沉积所产生的有害作用有关,导致肺组织中ROS水平升高。ROS代谢相关基因表达水平的这种改变可能是导致观察到的ROS水平升高的一个重要因素。
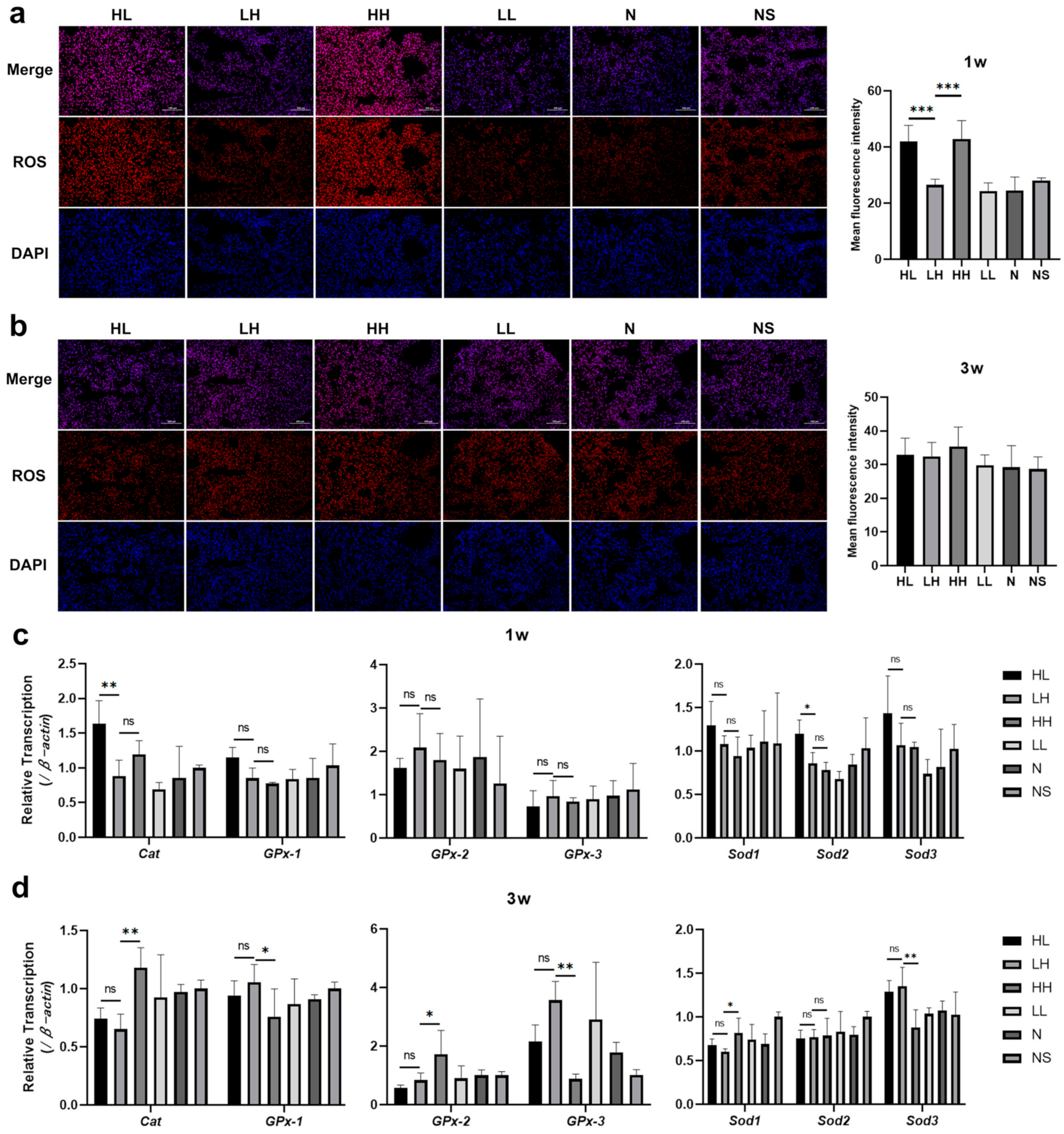
图3. 抗Dsg 1抗体诱导小鼠肺部氧化应激增加。(a)1周后肺组织的ROS荧光染色和平均荧光强度;(b)3周后肺组织中ROS的荧光染色和平均荧光强度;(c)1周时小鼠肺组织中与ROS代谢相关基因表达水平的变化;(d)3周后小鼠肺组织中与ROS代谢相关基因表达水平的变化。1w,天疱疮小鼠模型建立后1周;3w,天疱疮小鼠模型建立后3周;ROS,活性氧(红色);DAPI,细胞核(蓝色)。数据采用单因素方差分析结合Bonferroni事后检验进行多重比较。柱状图表示平均值±标准差;ns——无显著性差异,* p < 0.05,** p < 0.01,*** p < 0.001。
2.3. 氢气改善P-ILD小鼠的间质性肺疾病
为了研究氢分子的治疗潜力,建立了P-ILD小鼠模型。模型组和治疗组的小鼠均出现皮肤糜烂和结痂。组织病理学分析证实成功建立了天疱疮小鼠模型(图4)。
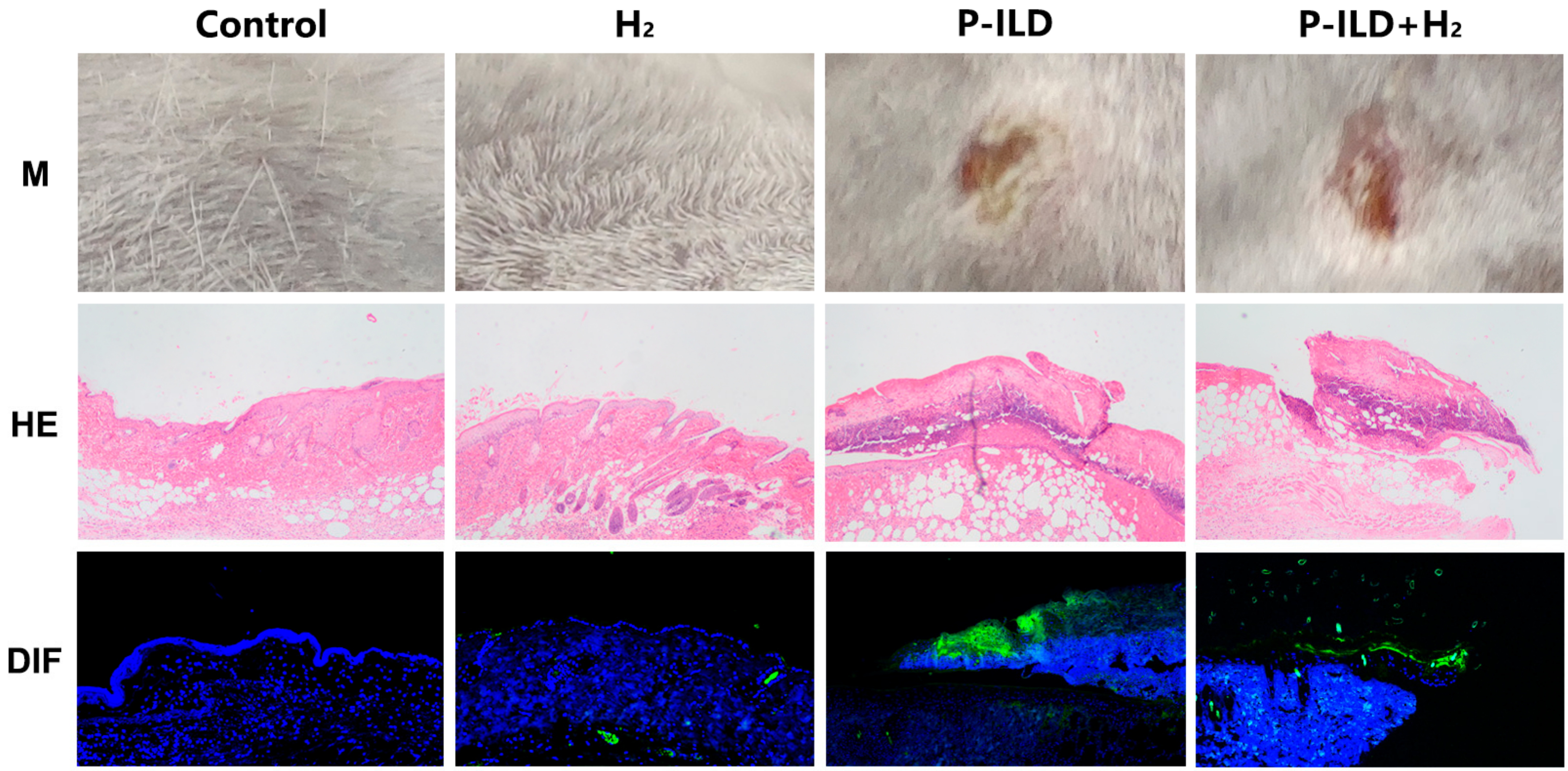
图4. 在模型组和治疗组中成功建立了天疱疮小鼠模型。M显示对小鼠皮肤的影响;HE显示小鼠皮肤的苏木精-伊红染色(显微镜放大倍数为100倍);DIF显示小鼠皮肤的直接免疫荧光染色(荧光显微镜放大倍数为40倍)。IgG沉积(绿色);DAPI,细胞核(蓝色)。
随后,给小鼠分别给予普通水或富氢水,持续1周,之后收集各组小鼠的肺组织进行组织病理学检查。研究显示,模型组小鼠的肺组织受到显著破坏,表现为炎症细胞广泛浸润和明显的炎症反应。相比之下,治疗组的肺部炎症反应与模型组相比明显减轻,肺泡间隔呈中度增厚,炎症细胞浸润减少(图5a)。HE和Masson染色显示,3周后P-ILD小鼠出现明显的肺纤维化改变,表现为肺组织中胶原纤维广泛沉积以及组织间腔的形成,呈现典型的“蜂窝肺”表型(图5b)。给P-ILD小鼠给予氢水显著改善了这些病理改变,仅出现肺泡或支气管壁的轻度至中度增厚,肺泡结构得以保留,无明显紊乱,且胶原沉积减少(图5b)。对1周和3周时从小鼠获取的肺组织样本进行免疫荧光染色,结果显示模型组和治疗组均有IgG沉积。因此,给小鼠引入富氢水并未改变IgG在其肺部的沉积(图5c)。

图5. 氢气改善P-ILD小鼠的间质性肺疾病。(a)氢气抑制P-ILD小鼠的肺部炎症;(b)氢气抑制P-ILD小鼠的肺纤维化;(c)氢气不影响P-ILD小鼠肺部的IgG沉积(荧光显微镜放大倍数为20倍);(d)采用RT-qPCR检测1周后小鼠肺组织中IL-1β和IL-13基因表达的变化;(e)采用RT-qPCR检测3周后小鼠肺组织中S100A4、Col1a1、Col1a2和Col3a1基因表达的变化;(f)小鼠肺组织的Ashcroft评分;(g)通过Sircol法检测各组小鼠肺组织中的胶原蛋白含量。IgG沉积(绿色);DAPI,细胞核(蓝色)。数据采用单因素方差分析结合Bonferroni事后检验进行多重比较。柱状图表示平均值±标准差;ns,无显著性差异,* p < 0.05,** p < 0.01,*** p < 0.001。
随后对与肺部炎症相关的基因进行分析,结果显示,与模型组以及对照组和富氢水组相比,治疗组中IL-1β的表达明显降低。此外,治疗组中IL-13的表达低于模型组,但与对照组和富氢水组的水平相似(图5d)。模型组小鼠肺组织中胶原蛋白基因(Col1a1、Col1a2、Col3a1)和促纤维化基因(S100A4)的表达显著增加,而氢分子可能显著降低了Col1a1、Col3a1和S100A4基因的表达(图5e)。进一步采用Ashcroft评分和Sircol法对各组小鼠的肺纤维化程度进行半定量/定量评估。结果发现,3周时治疗组的胶原蛋白含量与对照组和富氢水组相当,且明显低于模型组(图5f, g)。
这些发现表明,氢分子可能有效地抑制P-ILD小鼠肺部炎症和纤维化的进展。此外,富氢水组与对照组在组织病理学表现、基因表达水平或肺胶原蛋白含量方面未观察到显著差异,这表明氢气对小鼠肺部的生理功能没有不利影响。
2.4. 氢气抑制P-ILD小鼠肺部的氧化应激
口服氢水1周后,对小鼠肺组织冷冻切片进行ROS荧光染色评估,结果显示,与模型组相比,治疗组中的ROS水平显著降低(图6a)。然而,给药3周后,两组之间的ROS水平没有显著差异(图6b)。值得注意的是,对照组和富氢水组在两个时间点的ROS水平相当,这表明氢分子不会干扰体内的生理氧化还原反应。随后对与ROS清除相关的基因表达进行分析,结果显示,1周后治疗组小鼠肺组织中谷胱甘肽过氧化物酶GPx-2基因的表达上调,而模型组小鼠肺组织中的GPx-3基因在3周后下调(图6c, d)。
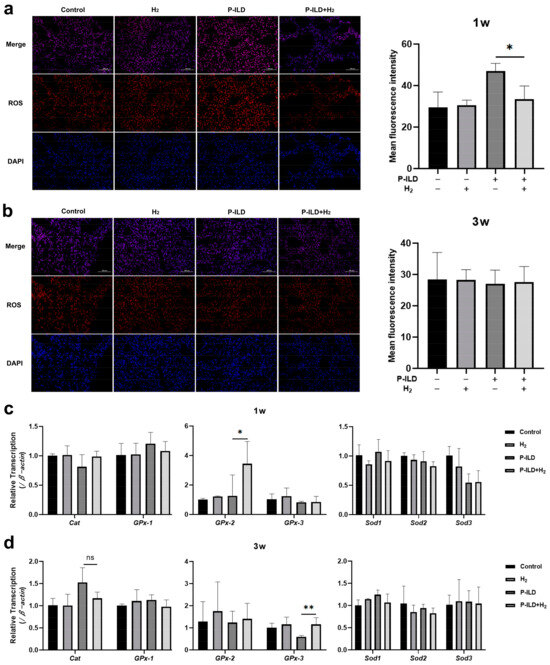
图6. 氢气抑制P-ILD小鼠肺部的氧化应激。(a)1周后肺组织的ROS荧光染色和平均荧光强度;(b)3周后小鼠肺组织中ROS的荧光染色和平均荧光强度;(c)1周时小鼠肺组织中与ROS代谢相关基因表达水平的变化;(d)3周后小鼠肺组织中与ROS代谢相关基因表达水平的变化。1w,天疱疮小鼠模型建立后1周;3w,天疱疮小鼠模型建立后3周;ROS,活性氧(红色);DAPI,细胞核(蓝色)。数据采用单因素方差分析结合Bonferroni事后检验进行多重比较。柱状图表示平均值±标准差;ns——无显著性差异,* p < 0.05,** p < 0.01。
3. 讨论
先前的研究表明,给小鼠皮下注射天疱疮患者的血清IgG后,天疱疮小鼠存在肺间质改变[5]。然而,我们通过给BALB/cJGpt小鼠皮下注射具有不同抗Dsg 1/3抗体滴度的血清IgG进行的研究发现,间质性肺疾病仅在HL和HH组小鼠中发生。LH组小鼠在建模后1周和3周的时间点均未表现出明显的肺间质炎症或纤维化改变。由此可以推断,皮下注射抗Dsg 3抗体不能有效地诱导建立P-ILD小鼠模型,抗Dsg 1抗体可能在诱导小鼠肺部间质炎症改变中起重要作用。此外,小鼠肺组织的免疫荧光染色显示,1周和3周后HL和HH组存在IgG沉积,而LH组未观察到这种沉积。这一观察结果表明,抗Dsg 1抗体可能与小鼠肺上皮组织中的抗原相互作用,导致免疫复合物的形成以及随后肺泡上皮细胞的损伤。
RT-qPCR分析结果表明,1周后P-ILD小鼠肺组织中促炎细胞因子IL-1β和IL-13基因的表达显著上调。随后,3周后促纤维化基因α-SMA、S100A4和TGF-β以及胶原蛋白基因Col1a1、Col1a2和Col3a1的表达明显增加。这些发现表明,IL-1β和IL-13可能在ILD的早期阶段发挥关键作用,可能通过与成纤维细胞表面受体相互作用激活肌成纤维细胞[24]。IL-1β诱导表达ROS的中性粒细胞活化,这可能进一步损伤上皮细胞[25]。IL-1β还促进TGF-β1的产生,TGF-β1是一种重要的促纤维化细胞因子,可触发成纤维细胞增殖和活化[25]。TGF-β1可诱导上皮-间质转化,将肺上皮细胞的表型转化为间质细胞表型,并形成成纤维细胞样上皮细胞,其特征是间质细胞标记蛋白α-SMA的表达增加[24]。IL-13也可以独立于TGF-β1直接激活成纤维细胞[26]。具有间质细胞特征的成纤维细胞和成纤维细胞样上皮细胞分泌大量细胞外基质成分,如胶原蛋白,导致肺中胶原蛋白沉积和纤维化[24]。
ROS水平的升高可归因于体内促氧化和抗氧化机制之间的失衡,导致中和ROS的能力下降[27]。在这里,我们发现P-ILD小鼠肺部的ROS水平升高,这与在博来霉素诱导的ILD小鼠模型和类风湿关节炎相关ILD小鼠模型中观察到的结果一致,进一步证实氧化应激是导致ILD的重要机制[28,29]。与ROS代谢相关的酶,如Cat、GPx和Sods,是抗氧化系统的关键组成部分[10]。P-ILD不同炎症和纤维化阶段中不同组之间与ROS清除相关基因表达的差异表明,抗Dsg 3抗体对抗Dsg 1抗体诱导的氧化应激可能存在潜在影响。此外,ROS代谢相关基因表达水平的改变可能导致ROS水平升高。
迄今为止,许多研究已经证明了氢分子在治疗各种肺部疾病(如急性肺损伤、慢性阻塞性肺疾病、哮喘、肺癌和肺动脉高压)方面的治疗潜力[30,31,32,33,34]。Yasuhiro等人发现,氢分子可以通过降低类风湿关节炎相关ILD小鼠血清中的脂质过氧化物水平和肺组织中的8-羟基脱氧鸟苷水平来抑制炎症反应和纤维化,从而减少肺部炎症因子(如肿瘤坏死因子-α、IL-6和TGF-β)的表达[28]。Li Gao等人发现,氢分子通过减少ROS的产生和抑制TGF-β的表达来逆转上皮-间质转化,从而减少细胞外基质沉积,最终预防肺纤维化的产生[35]。在本研究中,我们使用小鼠模型研究了氢分子对天疱疮相关间质性肺疾病的治疗作用(图7)。一致地,我们的研究结果表明,P-ILD小鼠持续饮用富氢水有效地减轻了氧化应激,从而减少了肺间质炎症,并预防了向肺纤维化的进展。
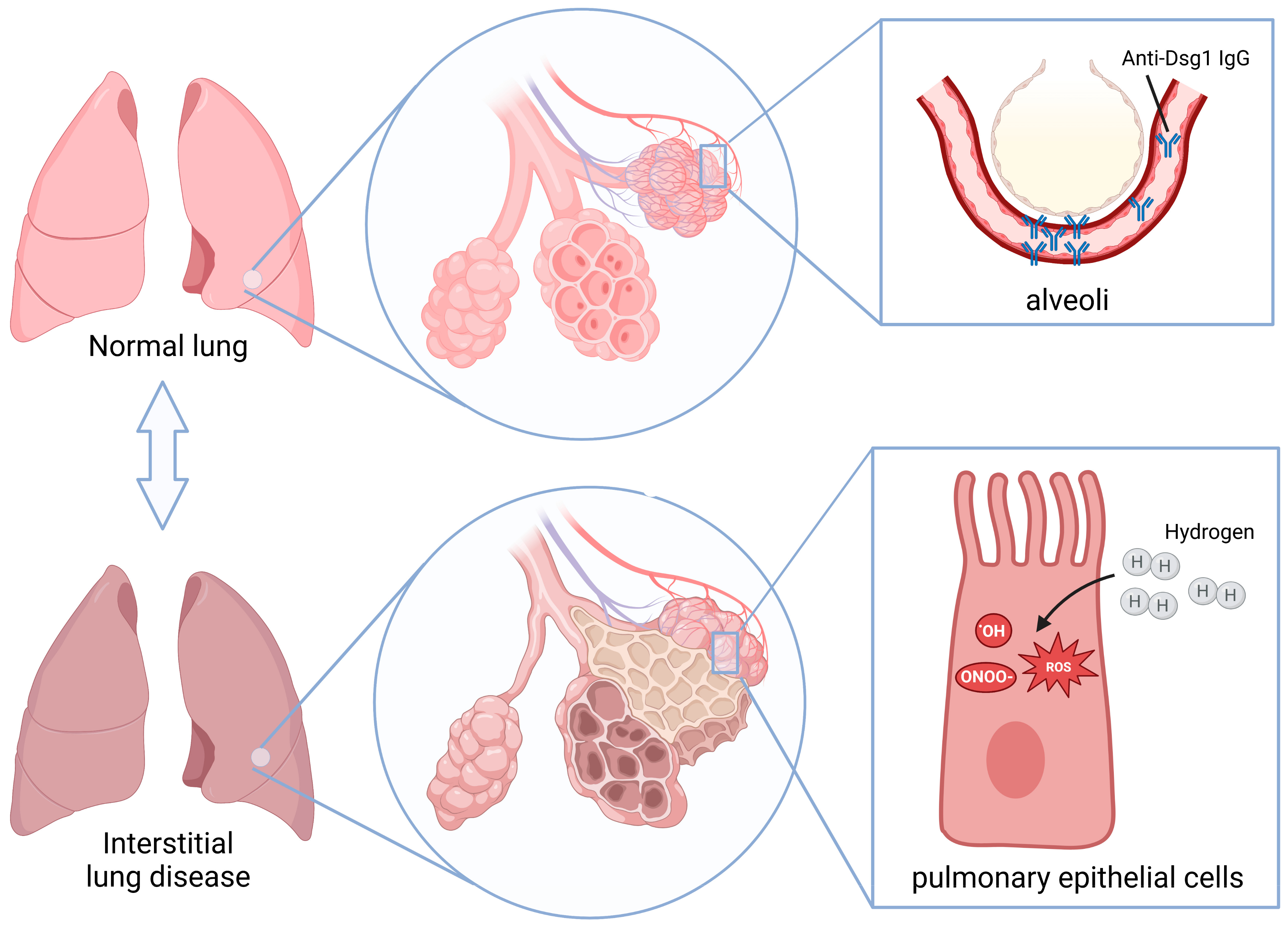
图7. P-ILD的发病机制以及氢气的治疗作用。天疱疮患者血清中的抗Dsg 1抗体靶向肺泡上皮,诱导损伤并引发间质炎症,随后导致肺纤维化。氢气通过抑制P-ILD早期炎症阶段的氧化应激发挥治疗作用。示意图使用BioRender(https://www.biorender.com/)制作。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1485656.html?mobile=1
收藏

