 精选
精选
蛋白相分离凝结物可切割塑造细胞膜
点评:生物学的神奇在于,一切可能的物理现象,都能在生物学领域找到用武之地。声光电磁机械力,毛细现象,表面张力,没有做不到,只有想不到。
Biomolecular condensates mediate bending and scission of endosome membranes | Nature
复杂的分子机器,如ESCRT蛋白复合体,因其切割生物膜的能力而闻名。发现膜也可以通过相分离的凝结物通过线张力力被切断,揭示了一个以前未知的膜分裂机制,这强调了凝结物在细胞组织中的基础作用。
问题提出
在过去几年中,已经很好地确定,在细胞中会发生液-液相分离,形成生物分子凝结物。然而,我们只是刚开始理解这些凝结物在细胞内组织中的多种方式1,2。研究表明,凝结物与膜3,4和其他细胞结构相互作用,包括细胞骨架5。这种凝结物-底物的相互作用被称为“湿润”,并产生了毛细现象——一种物理力,已被证明能驱动细胞内的生理过程3,5。例如,毛细现象控制了蛋白质储存囊泡发展过程中膜的形状4以及包裹不需要的细胞内容物的器官(自噬体)的形成3。凝结物的湿润还可以决定自噬体膜弯曲的方向,从而指定要被打包降解的细胞物质3。尽管这种ATP非依赖性的膜塑形机制具有广泛的潜力,但进一步湿润相关力量在细胞过程中的生物学意义尚未得到很好的描述。
发现
内体是经历复杂膜重塑以形成内部囊泡的膜结合器官。由于我们早期发现植物蛋白FREE1形成凝结物,并且之前的研究表明FREE1在内体发展中扮演关键角色,我们怀疑凝结物在内体重塑事件中发挥作用。然而,因为内部囊泡非常小,光学成像技术无法解析它们形成过程中涉及的事件。为了绕过这个限制并探究凝结物在内体重塑中的作用,我们采用了几种方法:遗传工程改造形成凝结物的蛋白质;体外重建凝结物-膜相互作用;计算机模拟和数学建模预测凝结物介导的膜分裂事件;以及植物遗传学来评估分裂机制在植物发育期间的生理相关性(图1)。
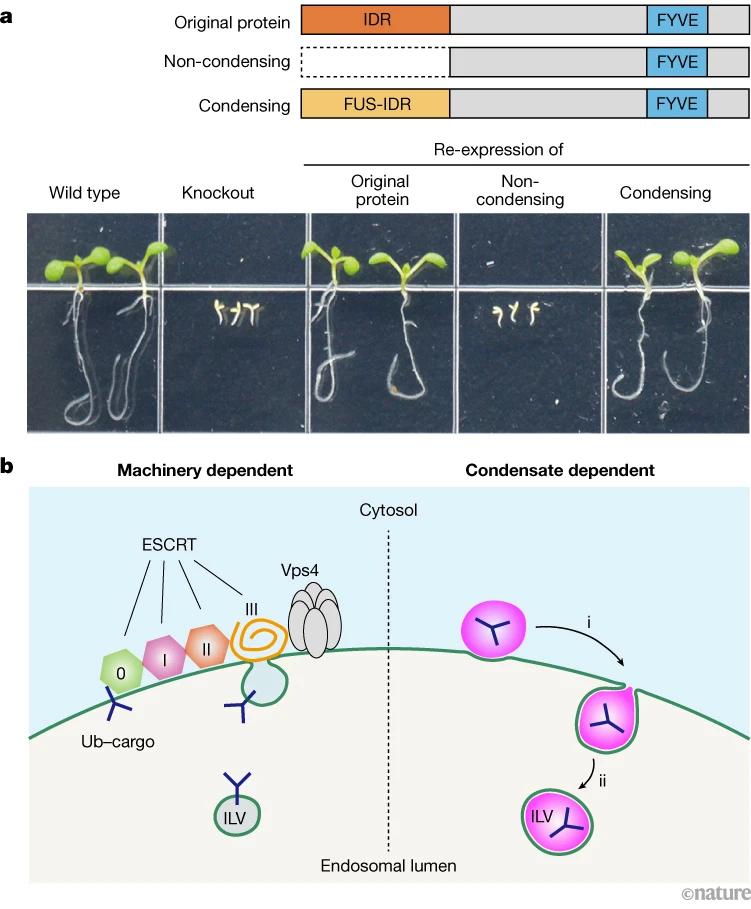
图1 | 凝结物介导膜分裂,因此对植物生存至关重要。a,凝结物控制存活能力。顶部,正常和基因工程改造的FREE1蛋白示意图:原始的,凝结蛋白;一个缺乏负责凝结的区域的版本;以及通过添加FUS–IDR序列恢复凝结物形成的人工蛋白。IDR,内在无序区域。FYVE域锚定到细胞膜上。底部,表达FREE1变体(包括完全敲除FREE1)对拟南芥植物存活的影响。b,左侧,传统分裂:复杂的多组分蛋白机器(包括ESCRT蛋白复合体)在膜上组装(绿色),驱动膜弯曲和分裂。ILV,内部囊泡;蓝色Y形,泛素化货物。右侧,凝结物介导的分裂:凝结物(洋红色)湿润膜并驱动膜弯曲(i)和分裂(ii)。版权归王等人所有/自然(CC BY 4.0)
我们的突破来自于我们在缺乏标准分裂机制蛋白质的情况下,观察微米大小的、类似内体的囊泡和FREE1蛋白的凝结物,并观察到充满FREE1凝结物的高度移动的自由移动的内部囊泡的形成。这一激动人心的结果展示了凝结物可以直接切割膜,并暗示了一个以前未知的分裂机制。计算机模拟和数学建模揭示,凝结物可以通过弯曲和切断膜有效地介导囊泡形成,这是通过线张力力实现的。这种自由能惩罚与通过湿润形成的凝结物边缘的存在有关,并通过分裂消除。这一发现表明,线张力力在一系列与相分离和凝结物形成相关的细胞膜分裂事件中发挥关键作用。
影响
我们的结果为膜和凝结物生物学提供了新的视角,并强调了它们的相互作用如何在细胞组织中引发显著变化。虽然我们发现凝结物可以介导内体中的膜重塑和分裂,但推动内体塑形的基本材料属性导致了一种几乎肯定在其他膜运输过程中涉及的普遍机制。对这些塑形动力学和物理参数的描述应该能够详细理解其他生理重要过程中多样的凝结介导的膜形态,如自噬体3的形成和蛋白质储存囊泡4。探索凝结物形成在膜重塑中的角色也可能揭示复杂蛋白机器如ESCRT复合体是如何进化的。—罗兰德·L·克诺尔在德国科隆大学,科隆,德国,夏风方在北京清华大学,北京,中国。
专家意见
我发现这篇手稿有趣且与理解之前未被充分重视的相分离蛋白在膜变形中的角色相关。它意味着相分离蛋白可以在没有货物膜蛋白甚至已知在内体分拣中弯曲膜的晚期作用ESCRT蛋白存在的情况下诱导多囊泡内体的囊泡化。—玛丽莎·奥特吉在美国威斯康星大学麦迪逊分校,麦迪逊,威斯康星州。
文章背后
我们的团队使用非常不同的工具独立获得了有趣的实验结果,这促使我们通过电子邮件取得联系。X.F.发现FREE1的凝结对其体内功能是必要且充分的,并且还观察到了FREE1凝结物与内体膜之间的相互作用。R.L.K.的研究—无论是在体外重组实验还是体内—都提供了互补的结果,讨论促成了与理论家的高效合作。在一个跨学科团队中开发一个整体且机制全新的分裂概念是一个令人兴奋和刺激的经历。最终,这篇论文是八个核心研究小组的专业知识和开放性的产物。该项目强调了在尖端研究中合作、开放和建设性关系的重要性。— R.L.K. 和 X.F.
来自编辑
尽管这项研究因其对细胞运输过程的见解而具有价值,但它尤其值得注意的是其真正的多学科性质,它将理论建模和植物生物学等研究领域结合在一起。— 《自然》编辑团队
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1458233.html?mobile=1
收藏

