 精选
精选
葡萄糖敏感型胰岛素在降低低血糖风险方面的研究
摘要
糖尿病治疗中,胰岛素疗法引起的低血糖(血糖过低)风险构成了主要挑战1,2。必须调整胰岛素剂量以确保血糖值处于正常范围内,但由于多种因素,如饮食的性质和时间、运动、感染以及个体对胰岛素敏感性的变化,使得匹配胰岛素剂量与波动的血糖水平变得困难。即使是稍微高于所需剂量的胰岛素也可能导致低血糖事件,这可能从不适到生命威胁不等。因此,长期以来的目标一直是设计一种葡萄糖敏感型胰岛素,能够根据周围葡萄糖水平以可逆的方式自动调节其生物活性,从而最终实现更好的血糖控制,同时降低低血糖的风险3。在这里,我们报告了NNC2215的设计及其特性,这是一种胰岛素结合物,其生物活性可逆地响应于与糖尿病相关的葡萄糖范围,这一点已在体外和体内得到证明。通过将一个葡萄糖结合的大环4和一个葡糖苷连接到胰岛素上,工程化了NNC2215,从而引入了一个开关,该开关可以根据葡萄糖浓度打开和关闭,从而使胰岛素在活性和非活性构象之间达到平衡。当葡萄糖浓度从3增加到20 mM时,NNC2215对胰岛素受体的亲和力增加了3.2倍。在动物研究中,NNC2215的葡萄糖敏感生物活性被证明可以保护免受低血糖的影响,同时部分覆盖了葡萄糖波动。
主文
使用胰岛素控制糖尿病伴随着引入低血糖的风险,即血糖值低于3.9 mM(参考文献1,2)。这是由于许多因素导致血糖波动难以预测,例如饮食的性质和时间、运动、感染和个体对胰岛素敏感性的变化。因此,糖尿病患者必须调整他们每天的胰岛素剂量(包括基础和餐前胰岛素),以考虑这些因素。然而,为了避免低血糖事件,尤其是在夜间可能会很危险,许多人选择保守的胰岛素剂量。由于害怕低血糖而妥协胰岛素剂量,随后导致血糖控制不佳,从而增加了长期高血糖引发并发症的风险。为了在不增加低血糖风险的情况下促进改善血糖控制,自20世纪70年代以来,人们一直在追求设计一种能够根据变化的血糖水平修改其生物活性的胰岛素的想法3。尽管有许多出版物和专利,但到目前为止,没有一种机制被证明能够解决这个问题,以至于它可以应用于治疗糖尿病5,6,7,8,9,10,11。该领域的大多数论文描述了聚合物系统,这些系统可以根据血糖波动从皮下(s.c.)储库释放胰岛素,但这样的系统受到延迟的葡萄糖向皮下扩散的限制,以及释放的胰岛素进入血液循环的延迟。此外,这样的系统不可逆地释放胰岛素,意味着一旦胰岛素从储库释放,它就不再是葡萄糖敏感的了。一个更好的方法似乎是让胰岛素本身具备葡萄糖响应特性,使其能够以可逆的方式响应葡萄糖。值得注意的是,葡萄糖值在一个狭窄的范围内变化(在糖尿病患者中大约从2到20–30 mM),因此为了葡萄糖敏感型胰岛素产生影响,必须在这一葡萄糖范围内获得相当陡峭的胰岛素生物活性变化。为了达到这种对葡萄糖的敏感性,将需要一个化学基团,它能够在这一葡萄糖范围内以最大灵敏度与葡萄糖结合。一个系统基于寡聚岩藻糖/甘露糖胰岛素结合物,它们可以在葡萄糖敏感地与甘露糖受体结合与胰岛素与胰岛素受体结合之间的平衡中从循环中清除12,但这并没有超过I期临床试验就值得进一步追求13。发现葡萄糖反应是浅的,甘露糖受体的高清除率导致非常低的体内效能,这意味着最终需要禁止高的胰岛素剂量。
多年来,人们一直在探索将葡萄糖敏感开关引入胰岛素分子中的概念1,14,15,16。一个开关涉及在胰岛素上双重结合一个葡萄糖结合基序和一个结合伴侣,这样在低葡萄糖浓度下,开关会诱导一个闭合的低活性状态,随着葡萄糖浓度的增加,平衡会向一个开放的高活性状态倾斜。因此,葡萄糖结合基序必须在糖尿病患者体内出现的狭窄葡萄糖范围(约2到20–30 mM)内同时对葡萄糖和结合伴侣具有亲和力。此外,开关的两个组成部分必须以某种方式连接到胰岛素上,以确保在闭合状态下,通过改变胰岛素构象和/或阻断胰岛素的受体结合表面,降低胰岛素的生物活性。这个想法已经通过使用硼酸酯作为葡萄糖结合剂来追求,但迄今为止,此类设计的葡萄糖敏感性对于药理用途来说还太有限。之前关于与胰岛素一起工作的碳水化合物敏感开关的最佳示例显示了对高浓度果糖(50 mM)的敏感性,但该化合物对葡萄糖不敏感15。最近发现的一种大环提供了另一种葡萄糖结合元素的选择4。设计这种大环是为了提供一个葡萄糖结合腔室,该腔室确保对葡萄糖的相关亲和力以及相对于其他碳水化合物和可能干扰的小分子的选择性。在这里,我们描述了NNC2215的分子设计,这是一种通过在B29Lys处引入大环并在B1Phe处通过短连接子引入O1-葡糖苷而具有葡萄糖开关的胰岛素(图1a)。这种葡萄糖结合剂、葡糖苷、连接子和偶联位点的组合被证明赋予了NNC2215葡萄糖敏感的生物活性,当葡萄糖从0增加到20 mM时,胰岛素受体结合亲和力增加了12.5倍,从3增加到20 mM时增加了3.2倍。此外,NNC2215被证明在体内对葡萄糖敏感,能够减轻猪的低血糖,并减少糖尿病大鼠口服葡萄糖耐量试验(GTTs)期间的葡萄糖波动。
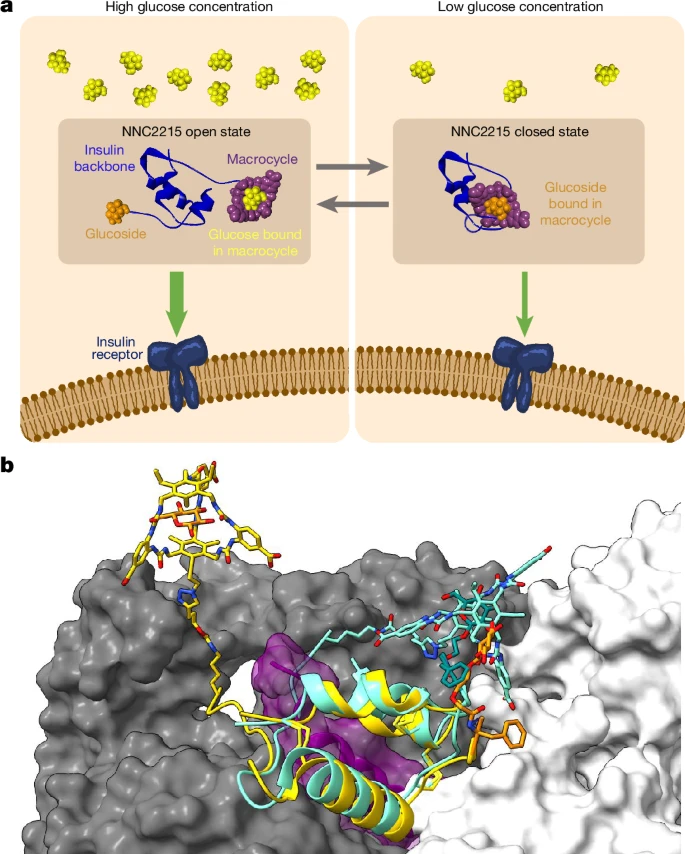
图1:NNC2215的功能原理和3D模型。
a,NNC2215是一个具有葡萄糖敏感开关的胰岛素分子。随着葡萄糖浓度的增加,开关平衡朝向开放状态,NNC2215的胰岛素受体亲和力高,从而有助于防止高血糖。当葡萄糖水平下降时,开关平衡朝向闭合状态,干扰NNC2215与胰岛素受体的结合能力,从而有助于防止低血糖。胰岛素主链、大环、葡糖苷和葡萄糖模型是使用BIOVIA Discovery Studio(达索系统公司)制备的。b,NNC2215在开放和闭合形式的3D模型。胰岛素主链显示为带状,开关元件(葡糖苷和大环)显示为棍状表示。来自PDB 6PXV的胰岛素受体链A和C显示为白色和灰色的表面表示。NNC2215的开放形式(黄色)有自由的葡萄糖(橙色;左上角)绑定在大环上B29处。NNC2215开放形式的B1–葡糖苷显示为橙色(右侧)。NNC2215的闭合形式(青色)有葡糖苷绑定在大环中,并显示胰岛素B链的C端部分(包括开关)与胰岛素受体的C端域(α-CT,紫色)之间的冲突。
化学
通过在三唑形成过程中将带有叠氮丙基连接子的大环衍生物与B29Lys Nε氨基组连接,将大环4(图2a)偶联到desB30人胰岛素上17。通过这种方式,避免了需要正交地处理三个羧酸之一的需求,这对于连接到大环支柱上的任何一个COOH基团来说是必需的。最初报道的大环使用的树枝状聚合物在与胰岛素-大环偶联物一起工作时被发现是不必要的。除了B29处的大环外,通过在pH 7.5下使用相应的溴代三氟甲基磺酸苯酯,将带有短连接子的O1-葡糖苷附着到B链N端氨基组(PheB1)上(参考文献18)。葡糖苷以其O-全乙酰保护的建筑块形式使用,并通过温和皂化从胰岛素偶联物中去除了乙酰基。通过省略葡糖苷步骤,以类似NNC2215的方式制备了仅在B29处有大环的对照化合物NNC2215a。通过液相色谱-质谱联用(LC–MS)分析经过胰蛋白酶处理然后进行三(2-羧乙基)膦(TCEP)处理的样品,记录了胰岛素上的偶联位点。胰蛋白酶处理切割了NNC2215的B22Arg之后,释放了B23–B29片段,TCEP切断了NNC2215的二硫键,分离出A和B链。LC–MS分析所得的分析混合物显示大环附着在B23–B29片段上,葡糖苷附着在B1–B22片段上,以及游离的A链(化学细节和LC–MS光谱提供在补充信息和补充数据中)。
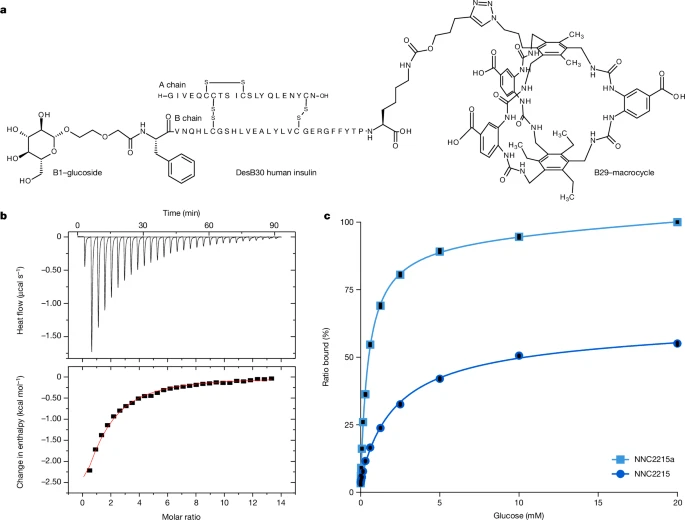
图2:NNC2215的化学结构和葡萄糖结合特性
a,NNC2215在B29和B1分别连接大环和葡糖苷。对照化合物NNC2215a只在B29连接了大环。使用BIOVIA Draw(Dassault Systèmes)准备。b,通过等温滴定量热法(ITC)测量大环与葡萄糖的结合亲和力。通过将数据拟合到1:1结合模型,获得了98 µM的Kd值。c,利用质谱(MS)分析研究NNC2215对葡萄糖的结合。如预期的那样,双连接物中葡糖苷的存在改变了NNC2215相对于自由大环的葡萄糖亲和力,使得NNC2215与葡萄糖结合的Kd为2.1 mM,这在糖尿病的背景下被认为是严重的低血糖。对照化合物NNC2215a只包含大环,通过质谱发现其与葡萄糖结合的Kd为0.5 mM。可以预见,将大环连接到胰岛素上会适度改变其相对于自由大环的葡萄糖亲和力。同样地,将白蛋白结合部分连接到胰岛素或其他蛋白质上也通常会改变它们相对于自由配体的亲和力,这可能是由于连接部分与邻近蛋白质及其侧链的弱相互作用所致。总体而言,通过质谱测得的NNC2215和对照化合物NNC2215a的葡萄糖亲和力比自由大环分别减弱了约20倍和5倍,从而证明了合适的开关动态已经实现。NNC2215和NNC2215a响应0至20 mM葡萄糖的葡萄糖结合和同时发生的开关打开可以通过图2c中的质谱结合图进行跟踪。结合曲线的最陡部分与被认为是低血糖的情况一致,即葡萄糖浓度低于4 mM。尽管质谱数据是在气相(质谱真空)中获得的,但这些数据通常反映了从中取样的溶液中分子的相互作用19。
NNC2215–胰岛素受体的3D模型
通过将NNC2215的模型叠加到胰岛素-胰岛素受体复合物的蛋白质数据库(PDB)6PXV(参考文献20,21,22,23,24)上来构建结构模型,以示范其功能。如图1b所示,当开关闭合时,胰岛素B链的C端部分与胰岛素受体的C端结构域(称为α-CT)之间发生冲突。α-CT结构域是胰岛素结合的关键部分25。我们认为,这种空间位阻是观察到的NNC2215在低葡萄糖浓度下(即开关主要处于闭合构象时)受体亲和力降低的驱动力。相比之下,开放状态的模型与能够与受体结合的完全活性胰岛素构象兼容。
体外研究
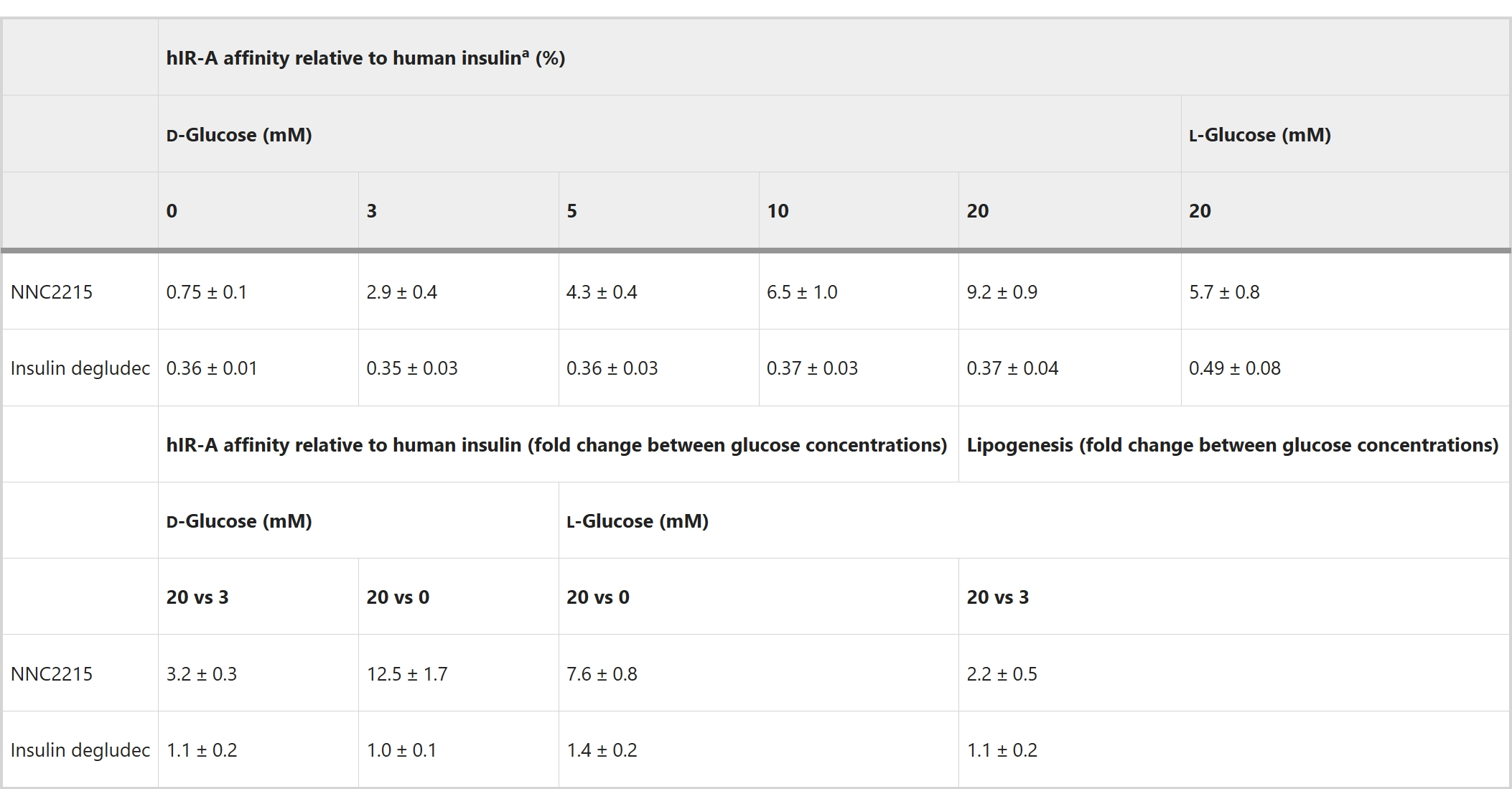
为了研究NNC2215与胰岛素受体的葡萄糖敏感相互作用,进行了有无不同葡萄糖浓度下的胰岛素受体结合研究,其中比较了人胰岛素受体A(hIR-A)与NNC2215、人胰岛素和胰岛素德谷列汀(一种酰化的长效基础胰岛素)的结合(图3a–c)。独特之处在于,可以看到随着葡萄糖浓度的增加,NNC2215的结合曲线受到影响(图3a)。相对于hIR-A对人胰岛素的亲和力,NNC2215的亲和力从0增加到20 mM葡萄糖时的0.75%增加到2.9%, 4.3%, 6.5%和9.2%,而胰岛素德谷列汀相对于人胰岛素具有恒定的亲和力(表1和图3d)。从0到20 mM葡萄糖,hIR-A对NNC2215的亲和力增加了12.5倍,而从3到20 mM葡萄糖则增加了3.2倍,这是糖尿病患者中可观察到的浓度范围(表1)。值得注意的是,这个增加的hIR-A亲和力是在存在1.5%白蛋白的情况下确定的,这是该测定中能容忍的最大浓度(与人体内大约4%的白蛋白相比)。在没有白蛋白的情况下,从0到20 mM葡萄糖,hIR-A对NNC2215的亲和力增加减少到6.8倍(图扩展数据图1a)。此外,观察到在存在1.5%白蛋白的情况下,对于仅含大环的对照化合物NNC2215a,hIR-A的亲和力也有小幅度的增加(从0到20 mM葡萄糖增加了2.4倍),这也表明了弱的白蛋白结合效果(图扩展数据图1b)。
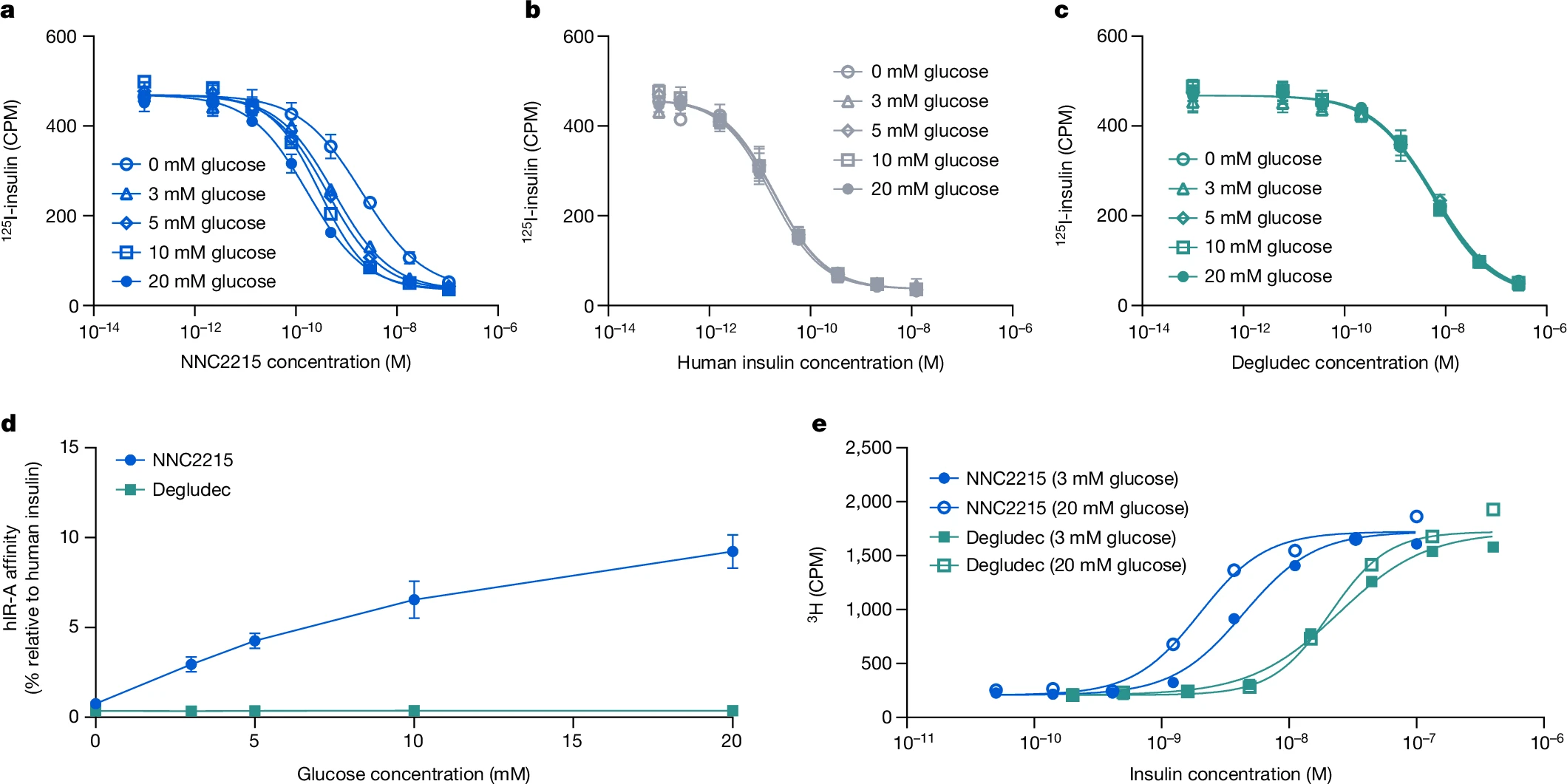
图3:NNC2215的hIR-A亲和力与葡萄糖浓度的关系
a–c,在0至20 mM d-葡萄糖存在下,NNC2215(a)、人类胰岛素(b)和胰岛素德谷(c)从hIR-A置换125I-胰岛素的代表性曲线。数据为均值±标准差。n=3次技术重复。对于某些数据点,标准差误差条小于符号大小。d,在不同葡萄糖浓度下,NNC2215和胰岛素德谷相对于人类胰岛素的hIR-A亲和力。数据为均值±标准差。n=3次独立重复。对于某些数据点,标准差误差条小于符号大小。e,在低(3 mM)和高(20 mM)l-葡萄糖浓度下,NNC2215和胰岛素德谷剂量依赖性地将3H-d-葡萄糖转化为脂质的代表性曲线。数据为均值。n=2次技术重复。CPM,每分钟计数。
表1 NNC2215活性对hIR-A结合和下游代谢反应的葡萄糖敏感性
与胰岛素样生长因子1受体(IGF-1R)相比,对胰岛素受体的特异性非常重要,以避免任何增加的促有丝分裂活性。在有无20 mM d-葡萄糖的情况下测量了IGF-1R的结合(扩展数据图1c)。相对于人类胰岛素,在0和20 mM葡萄糖时,NNC2215的IGF-1R亲和力约为其胰岛素受体亲和力的10%(扩展数据图1a、d)。因此,与人类胰岛素相比,NNC2215对胰岛素受体的特异性高于对IGF-1R的特异性。
在表达克隆人类胰岛素受体的CHO-hIR细胞中检查了NNC2215激活胰岛素信号通路的能力。获得了NNC2215刺激人类胰岛素受体酪氨酸磷酸化的完整剂量-反应曲线,其效能为57.1%(95%置信区间(CI)=41.7–78.1)。通过AKT和ERK激活的下游信号传导相对于人类胰岛素具有相同的平衡,效能分别为68.4%(95% CI=55.7–84.0)和48.0%(95% CI=34.4–66.9)(扩展数据图1e–g)。
NNC2215的葡萄糖敏感性反映在大鼠脂肪细胞中测量的体外代谢终点上。在利用生理活性d-葡萄糖的对映体,即l-葡萄糖的优势下,我们测量了大鼠脂肪细胞中的葡萄糖摄取和并入脂质的过程,即生脂作用。使用l-葡萄糖的理由是,至少在某些条件下,细胞不会以可饱和的方式催化或摄取l-葡萄糖,除了一些革兰氏阴性菌和植物外。在对照实验中,l-葡萄糖不与d-葡萄糖竞争进入脂肪细胞的摄取,但l-葡萄糖与NNC2215的非手性大环结合的亲和力与d-葡萄糖相同。在hIR-A结合测定中,l-葡萄糖在激活NNC2215方面的效力不如d-葡萄糖。在0至20 mM之间观察到的NNC2215结合亲和力的增加对于l-葡萄糖是7.6倍,而对于d-葡萄糖是12.5倍。因此,用l-葡萄糖测得的代谢反应将低于用d-葡萄糖的效果。生脂作用测量显示,在低(3 mM)与高(20 mM)l-葡萄糖下,由NNC2215诱导的3H-d-葡萄糖转化为脂质的半最大效应剂量差异为2.2倍(图3e)。这证明了NNC2215在体外关于胰岛素诱导的代谢反应的葡萄糖敏感性。使用胰岛素德谷时,生脂作用对l-葡萄糖无响应。
体内药理学
为了研究NNC2215在体内的葡萄糖浓度敏感的激活和失活,我们开发了三种不同的方案。最简单的方案是,大鼠静脉注射NNC2215后给予l-葡萄糖,从而触发NNC2215,导致d-葡萄糖降低,且这种降低依赖于l-葡萄糖的剂量。此外,在猪中通过急性降低血浆葡萄糖来研究NNC2215在低葡萄糖下的失活,与非葡萄糖敏感胰岛素(胰岛素德谷)引起的血糖下降进行比较。最后,在糖尿病大鼠中进行葡萄糖挑战期间,研究了NNC2215在类似餐后葡萄糖波动期间的活化。由于类似的药代动力学特性,胰岛素德谷被用作静脉注射大鼠研究的对照组和猪研究中的比较组(扩展数据表1a),而在大鼠葡萄糖挑战研究中,人类胰岛素被用作对照组。通过给大鼠静脉注射确定NNC2215的体内半衰期为1.2小时,给猪静脉注射确定为1.3小时(扩展数据表1a)。
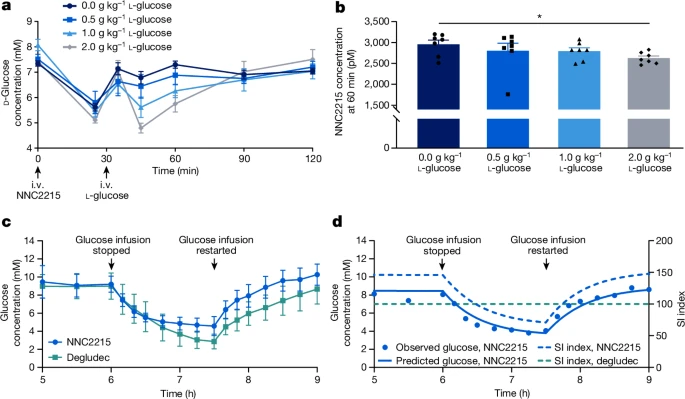
图4: NNC2215在体内的葡萄糖浓度敏感性激活和失活
图4a通过静脉注射不同剂量的NNC2215并随后给予l-葡萄糖(包括载体)来触发NNC2215的胰岛素作用,导致d-葡萄糖降低。数据为每组7只动物的平均值±标准误。
图4b通过测量60分钟后的NNC2215浓度评估NNC2215的葡萄糖剂量依赖性清除。数据为每组7只动物的平均值±标准误。统计分析采用双侧学生t检验;*P=0.013。
图4c在停止并重新启动恒定静脉输注葡萄糖(6毫克/千克/分钟)后,持续静脉输注NNC2215(1.86皮摩尔/千克/分钟)或胰岛素德谷列(0.9皮摩尔/千克/分钟)期间,LYD猪的代表性血糖轮廓。数据为每组7只(NNC2215)和8只(胰岛素德谷列)猪的平均值±标准差。
图4d对一只接受1.72皮摩尔/千克/分钟NNC2215剂量的LYD猪进行药代动力学/药效学建模的结果。SI,胰岛素敏感性指数。
低血糖研究在LYD猪中
为了评估健康Landrace–Yorkshire–Duroc(LYD)猪中NNC2215的体内活性,并基本上消除d-葡萄糖波动对内源性激素释放的影响,使用了生长抑素输注来抑制胰高血糖素和胰岛素的分泌。此外,该研究在不同的输注速率下,伴随胰高血糖素替代和恒定葡萄糖输注,进行了NNC2215与胰岛素德谷列的比较。5小时输注后,当达到胰岛素(德谷列或NNC2215)和葡萄糖的近似稳态血浆浓度时,停止d-葡萄糖输注(见图4c)。此程序导致血浆d-葡萄糖下降,由持续的胰岛素输注促进,但与胰岛素德谷列相比,NNC2215的下降较少,从而显示出胰岛素生物活性的葡萄糖敏感切换。使用不同的胰岛素输注速率评估完整数据集表明,在停止葡萄糖输注后,对于任何给定的血浆葡萄糖浓度,NNC2215的血浆葡萄糖下降幅度小于胰岛素德谷列(扩展数据图3)。在C肽反应中的大标准差是由于一个在所有六天实验期间C肽水平较高的动物引起的(扩展数据图3d)。省略这个动物的数据并不改变关于葡萄糖敏感性的结论(扩展数据图3c)。图4c中显示了两个代表性组的数据,其中葡萄糖在使用NNC2215时下降到约4.5毫摩尔/升,而在使用胰岛素德谷列时下降到约3毫摩尔/升,从而证明了NNC2215对抗低血糖的保护作用。
药代动力学/药效学模型
通过对猪的药效学数据应用最小模型进行分析,该模型以定量方式描述了葡萄糖动力学和胰岛素活性(补充信息和扩展数据图5a)。结合药代动力学模型(补充信息和扩展数据表1b),最小模型用于量化NNC2215随血浆葡萄糖变化的胰岛素活性变化。通过对一只接受1.72皮摩尔/千克/分钟NNC2215剂量的LYD猪的葡萄糖数据进行拟合,得到了最佳拟合(图4d)。对于这只猪,当停止葡萄糖输注时,血浆葡萄糖从8.5毫摩尔/升降至3.8毫摩尔/升,SI指数从140%降至70%,表明在相关葡萄糖范围内NNC2215激活的显著动态范围。对于胰岛素德谷列,SI指数始终为100%,如图4d中的水平虚线所示。模型表明,在3至15毫摩尔/升葡萄糖范围内,血浆葡萄糖与SI指数之间的关系是线性的,斜率为每毫摩尔/升葡萄糖14.6%(扩展数据图5b)。
在STZ-糖尿病大鼠中的葡萄糖耐受性
胰岛素缺乏的链脲佐菌素(STZ)糖尿病大鼠被用来在不干扰内源性胰岛素释放的情况下,通过静脉GTT研究葡萄糖诱导的NNC2215激活。隔夜禁食的大鼠通过静脉以三种不同的恒定摩尔速率输注NNC2215或人胰岛素,以将血浆葡萄糖从≥15毫摩尔/升降至预定目标5.7毫摩尔/升。当葡萄糖输注速率稳定时,进行GTT,通过在个体稳定状态葡萄糖输注速率的基础上额外输注25毫克/千克/分钟的葡萄糖60分钟(图5a),并记录结果。
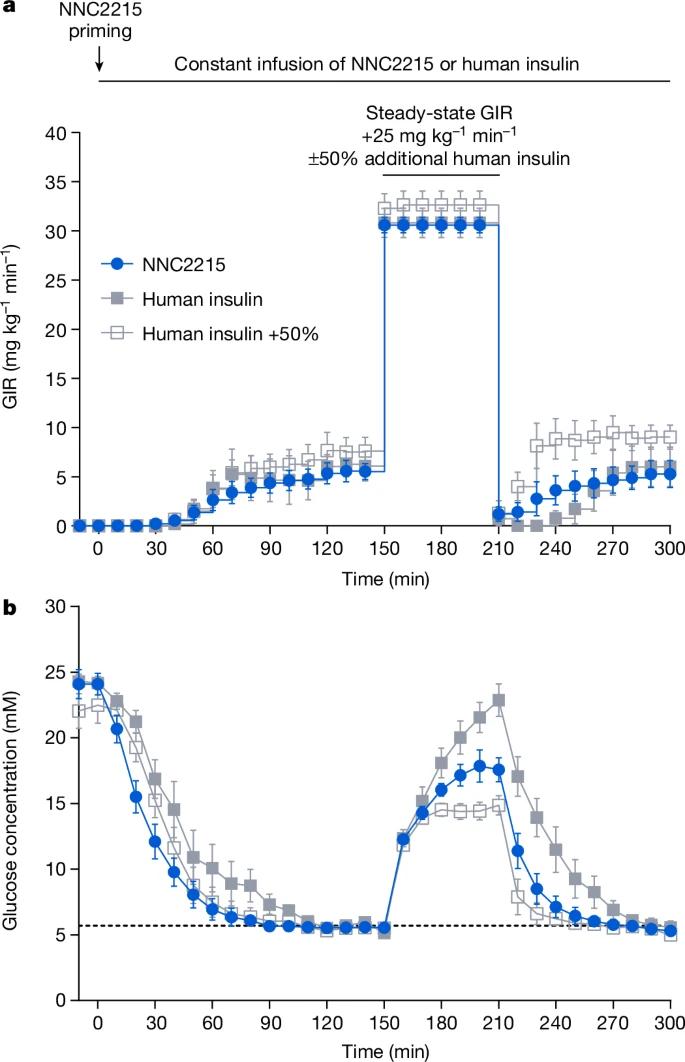
图5:链脲佐菌素糖尿病大鼠中NNC2215在葡萄糖耐量测试(GTT)期间的葡萄糖诱导激活。
a,b,在接受静脉输注NNC2215(84 pmol kg⁻¹ min⁻¹)、人胰岛素(20 pmol kg⁻¹ min⁻¹)或人胰岛素(20 pmol kg⁻¹ min⁻¹)加上GTT期间额外10 pmol kg⁻¹ min⁻¹(+50%)的链脲佐菌素糖尿病大鼠中,GTT前(0–150分钟)、GTT期间(150–210分钟)和GTT后(210–300分钟)的葡萄糖输注率(GIR)(a)和血浆葡萄糖(b)曲线。数据表示为平均值±标准误,n=5(NNC2215和人胰岛素)和n=7(人胰岛素+50%)大鼠。
图5显示了在GTT之前具有相似稳态葡萄糖输注率(即相似的胰岛素效应)的STZ糖尿病大鼠的数据子集。如图5b所示,在GTT期间,与人类胰岛素组相比,NNC2215组的血浆葡萄糖增加大约减少了20%(平均值±标准误,18.3±1.1对比22.9±1.3 mM,P<0.02),表明在高葡萄糖浓度下NNC2215的胰岛素效应更大,而胰岛素暴露量没有变化。为了量化50%额外人类胰岛素在GTT期间能减少多少最大血浆葡萄糖浓度,另一组大鼠在其恒定输注率的基础上给予了50%的额外人类胰岛素,即在GTT期间为20+10 pmol kg⁻¹ min⁻¹。与等摩尔输注率的人类胰岛素相比,50%额外人类胰岛素导致的最大血浆葡萄糖浓度显著降低(约34%)(平均值±标准误,15.1±0.7对比22.9±1.3 mM,P<0.0002),并且与NNC2215相比,最大血浆葡萄糖也倾向于进一步降低(平均值±标准误,15.1±0.7对比18.3±1.1 mM,P=0.08)(图5b)。
对完整数据集的分析显示,在不同胰岛素剂量测试中,由NNC2215和50%额外人类胰岛素引起的最大血浆葡萄糖浓度降低与人胰岛素在等摩尔输注率下的降低相当。在GTT期间,NNC2215的葡萄糖诱导增加的胰岛素活性估计相当于人类胰岛素剂量约30%的增加(扩展数据图6)。
讨论
胰岛素配备了一个对葡萄糖敏感的开关,该开关由与LysB29结合的大环和通过短链与B1Phe结合的O1-糖苷组成。使用质谱分析评估了NNC2215与葡萄糖的结合,结果显示结合曲线最陡的部分与低血糖范围相匹配,即低于4 mM葡萄糖。测量了在0到20 mM葡萄糖浓度范围内,NNC2215对胰岛素受体的葡萄糖敏感结合,发现NNC2215的葡萄糖反应性比之前尝试为胰岛素配备葡萄糖敏感开关的报告要强得多。通过3D分子建模研究可以合理解释NNC2215与胰岛素受体相互作用的葡萄糖促进调节,可视化展示了处于关闭状态的NNC2215如何干扰与胰岛素受体α-CT域的结合。为了作为药物使用,这个开关应该对糖尿病患者中出现的葡萄糖浓度(即约2到20–30 mM)做出响应。大环的葡萄糖特异性之前已经研究过,但不能排除它可能会与糖基化蛋白发生一些结合。然而,当观察胰岛素受体时,它是一种糖基化蛋白,并且是使用含有麦胚凝集素(WGA)的糖基化结合柱进行半纯化的,如果NNC2215与胰岛素受体的聚糖结合,那么仅含大环的对照化合物NNC2215a应该在结合测定中表现出葡萄糖敏感性,而实际上并没有。这表明NNC2215在很大程度上不会与糖基化蛋白结合。
在一个简单的急性大鼠模型中支持了体内的葡萄糖敏感性,使用l-葡萄糖剂量来触发NNC2215的胰岛素效应而不刺激内源性胰岛素释放。通过l-葡萄糖激活的NNC2215导致d-葡萄糖降低和NNC2215清除呈剂量依赖性。这一方案受到使用α-甲基-d-甘露糖触发依赖于先前描述的甘露糖受体原理的葡萄糖敏感胰岛素衍生物的启发。
值得注意的是,NNC2215的葡萄糖敏感胰岛素受体结合和细胞效应转化为在由生长抑素和胰高血糖素替代输注诱导的急性糖尿病样猪模型中观察到的体内低血糖保护效应。对于同样的降糖效果开始时,当d-葡萄糖输注关闭时,我们观察到血浆葡萄糖下降,但NNC2215的下降幅度比胰岛素degludec小,最低葡萄糖值平均约为4.5 mM,而胰岛素degludec低于3 mM。在所有测试的剂量水平上观察到NNC2215与胰岛素degludec之间葡萄糖下降的差异,估计在重叠的起始葡萄糖范围内约为1.8 mM(扩展数据图3)。当胰岛素剂量与实际需求不匹配时,这种在低血糖水平时减少不理想的血浆葡萄糖降低效应的程度预计会给像NNC2215这样的胰岛素偶联物带来显著优势,减少胰岛素治疗固有的低血糖风险。
我们还观察到在STZ糖尿病大鼠中的葡萄糖挑战期间,NNC2215的激活相当于额外30%的人胰岛素效果。这种由葡萄糖诱导的NNC2215激活表明它可能有助于减少餐后的一些葡萄糖波动。因此,可能需要较少的快速作用胰岛素剂量来应对较大的餐食。较小剂量的餐时胰岛素与NNC2215结合使用可能潜在地减少由快速作用胰岛素引起的低血糖风险,并总体上允许更紧密的葡萄糖控制而无需担心低血糖。
在猪中对药代动力学/药效学数据的建模量化了NNC2215在体内的动态范围。根据药代动力学/药效学建模,在与糖尿病相关的葡萄糖范围内,胰岛素活性指数在3 mM葡萄糖时约为60%,在20 mM葡萄糖时为290%(扩展数据图5b),即5倍的范围,这与体外发现的3和20 mM葡萄糖之间的胰岛素受体亲和力3.2倍差异一致。NNC2215在体外和体内葡萄糖敏感性的这种一致性支持了具有类似NNC2215特性的化合物可能转化为人类使用的潜力。
总之,像NNC2215这样的胰岛素偶联物通过潜在地降低低血糖风险和部分满足餐时快速作用胰岛素的需求,有望改善糖尿病的治疗。这两个特性的结合应该允许与目前的胰岛素疗法相比进行更积极的胰岛素滴定,以实现正常的葡萄糖水平而不增加低血糖的风险。这可能会改善与糖尿病相关的短期和长期风险及并发症。总的来说,NNC2215展示了如何设计分子开关以使分子生物活性能够自主控制在另一个分子变化浓度下的响应,即使是像血糖水平这样狭窄的范围。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1456161.html?mobile=1
收藏

