 精选
精选
饮食限制对遗传多样性小鼠的健康和寿命的影响
相关评论文章:
热量限制在多个物种中延长了健康寿命。间歇性禁食作为饮食限制的另一种形式,对人类来说可能更具可持续性,但其有效性仍然在很大程度上未被探索。确定最有效的饮食限制形式对于开发改善人类健康和长寿的干预措施至关重要。在这里,我们对960只遗传多样性雌性小鼠进行了广泛的评估,包括不同程度的热量限制(20%和40%)和间歇性禁食(每周1天和2天禁食)对其健康和存活的影响。我们展示了热量限制和间歇性禁食都按限制的程度延长了寿命。寿命是可遗传的,基因对寿命的影响大于饮食限制。与寿命最强烈的特征关联包括在处理期间保持体重——这是应激韧性的指标、高淋巴细胞比例、低红细胞分布宽度以及晚年的高脂肪含量。不同干预措施的健康效应各不相同,并且与寿命延长的关系不一致。40%的热量限制具有最强的寿命延长效果,但导致了瘦肉质量的损失和免疫库的变化,这可能会使易感性增加感染。间歇性禁食没有延长干预前体重高的小鼠的寿命,两天的间歇性禁食与红系细胞群的破坏有关。对饮食限制的代谢反应,包括减少脂肪含量和降低空腹血糖,与增加寿命无关,这表明饮食限制不仅仅是抵消肥胖的负面影响。我们的发现表明,改善健康和延长寿命并不是同义词,并对在临床前模型和临床试验中评估衰老干预措施的最相关终点提出了问题。
主要
热量限制(CR)推迟了与年龄相关的疾病的发生并延长了多个物种的寿命。在人类中,遵循CR具有挑战性,兴趣已经转向更宽松的饮食限制(DR)形式,如限时喂养和间歇性禁食(IF),这些已被证明在促进机体健康方面有效。在小鼠中,定期禁食可以带来相当大的好处,而无需减少总能量摄入。进行CR的小鼠也经历了长时间的每日禁食,通过在一天中的特定时间喂食可以优化CR的健康益处,这表明热量摄入和喂食时间都对生理反应和寿命延长有贡献。尽管这些观察很重要,但关于CR和IF在健康老龄化和长寿方面的不同之处的信息有限。
对DR的反应因个体而异,这种变异性的机制在很大程度上仍不清楚。在小鼠和非人灵长类动物中的研究表明,DR的效果受到个体特征的影响,包括性别、体型和组成以及遗传学。测试DR对健康的效应的人类临床研究主要集中在体重、脂肪含量、能量代谢和心血管风险因素的变化上。由于人类研究的样本量小且持续时间短,对DR的长期效应的探索较少。此外,DR的安全性和有效性可能取决于年龄和健康状况等因素。关于预测个人如何响应DR的生理标记的知识缺乏。识别这样的预测因子可以帮助定制DR以满足个人需求,作为纵向评估干预成功的工具,并阐明介导DR对寿命影响的生物过程。
在这项关于饮食限制的研究中,我们调查了热量限制(CR)和间歇性禁食(IF)对雌性多样性杂交(DO)小鼠的健康和寿命的影响。除了测量寿命外,我们还进行了数百次纵向评估以评估DR的健康效应。最近使用UM-HET3小鼠(另一个遗传多样性小鼠群体)的研究揭示了与规范老化相关的遗传变异。我们使用DO小鼠是因为在遗传多样性小鼠中的发现更有可能跨物种推广,并且因为DO小鼠呈现出广泛的生理特征,包括体成分和其他代谢特征的变异,这些可以作为预测个人对DR反应的预测标记。我们的研究目标是(1)描述DR的寿命和健康效应;(2)识别预测个人对DR反应的生理和遗传因素。
DR延长了雌性DO小鼠的寿命
我们检查了分级水平的影响CR和IF960雌性做老鼠随机分配到五种饮食:随意喂养(AL),每周禁食一天(1D组)或连续两天(2D组),和CR在20%或40%的基线随意的食物摄入量(图1)。在6个月大时,我们对937只存活的小鼠进行了DR治疗,并在它们的自然寿命中维持DR治疗。
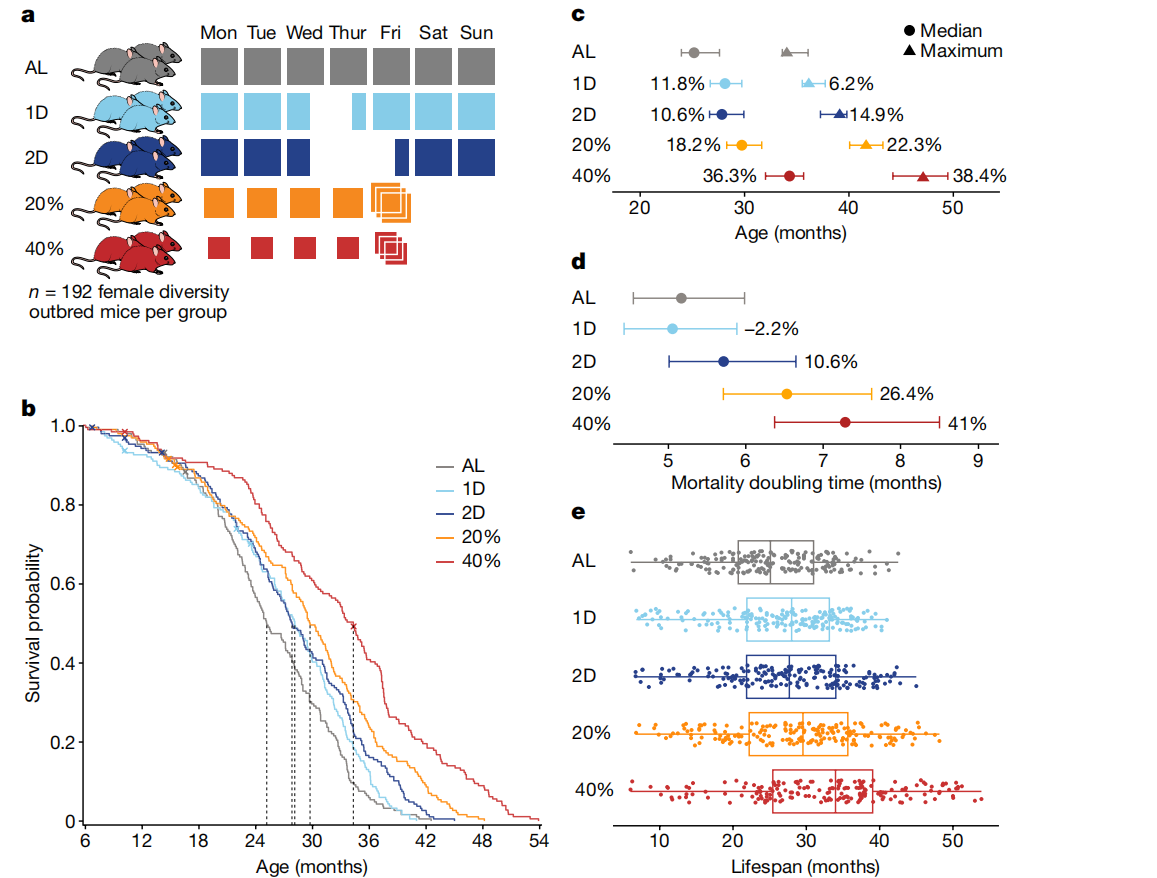
图1: DR延长了DO小鼠的寿命。
a, 研究设计:960只雌性DO小鼠被随机分配到五个饮食干预组之一:自由进食(AL);每周禁食一天(1D)或两天(2D);或者分别按估计成年食量的20%(20%)或40%(40%)进行热量限制(CR)。
b, 按饮食组别的Kaplan–Meier生存曲线。虚线表示中位寿命。审查事件用“X”表示。
c, 按饮食组别的Kaplan–Meier估计的中位(50%死亡率)和最大(90%死亡率)寿命,显示相对于AL的百分比变化以及95%置信区间(使用R/survfit计算)。n=937只小鼠。
d, 从Gompertz对数线性危险模型估算的死亡翻倍时间,显示相对于AL的百分比变化以及95%置信区间(使用R/flexsurvreg计算)。n=937只小鼠。
e, 饮食组别内的个体小鼠寿命(点)。n=188(AL),n=188(1D),n=190(2D),n=189(20%)和n=182(40%)。箱线图显示了中位寿命(中心线)、四分位数(盒边界)和范围(触须)。
我们还使用了额外的160只DO小鼠来评估每日和累计食物摄入量(扩展数据图1a-c)。IF小鼠在周三下午3点移除食物,并在24小时后(1D组)或48小时后(2D组)补充食物(图1a)。这些小鼠在禁食期后表现出补偿性进食,使得1D小鼠总共摄入的食物量与AL小鼠相似,而2D小鼠比AL小鼠少摄入12%的食物(扩展数据图1b、c)。在禁食期间,1D和2D IF小鼠分别平均减重2.5克和4.0克,随后恢复体重(扩展数据图1d)。CR小鼠每天下午3点被喂食固定量的食物。周五下午,CR小鼠收到通常在周六下午3点或周日下午3点之前消耗的三倍食物量,导致类似IF小鼠经历的每周禁食期(扩展数据图1a)。尽管经历了禁食期,CR小鼠周末体重平均变化不到1克。
在大约5个月、16个月和26个月大时,主要研究队列中的小鼠在代谢笼中被监测,以观察DR如何影响每日食物消耗波动、呼吸商(一种代谢底物使用的衡量指标)、能量消耗和跑轮活动(扩展数据图2a-d)。所有组别的小鼠都在熄灯前不久开始每日进食(扩展数据图2a),但CR小鼠在几小时内就消耗了可用的食物,导致长时间的每日禁食。呼吸商的每日和每周波动反映了进食和禁食状态,这在40% CR组中最为明显(扩展数据图2e)。调整后的能量消耗最低的是40% CR组,其次是20% CR和2D IF组(扩展数据图2f)。除了40% CR小鼠外,跑轮活动随着年龄增长而减少,这些小鼠显示出最高的累积跑轮活动(扩展数据图2g),包括与觅食行为一致的中午跑轮活动(扩展数据图2d)。
DR延长了雌性DO小鼠的寿命(log-rank P < 2.2 × 10^-16),反应与限制程度或禁食长度成正比(40% > 20% > 2D > 1D > AL;图1b及补充表1)。DR影响了中位和最大寿命(Kaplan–Meier估计的50%和90%死亡率,分别见图1c及补充表2)。40% CR小鼠的中位寿命比AL组小鼠长约9个月(36.3%)。值得注意的是,IF小鼠在最小或没有净热量摄入减少的情况下也延长了中位寿命。我们通过拟合Gompertz生命模型估算了死亡率翻倍时间(图1d及补充表3),并观察到CR小鼠相比AL小鼠的年龄相关衰退速率显著降低(总体饮食效应对Gompertz模型斜率的影响,P = 7.78 × 10^-4)。
尽管DR有深远影响,但寿命在各饮食组内高度可变(图1e)。这促使我们检查是否有任何生理特征可以解释寿命的变异性。我们在12个实验组中评估了200多个特征,每个特征在不同时间重复测量,每只小鼠最多得到724个测量值。我们每周获取体重;每六个月评估虚弱指数、握力和体温;每年进行评估,包括代谢笼分析、体成分、心脏超声、跑轮、转棒、听觉惊吓、膀胱功能、空腹血糖、免疫细胞分析和全血分析(参见方法部分的“表型分析”;补充表4和5)。我们进行了纵向分析,以评估哪些特征受体重、年龄和饮食的影响(扩展数据图3b及补充表6)。我们进行线性回归分析,以确定哪些特征在控制饮食和体重后与寿命相关(扩展数据图3c-e及补充表7)。在以下部分,我们将探讨饮食对体重和成分的影响;然后研究DR对健康指标的影响,包括代谢、免疫和血液学特征;最后,我们考察遗传对健康和寿命的影响。
DR对体重和成分的影响
DR显著改变了终生体重轨迹(图2a及扩展数据图4a)。在DR上的体重减轻大致与CR的程度成比例,但IF对体重也有额外影响,例如,1D小鼠尽管摄入的热量与AL小鼠相似,但体重较轻(扩展数据图1c)。40% CR小鼠在DR开始时迅速减重,并在18个月大时平均减重24.3%。相比之下,AL小鼠在同一时期平均增重28.4%。40% CR小鼠的体重减轻持续一生,表明这些动物大多未能达到能量平衡。将实际年龄重新标定为寿命比例(PLL = 测试时年龄/寿命)使我们能够更好地比较临终前的特征,而不会受到不同存活率的扭曲(图2b)。除了40% CR组外,所有小鼠的平均体重增加持续到中年,稳定在0.50至0.75 PLL之间,并在接近生命终点时迅速下降(超过0.90 PLL)。临终前的体重减轻可能反映癌症或其他终末期疾病的存在,但我们无法确定大多数小鼠的死因。
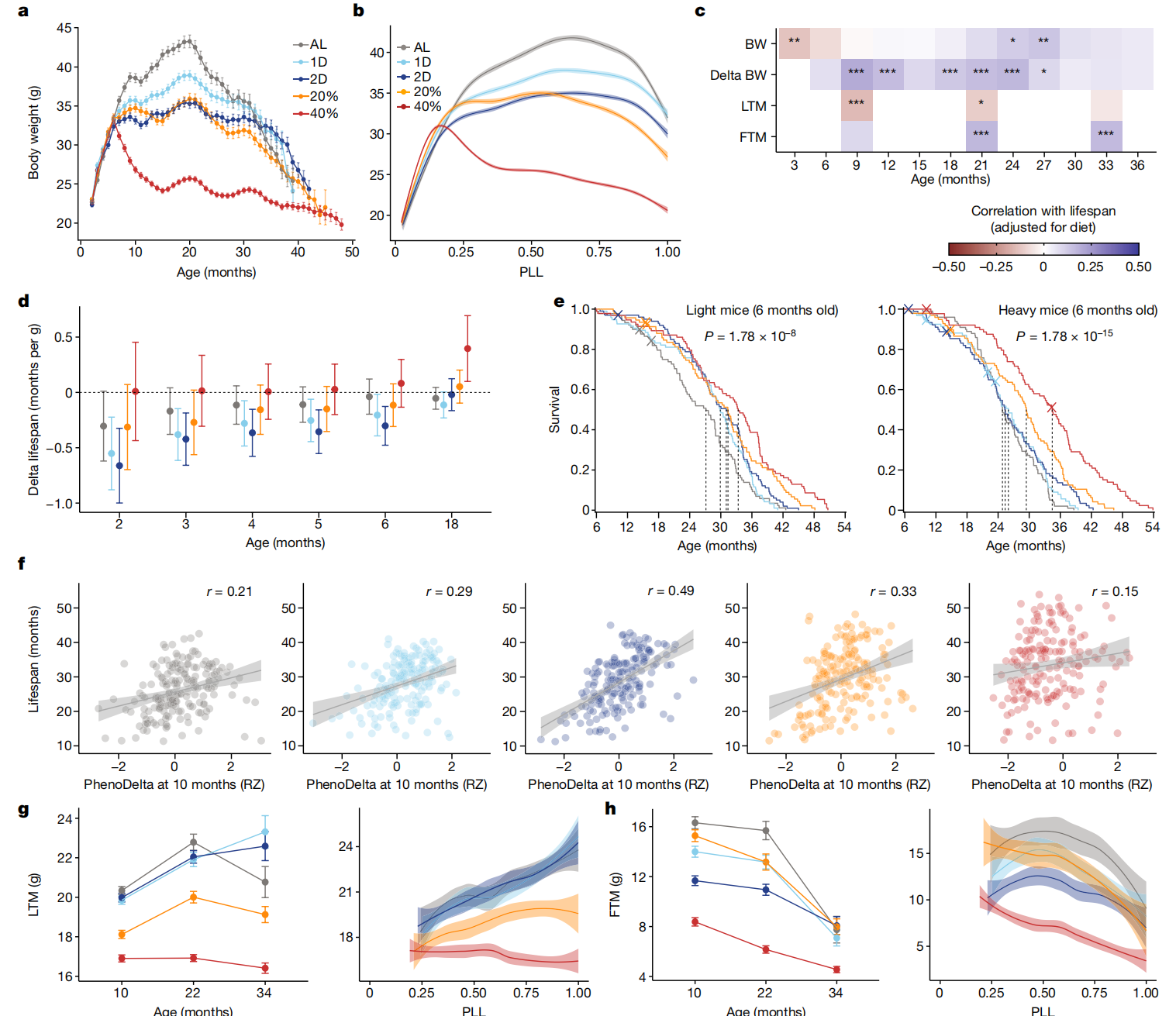
图2 DR显著改变了终生体重轨迹。
a,按饮食组别划分的体重(克)终身轨迹。数据是每月平均值±1个标准误。n=937。b,按PLL进行loess拟合的体重(克)轨迹,带有95%置信带。c,经饮食调整后与寿命相关的体重、三个月间隔体重变化(delta BW)、瘦组织质量(LTM)和脂肪组织质量(FTM)。星号表示通过线性回归分析寿命特征后的多重检验调整显著性,*p < 0.01, **p < 0.001, ***p < 0.0001。d,2到6个月和18个月时每克体重的预期寿命差异按饮食分组。数据是平均值±2个标准误。n=937(2到6个月)和n=802(18个月)。e,按饮食组别(颜色)对低于和高于中位数6个月体重的小鼠进行的Kaplan–Meier生存曲线。虚线表示中位生存时间。显著性是通过在体重分层内跨饮食比较的log-rank检验计算得出。n=469(轻)和n=468(重)。f,按表型期间(10至11个月;PhenoDelta)体重变化的生存期,显示回归线、95%置信带和特定饮食的相关性(p<2.2×10^-16; 饮食×特征: P=0.00172, r=0.287)。g,按年龄(平均数±2个标准误;n=895(10个月),n=689(22个月),n=241(34个月)小鼠)和PLL进行loess平滑处理及95%置信带的瘦组织质量(克)(PLL: P<2.2×10^-16; 饮食: P<2.2×10^-16; 饮食×PLL: P=1.07×10^-7)。h,按年龄(平均数±2个标准误;n值如g所示)和PLL进行loess平滑处理及95%置信带的脂肪组织质量(克)(PLL: P<2.2×10^-16, 饮食: P<2.2×10^-16, 饮食×PLL: P=0.168)。对于g和h,统计测试的详细信息见“纵向特征分析”部分的方法。
早期较高的体重与小鼠和其他物种的缩短寿命相关32,33,34。与这些发现一致,我们观察到寿命与干预前体重之间的负相关(图2c(顶行)和扩展数据图4b)。然而,这种负相关随着年龄的增长而减弱,并在两年后变为正相关(图2c(顶行)和扩展数据图4c)。对于2D IF小鼠,2个月龄时体重差1克对应于预期寿命减少0.66个月(20天),但这种关联随年龄增长而减弱(图2d)。所有饮食组中都存在体重与寿命关联随年龄逆转的现象。接下来,我们检查了早期体重是否也可能改变对DR的反应。按中位数6个月体重分层的Kaplan–Meier分析显示,CR在较轻和较重的小鼠中延长寿命的程度相同(图2e,扩展数据图4d和补充表8)。相比之下,IF小鼠在高干预前体重的情况下没有显示出寿命延长的证据。
此外,我们评估了个体寿命延长是否可以由DR后期体重变化来解释。值得注意的是,我们发现,在饮食组内,保留更多体重的小鼠寿命更长(扩展数据图4e)。与传统观点相反,该观点认为DR的有益效果是由于减少了肥胖水平36,在任何年龄体重减轻都与寿命减少相关(图2c(第二行))。这些结果反驳了DR仅通过对抗肥胖的负面影响而起作用的观点。
在10、22和34个月龄的为期一个月的表型测定期间,由于处理导致的压力,小鼠经历了短期体重减轻,随后在之后的几周恢复。从10到11个月龄的表型测定期间体重变化(PhenoDelta)显示出与本研究中检查的所有特征中最强的寿命关联(图2f和扩展数据图3d)。对体重减轻最有抵抗力的小鼠寿命更长。在22个月龄的表型测定期间体重减轻也与寿命减少相关(扩展数据图4f)。
我们在10、22和34个月龄分析了体成分以获取脂肪组织质量(FTM)和瘦组织质量(LTM),并计算了总组织质量(TTM = FTM + LTM)和脂肪百分比(脂肪百分比 = FTM/TTM)。基因多样性的小鼠在所有饮食组和年龄段表现出广泛的体重和成分变化,脂肪百分比从不到10%到超过60%不等(扩展数据图5a)。对于AL和IF小鼠,LTM在整个生命中增加(图2h)。对于CR小鼠,LTM与AL小鼠相比在干预后4个月期间大幅减少,并保持恒定(20% CR)或随年龄下降(40% CR)。所有组别的小鼠随着年龄的增长都失去了脂肪质量,特别是在生命的后半段(图2i)。虽然40% CR小鼠的平均脂肪百分比最低,但20% CR小鼠的脂肪百分比与AL小鼠相当,脂肪百分比最高的个体小鼠出现在20% CR组(扩展数据图5a)。
先前的研究表明,在慢性CR下保持脂肪可能会增加存活率11,16,37。我们检查了10和22个月龄时寿命与脂肪百分比的关联(扩展数据图5b,c)。较高的脂肪百分比通常与较长的寿命相关。这种关联在经受2D IF或CR的老年小鼠中更强。在我们测试的所有与寿命相关的特征中,只有10个月龄的TTM和LTM显示出显著的饮食特异性与寿命的关联(饮食×特征: p < 0.01),而10个月龄的FTM接近显著(扩展数据图5d,e)。具体来说,较高的LTM与IF小鼠的较短寿命相关,但与40% CR小鼠的较长寿命相关。总的来说,这些结果突出了一个悖论:DR在减少体重和脂肪质量的同时延长了寿命,但保持体重和脂肪质量却与较长的寿命相关。这个悖论是本研究反复出现的主题。
DR对健康和代谢的影响
我们的表型管道中的大多数健康相关特征随年龄变化并对DR有反应(扩展数据图3b),但令人惊讶的是,这些特征中很少有显示出与寿命的关联(图3a,b和扩展数据图3c)。一个例外是28个月的虚弱指数(FI; 图3c,d),这是一种衡量与年龄相关的健康缺陷的病态指标。一些最明显受年龄影响的虚弱成分包括驼背和步态障碍的增加(扩展数据图6a,b)。有益的饮食特异性反应包括可触摸肿瘤和腹部膨胀的发生率降低。我们还观察到,低早期体重的小鼠这两种特征都有所减少(扩展数据图6c,d),这可能有助于这些小鼠的较长寿命。
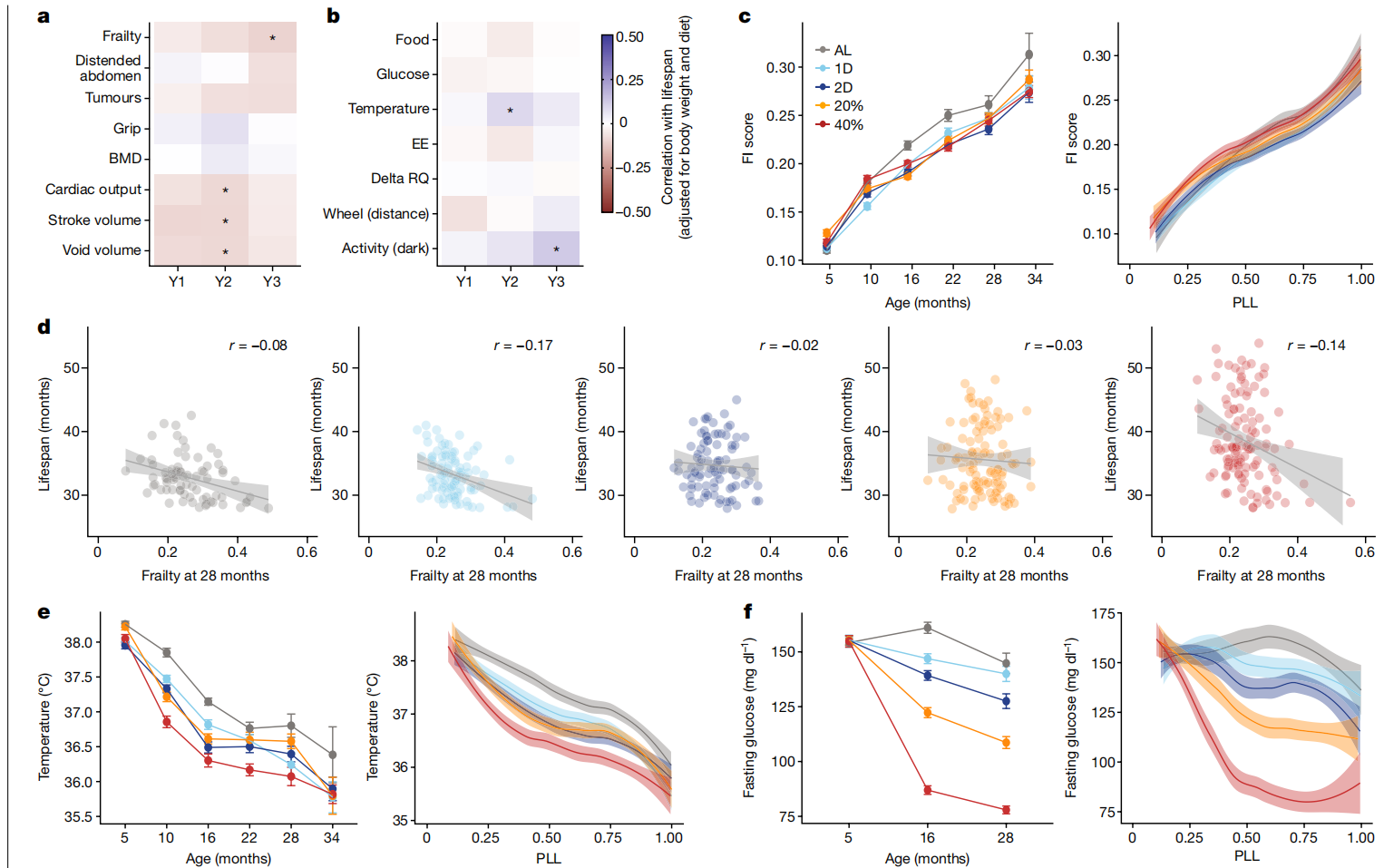
图3 DR对健康和代谢的影响。
a,b,针对选定的健康(a)和代谢(b)特征,在年度测试间隔内对饮食和体重进行调整后与寿命的相关性热图。年龄(1年、2年和3年分别表示为Y1、Y2和Y3)根据检测方法而变化(补充表4)。星号表示通过线性回归分析寿命特征后的多重检验调整显著性,*p < 0.01。c,按年龄(平均数±2个标准误;n=770(5个月),n=909(10个月),n=834(16个月),n=704(22个月),n=489(28个月),n=260(34个月)小鼠)和PLL进行loess平滑处理及95%置信带的FI评分(经技术和毛色调整)(PLL: P<2.2×10^-16; 饮食: P=7.37×10^-5; 饮食×PLL: P=0.633)。d,按脆弱性评分(经技术和毛色调整)在28个月时的生存期,带有回归线和95%置信带(p=0.00238; 饮食×特征: P=0.260, r=-0.90)。e,按年龄(平均数±2个标准误;样本大小如c所述)和PLL进行loess平滑处理及95%置信带的体温(°C; 经毛色调整)(PLL: P<2.2×10^-16; 饮食: P<2.2×10^-16; 饮食×PLL: P=0.0242)。f,按年龄(平均数±2个标准误;样本大小如c所述)和PLL进行loess平滑处理及95%置信带的空腹血糖(mg/dl,经体重调整)(PLL: P<2.80×10^-4; 饮食: P<2.2×10^-16; 饮食×PLL: P=0.0368)。统计详情见“纵向特征分析”(c、e、f)和“特征与寿命的关联性”(d)部分的方法。BMD,骨密度;EE,能量消耗;RQ,呼吸商。
改善的葡萄糖稳态、较低的能量消耗、降低的体温和代谢灵活性的保留(delta呼吸商)是啮齿动物和人类中与DR相关的常见生理适应,这些被提出作为DR延长寿命的潜在机制39,40。随着年龄的增长,体温下降(图3e)。DR显著降低了空腹血糖(图3f)。然而,我们未发现寿命与空腹血糖、能量消耗或delta呼吸商之间存在显著关联(图3b)。较高的体温与较长的寿命有中等程度的关联,这不是预期的方向。尽管DR对代谢特征有深刻影响,但它们仅显示弱或无关联性与寿命。
DR对血细胞群落的影响
与健康和代谢特征不同,我们发现许多免疫学和血液学特征与寿命有很强的关联(图4a、b和扩展数据图3c)。DO小鼠中随年龄变化的免疫细胞亚群通常与之前描述的人类和常见近交系小鼠的变化一致41,42,43,44。总体而言,B细胞、效应T细胞和炎性单核细胞的比例随年龄积累增加,而淋巴细胞、成熟自然杀伤(NK)细胞和嗜酸性粒细胞的总比例则下降(图4c、d和扩展数据图7a-d)。DR对淋巴细胞百分比或效应T细胞百分比的年龄相关变化没有显著影响。然而,40% CR对成熟NK细胞、嗜酸性粒细胞、循环B细胞和炎性单核细胞的频率有深远影响(扩展数据图7a-d)。
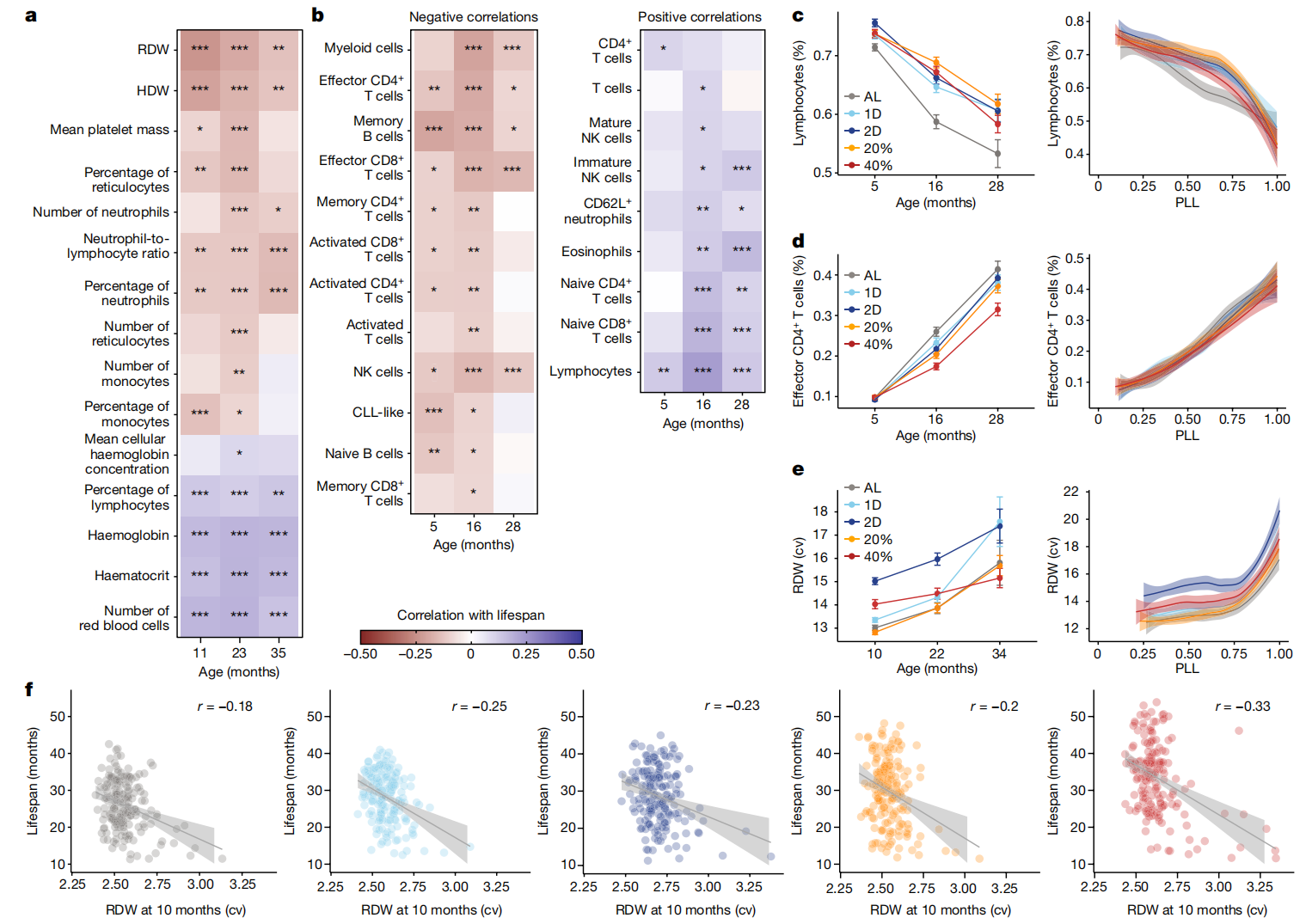
图4:免疫和血液学特征随年龄变化、响应饮食并预测寿命。
a,b,在指定年龄对选定的血液学特征从流式细胞术(a)和免疫特征从完整血细胞计数(b)进行饮食和体重调整后的与寿命的相关性。星号表示通过线性回归分析寿命特征后的多重检验调整显著性,*p < 0.01, **p < 0.001, ***p < 0.0001。c,按年龄(平均数±2个标准误;n=936(5个月),n=830(16个月),n=485(28个月)小鼠)和PLL进行loess平滑处理及95%置信带的淋巴细胞(活细胞比例)(PLL: P<2.2×10^-16; 饮食: P<4.43×10^-8; 饮食×PLL: P=0.0670)。d,效应CD4 T细胞(所有CD4 T细胞的比例)按年龄(平均数±2个标准误;样本大小如c所述)和PLL进行loess平滑处理及95%置信带(PLL: P<2.2×10^-16; 饮食: P=0.268; 饮食×PLL: P=0.300)。e,红细胞分布宽度(变异系数(cv))按年龄(平均数±2个标准误;n=892(10个月),n=665(22个月),n=208(34个月)小鼠)和PLL进行loess平滑处理及95%置信带(PLL: P<2.2×10^-16; 饮食: P<2.2×10^-16; 饮食×PLL: P=4.77×10^-5)。f,按10个月时的红细胞分布宽度生存期,带有回归线、95%置信带和特定饮食的相关性(p = 5.71×10^-11; 饮食×特征: P=0.395, r=-0.239)。统计测试的详细信息见“纵向特征分析”(c-e)和“特征与寿命的关联性”(f)部分的方法。CLL,慢性淋巴细胞白血病。
主要的红细胞特征(血红蛋白、血细胞比容、红细胞计数)随着年龄的增长而减少,而红细胞分布宽度(RDW;红细胞体积的变异系数)和血红蛋白分布宽度(HDW;红细胞血红蛋白浓度的变异系数)均有所增加(图4e、g 和扩展数据图7g–i)。这些变化在同一动物中同时发生,并且在老龄化人类群体中也观察到平行的变化,在这些人群中贫血是一个常见且严重的问题45,46。在CR下血红蛋白水平得到了改善(提高),但在IF下没有,这表明CR在降低贫血风险方面具有有益效果。RDW对饮食的反应是独特的。到10个月大时,2D IF小鼠的RDW急剧增加,而在40% CR小鼠中增加程度较小。许多完整的血液计数(CBC)特征,包括RDW和血红蛋白,在生命的最后25%显示出拐点和更高的变化率,并作为即将发生的死亡指标。在红细胞特征中,HDW和RDW与寿命的关联最强,大多数红细胞特征显示出与寿命的显著正相关(血红蛋白、血细胞比容、红细胞计数)或负相关(RDW、HDW)(图4f 和扩展数据图7k)。
DR对寿命影响的中介作用
鉴于有许多特征既受DR影响又与寿命相关,我们试图估计通过测量的特征解释的DR对寿命总效应的比例。我们进一步试图通过识别条件独立的特征组来解析DR的不同效应,这些特征组作为潜在生理过程的代表,对寿命有影响。我们首先对194个特征进行多元网络分析,这些特征是在10至16个月大时评估的,加上寿命和饮食,并拟合了一个部分相关网络(稀疏无向高斯图形模型47)。该网络揭示了高度相关的特征组,主要在表型域内聚集(扩展数据图8a 和补充表10),我们将这些特征与重要的生理变量(如能量消耗)联系起来。为了识别条件独立效应,我们从整个网络中的每个簇选择了一个代表性特征子集(共21个典型特征)。然后我们拟合了一个简化的部分相关网络,并执行路径分析48以分解饮食与寿命之间的协方差(扩展数据图8b)。总计,所有通过测量的特征路径解释了39%的饮食与寿命协方差(补充表11)。直接路径(饮食→寿命)代表了剩余61%的未解释协方差。下一个最高分路径(饮食→PhenoDelta→寿命)解释了10.8%的协方差,代表了DR对寿命的负面影响。另一个高分路径(饮食→ RDW→寿命)也代表了DR对寿命的负面影响,解释了0.7%的协方差。几个包含代谢特征(能量消耗、葡萄糖、食物摄入)的路径通过LTM汇聚,解释了3.8%的协方差。其他高分路径通过免疫特征起作用,包括淋巴细胞、嗜酸性粒细胞和T细胞类别,并解释了7.5%的协方差。尽管选定的特征不太可能是DR对寿命影响的直接因果中介,但它们作为代表DR影响机制的潜在机制的替代物。这些机制的鉴定可以为干预提供目标。然而,独立路径的多样性以及具有一致和不一致效应的路径的混合支持了DR对寿命影响的多效性模型。值得注意的是,DR对多个特征的影响,包括那些与寿命最强烈相关的特征,如表型期间的体重减轻和RDW,显示出与DR对寿命直接影响相反的效果。
寿命的遗传决定因素
我们获得了929只(共937只)小鼠的全基因组基因型数据,并研究了饮食和遗传学对寿命的综合影响。对于至少活到6个月大的小鼠,遗传背景解释了23.6%的寿命变异(h2 = 0.236, 95% Bootstrap置信区间 0.106–0.360),而饮食仅解释了7.4%的变异。随着小鼠年龄的增长,遗传性下降到存活超过12个月的小鼠的17.1%,以及存活超过18个月的小鼠的15.9%。与此同时,饮食对寿命的贡献随年龄增加到12个月时的8.4%以及18个月时的11.4%。先前已报告过类似的遗传效应减少和DR效应增加的趋势,用于体重49(图5a–c)。
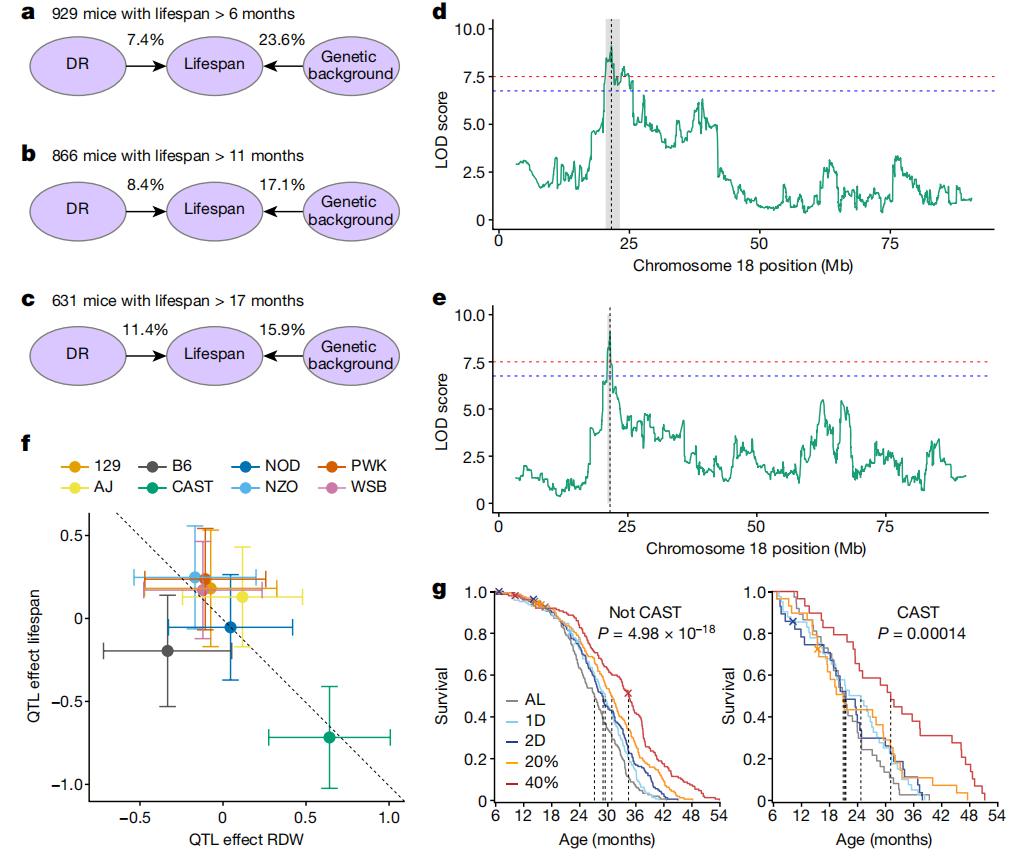
图5:DO小鼠中寿命的遗传效应。
a–c,由遗传学和DR解释的寿命变异比例随年龄变化(>6个月 (a), >11个月 (b) 和 >17个月 (c))。d,e,遗传定位确定了与寿命(d)和RDW(e)在小鼠染色体18上的全基因组显著关联。x轴显示基因组位置,y轴显示对数转换后的可能性比值(LOD分数)。f,估计了每种创始品系单倍型的加性遗传效应(中心)对染色体18 QTL的RDW(x轴)和寿命(y轴)的影响(回归系数±1个标准误;n=892只小鼠)。参考线(虚线)的斜率为-1,截距为0。g,按饮食组别显示Kaplan–Meier生存曲线(颜色)针对携带QTL处的CAST等位基因的小鼠进行了分层。虚线表示每组的中位生存年龄。显著性是通过在基因型分层内跨饮食比较的log-rank检验计算得出。n=765(非CAST)和n=164(CAST)。
我们对生理特征进行了遗传定位分析,并鉴定了300个显著的数量性状基因座(QTL;全基因组调整P < 0.05;扩展数据图9 和补充表12)。一个显著的寿命QTL映射到染色体18的21.55 Mb处(95%支持区间=20.44–24.92;图5d 和扩展数据图10a)。该QTL解释了4.34%的饮食调整后的寿命方差,相当于总遗传效应的23.4%。尽管超过75%的遗传贡献仍未解释,但我们没有检测到任何额外的显著寿命QTL。
在生理特征中,10个月时的红细胞分布宽度(RDW)是唯一一个与寿命相关的数量性状位点(QTL)共定位的特征(RDW QTL位于21.55 Mb处,95%支持区间=21.06–21.61;图5e和扩展数据图10b)。我们估计了这些QTL处的创始株系单倍型的加性遗传贡献(DO小鼠源自八个近交系创始株),发现两者都是由CAST/EiJ(CAST)创始株系单倍型驱动的(图5f)。在该位点存在CAST单倍型与缩短寿命和较高的RDW相关。在929只小鼠中,有164只至少携带一份CAST单倍型,这些小鼠的寿命平均减少了3.7个月(12.5%,P=6.66×10−7)。通过Kaplan-Meier分析寿命,按该QTL处是否存在CAST等位基因分层,证实饮食对两种基因型组的寿命都有显著影响(图5g)。此外,携带CAST等位基因的小鼠显示出寿命缩短,可能的例外是40% CR组,对于这组内的基因型效应测试不显著(扩展数据图10c和补充表13)。
寿命和RDW的变异关联作图(扩展数据图10d,e)将QTL缩小到一个包含约20个位置候选基因的区域,包括Garem1、Klhl14、Asxl3、Mep1b、Rnf138和Rnf125,以及一个包含desmocollin和desmoglein家族成员(Dsc和Dsg)的簇。后者在维持红细胞的结构和大小方面具有合理的功能作用。Garem1的功能丧失与小鼠的脾脏大小和形态有关50,这表明通过回收红细胞与RDW之间可能存在联系。在其他候选基因中,我们识别出一个在小鼠肝脏中有与CAST等位基因相关联的eQTL(https://qtlviewer.jax.org/#datasets)。在QTL区域,包括Garem在内的11个基因中,有34个错义变异具有私有的CAST等位基因。人类研究中已将RDW与寿命关联起来52。尽管已报告了数百种与人类GWAS关联的RDW53,54,但似乎没有与小鼠染色体18 QTL同源或与人类寿命的GWAS关联共定位。明确鉴定一个因果基因候选者可以进一步阐明RDW与寿命之间的机制联系。
讨论
在这里,我们报告了分级CR和IF对近1000只雌性DO小鼠健康和寿命的影响,我们对数百个生理特征进行了纵向剖析。总的来说,我们的研究突显了生理韧性,特别是体重、体成分和关键免疫细胞群的维持,作为长寿的主要生物标志,并表明DR的促长寿效应可能与其对代谢特征的影响解耦。尽管本研究中DR的强大效果,但遗传背景被证明是决定寿命的更重要因素。
我们的结果有几个重要的含义(补充讨论)。首先,它们表明DR对健康和长寿的影响有所分歧。DR对代谢健康的几种描述良好的影响,如改善空腹血糖、能量消耗和呼吸商的波动,并未预测饮食组内的寿命。这意味着,尽管DR诱导的代谢特征变化对健康有益,但不一定转化为寿命的大幅延长。这一见解对人类饮食干预研究中生物标志物的选择具有重要意义,这些研究通常关注代谢健康55。
其次,我们的发现更一般地意味着DR对健康和寿命的影响可能是部分不重叠的,某些延长寿命的DR属性实际上可能对其他生理健康方面有害。例如,尽管40% CR上的小鼠在大多数指标上是健康的,但我们看到了一些不利影响的迹象,包括终生瘦体重损失、体温降低、食物寻求行为(饥饿的迹象)和免疫谱系的变化,这可能会增加感染的易感性。这些在小鼠中的效果可能引发人们对人类极端DR潜在风险的担忧。
最后,是否IF和CR会延长人类的寿命仍有待确定性调查56。由于代谢率的差异,这些DR干预措施的人类等效尚不清楚。尽管需要进一步工作来解析DR的复杂生理效应,我们的发现表明,基于遗传背景,人类对DR的反应将是高度个体化的,适度减少热量摄入和规律的日常喂养及禁食周期是关键的贡献因素7,8,并且特定的血液生物标志物可以预测个人从DR的某些生理效应中受益的能力,同时承受其他方面的影响,以最大化其健康和长寿效果。
实验方法
小鼠
我们招募了960只雌性DO小鼠,分12个批次进行,对应于第22至24代和第26至28代的出生队列,每代分别有80只初产妇和80只二胎动物,这些动物大约每隔3周出生一次。每个窝中最多只有一只小鼠被纳入研究。第一批小鼠于2016年3月进入研究,到2017年11月研究完全招募完毕。这一时间表旨在高效利用我们的表型分析能力,并尽量减少季节性混杂因素的干扰。样本量确定为能够检测干预组之间10%的平均寿命变化,同时允许因非年龄相关事件造成的一些动物损失。由于担心雄性攻击性,我们使用了雌性小鼠。小鼠被分配到八个一组的居住群体中,住在大型断奶盒中,带有正压通风和进入空气温度为24.4至25.6摄氏度的环境。提供了包括巢穴、生物管和啃咬块在内的环境丰富物。根据住房组,将小鼠随机分配到五种饮食干预措施之一。由于每个干预组有不同的喂养要求,无法实现盲法。在研究中登记的960只小鼠中,当干预措施在6个月大时开始时,有937只小鼠存活,并且只有这些小鼠被纳入我们的分析。所有用于研究的流程均经过杰克逊实验室IACUC协议06005的审查和批准。
饮食限制(DR)
通过控制提供给小鼠的食物的时间和数量来实施DR。DR的喂养计划从6个月大时开始。所有小鼠都喂食标准的小鼠饲料(5K0G, LabDiet)。自由进食(AL)组提供无限量的食物和水。间歇性禁食(IF)小鼠提供无限量的食物和水。每周三下午3点,将IF小鼠放入干净的笼子中,并在接下来24或48小时内分别对1D和2D组撤除食物。热量限制(CR)小鼠提供无限量的水,每天下午3点左右提供固定量的食物,20% CR每天每只小鼠2.75克,40% CR每天每只小鼠2.06克。这些数量基于我们根据历史上的DO小鼠饲养数据估计的AL摄入量3.43克/每只小鼠/每天。对于40% CR方案,实施了逐渐减少食物摄入的方法:首先让小鼠接受20% CR两周,然后额外两周接受30% CR,再过渡到完整的40% CR。在2D IF方案中,最初让小鼠适应1D IF方案两周。小鼠与多达八只小鼠共同饲养。共同饲养是CR研究的标准做法;通过将食物直接放入笼子底部,最小化了竞争,允许个体小鼠“抓取”一个颗粒并在进食时隔离自己。CR小鼠在周五下午被提供三天的食物量,这导致了每周的盛宴期,接着是大约1天的食物剥夺期(对于20% CR小鼠)和2天的食物剥夺期(对于40% CR小鼠),与IF禁食期相当。下午3点的喂食时间紧密地接近了喂食的昼夜节律,正好在黑暗周期开始之前,这是小鼠的正常活跃和进食时间。这种时机安排已被证明能最大程度地延长受30% CR处理的小鼠的寿命。周五三倍喂食引发的盛宴-饥荒周期在其他CR研究中也被使用过,但直接评估其健康影响的研究缺乏。
食物摄入(160只独立的小鼠队列)
为了准确估计食物摄入以及每周禁食周期引起的体重变化,我们设立了一个独立的160只雌性DO小鼠队列。将这些小鼠置于与主研究相同的DR方案中。在小鼠30、36和43周龄时,每天称量食物一周。食物摄入数据按每只小鼠每天的克数进行标准化,并按时间点呈现每日和每周平均值。在43和45周龄时,使用非成像核磁共振(NMR)设备Echo MRI进行体成分测定,该设备配有5高斯磁体,适用于小动物研究。NMR数据用于检测禁食前后的体重和体成分变化。禁食前的体重、瘦体重、脂肪重量和脂肪率(100%×脂肪重量/总重量)与禁食后的差异(对于AL和CR是周五到周一;对于1D IF是周二到周四;对于2D IF是周二到周五)共同绘制。
表型分析
我们在早期、中期和晚期进行了三次健康评估周期。这些评估包括在大约16、62和114周龄时进行的为期7天的代谢笼实验;在24、71和122周龄时收集血液进行流式细胞术分析;在大约44、96和144周龄时进行转轮试验、体成分、超声心动图、听觉惊吓反应、膀胱功能、跑轮和CBC分析的血液收集。此外,每周记录体重,每6个月进行手动虚弱和握力评估。所有实验均按照杰克逊实验室的标准操作程序进行。
体重
我们在整个生命周期内每周称重一次小鼠,共纵向收集了超过100,000个值,涉及937只小鼠。体重数据在小鼠内部经过局部多项式回归拟合(即loess平滑)后进行分析。
虚弱、握力和体温
我们应用了临床相关的FI38的修改版本,该指数计算为31个指示年龄相关缺陷和健康恶化的特征的平均值。每个特征按0、0.5或1的等级评分,其中0表示没有缺陷;0.5表示轻度缺陷;1表示严重缺陷。测量在基线时(5个月)进行,并大约每6个月重复一次。简单平均得到每只小鼠之间的原始FI分数,范围从0到1。通过估计批次、毛色和实验者效应作为随机因素,从原始虚弱分数中减去这些效应进行调整,然后在统计分析前进行调整。Body 好的,以下是您需要的中文译文:
我们使用LUNAR PIXImus II双能X射线骨密度仪进行了双能X射线吸收法分析,以收集小鼠的骨密度和体成分(包括脂肪和非脂肪瘦肉组织)。小鼠被麻醉后单独放置在一个一次性塑料托盘上,然后将托盘放置在PIXImus的曝光平台上。获取单次扫描的过程大约需要4分钟。测量在大约44周龄、96周龄和144周龄时进行。
流式细胞术免疫细胞分型
外周血样本通过流式细胞术进行分析,以确定主要循环免疫细胞亚群的频率。分析在饮食干预开始前的5个月进行,然后在16个月和24个月龄时进行。这些时间点分别对应于饮食干预后的11个月和19个月。PBL样本中的红细胞被裂解,样本用FACS缓冲液(Mitenyi, 130-091-222)洗涤。细胞重悬在含有0.5% BSA的25μl FACS缓冲液中(Miltenyi, 130-091-222 with 130-091-376)。添加了包括Fc阻断剂(2.4G2, Leinco Technologies)在内的抗体,并在4°C下孵育30分钟。标记后的细胞经洗涤,加入DAPI后在LSRII(BD Bioscience)系统上进行分析。抗体鸡尾酒包含CD11c FITC, N418 (Tonbo Biosciences, 1:100); NKG2D (CD314) PE, CX5 (BD Biosciences, 1:80); CD3e PE-CF594, 145-2C11 (BD Biosciences, 1:40); CD19 BB700, 1D3 (BD Biosciences, 1:40); CD62L PE-Cy7, MEL-14 (Tonbo Biosciences, 1:100); CD25 APC, PC61 (BioLegend, 1:80); CD44 APC-Cy7, IM7 (Tonbo Biosciences, 1:40); Ly6G BV421, 1A8 (BD Biosciences, 1:80); CD4 BV570, RM4-5 (BioLegend, 1:40); CD11b BV650, M1/70 (BD Biosciences, 1:160); CD45R/B220 BUV496 (RA3-6B2, BD Biosciences, 1:20); Fc阻断剂, 2.4G2 (C247, Leinco Technologies, 1:100)。
由于这些小鼠的杂交性质,流式细胞术标记受到限制,T细胞亚群通常根据CD62L和CD44的存在被分为初始和非初始。NKG2D阳性细胞被计数,可能代表在免疫反应后积累的记忆T细胞。由于识别小鼠品系中NK细胞及其亚群的流式细胞术标记的限制,NK细胞被定义为表达NKG2D的非T非B淋巴细胞。在这个群体中,CD11c和CD11b被用于一般定义成熟亚群。CD11b表达标记更成熟的NK细胞,而CD11c在最不成熟的NK亚组上减少。
血糖
在16周、62周和114周的流式细胞术血液采集时,小鼠被禁食4小时,并使用LifeScan的OneTouch Ultra2血糖仪及OneTouch Ultra测试条测量血糖。在24周、71周和122周的每次CBC血液采集时,非禁食血糖使用血糖仪测量。
超声心动图
使用VisualSonics(VSI)Vevo 770/2100高频超声系统进行超声检查,配备30 MHz和40 MHz探头。超声心动图利用脉冲多普勒超声技术,通过超声探头测量血流速率和体积。
代谢监测笼
小鼠在Promethion Model代谢笼(Sable Systems International)中单独饲养7天,跟踪其活动、进食和呼吸情况。维持饮食干预的喂养方案。代谢笼数据用于评估Y1、Y2和Y3期间小鼠的代谢、能量消耗和活动情况。动物级数据经过清理,去除异常值和仪器故障,汇总为累积值(食物、跑轮距离)或每5分钟间隔的中位数(呼吸商、能量消耗)。计算4小时和1小时间隔的均值和标准差,并绘制为时间点间隔的均值±2个标准误。计算动物级汇总数据,作为每天(24小时)、光照期(12小时)或暗期(12小时)中值的平均值。此外,我们还计算了‘变化’特征(例如,delta呼吸商和delta能量消耗),作为整个7天运行中所有1小时汇总的5th到95th百分位之间的差异。
CBC分析
血液样本在Siemens ADVIA 2120血液学分析仪上运行,并使用之前描述的小鼠专用软件进行分析。
听觉惊吓反应
使用自动化惊吓室测量啮齿类动物的惊吓反应,将小鼠放置在透明的丙烯酸管中,该管放置在高度敏感的平台上,平台校准以跟踪其惊吓反射,同时暴露于一系列不同分贝和时间的声刺激。小鼠最初暴露于头顶扬声器发出的白噪声,然后转变为一系列随机生成的计算机化刺激,音量范围从70到120分贝,持续时间为40毫秒,间隔为9–22秒。测试运行约30分钟。
转轮试验
我们使用了Ugo-Basile转轮仪,该仪器有五个均匀分布在电机驱动的水平旋转杆上的通道,允许同时测试多达五只小鼠。每个通道下方都有一个带有跳板的平台,用于记录每只小鼠掉落的潜伏时间。在测试开始时,小鼠被放置在旋转杆上,旋转杆以4转/分钟的速度开始旋转,并在300秒内缓慢加速到最大速度40转/分钟。小鼠进行了三次连续试验。我们报告了平均潜伏时间(跌落时间)和各次试验中潜伏时间的斜率,以及没有跌落的试验次数和立即跌落的试验次数。如果小鼠不配合测试,试验将被记录为缺失。
排空测定
通过剪一块360克重的吸水纸至标准双层笼子尺寸来准备笼子。从干净的笼子中移除刨花,并将纸张粘贴到笼子底部。在此测试期间提供食物;然而,移除水以防止可能泄漏到吸水纸上。小鼠被单独放置在准备好的笼子里4小时。试验结束时,将小鼠返回到其原始住所,取出并晾干纸张2–4小时,然后分别装袋。将纸张运送到Beth Israel Deaconess医学中心,在那里用紫外线扫描以成像和量化排便斑点。
自由转轮运动
在大约44周、96周和144周龄时收集自由转轮运动数据。小鼠被单独放置在一个特殊笼子中至少36小时,该笼子适合容纳Med Associate低轮廓跑轮和无线发射器。移除食物漏斗以允许跑轮顺畅移动,并将食物放置在笼子地板上。直径15.5厘米的塑料跑轮位于电子底座上的一个角度,底座跟踪转数。电池供电的底座允许持续监测数据,然后以30秒的间隔无线传输到本地计算机。
寿命
研究工作人员定期评估小鼠的预定临床症状:可触摸的低温、对刺激的反应能力、进食或饮水的能力、皮炎、肿瘤、腹部膨胀、活动能力、眼部状况(如角膜溃疡)、错颌、创伤和攻击伤口。如果小鼠符合这些类别中的任何观察标准,将联系兽医人员。如果临床团队确定小鼠明显低温且无反应,无法进食或饮水,和/或符合严重皮炎、肿瘤和/或战斗伤口的协议标准,则进行预防性安乐死以防止痛苦;否则,兽医人员提供治疗。无论是安乐死还是发现的死亡小鼠均在生存曲线中表示为死亡。因与临近死亡无关的伤害而被安乐死的小鼠被视为截尾(我们记录了总共13个截尾事件)。
数据准备和分析
使用云端研究管理软件(Climb by Rockstep)来追踪动物、安排测试并为原始数据收集提供稳定的存储库。数据在研究期间由统计分析师定期审查异常情况。初始数据质量控制包括识别和解决设备误校准、动物标签错误和技术不可能值。如果我们不能使用实验室记录手动更正这些问题,它们将被移除。探索了包括体重和体温在内的定量测定中的离群值。除体重外的定量特征被校正为批次效应。为了量化批次效应,我们基于饮食、测试时的体重和年龄拟合了一个完全随机效应的线性混合模型。我们通过减去批次模型系数来调整特征值。寿命数据以天记录,但为了便于解释,以月(每月30.4天)为单位呈现。主要文本中报告的极其小的P值的统计显著性为P < 2.2 × 10^-16;非截断的P值在补充信息中提供。所有分析均使用R v.4.2.2和RStudio v.2022.12.0+353进行。数据分析脚本是可用的(数据可用性)。
生存分析
我们对五个研究组的寿命结果进行了生存分析。我们绘制了Kaplan-Meier生存曲线,并使用对数秩检验测试了不同饮食组之间生存分布的等同性,使用总体检验(4 d.f.)和饮食之间的所有成对比较。P值未进行多重测试调整报告,我们认为P < 0.01的比较具有统计学意义。我们估计了各饮食组的中位寿命和最大寿命(90%存活率),以及相对于AL组的95%置信区间和百分比变化。使用Gompertz对数线性危险模型估算了死亡率翻倍时间,95%置信区间和相对于AL组的百分比变化(flexsurv R包v.2.2.2)。
纵向特征分析
对于每年或每两年收集的特征,我们能够探索与饮食、体重和年龄相关的假设直接和间接关系。我们使用广义可加性混合模型(GAMMs)与高斯/恒等链接分析这些效应,通过拟合特征响应与协变量之间的一系列非线性关系。GAMMs结合了固定效应和随机效应(如下所示的公式),使用R中的gam()函数拟合mgcv包,采用Newton优化器和默认控制参数。将年龄重新缩放为已生活的比例(PLL = 测试时的年龄/寿命)。PLL比例尺消除了不同寿命组之间因生存偏差而产生的伪像。在拟合模型之前,除PLL外的所有连续变量都被转换为排名正态得分(RZ)。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1454640.html?mobile=1
收藏

