跨性别男性的免疫系统揭示了激素如何塑造免疫力
是什么驱动了免疫系统中的性别偏见?通过检查性别确认治疗如何影响跨性别男性免疫细胞的分子特征,揭示了激素是如何支撑免疫反应的。
性别对免疫系统有影响这一观点因男性COVID-19死亡率显著高于女性而成为头条新闻1,这激发了研究人员想要了解免疫细胞性别差异的起源和后果。Lakshmikanth等人在《自然》杂志上发表的文章2阐明了激素在免疫系统中这种差异的贡献。作者报告说,在跨性别男性进行性别确认激素治疗(GAHT)期间,给予一种类似睾酮的分子会迅速导致免疫反应的持续改变,趋向于顺性别男性的典型反应,而不是顺性别女性的典型反应。
每个生命体都需要一个免疫系统来抵御寄生虫、病原体和瘟疫等敌对世界。令人眼花缭乱的免疫细胞构成了一个连贯有效的防御系统;这些细胞还参与组织重塑和维护健康状态。一个关键问题是性染色体(一个人是XX还是XY染色体)和性腺激素(生殖组织产生的类固醇分子,如雄激素、雌激素和孕激素)对免疫反应性别差异的相对贡献。与男性相比,女性倾向于从先天和适应性免疫系统分支产生更强烈的免疫反应,特别是在对病毒感染的反应中3。
当TLR7等受体检测到病毒时,女性通常会产生更多称为I型干扰素的蛋白质。TLR7是从X染色体表达的,Y染色体上没有相应的基因。重要的是,在拥有两个X染色体的人中,尽管其中一个X染色体上的大多数基因不表达,但TLR7基因在失活的X染色体上并未沉默4,导致TLR7的双重剂量。
因此,当女性的血液中检测到病毒时,表达TLR7的免疫细胞通常会比男性产生更多的干扰素(图1a)。人们长期以来一直推测,这是自身免疫疾病红斑狼疮(系统性红斑狼疮)发病率在女性中比男性高九倍的原因5。然而,大多数XX个体具有卵巢,因此激素水平为高雌激素和低雄激素(如睾酮),这引发了一个问题,即他们高干扰素产量是由性染色体还是激素概况引起的。在出生时被指定为女性的跨性别男性中实施GAHT提供了一个独特的机会,通过探索增加雄激素水平前后XX个体中雄激素的影响来解答这个问题。
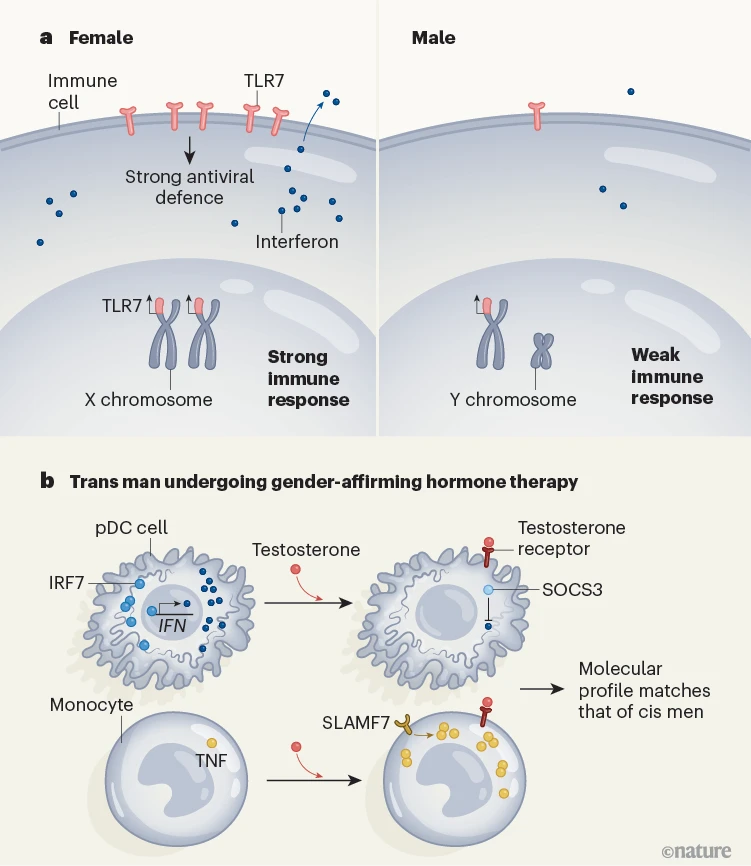
图1 | 睾酮治疗如何影响免疫细胞的概况。a, 女性通常比男性有更强烈的免疫反应3。由X染色体上的基因编码的受体TLR7有助于抗病毒防御。女性通常也比男性有更高的TLR7和一种叫做干扰素的免疫系统信号蛋白的表达。b, Lakshmikanth等人2报告了在出生时被指定为女性并接受性别确认激素治疗的跨性别男性免疫细胞概况中发生的变化。对这些个体应用一种类型的睾酮导致被称为浆细胞样树突状细胞(pDCs)的免疫细胞产生的干扰素减少。减少是由于生产干扰素所需的受体(称为IRF7)的表达降低以及抑制干扰素反应的蛋白质SOCS3的表达增加。在称为单核细胞的免疫细胞中,激素治疗后免疫信号蛋白TNF的产生增加,伴随着SLAMF7受体的激素介导上升。在激素治疗开始后的三个月内,跨性别男性的免疫细胞具有与顺性别男性相似的信号概况。
Lakshmikanth及其同事在GAHT开始前、治疗后三个月和一年时对23名跨性别男性的免疫系统进行了分析。作者观察到,在雄激素治疗几个月内,个体的免疫系统概况向顺性别男性的典型概况发生了深刻转变,并且这种反应至少维持了一年。GAHT增加了所有23名研究参与者的循环睾酮并降低了雌激素水平,同时降低了基线和病毒触发的干扰素介导的防御反应。在用雄激素处理的顺性别女性的细胞样本中观察到了相同类型的结果,证实这些效应是由于激活雄激素受体而非缺乏雌激素造成的。
雄激素介导的干扰素反应抑制并非直接由免疫细胞中编码TLR7的基因表达变化或与TLR7密切相关的受体(称为TLR8)的基因表达变化引起。相反,这种变化是通过同时上调负调节因子(SOCS3)和下调正调节因子(IRF7)的干扰素产生而发生的(图1b)。这表明激素是干扰素生产的主要调节因素,但并不排除性染色体的潜在贡献,特别是在生命期间性腺激素水平低或缺失时。
随着GAHT后干扰素信号的减弱,另一类名为TNF的免疫信号分子以及受体SLAMF7增加。TNF在顺性别男性中的表达高于顺性别女性。类固醇的影响再次间接通过如SLAMF7等次级信号分子发生。本质上,观察到一种交叉调节:由于激素治疗,跨性别男性在被称为浆细胞样树突状细胞的免疫细胞中减少了I型干扰素信号,而在被称为单核细胞的免疫细胞中增加了TNF响应。这两种细胞类型都在先天防御中发挥作用,并在血液中循环。这些发现具有广泛的相关性,对顺性别和跨性别的免疫健康、男女疫苗效果的差异、男性因传染病导致的死亡率高于女性、女性自身免疫疾病发生率远高于男性、以及更年期后免疫概况的变化都有影响。
Lakshmikanth及其同事的研究的一个重要优势是他们对雄激素治疗前的时间评估(纵向研究),随后为所有参与者应用了相似的剂量和激素配方。大多数关于人类激素效应的研究都受到给药途径、成分、剂量和时间测量的变化所困扰。身体的许多性别差异是由胎儿发育期间和青春期再次由类固醇编程的。在青春期,出生时被指定为男性的人会暴露于来自他们睾丸的高级别雄激素,而当那些出生时被指定为女性的人到达青春期时,她们的卵巢开始产生波动的雌激素和孕酮水平。
所有研究参与者在完成其出生指定性别的青春期后开始接受GAHT,这表明成年后给予的睾酮足以重新编程免疫系统。然而,没有类似使用基于雌激素的GAHT的跨性别女性的研究,无法排除发育期雄激素(产前激增或青春期增加的雄激素)的潜在编程效应。无论如何,雄激素治疗对干扰素和TNF信号级联在免疫系统中的相反效应为男性系统性红斑狼疮和其他可能的自身免疫疾病的显著较低发生率提供了一个合理的解释。是否GAHT能保护跨性别男性免受自身免疫性疾病的影响,或者使他们面临更高的传染病有害后果风险,还有待观察,但其对跨性别健康的影响值得进一步关注。
尚不清楚为什么免疫系统概况如此深刻地受到雄激素的调节,特别是鉴于男性因传染病导致的死亡风险增加。考虑到这种成本,大概有一些抵消的好处。
来自免疫细胞的TNF是已知的肌肉生长和修复促进剂,有利于那些雄性生殖优势依赖于更大体型和力量的物种中的雄性。相反,哺乳动物雌性生殖优势需要避免免疫学上排斥内部孕育的胎儿的同时,维持对外来病原体的强有力免疫反应,并且在感染发生时避免将疾病传递给胎儿的复杂能力。干扰素特别适合这些生殖上有利的角色,因此可能总是准备好在生殖年龄的女性中发挥作用。激素疗法如此有效地切换这一概况,通过一个紧密协调的多细胞、多信号分子级联反应揭示出对抗寄生虫、病原体和瘟疫世界的潜在预防和干预新领域。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1450216.html?mobile=1
收藏

